Keywords
Alzheimer’s disease, statins, NSAIs
Introducción
Los antiinflamatorios no esteroideos (AINEs) y las estatinas son fármacos de uso muy extendido en medicina, con múltiples principios activos e indicaciones dentro de cada grupo. Una posible indicación común, que se encuentra en fase de investigación, es el tratamiento de la enfermedad de Alzheimer (EA). En este artículo se pretende repasar los fundamentos en los que se basa su posible utilidad, los mecanismos de acción propuestos y los resultados relativos tanto a la experimentación clínica como experimental que se han alcanzado hasta el momento.
Se dan una serie hechos que invitan a pensar que los AINEs puedan resultar eficaces en el tratamiento de la EA: 1. Desde el punto de vista neuropatológico la EA se caracteriza por depósitos de beta-amiloide (Abeta) y ovillos neurofibrilares (neurofibrillary tangles, NFT) rodeados por células inflamatorias (microglía) [1]. La respuesta inflamatoria se asocia con la pérdida de neuronas adyacentes a las placas de Abeta [2]. 2. Se ha comprobado que tanto la ciclooxigenasa 1 (COX-1) como la ciclooxigenasa 2 (COX-2) potencian la generación de Abeta mediante mecanismos que implican actividad de la gamma-secretasa [3]. La gamma-secretasa es una enzima que cliva el péptido precursor del amiloide (APP) necesaria para generar Abeta. 3. Los estudios observacionales han coincidido en señalar que el uso prolongado de AINEs reduce el riesgo de desarrollar EA y retrasa la instauración de la enfermedad. La primera noción de que el uso prolongado de AINEs podía reducir el riesgo de EA procede de la observación de la escasa prevalencia de demencia que se da entre pacientes con artritis reumatoide [4]. Desde entonces varios estudios epidemiológicos han confirmado que el uso prolongado de AINEs reduce el riesgo de EA [5-7].
Respecto a los inhibidores de la 3-hidroxil-3-metilglutaril coenzima A (HMG-CoA) reductasa (“estatinas”), son fármacos que reducen el colesterol LDL (low-density lipoprotein) y aumentan el colesterol HDL (high-density lipoprotein) reduciendo así el riesgo cardiovascular. Es bien conocido que los factores de riesgo vascular se asocian no sólo con demencia de origen vascular sino también con demencia degenerativa tipo EA. De hecho se ha visto en modelos animales de EA que la hipercolesterolemia acelera la neuropatología amiloide [8,9]. Pero más allá del nexo de unión entre la hipercolesterolemia y la EA, el verdadero motivo para hacer pensar que las estatinas podrían resultar eficaces en la EA procede de varios estudios observacionales caso-control que demuestran que aquellos pacientes a los que se les prescribían estatinas tienen menor riesgo de desarrollar demencia, independientemente de la presencia de dislipemia o tratamiento con otros hipolipemiantes distintos a las estatinas [10-12]. El contrapunto a estas conclusiones llegó en el año 2005 de mano de los estudios de cohortes: 2 estudios de este tipo, contando cada uno con más de 2000 individuos mayores de 65 años sin demencia en el momento de inicio del estudio, no hallaron reducción del riesgo de sufrir ningún tipo demencia tras 1-2 años de seguimiento [13,14].
Discusión
AINES
Mecanismo de acción
Tanto COX-1 como COX-2 potencian la actividad de la gamma-secretasa favoreciendo la producción de Abeta; por tanto los inhibidores de las ciclooxigenasas podrían reducir este efecto. Mientras que la inhibición de las COX in vitro sucede a bajas concentraciones; para que se produzca reducción de Abeta se precisan concentraciones significativamente más altas. No obstante estudios en ratones transgénicos muestran que los efectos sobre los niveles y depósitos de Abeta se consiguen con niveles plasmáticos de medicación equivalentes a las dosis terapéuticas que se usan en humanos [15], aunque otros estudios en cultivos neuronales muestran que sólo ciertos AINEs no selectivos tienen esta propiedad [16].
Sin embargo, cada vez eran más lo autores que intuían que las dianas clásicas de los AINEs (las COX) no podrían explicar todos los efectos descritos [17,18]. En un interesante estudio realizado por A. Lleó [19] se describe cómo aquellos AINEs capaces de reducir la formación de Abeta alteran la distancia existente entre APP y la presenilina1 (que forma parte del complejo de la gamma-secretasa), sugiriendo que algún cambio alostérico en la relación de estas dos moléculas podría provocar una modulación de la actividad de la gamma-secretasa de forma que genera fragmentos más cortos y menos tóxicos.
Recientemente se ha involucrado al receptor gamma activado por el proliferador de peroxisomas (PPARgamma) en la modulación de la producción de Abeta; ya que este receptor, que puede ser activado por los AINEs, reduce la transcripción génica de la betasecretasa [20].
Eficacia experimental
Varios estudios con modelos animales de EA han demostrado que la administración continuada (durante al menos 6 meses) de AINES reduce los niveles cerebrales de Abeta, los depósitos de Abeta en las placas y la activación microglial [21-26].
En una revisión sistemática de la Cochrane Database (año 2003) para investigar la eficacia del tratamiento con Ibuprofeno para la EA se concluye que no existe evidencia científica que apoye su utilidad [27].
En un ensayo realizado para determinar si el tratamiento con un inhibidor selectivo de la COX-2 (rofecoxib) o con un AINE clásico no-selectivo (naproxeno) es eficaz para ralentizar el declinar de pacientes con EA leve y moderada, ninguno de los dos AINE resultó eficaz [28].
En otro estudio con indometacina frente a placebo con pacientes de EA levemoderada, el grupo de indometacina parecía encontrarse más protegido frente a la progresión del declinar cognitivo que el grupo placebo; sin embargo el estudio tenía una duración de sólo 6 meses; con lo que los resultados son limitados [29].
Actualmente se encuentran en curso un ensayo con Ibuprofen (Advil™, Motrin™, Nuprin™, Neobrufen™) en Fase III de la FDA, otro con r-flurbiprofen (Flurizan™) en Fase III, otro con Rofecoxib (Vioxx™) en Fase III y otro con Naproxeno (Aleve™, Anaprox™, Naprosyn™) también en Fase III [30].
Una razón para explicar la discrepancia entre los estudios observacionales y los resultados de los ensayos clínicos randomizados podría ser que en los ensayos no se han seleccionado los AINEs correctos; ya que los estudios observacionales se refieren a AINEs en general y los ensayos clínicos se realizan con uno de ellos en concreto. Otra explicación podría ser que los AINEs son ineficaces cuando la enfermedad ya está establecida y que puedan ser eficaces en una fase presintomática de la enfermedad.
Estatinas
Mecanismos de acción
El mecanismo de acción inicialmente propuesto para las estatinas en la EA no es otro que el de poder reducir la patología vascular presente en esta enfermedad. Sin embargo, cada vez se está dando más importancia a la actividad inmunomoduladora de estas moléculas. Así, las estatinas bloquean la capacidad del interferón-gamma de activar linfocitos T, con lo cual se podría reducir el componente inflamatorio que existe en la EA. Además se ha demostrado en animales de experimentación que la vasoconstricción que el péptido Abeta puede inducir mediante la activación de una vía proinflamatoria se puede abolir mediante el tratamiento con estatinas [31]. También se está investigando la posible influencia que las estatinas tienen sobre el procesamiento de la proteína precursora del amiloide (APP) y en concreto sobre las secretasas (las proteasas que clivan el APP) ya que parece que son capaces de inhibir a las beta-secretasas [32] e inducir a las alpha-secretasas [33], previniendo así la formación de Abeta. Las estatinas también inhiben la vía del isoprenoide lo cual puede tener influencia tanto sobre el procesamiento de APP [34] como sobre la regulación de la microglía [35].
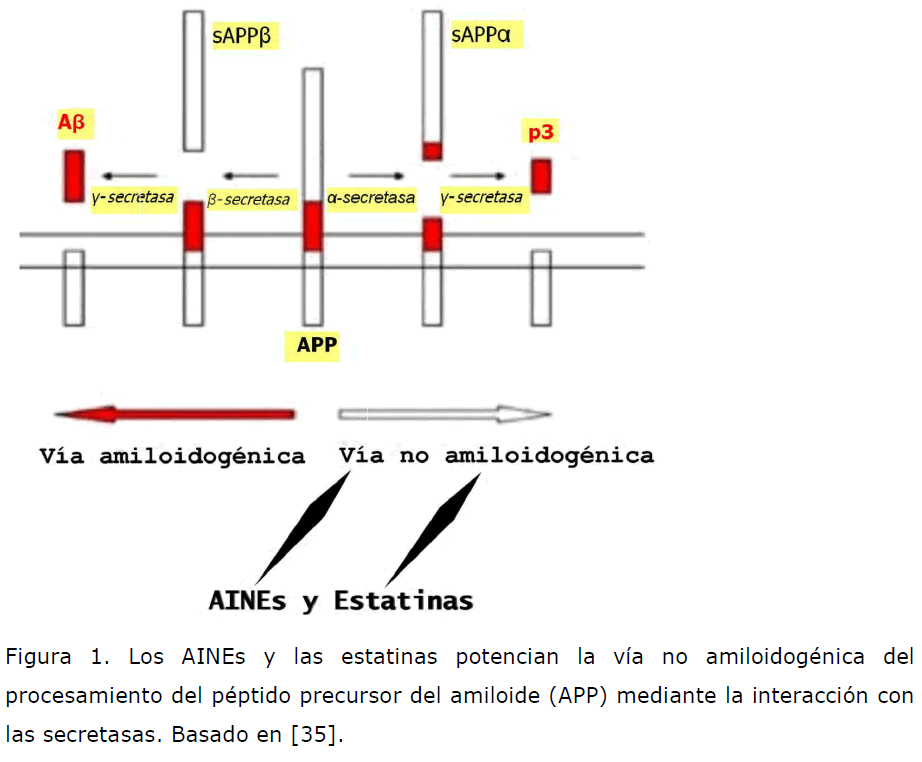
Figura 1. Los AINEs y las estatinas potencian la vía no amiloidogénica del procesamiento del péptido precursor del amiloide (APP) mediante la interacción con las secretasas. Basado en [35].
Eficacia experimental
En modelos animales de EA la hipocolesterolemia inducida por tratamiento con atorvastatina se asoció con una reducción marcada de los depósitos cerebrales de Abeta [37]. Los niveles plasmáticos de Abeta (tanto las formas 1-40 y 1-42 como el Abeta total) no se alteran en pacientes con hipercolesterolemia tratados con estatinas [38].
Eficacia clínica (ensayos clínicos)
En una Revisión Sistemática de la Cochrane Database realizada en el año 2001 sobre la evidencia acumulada hasta ese momento respecto al efecto protector del tratamiento con estatinas frente a EA se concluye que no existe evidencia de suficiente calidad científica como para recomendar el uso de estos tratamientos, fundamentalmente porque no se habían realizado ensayos randomizados [39]. En estos últimos años sí se están realizando ensayos clínicos rigurosos para conocer el verdadero alcance del tratamiento con algunas estatinas en la EA: en un ensayo realizado con simvastatina frente a placebo en pacientes con EA sin hipercolesterolemia los niveles de Abeta el LCR no se redujeron de forma significativa; sin embargo cuando en un postanálisis se analizaron los datos en el grupo de pacientes con EA leve sí se encontró reducción de los niveles licuorales de Abeta40 y Abeta42 [39]. Un ensayo comparando el tratamiento con atorvastatina frente a placebo durante 1 año en pacientes con EA leve y moderada evidenció una mejoría clínica (en la escala ADAS-Cog) clínicamente significativa [40]. Mencionar que también se encuentra en curso otro ensayo con atorvastatina (Lipitor™, Cardyl™, Zarator™, Prevencor™) en Fase II de la FDA [30].
Conclusiones
Tanto los AINES como las estatinas cuentan con estudios observacionales que parecen indicar que el tratamiento con estos fármacos reduce el riesgo de padecer EA.
El mecanismo de acción de ambos grupos terapéuticos se encuentra en relación con el potenciamiento de la vía no amiloidogénica en el procesamiento de la APP mediante la interacción con las secretasas.
Aunque los estudios experimentales en modelos animales con ambos tratamientos demuestran una disminución de la patología amiloidea los ensayos clínicos aportan resultados negativos o poco concluyentes, por lo que se hace necesario esperar por los resultados de los ensayos clínicos en curso para alcanzar conclusiones definitivas.
Bibliografía
- Stalder M, Phinney A, Probst A, Sommer B, Staufenbiel M, Jucker M.Association of microglia with amyloid plaques in brains of APP23 transgenic mice. Am J Pathol. 1999;154(6):1673-84
- Kalaria RN. Microglia and Alzheimer's disease. Curr Opin Hematol. 1999;6(1):15- 24
- Qin W, Ho L, Pompl PN, Peng Y, Zhao Z, Xiang Z, Robakis NK, Shioi J, Suh J, Pasinetti GM. Cyclooxygenase (COX)-2 and COX-1 potentiate beta-amyloid peptide generation through mechanisms that involve gamma-secretase activity. J Biol Chem. 2003;278(51):50970-7
- McGeer PL, Schulzer M, McGeer EG. Arthritis and anti-inflammatory agents as possible protective factors for Alzheimer's disease: a review of 17 epidemiologic studies. Neurology. 1996;47(2):425-32.
- Cornelius C, Fastbom J, Winblad B, Viitanen M.Aspirin, NSAIDs, risk of dementia, and influence of the apolipoprotein E epsilon 4 allele in an elderly population. Neuroepidemiology. 2004;23(3):135-43
- Stewart WF, Kawas C, Corrada M, Metter EJ. Risk of Alzheimer's disease and duration of NSAID use. Neurology. 1997;48(3):626-32
- in t' Veld BA, Ruitenberg A, Hofman A, Launer LJ, van Duijn CM, Stijnen T, Breteler MM, Stricker BH. Nonsteroidal antiinflammatory drugs and the risk of Alzheimer's disease. N Engl J Med. 2001;345(21):1515-21.
- Refolo LM, Pappolla MA, Malester B, LaFrancois J, Bryant- Thomas T, Wang R, Tint GS, Sambamurti K, Duff K. Hypercholesterolemia accelerates the Alzheimer's amyloid pathology in a transgenic mouse model. Neurobiol Dis. 2000;7(4):321-31
- Pappolla MA, Bryant-Thomas TK, Herbert D, Pacheco J, Fabra Garcia M, Manjon M, Girones X, Henry TL, Matsubara E, Zambon D, Wolozin B, Sano M, Cruz-Sanchez FF, Thal LJ, Petanceska SS, Refolo LM. Mild hypercholesterolemia is an early risk factor for the development of Alzheimer amyloid pathology. Neurology 2003;61(2):199-205
- Jick H, Zornberg GL, Jick SS, Seshadri S, Drachman DA. Statins and the risk of dementia. Lancet. 2000 Nov 11;356(9242):1627-31
- Hajjar I, Schumpert J, Hirth V, Wieland D, Eleazer GP. The impact of the use of statins on the prevalence of dementia and the progression of cognitive impairment. J Gerontol A Biol Sci Med Sci. 2002;57(7):M414-8
- Wolozin B, Kellman W, Ruosseau P, Celesia GG, Siegel G. Decreased prevalence of Alzheimer disease associated with 3- hydroxy-3-methyglutaryl coenzyme A reductase inhibitors. Arch Neurol. 2000;57(10):1439-43.
- Rea TD, Breitner JC, Psaty BM, Fitzpatrick AL, Lopez OL, Newman AB, Hazzard WR, Zandi PP, Burke GL, Lyketsos CG, Bernick C, Kuller LH. Statin use and the risk of incident dementia: the Cardiovascular Health Study. Arch Neurol. 2005 Jul;62(7):1047-51
- Li G, Higdon R, Kukull WA, Peskind E, Van Valen Moore K, Tsuang D, van Belle G, McCormick W, Bowen JD, Teri L, Schellenberg GD, Larson EB. Statin therapy and risk of dementia in the elderly: a community-based prospective cohort study. Neurology. 2004;63(9):1624-8
- Eriksen JL, Sagi SA, Smith TE, Weggen S, Das P, McLendon DC, Ozols VV, Jessing KW, Zavitz KH, Koo EH, Golde TE. NSAIDs and enantiomers of flurbiprofen target gamma-secretase and lower Abeta 42 in vivo. J Clin Invest. 2003;112(3):440-9
- Gasparini L, Rusconi L, Xu H, del Soldato P, Ongini E. Modulation of betaamyloid metabolism by non-steroidal anti-inflammatory drugs in neuronal cell cultures. J Neurochem. 2004;88(2):337-48.
- Landreth GE, Heneka MT.Anti-inflammatory actions of peroxisome proliferatoractivated receptor gamma agonists in Alzheimer's disease. Neurobiol Aging. 2001;22(6):937-44
- Weggen S, Eriksen JL, Das P, Sagi SA, Wang R, Pietrzik CU, Findlay KA, Smith TE, Murphy MP, Bulter T, Kang DE, Marquez-Sterling N, Golde TE, Koo EH. A subset of NSAIDs lower amyloidogenic Abeta42 independently of cyclooxygenase activity. Nature. 2001;414(6860):212-6.
- Lleó A, Berezovska O, Herl L, Raju S, Deng A, Bacskai BJ, Frosch MP, Irizarry M, Hyman BT. Nonsteroidal anti- inflammatory drugs lower Abeta(42) and change presenilin 1 conformation. Nat Med. 2004;10(10):1065-6
- Sastre M, Dewachter I, Rossner S, Bogdanovic N, Rosen E, Borghgraef P, Evert BO, Dumitrescu-Ozimek L, Thal DR, Landreth G, Walter J, Klockgether T, van Leuven F, Heneka MT. Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. Proc Natl Acad Sci U S A. 2006;103(2):443-8
- Yan Q, Zhang J, Liu H, Babu-Khan S, Vassar R, Biere AL, Citron M, Landreth G.Anti-inflammatory drug therapy alters beta-amyloid processing and deposition in an animal model of Alzheimer's disease. J Neurosci. 2003;23(20):7504-9
- Lim GP, Yang F, Chu T, Gahtan E, Ubeda O, Beech W, Overmier JB, Hsiao-Ashec K, Frautschy SA, Cole GM. Ibuprofen effects on Alzheimer pathology and open field activity in APPsw transgenic mice. Neurobiol Aging. 2001;22(6):983-91
- Jantzen PT, Connor KE, DiCarlo G, Wenk GL, Wallace JL, Rojiani AM, Coppola D, Morgan D, Gordon MN.Microglial activation and beta -amyloid deposit reduction caused by a nitric oxide-releasing nonsteroidal anti-inflammatory drug in amyloid precursor protein plus presenilin-1 transgenic mice. J Neurosci. 2002;22(6):2246- 54
- Eriksen JL, Sagi SA, Smith TE, Weggen S, Das P, McLendon DC, Ozols VV, Jessing KW, Zavitz KH, Koo EH, Golde TE. NSAIDs and enantiomers of flurbiprofen target gamma-secretase and lower Abeta 42 in vivo. J Clin Invest. 2003;112(3):440-9
- Mackenzie IR, Munoz DG. Nonsteroidal anti-inflammatory drug use and Alzheimer-type pathology in aging. Neurology. 1998;50(4):986-90.
- Blasko I, Apochal A, Boeck G, Hartmann T, Grubeck- Loebenstein B, Ransmayr G. Ibuprofen decreases cytokine-induced amyloid beta production in neuronal cells. Neurobiol Dis. 2001;8(6):1094-101
- Tabet N, Feldmand H. Ibuprofen for Alzheimer's disease (Cochrane Review). Cochrane Database Syst Rev. 2003. CD004031
- Aisen PS, Schafer KA, Grundman M, Pfeiffer E, Sano M, Davis KL, Farlow MR, Jin S, Thomas RG, Thal LJ; Alzheimer's Disease Cooperative Study. Effects of rofecoxib or naproxen vs placebo on Alzheimer disease progression: a randomized controlled trial. JAMA;289(21):2819-26
- Rogers J, Kirby LC, Hempelman SR, Berry DL, McGeer PL, Kaszniak AW, Zalinski J, Cofield M, Mansukhani L, Willson P, et al. Clinical trial of indomethacin in Alzheimer's disease. Neurology. 1993;43(8):1609-11 28. https://clinicaltrial.gov
- Paris D, Townsend KP, Humphrey J, Obregon DF, Yokota K, Mullan M.Statins inhibit A beta-neurotoxicity in vitro and A beta-induced vasoconstriction and inflammation in rat aortae. Atherosclerosis. 2002;161(2):293-9.
- Sidera C, Parsons R, Austen B. The regulation of beta-secretase by cholesterol and statins in Alzheimer's disease. J Neurol Sci. 2005;229-230:269-73
- Parvathy S, Ehrlich M, Pedrini S, Diaz N, Refolo L, Buxbaum JD, Bogush A, Petanceska S, Gandy S. Atorvastatin-induced activation of Alzheimer's alpha secretase is resistant to standard inhibitors of protein phosphorylation-regulated ectodomain shedding. J Neurochem. 2004;90(4):1005-10
- Pedrini S, Carter TL, Prendergast G, Petanceska S, Ehrlich ME, Gandy S. Modulation of statin-activated shedding of Alzheimer APP ectodomain by ROCK. PLoS Med. 2005;2(1):e18.
- Bi X, Baudry M, Liu J, Yao Y, Fu L, Brucher F, Lynch G. Inhibition of geranylgeranylation mediates the effects of 3-hydroxy-3-methylglutaryl (HMG)-CoA reductase inhibitors on microglia. J Biol Chem. 2004;279(46):48238-45
- Tang B. Alzheimers disease. Changing APP to non amiloidogenic processing. Biochemical and Biophysical Research Communications 2005;331:374-378
- Petanceska S, Pappolla M, Refolo LM. Modulation of Alzheimer's amyloidosis by statins: Mechanisms of action. Curr Med Chem Imun Endoc & Metab Agents. 2003;3(1):1- 7
- Höglund K, Wiklund O, Vanderstichele H, Eikenberg O, Vanmechelen E, Blennow K. Plasma Levels of {beta}-Amyloid (1-40), {beta}-Amyloid(1-42), and Total {beta}-Amyloid Remain Unaffected in Adult Patients With Hypercholesterolemia After Treatment With Statins. Arch Neurol. 2004;61(3):333-337.
- Scott HD, Laake K. Statins for the prevention of Alzheimer's disease. Cochrane Database Syst Rev. 2001;(4):CD003160.
- Simons M, Schwarzler F, Lutjohann D, von Bergmann K, Beyreuther K, Dichgans J, Wormstall H, Hartmann T, Schulz JB. Treatment with simvastatin in normocholesterolemic patients with Alzheimer's disease: A 26-week randomized, placebo-controlled, double-blind trial. Ann Neurol. 2002;52(3):346-50
- Sparks DL, Sabbagh MN, Connor DJ, Lopez J, Launer LJ, Petanceska S, Browne P, Wassar D, Johnson-Traver S, Lochhead J, Ziolkowski C. Atorvastatin therapy lowers circulating cholesterol but not free radical activity in advance of identifiable clinical benefit in the treatment of mild-to-moderate AD. Curr Alzheimer Res. 2005 Jul;2(3):343-53
1289