Key words
Rheumatoid Arthritis, Citrullinated Cyclic Peptides.
Introducción
Las enfermedades reumáticas son conocidas en medicina como enfermedades del tejido conectivo [1,2], ya que afectan al tejido o estructura que soporta el cuerpo y sus órganos internos [1]. Algunas de ellas conocidas como enfermedades autoinmunes, son debidas a que el sistema inmune que está estructurado para defender al organismo de agentes externos, se altera y daña los tejidos propios [3], como la artritis reumatoide (AR) (Imagen 1). “Las artritis” se caracterizan por la inflamación de las articulaciones y pueden tener diferentes causas, por ello, existen muchos tipos de artritis, como la artritis psoriásica, las artritis infecciosas, la gota, la AR, etc. [1].
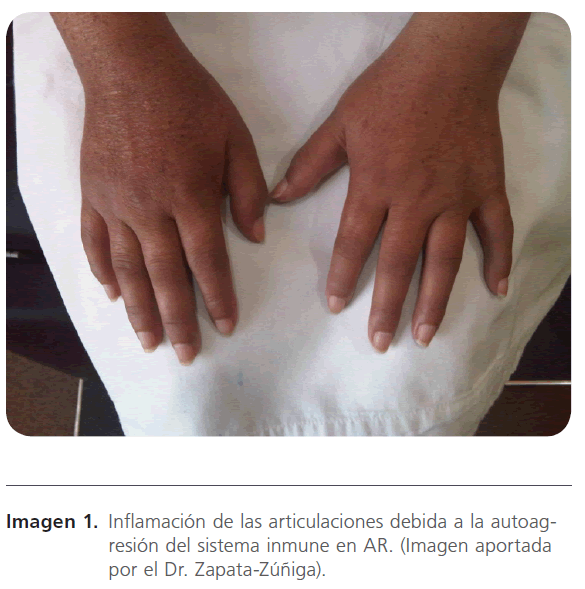
Imagen 1: Inflamación de las articulaciones debida a la autoagresión del sistema inmune en AR. (Imagen aportada por el Dr. Zapata-Zúñiga).
La AR es una enfermedad inflamatoria [4], crónica [5], degenerativa, de carácter sistémico [6] cuya etiología es multifactorial [7] y afecta principalmente las membranas sinoviales de las articulaciones diartrodiales [8-10] lo que ocasiona dolor e inflamación [11] y puede conducir a una discapacidad severa [12]. También puede incluir manifestaciones extraarticulares [9] como vasculitis, glomerulonefritis, pericarditis, pleuritis, escleritis, entre otras. Las manifestaciones extra-articulares más frecuentes, son los nódulos reumatoides, los cuales se presentan en un 7% en pacientes con AR en etapa temprana y un 30% de pacientes lo desarrollan en una etapa tardía de la enfermedad. Se encuentran comúnmente en codos (imagen 2), articulaciones de los dedos, protuberancias isquiática y sacro, cuero cabelludo occipital y tendón de Aquiles, aunque también se pueden encontrar en órganos internos [2].
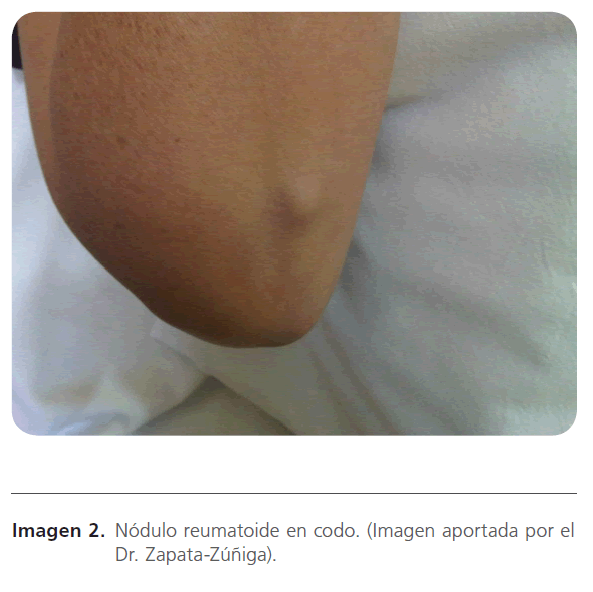
Imagen 2: Nódulo reumatoide en codo. (Imagen aportada por el Dr. Zapata-Zúñiga).
La prevalencia es alrededor del 1,0% en la población general [2,13-15], y es más frecuente en mujeres que en hombres [2] en relación 2-3:1 [6,13], dando un cambio importante en la calidad de vida de las personas [16]. La incidencia en mujeres ocurre entre los 40 y los 60 años de edad [13]. En cinco zonas de la república mexicana se realizó un estudio sobre las enfermedades musculoesqueléticas, entre ellas la AR, encontrando una prevalencia de 1.6% [17], mientras que otra encuesta similar hecha en Yucatán, mostró una prevalencia de 2.8% en este estado [18].
Causas y factores de predisposición a la artritis reumatoide
La AR se caracteriza por la intervención de factores genéticos, ambientales, étnicos [7,19], geográficos [17] y nutricionales [20] que interaccionan y llevan al desarrollo de una reacción autoinmunitaria. Estudios en familiares demostraron que dentro de la familia existe un alto grado de predisposición hacía la autoinmunidad [7].
Análisis en gemelos indican que la genética influye en gran medida en la prevalencia de la AR y se sabe que la herencia se debe mayormente a factores genéticos que a factores ambientales. Algunos estudios han mostrado que aproximadamente el 60% de la variabilidad de la enfermedad es heredada, ya que considerando el riesgo de la población de desarrollar AR es de aproximadamente 1%. Los gemelos ho- mocigotos de un paciente con AR tienen un riesgo de 15% de desarrollarla, y el riesgo del hermano de un afectado es de aproximadamente 5% [2].
Se ha estimado que la región del complejo mayor de histocmpatibilidad (MHC) del genoma humano, denominado Human Leukocyte Antigen (HLA) [2], cuenta con un tercio del componente genético general de riesgo para desarrollar AR [21,22]. El HLA contiene cientos de genes que se involucran en la función inmune [21]. Gran parte del riesgo de presentar AR es atribuido a los alelos en el genotipo HLA-DRB1 [23,24].
Por otra parte, uno de los factores que se ha relacionado con el incremento del riesgo para desarrollar AR, es fumar [2]. Klareskog y col., en 2006 observaron una correlación entre la presencia del alelo HDRB1*0401 [25] y anticuerpos anti-péptidos cíclicos citrulinados (anti-CCP) en individuos fumadores con AR. El riesgo de desarrollar AR y la presencia de anti-CCP positivos es 20 veces mayor para los pacientes fumadores con este alelo [13]. Los pacientes con manifestaciones extraarticulares muestran un riesgo más elevado de desarrollar una enfermedad cardiovascular (CV) o graves infecciones [2]. La presencia de los alelos DRB1*0401 y DRB1*0404, con una inflamación crónica en pacientes con AR, puede llevar a un mayor riesgo de desarrollar una enfermedad CV [26]. Estos dos alelos se asocian también a enfermedades de inicio temprano y de fenotipo grave [23].
Una asociación entre AR y las proteínas HLA de clase II, fue notado por primera vez en 1970, cuando el cultivo de linfocitos mixtos (MLC, por sus siglas en inglés) tipo Dw4 relacionado con el subtipo serológico DR4, fue el más comúnmente observado entre los pacientes con AR en comparación con controles. Subsecuentemente, la investigación de la diversidad molecular de proteínas de clase II (subunidades de HLA-DR, DQ y DP) localizó el subtipo serológico Dw4 para el gen HLA DRB1. Cuando los subtipos susceptibles DR fueron considerados como un grupo de riesgo para desarrollar AR, Gregersen y colaboradores, notaron una secuencia de aminoácidos compartidos en las posiciones 70-74 de la proteína HLA-DRB1 [2]. Estos residuos son importantes para la unión del péptido y por lo tanto los alelos asociados se unen a péptidos específicos [23], que a su vez facilita el desarrollo de células T autorreactivas [2]. Estos alelos son ahora conocidos como “epítopo compartido” [22,27].
Biomarcadores
La AR conlleva la producción de auto-anticuerpos dirigidos hacía numerosos antígenos, pero la mayoría de esos autoanticuerpos no son específicos para AR [28]. El único biomarcador anteriormente incluido en los criterios de clasificación del Colegio Americano de Reumatología (CAR) (1987) es el factor reumatoide (FR) [14,29] descubierto hace más de 50 años [30,31], corresponde a una inmunoglobulina de varios isotipos (IgM, IgG o IgA) dirigida contra distintos epitopos [14,30,32]. El FR posee una gran sensibilidad para el diagnóstico de AR (de un 65% a 85%), el problema es su baja especificidad (50 % a 80%) ya que puede detectarse en otros trastornos inflamatorios agudos y crónicos de tipo autoinmune o infeccioso, entre otros, e incluso en población sana, principalmente mayores de 55 años [14].
A partir de ello, se ha tratado de encontrar un marcador más específico que permita conocer no sólo el diagnóstico de la enfermedad, sino también facilitar el diagnóstico diferencial con otras enfermedades inflamatorias, es por ello que en la actualidad se analizan los anticuerpos anti-CCP [14,30,33], ya que se ha demostrado que los auto-anticuerpos de AR reconocen péptidos que contienen residuos de citrulina [6,25,34] y son actualmente usados como herramienta para el diagnóstico de AR [25,29,35].
La citrulina es una modificación de la arginina [36] y corresponde a un aminoácido que no se incorpora a la cadena polipeptídica durante el proceso de síntesis, sino que se genera a partir de una modificación postraduccional de la arginina por acción de la enzima peptidil arginina deaminasa (PAD) [12,31,37], que convierte la peptidilarginina en peptidilcitrulina. De esta forma, el blanco antigénico de estos anti-CCP son estos residuos peptídicos citrulinados de la filagrina [36], por ello se denominaron anticuerpos anti-péptidos cíclicos citrulinados. En la citrulinación ocurren procesos físico-químicos, que conducen a un cambio en la masa molecular del péptido y lleva a la pérdida de la carga positiva de la arginina hacia una carga neutra de la citrulina. Esta nueva estructura del péptido es reconocida por el sistema inmune cuando es presentada por moléculas del HLA de clase II, dado que posee los alelos “epítopo compartido” [14], y se denomina de ésta forma por la composición de las secuencias de aminoácidos [23] relacionadas en la tercera región hipervariable [38] de la cadena beta de las moléculas DRB1, DR6 y DR10, de forma que las moléculas del HLA que poseen esta secuencia se denotan porque es un sitio de unión peptídica (P4) con carga positiva; así los péptidos que tienen arginina no se adhieran a él ya que sus cargas se contraponen, en cambio cuando los residuos arginina son citrulinados, su carga pasa a ser neutra con sus mismas características polares, ello permite que se unan con más eficacia a las moléculas HLA DR4 y de esta forma pueden ser presentados a los linfocitos T [14]. Los alelos del epítopo compartido que llevan esta secuencia son del genotipo DRB1 (*0401, *0404, *0405, *0408, *0101, *0102 y *1001), y DQB1 (*0302 Y *0501) [22,23] y están asociados con la presencia de los anti-CCP en AR [38].
Schellekens estudió mediante la técnica de ELISA, los fragmentos citrulinados de la filagrina [31,39], obteniendo en sus ensayos una sensibilidad de 76% con una especificidad para AR de 96% [14,29]. En otros estudios los anti-CCP han resultado tener una especificidad de 98-99% [28,40] como marcadores serológicos para AR y una sensibilidad de 80% [38,41].
Se han descrito distintas proteínas citrulinadas con alta especificidad para AR, entre las que se encuentran la filagrina, las colagenas tipo I y II, fibrinógeno y vimentina [13]. El antígeno Sa, ha sido identificado como vimentina citrulinada y se ha demostrado que está presente en el líquido sinovial de pacientes con AR [34,42] aunque pocos estudios han comparado la coexistencia de anticuerpos anti-Sa y anti-CCP en suero de pacientes con AR [28]. Otros anticuerpos que han sido descritos para AR son anti-AR33, P68, anti-calpastatina [12], anti-factor perinuclear (AFP) y anti-queratina (AKA) [13]. Sin embargo, auto-anticuerpos como anti-AR33 tienen baja especificidad al ser encontrados en aproximadamente un tercio de pacientes con Lupus Eritematoso Generalizado y otras enfermedades del tejido conectivo. De igual manera los anticalpastatina no son muy específicos [12]. Los AFP y AKA son muy específicos para AR pero poseen una sensibilidad de casi 50%. En 1995 Sebbag demostró que los AFP y los AKA portaban el mismo determinante antigénico, correspondiente a una proteína conocida como filagrina, proponiendo el nombre de anticuerpos anti-filagrina (AFA). En 1998 Schellekens demostró que los AFA no se dirigían contra toda la molécula completa de filagrina sino contra residuos peptídicos caracterizados por la presencia de citrulina; así el blanco antigénico de los anti-CCP eran los residuos citrulinados en patrones antigénicos AFP, AKA y AFA [14,29].
Modulación de la respuesta inmune en AR
En los linfocitos T (LT) se han identificados dos tipos de respuestas colaboradoras (Th): las Th1 (inmunidad celular o retardada) y las Th2 (inmunidad humoral). Las Th1 participan en la eliminación de patógenos intracelulares y las Th2 en la eliminación de microorganismos extracelulares [21]. En la figura 1 se muestra la activación de LT mediante la presentación de auto-antígenos y señales coestimuladoras por parte de las células presentadoras de antígenos mediante el HLA de clase II; los Th1 son los linfocitos secretores de interferón gamma (IFN-g) [19] e interleucina 2 (IL-2), y los Th2 son los linfocitos que liberan citocinas IL-4, IL-10 [2] e IL-13, mencionando que en la activación de células T, además de la diferenciación de Th1 promovida por IL-12 y Th2 por IL-4 [21], existe un subgrupo de linfocitos T CD4+ denominados Th17 promovidos por el factor de crecimiento transformante b (TGF-b) e IL-6, que secretan IL-17 [2,43] y que coordinan la respuesta inmune de un modo diferente a las Th1 o a las Th2 [21], a su vez, las Th también estimulan a los linfocitos B (LB) para producir auto-anticuerpos [2]. Las Th17 se asocian a procesos inflamatorios [21,43,44] crónicos y autoinmunes promovidos fundamentalmente por el efecto proinflamatorio de la IL-17 y son las IL-23 las que inducen su proliferación. Se ha implicado a la IL-17 con el desarrollo de diversas enfermedades autoinmunes, entre ellas se destaca la AR, ya que se ha encontrado que la expresión de IL-17 esta elevada en zonas afectadas [21,45]. En AR, la IL-17, además de potenciar la actividad de IL-1 y TNF-a (factor de necrosis tumoral a), estimula la diferenciación de los osteoclastos y promueve la destrucción de cartílago y hueso [21]. El TNF-a también participa en la activación de neutrófilos, LT, estimula la producción de citocinas y coestimula la producción de anticuerpos por LB. Otra citocina proinflamatoria que fue descrita por el Dr. kishimoto al final de los años ochenta en tejido sinovial reumatoide [43], es la interleucina 6 (IL-6) [23]. La IL-6 fue identificada como un factor producido por los LT [43] y al igual que la IL-1 contribuye al desarrollo de osteoporosis y destrucción articular en AR mediante la proliferación de los fibroblastos sinoviales y de la diferenciación de los osteoclastos [23,46].
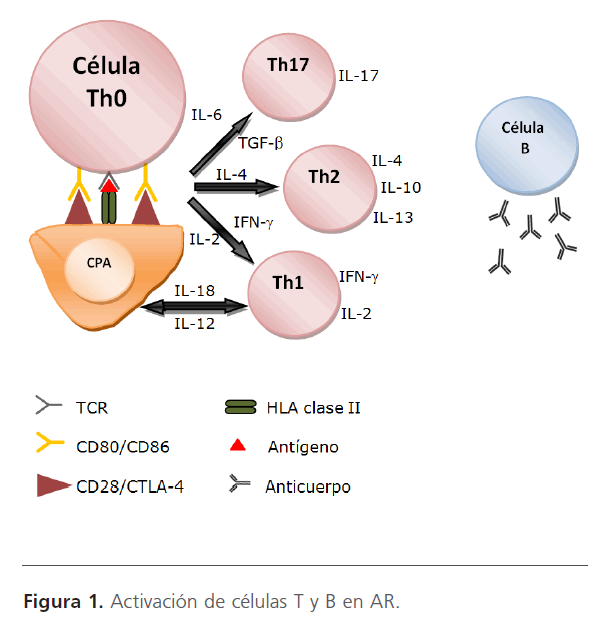
Figura 1: Activación de células T y B en AR.
Anteriormente se creía que los LB desempeñaban un papel colateral en la patogenia de AR. Sin embargo, es importante señalar que su participación implica diversos mecanismos in- cluyendo la producción de auto-anticuerpos, la activación de LT y la secreción de factores solubles proinflamatorios y efectores como son IL-6, IL-10, TNF-a, etc. [8]. Se ha demostrado que una forma de activar las células B, es por la co-ligadura de los receptores tipo toll (TLRs) con el receptor de células B (BCR) en artritis inducida por colágeno con destrucción de las articulaciones y el TLR9 inducido por CpG colaborando a la activación de artritis inducida por adyuvantes [2].
Criterios de clasificación para el diagnóstico de la AR
La investigación de auto-anticuerpos en el suero de pacientes con enfermedades reumáticas ha sido muy importante en los últimos 20 años y aunque su valor diagnostico es limitado, la principal utilidad de estos auto-anticuerpos ha sido utilizarlos como marcadores para el diagnóstico, y en algunos casos ayudan además a identificar subgrupos clínicos de ciertas enfermedades [47].
Para determinar el diagnóstico de una enfermedad reumática, se basan en los criterios de unanimidad de diagnóstico establecidos por el CAR revisados en 1987, basándose en características clínicas cuya presencia implica la existencia de daño tisular previo [14,20,48]. En 2010 fueron publicados nuevos criterios de clasificación para AR en una acción conjunta de la Liga Europea Contra el Reumatismo (EULAR, por sus siglas en inglés) y el CAR con la intención de determinar la enfermedad de forma temprana y mejorar los criterios [30,33,49].
Los nuevos criterios de clasificación de AR se aplican a una población con las siguientes características como se muestra en la tabla 1:
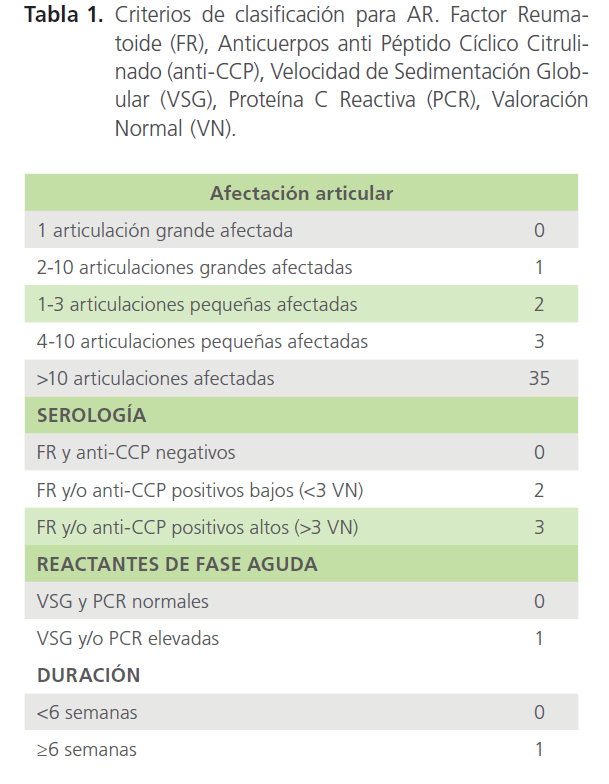
Tabla 1: Criterios de clasificación para AR. Factor Reumatoide (FR), Anticuerpos anti Péptido Cíclico Citrulinado (anti-CCP), Velocidad de Sedimentación Globular (VSG), Proteína C Reactiva (PCR), Valoración Normal (VN).
• Presentar al menos una articulación con sinovitis clínica y que dicha sinovitis no pueda explicarse por el padecimiento de otra enfermedad.
• Tener una puntuación igual o superior a 6 en el sistema de puntuación que se presenta en la tabla 1 y que considera la distribución de la afectación articular, serología del FR y/o anti-CCP, aumento de los reactantes de fase aguda y la duración igual o superior a semanas
Estos criterios que también permiten hacer el diagnóstico en aquellos pacientes que presenten una AR evolucionada siempre que:
• Tengan erosiones típicas de AR
• Presenten una enfermedad de larga evolución (activa o inactiva) cuyos datos retrospectivos permitan la clasificación con los criterios mencionados [33]
Los criterios de clasificación de la AR de 1987 y de 2010 tienen diferencias importantes. La primera de ella es la población específica a la que se aplica, ya que los criterios de 1987 se pueden aplicar a cualquier individuo, los criterios del 2010 están diseñados para ser aplicados exclusivamente a pacientes con artritis indiferenciada que no pueda ser justificada por otras causas. Las diferencias en los criterios valorados, se puede ver como desaparece la valoración de la rigidez matutina, así como la afectación de las manos o la afectación simétrica. La localización de la afectación articular para valorar tanto el numero de articulaciones afectadas, entre 1 (es el mínimo) a más de 10 como tamaño de las articulaciones afectadas, si se trata de grandes articulaciones (entre las que se consideran los hombros, codos, caderas, rodillas y tobillos) o pequeñas articulaciones. Los nódulos reumatoides dejan de formar parte de los criterios ya que se consideraron como una expresión tardía de la enfermedad y estos nuevos criterios están destinados al diagnóstico precoz de ésta [33].
Una de las diferencias más importantes en los criterios del 2010 es la valoración de los marcadores serológicos de AR y de los reactantes de fase aguda. En cuanto a los factores serológicos, además de presenciar el FR, valora por primera vez la presencia de los anti-CCP. También introducen los reactantes de fase aguda, velocidad de sedimentación globular y Proteína C Reactiva (PCR). Los cambios radiológicos también cambian ya que se consideraban las lesiones típicas de AR como uno o más de los criterios que se deben considerar a la hora de realizar la clasificación (1987), en los criterios del 2010, las lesiones radiológicas típicas de la AR no se incluyen en el sistema de puntuación, sino que el hecho de presentar lesiones típicas de AR hacen que el paciente sea diagnosticado directamente como afectado de AR. Otro cambio, es la duración de los síntomas. Anteriormente (1987) se requería que los criterios del 1 al 4 estuviesen presentes un mínimo de 6 semanas (rigidez matutina y artritis), en los nuevos criterios del 2010 la duración igual o mayor a 6 semanas es otro punto que se debe tener en cuenta, aunque no es prescindible para poder realizar el diagnóstico de AR [33].
Pruebas de laboratorio usadas para el diagnóstico de AR
Existen técnicas de laboratorio que ayudan a conocer el diagnóstico de enfermedades autoinmunes y permiten identificar cualitativa y cuantitativamente los antígenos reconocidos. Estas técnicas son las inmunofluorescencia indirecta (IFI), el ensayo inmunoenzimático (ELISA), el ensayo luminométrico múltiple (ELM) y el Western blot [32,50,51].
Conclusiones
La artritis reumatoide es una enfermedad, crónica, que implica diversos factores de riesgo para su desarrollo. En México existe una alta prevalencia de AR siendo mayor en el estado de Yucatán, situación que contrasta con otras partes del país y con otras zonas del mundo. En la práctica clínica, se pretende un diagnóstico más temprano de acuerdo a los criterios del CAR-EULAR 2010; con el objetivo de mejorar la calidad de vida de éstos pacientes.
703
References
- Álvares LB. Artritis reumatoide. Díaz de Santos, Madrid, España. 2003.
- Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH. Rheumatoid arthritis. Philadelphia. 2009.
- Sánchez-Rodríguez SH, Barajas-Vázquez GE, Rámirez-Alvarado ED, Moreno-García A, Barbosa-Cisneros OY. El fenómeno de autoinmunidad: enfermedades y antígenos relacionados. Rev Biomed 2004;15:4955.
- Roig VD, Hoces HC. Efecto de la coexistencia de fibromialgia en el índice DAS28 en mujeres con artritis reumatoide. Reumatol Clin. 2008;4:96-99.
- Moreno J, Vázquez-Ortiz G, López-Blanco JA, López-Romero R, Medina F. Hacia un tratamiento no empírico de la artritis reumatoide basado en su patogenia molecular. Reumatol Clin. 2008;4:19-31.
- Pérez ML, Gómara MJ, Kasi D, Alonso A, Viñas O, Ercilla G, et al. Synthesis of overlapping fibrin citrullinated peptides and their use for diagnosing rheumatoid arthritis. Chem Biol Drug Des 2006,68:194- 200.
- Rueda B, Orozco G, Sánchez E, Oliver J, Martín J. Factores genéticos comunes en autoinmunidad. Reumatol Clin. 2008;4:supl 1S1-4.
- Díaz-González JF, Ferraz AI. La célula B en la patogenia de la artritis reumatoide. Reumatol Clin. 2007;3:176-182.
- García VM, Quesada MMS. Artritis reumatoide fisiopatología y tratamiento. Centro Nacional de Información de Medicamentos, Instituto de Investigaciones, Farmacéuticas, Facultad de Farmacia, Universidad de Costa Rica. 2004.
- Mahler M, Fritzler MJ. Epitope specificity and significance in systemic autoimmune diseases. Ann. N.Y. Acad. Sci. 2010;1183:267-287.
- Carbonell J, Badia X, EXPRESAR G. desarrollo y validación de un cuestionario de satisfacción con el tratamiento en pacientes con artritis reumatoide. Reumatol Clin. 2006;2:173-145.
- Schellekens GA, Hendrik V, De Jong BAW, Van Den Hoogen FHJ, Hazes JMW, Breedveld FC, et al. The diagnostic properties of rheumatoid arthritis antibodies recognizing a cyclic citrullinated peptide. Arthritis & Reumatism 2000;43:155-163.
- Olivares Martínez E, Hernández Ramírez DF, Núñez-Álvares CA, Caiedes J. proteínas citrulinada en artritis reumatoide. Reumatol Clin. 2010;doi:10.1016/j.reuma.2009.09.010.
- Jaude AN. Anticuerpos anti-péptido citrulinado cíclico en artritis reumatoide, artritis psoriática y otras enfermedades. Reumatología 2007;23:142-150.
- Xibillé-Friedmann D, Mondragón-Flores V, Horcasitas de la Rosa C. Criteria used by primary care physicians for the diagnosis and referral to a rheumatologist of patients with rheumatoid arthritis. Reumatol Clin. 2006;2:235-238.
- Ábalos MGM, Rúiz VG, Sánchez CD, Rúiz VR, Ramírez RJ, Raya AE, et al. calidad de vida relacionada con la salud tras terapia anti-factor de necrosis tumoral alfa en pacientes con artritis reumatoide. Un estudio piloto. Reumatol Clin. 2011;7:167-171.
- Peláez-Ballestas I, Sanin LH, Moreno Montoya J, Álvarez Nemegyei J, Burgos-Vargas R, Garza-Elizondo M, et al. Epidemiology of the rheumatic diseases in Mexico. A study based on the COPCORD methodology. J Rheumatol Suppl. 2011;38(3):585.
- Alvares-Nemegyei J, Peláez-Ballestas I, Sanin LH, Cardiel MH, Ramirez- Angulo A, Goycochea-Robles MV. Prevalence of Musculoskeletal Pain and Rheumatic Diseases in the Southeastern Region of Mexico. A COPCORD-Based Community Survey. J Rheumatol Suppl. 2011;86:21- 25.
- García-Lechuz JMM. Los agentes infecciosos en la etiopatogenia de las enfermedades reumáticas. Reumatol Clin. 2008;4supl3:29-34.
- Cardiel MH. Epidemiología de la Artritis Reumatoide. Conceptos y retos actuales. Reumatología 2005; 21(3).
- Serrano HA. Células colaboradoras (TH1, TH2, TH17) y reguladoras (Treg, TH3, NKT) en la artritis reumatoide. Reumatol Clin. 2009;5:1-5.
- Van Der Woude D, Lie BA, Lundström E, Balsa A, Feitsma AL, Houwing-Duistermaat JJ, et al. Protection against anti-citrullinated protein antibody-positive rheumatoid arthritis is predominantly associated with HLA-DRB1*1301. Arthritis & Rheumatism 2010;62:1236-1245.
- Rego-Pérez I, Fernandez-Moreno M, Carreira-García V, Blanco FJ. Polimorfismos genéticos y farmacogenética en la artritis reumatoide. Reumatol Clin. 2009;5:268-279.
- Verpoort KN, Cheung K, Ioan-Facsinay A, Van der Helm-van Mil AH, de Vries-Bouwstra JK, Allart CF, et al. Fine Specifity of the Anti-citrullinated Protein Antibody Response Is Influenced by the Shared Epitope Alleles. Arthritis & Rheumatism. 2007;56:3949-3952.
- Snir O, Widhe M, Hermansson M, Von Spe C, Lindberg J, Hensen S, et al. Antibodies to several citrullinated antigens are enriched in the joints of rheumatoid arthritis patients. Arthritis & Rheumatism 2010;62:44- 52.
- González-Gay MA, González-Juanatey C. Enfermedad cardiovascular en artritis reumatoide. Importancia y tratamiento clínico. Reumatol Clin. 2009;5:95-97.
- Von Delwing A, Locke J, Robinson JH, Wan-fai N. Response of Th17 to a citrullinated erthritogenic aggrecan peptide in patients with rheumatoid arthritis. Arthritis & Rheumatism 2010;62:143-149.
- Rodríguez-Mahou M, López-Longo FJ, Sánchez-Ramón S, Estecha A, García-Segovia A, Rodríguez-Molina JJ, et al. Asociation of Anti-Cyclic citrullinated peptide and Anti-Sa/citrullinated vimentin autoantibodies in rheumatoid arthritis. Arthritis & Rheumatism 2006;55:657-661.
- Gómez CA. Anticuerpos antipéptidos citrulinados en la artritis reumatoide. Rev Esp Reumatol 2004;31:165-8.
- Sanmartí R, Gómez-Puerta JA. Biomarcadores en la artritis reumatoide. Reumatol Clin. 2011;6:525-528.
- Aggarwal R, Liao K, Nair R, Ringold S, Costenbader KH. Anti-citrullinated peptide antibody assays and their role in the diagnosis of rheumatoid arthritis. Arthritis & Rheumatism 2009;61:1472-1483.
- Hernández RDF, Cabiedes J. Técnicas inmunológicas que apoyan el diagnostico de enfermedades autoinmunes. Reumatol Clin. 2010;6:173-177.
- Gómez A. Nuevos criterios de clasificación de artritis reumatoide. Reumatol Clin. 2011;6:533-537.
- Feitsma AL, Van der Vort EIH, Franken KLMC, El Bannoudi H, Elferink BG, Drijfhout JW, et al. Identification of citrullinated vimentin peptides as T cell epitopes in HLA-DR4-positive patients with rheumatoid arthritis. Arthritis & Rheumatism 2010;62:117-125.
- Kinloch A, Lundberg K, Wait R, Wegner N, Lim NH, Zendman AJW, et al. Synovial fluid is a site of citrullination of autoantigens in inflammatory arthritis. Arthritis & Rheumatism 2008;58:22872295.
- De Rycke L, Nicholas AP, Cantaert T, Kruitof E, Echols JD, Vandekerckhove B, et al. Synovial intracellular citrullinated proteins colocalizing with peptidyl arginine deiminase as pathophysiologically relevant antigenic determinants of rheumatoid arthritis-specific humoral autoimmunity. Arthritis & Rheumatism 2005;52:2323-2330.
- Cantaert T, De Ricke L, Bongartz T, Matteson EL, Tak PP, Nicholas AP, et al. Citrullinated proteins in rheumatoid arthritis. Arthritis & Rheumatism 2006;54:3381-3389.
- Van Gaalen FA, Van Aken J, Huizinga TWJ, Schreuder GMT, Breebveld FC, Zanelli E, et al. Association between HLA class II genes and autoantibodies to cyclic citrullinated peptides (CCPs) influences the severity of rheumatoid arthritis. Arthritis & Rheumatism 2004;50:2113- 2121
- Levesque MC, Zhou Z, Moreland LW. Anti-cyclic citrullinated peptide testing for the diagnosis of rheumatoid arthritis and quest for improved sensitivity and predictive value. Arthritis & Rheumatism 2009;60:2211-2215.
- Vossenaar ER, Smeets TJM, Kraan MC, Raats JM, Van Venrooij WJ, Tak PP. The presence of citrullinated proteins is not specific for rheumatoid synovial tissue. Arthritis & Rheumatism 2004;50:3485-3494.
- Lundberg K, Kinloch A, Fisher BA, Wegner N, Wait R, Charles P, et al. Antibodies to citrullinated a -enolase peptide 1 are specific for rheumatoid arthritis and cross-react with bacterial enolase. Arthritis & Rheumatism 2008;58:3009-3019.
- Vittecoq O, Incaurgarat B, JouenBeades F, Legoedec J, Letourneur O, Rolland D. Autoantibodies recognizing citrullinated rat filaggrin in an ELISA using citrullinated and non-citrullinated recombinant proteins as antigens are highly diagnostic for rheumatoid arthritis. Clin Exp Immunol 2004;135:173-180.
- Pablos AJL. La interleucina 6 en la fisiopatología de la artritis reumatoide. Reumatol Clin. 2009;5:34-39.
- Romero ATB, García MGE, Leal J. Citocinas y lupus eritematoso sistémico. Gac Méd Caracas 2009;117:196-211.
- Sánchez-Ramón S, López-Longo FJ, Carreño L. Interleucinas en la fisiopatología de la artritis reumatoide: más allá de las citocinas proinflamatorias. Reumatol Clin. 2011;6:520-524.
- Rueda GJ, Blanco AR. Tocilizumab en artritis reumatoide. Reumatol Clin. 2011;529-532.
- García-De la Torre I, García Valladares I. Alteraciones de laboratorio y autoanticuerpos. Reumatol Clin. 2009;5:15-19.
- Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, et al. Arthritis & rheumatism. Arthritis & rheumatism. 2010;62:2569- 2581.
- Balsa A. Definiendo la remisión en la artritis reumatoide: nuevos criterios de la ACR/EULAR. Reumatol Clin. 2011;6:512-515.
- Gelpí SC. Anticuerpos en las enfermedades autoinmunitarias sistémicas. Especial mención al lupus eritematoso sistémico. Reumatol Clin. 2008;4 supl 1s11-16.
- Cabiedes J, Núñez-Álvarez CA. Anticuerpos antinucleares. Reumatol Clin. 2010;6:224-230.









