Keywords
Cardiac surgery; blood preservation; autotransfusión; shed blood retrieval
Introducción
Con el desarrollo de técnicas quirúrgicas cada vez más complejas y la intervención de pacientes de mayor edad y riesgo, la evolución de la cirugía cardiaca en los últimos años ha elevado la demanda de sangre homóloga hasta unos niveles que, en ocasiones, superan a la oferta.
Además de la elevación del coste que supone este hecho, el empleo de sangre homóloga tiene sus riesgos, entre los que se encuentran la inmunosupresión, las reacciones transfusionales o la posibilidad de transmisión de enfermedades infecciosas. Por ello, se han puesto en marcha medidas para reducir las necesidades de sangre de banco, basadas en las técnicas de autotransfusión, el empleo de fármacos, el desarrollo de protocolos racionales de transfusión, el empleo de dispositivos especiales, etc.
En el presente trabajo se analiza la autotransfusión de la sangre recuperada del drenaje mediastínico (ASDM), procedimiento sencillo y de bajo coste, que es cronológicamente la última modalidad de autotransfusión que se puede emplear. Esta técnica consiste en recoger la sangre obtenida por los drenajes mediastínicos tras la cirugía y, simplemente mediante un filtrado para eliminar las partículas de mayor tamaño, reinfundirla directamente vía intravenosa al paciente.
Se trata de una medida controvertida, pues su eficacia y seguridad han sido cuestionadas. Se han postulado posibles efectos adversos con esta práctica, como alteraciones de la hemostasia, aumento de las infecciones postoperatorias, nefrotoxicidad y aumento de la respuesta inflamatoria del paciente, entre otras. Por otra parte, han aparecido varios trabajos que no encuentran beneficio alguno en su utilización.
En este artículo se revisan las características de la sangre recuperada del drenaje mediastínico (SDM), los efectos adversos que puede tener su reinfusión y si realmente es eficaz su utilización en la reducción de los requerimientos de sangre homóloga.
Medidas Para El Ahorro De Sangre
Está bien establecido que para ahorrar sangre de forma eficaz en cirugía cardiaca es importante un abordaje multifactorial, pues la combinación de varias técnicas es más eficaz que la suma de cada una de ellas por separado [1].
Los programas intensivos de ahorro de sangre emplean un abordaje multidisciplinar que abarca todo el periodo perioperatorio. Las medidas más importantes se reflejan en la Tabla 1.
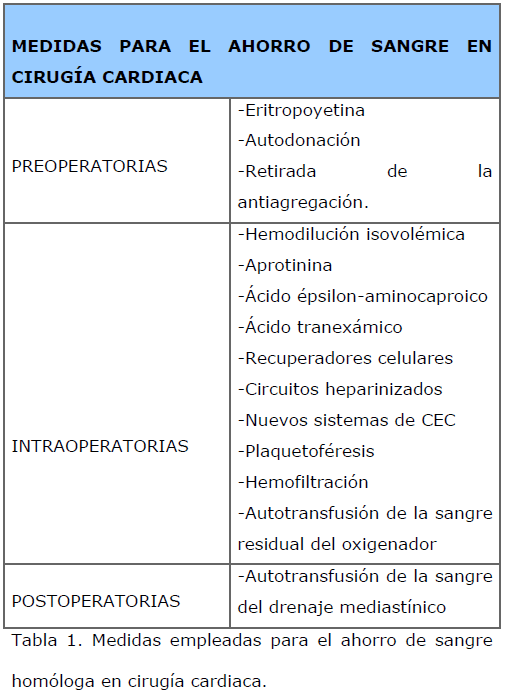
Tabla 1. Medidas empleadas para el ahorro de sangre homóloga en cirugía cardiaca.
Todas estas medidas son más efectivas en los pacientes de alto riesgo de transfusión, los cuales son el 20% de los enfermos intervenidos bajo circulación extracorpórea (CEC) y consumen el 80% de la sangre homóloga. La edad del paciente y el volumen de células rojas que posee son factores independientes que predicen una mayor necesidad de transfusiones durante y tras la intervención [1].
De todas las medidas enumeradas en la Tabla 1, hay cinco que han demostrado ser, sin duda, eficaces: Las altas dosis de aprotinina, el empleo preoperatorio de eritropoyetina, la hemodilución isovolémica, la autodonación prequirúrgica y la reinfusión de la sangre residual del oxigenador [1-3]. Así mismo, es de vital importancia la existencia de un protocolo estricto de transfusión y una correcta educación del personal sanitario en este aspecto [1,2].
Analizaremos a continuación las características de la SDM, la seguridad de su empleo y el papel real que juega en el ahorro de sangre de banco.
Características De La Sdm
Elementos formes:
• Serie roja: La concentración de hemoglobina en la SDM en los distintos estudios oscila entre 7 y 11 g/dl. y el hematocrito entre 20 y 35%. Estas cantidades son significativamente inferiores a las concentraciones basales de los pacientes y a las presentes en la sangre homóloga de banco [4], aunque ésta es una fuente no desdeñable de hematíes, y la duda surge, no tanto en cuanto a su cantidad, como en cuanto a su calidad. Se ha sospechado que, debido a su procedencia, su modo de recogida, el filtrado, etc., estos eritrocitos pudiesen estar dañados. Son numerosos los estudios que analizan estos aspectos, y todos concluyen que la vida media de estos glóbulos rojos es normal [4,5]. Incluso en uno de ellos se comprueba que su vida media es mayor que la de los hematíes de banco [6].
Morfológicamente se puede observar en los hematíes de la SDM un aumento de células crenadas, debido probablemente a un descenso de la albúmina [4], que se produce en esta sangre. Pese a esta alteración, existen estudios que valoran la fragilidad osmótica de estos eritrocitos coincidiendo en que es normal [4,6].
En cuanto al estado funcional se han realizado varios trabajos que valoran la capacidad para captar glucosa y aminoácidos, la capacidad de transporte de oxígeno, las concentraciones de ATP y de 2-3 bifosfoglicerato en estos hematíes [4,6-8] y la conclusión es que son normales. En algunos aspectos, como en el caso de la concentración de 2-3 bifosfoglicerato o la capacidad de transporte de oxígeno, son superiores a la sangre de banco [6,8].
Las células de la serie roja de la SDM no están, por tanto, significativamente dañadas, y mantienen su integridad funcional y metabólica, teniendo una vida media normal.
• Serie blanca: Su presencia en la SDM es baja, quizá debido a que sus células forman agregados, al salir del torrente sanguíneo, que son filtrados al entrar en el reservorio. De cualquier modo, no es un aspecto que se analice exhaustivamente en los estudios. Únicamente señalar que tras la CEC y la autotransfusión hay un aumento significativo de los leucocitos en la sangre del paciente, con respecto a las muestras previas a la cirugía. Este aumento se realiza a expensas de los neutrófilos y puede ser causado por una respuesta inflamatoria al trauma quirúrgico [4], aunque existen estudios que asocian la aparición de neutrófilos en sus formas inmaduras a la reinfusión de la SDM [9].
• Plaquetas: La cantidad de plaquetas en la SDM es baja, debido a varias causas. Por un lado, a la coagulación de la sangre en el saco pericárdico, y por otro, a la formación de agregados que quedan retenidos en el filtro del reservorio. La concentración de plaquetas oscila entre 20.000 y 30.000 / microlitro, cifras significativamente inferiores a las muestras basales y a la sangre de banco [4].
Proteínas:
Las proteínas totales, en general, se encuentran disminuidas, aunque existen artículos que no encuentran una disminución significativa [9].
Analizando mediante electroforesis el plasma de la SDM se observa un descenso de las concentraciones de albúmina, alfa1 y gamma globulinas. La fracción beta se eleva por ser el lugar en el que migra la hemoglobina libre, que está significativamente más elevada que en la sangre de los pacientes previa a la intervención. La hemoglobina libre tiene su importancia, pues sería la causante del fallo renal achacable a esta técnica de autotransfusión. Así, esta molécula en el ambiente ácido de los túbulos renales precipitaría y causaría un fallo renal agudo. De cualquier modo, si la cantidad de hemoglobina libre no es muy alta la haptoglobina libre en plasma la neutraliza evitando sus efectos adversos. De hecho, este fenómeno de unión ocurre ya en la SDM, donde la fracción alfa2 está elevada y es el lugar donde migra la fracción haptoglobina-hemoglobina libre. Pese a que la hemoglobina libre es uno de los elementos que se invocan como más dañinos en el empleo de la SDM, estudios que comparan su concentración en esta sangre con la de banco no encuentran diferencias significativas [4,10-12].
Efectos Adversos
Coagulopatía:
Éste es uno de los puntos clave que están a debate. Cuando se describió la técnica se supuso que esta sangre contendría, además de glóbulos rojos, plaquetas y factores de coagulación que mejorarían la hemostasia [13]. Posteriormente se han realizado estudios sobre la composición de la SDM que han demostrado que ésta es pobre en plaquetas y factores de coagulación y rica en productos de degradación de la fibrina [14]. Esto es así porque la sangre que se recoge por los drenajes mediastínicos ha sufrido en el saco pericárdico y en el mediastino un proceso de coagulación en el cual se consumen los factores de coagulación y las plaquetas, seguido un proceso de fibrinolisis que da como resultado una gran formación de productos de degradación de la fibrina. Estas alteraciones han sembrado la duda sobre los efectos perniciosos que puede tener su reinfusión para la coagulación del paciente. La observación, en algunos estudios, de una elevación de los productos de degradación de la fibrina en el plasma de los pacientes tras su empleo ha hecho sospechar que la SDM pudiese desencadenar una activación de la fibrinolisis sistémica o el desarrollo de una coagulación intravascular diseminada (CID). El problema es complejo y ha hecho mirar con recelo esta técnica y plantear muchos estudios que comprobasen qué hay de cierto en todo esto.
Todos los estudios realizados coinciden en que la SDM tiene un número bajo de plaquetas, de fibrinógeno, y de factores de la coagulación, y una cantidad elevada de factores de degradación de la fibrina y de D-dímero. Donde surgen las diferencias es al analizar qué efectos tiene esto tras la reinfusión de la sangre.
Salvo contadas excepciones [15,16] la mayoría de los estudios coinciden en que no hay una alteración significativa en las pruebas con que se valora la coagulación en la práctica clínica tras la ASDM. No obstante, tras observar en algún estudio que las cantidades totales de sangrado son mayores en los enfermos autotransfundidos con este método, se han empleado tests que miden aspectos de la coagulación no valorados de forma habitual. Uno de ellos es el tromboelastograma, prueba funcional que mide la interacción de las plaquetas con los factores de la coagulación en la formación del coágulo. Un trabajo de Vertrees R.A. y cols. describe que la formación del coágulo, estudiada mediante dicha prueba, es más lenta, y el coágulo formado es más laxo, en los pacientes en los que se ha practicado ASDM, lo que podría explicar la tendencia a la mayor duración del sangrado en los pacientes autransfundidos de su estudio [9]. Sin embargo, otros trabajos que valoran el tromboelastograma en estos pacientes lo encuentran normal [17].
Otro aspecto fundamental es si la SDM puede activar la fibrinolisis sistémica una vez reinfundida. Todos los estudios sobre este hecho coinciden en que, tanto las alteraciones en la coagulación (cuando éstas se producen), como los niveles de productos de la fibrinolisis presentes en los pacientes tras la ASDM, están en relación con el volumen infundido [15,18,19]. Éste un hallazgo importante, pues garantiza que cantidades moderadas de SDM (en torno a 800cc) puedan ser empleadas de forma segura sin actuar como desencadenantes de una cascada sistémica que deteriore la coagulación.
No existe ningún estudio que pruebe que la ASDM pueda causar CID. Sí parece que puede hacer más difícil su diagnóstico al elevar los productos de la fibrinolisis en el plasma del paciente [14,19].
Tras todo lo expuesto, lo más importante en la práctica es saber si los enfermos autotransfundidos por esta técnica sangran más en el postoperatorio o no.
Salvo en un estudio de Varennes B. y cols., de 1996, donde se observa que el grupo de enfermos autotransfundidos sangra menos que el control [20], en general, los estudios, o no encuentran diferencias en cuanto al volumen total de sangrado, o bien observan un mayor sangrado en los pacientes autotransfundidos. En la Tabla 2 se exponen los resultados de los estudios revisados.
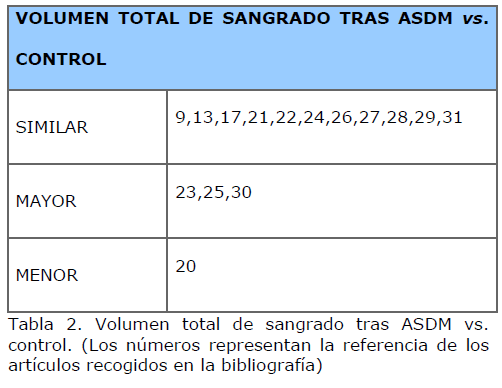
Tabla 2. Volumen total de sangrado tras ASDM vs. control. (Los números representan la referencia de los artículos recogidos en la bibliografía)
De cualquier modo, el objetivo de la mayoría de los trabajos es demostrar si el empleo de esta técnica produce un ahorro en el empleo de la sangre de banco. Así, publicaciones en las que se observa que los pacientes autotransfundidos tienen un mayor volumen de sangrado refieren una menor transfusión de sangre homóloga que en el grupo control [30].
Infecciones:
La infusión intravenosa de la SDM sin procesar ha hecho sospechar su asociación con complicaciones infecciosas y sepsis.
Surge la duda, en primer lugar, sobre si la sangre obtenida por este método está o no contaminada, y en segundo lugar, sobre la repercusión clínica que esto tiene.
Varios estudios han cultivado la SDM durante el periodo en el que se realiza la autotransfusión. Los datos varían desde un 0% de contaminación [15] a un 22% [32]. Las causas de esta gran variabilidad vienen dadas por el empleo de muestras de distinto volumen (a más volumen de muestra, más posibilidad de cultivo positivo), el empleo de distintos sistemas de cultivo (cada uno con una sensibilidad diferente) y a la interpretación de determinados cultivos positivos (como estafilococos coagulasa negativos o difteroides) como contaminación al obtener las muestras.
Andersen A.S. y cols., en un estudio bien diseñado, observan que al iniciar la autotransfusión el 22% de las muestras de SDM presentan cultivos positivos. El germen más frecuente es el Stafilococo epidermidis, seguido de otros estafilococos coagulasa negativos. Lo curioso es que, tras 18 horas, sólo en el 4% de las muestras se mantenían cultivos positivos. Esto sugiere que los gérmenes presentes en la SDM son organismos que contaminaron el campo quirúrgico durante la intervención, y que a medida que pasan las horas, van desapareciendo por efecto del sistema inmunológico y de la profilaxis antibiótica administrada perioperatoriamente [32].
En cuanto a la repercusión clínica de estos hallazgos, la mayoría de los estudios concluyen que no hay un aumento de las complicaciones infecciosas [21,22].
Existen trabajos que asocian la ASDM con una mayor incidencia de reacciones febriles en el postoperatorio inmediato [9,23], y con una mayor elevación de formas inmaduras de neutrófilos [9], pero sin poder asociar este hecho a causas infecciosas, estando posiblemente en relación con alteraciones en la respuesta inflamatoria sistémica.
Body S.C. y cols., describen que, en el subgrupo de pacientes autotransfundidos que no han recibido sangre homóloga, la incidencia de infecciones de la herida quirúrgica es mayor [29].
Por su parte, Dial S. y cols., en un estudio retrospectivo comparan 11 enfermos con mediastinitis con 33 pacientes control, encontrando que la ASDM durante más de 6 horas estaba asociada con el desarrollo de esta complicación [33].
Éstos son los dos únicos estudios en los que se aboga por una relación entre la ASDM y las complicaciones infecciosas. El resto de investigadores consideran que, en general, no parece existir relación.
Nefrotoxicidad:
Se ha intentado asociar la ASDM con el desarrollo de alteraciones renales, sobretodo en función de los efectos dañinos de la hemoglobina libre, ya expuestos anteriormente. Dado el efecto neutralizador de la haptoglobina plasmática del paciente, sólo algún estudio aislado ha podido demostrar un aumento de la hemoglobina libre tras la reinfusión. [34]. Únicamente un estudio ha encontrado un aumento de la creatinina en los pacientes autotransfundidos, aunque de forma transitoria y trivial [16].
Respuesta inflamatoria sistémica:
Otro factor a tener en cuenta es la posible contribución de la ASDM en la respuesta inflamatoria sistémica, importante por su asociación con disfunción orgánica, fallo renal, sangrado excesivo e incluso daño miocárdico35. El problema surge por el hecho de que la CEC por sí misma, el trauma quirúrgico, los fenómenos de isquemia reperfusión y la liberación de endotoxinas, producen un aumento de las citocinas, y es difícil discriminar si el aumento de todos estos factores se debe a estas circunstancias o a la autotransfusión [35]. Hay estudios que prueban que la ASDM no produce alteraciones significativas en el patrón de citocinas presentes tras la intervención. Lo característico de la SDM es la elevación de la IL- 1b y de la IL-6 [4,36], por encima de lo observado en la sangre del paciente tras CEC, aunque la mayoría de las investigaciones concluyen que la reinfusión no aumenta significativamente sus valores en la sangre del paciente. Westerberg M. y cols., en un estudio de 2004, encuentran que los niveles de TNF-alfa, IL-6 y del factor C3a del complemento se elevan en el plasma de los pacientes de forma significativamente mayor que en los no autotransfundidos [35]. De cualquier modo, en este estudio se analizan conjuntamente la autotransfusión de la sangre aspirada del campo durante la intervención y la ASDM, por lo que no discrimina entre el efecto de cada una de estas medidas por separado. No se perciben, de todas maneras, repercusiones clínicas de estos hallazgos bioquímicos. Otra hipótesis que se ha barajado es la posibilidad de que la SDM no produzca una respuesta inflamatoria sistémica por efecto directo de las citocinas que contiene, sino por actuar de desencadenante de una activación más amplia en el paciente una vez reinfundida. Estudios in vitro sugieren que la SDM produce activación leucocitaria, lo que indicaría que puede aumentar la respuesta inflamatoria. Esto no ha podido ser probado in vivo [36]. En general, la activación de la respuesta inflamatoria sistémica por la ASDM no ha podido ser claramente probada, al igual que la posible repercusión clínica que se pudiese derivar de ella. Sólo alguna publicación aislada ha asociado esta alteración inflamatoria sistémica con la presencia de un número mayor de síndromes febriles en el postoperatorio inmediato en los enfermos autotransfundidos [9,23].
Daño miocárdico:
También la ASDM se ha intentado asociar con un posible daño miocárdico. Los mecanismos por los que podría producirse no están claros y podrían estar en relación con la activación de la reacción inflamatoria sistémica. Sólo un estudio de Kitano T y cols., del año 2000, encuentra un deterioro en la fracción de eyección del ventrículo derecho inmediatamente tras la reinfusión de la SDM, recobrando su función normal a los 120 minutos. Este deterioro de la función del ventrículo derecho se asocia con un incremento de los niveles de tromboxano A2 tras la reinfusión de la sangre, aumentando la presión arterial pulmonar. Los niveles de tromboxano A2 adquieren niveles normales a los 120 minutos tras la autotransfusión, normalizándose en este momento la función ventricular del paciente [37]. No existen más estudios que asocien el empleo de la ASDM con un deterioro de la función contráctil ventricular. Sí se ha visto que los niveles de enzimas cardiacas empleados en el diagnóstico de daño miocárdico, como son la CK, la CK-MB, la LDH [38,39] e incluso la Troponina I [40], se encuentran muy elevados en la SDM, y que, tras la reinfusión, aumentan de forma significativa sus valores en el plasma del paciente, tanto más cuanto más volumen sea infundido. El hecho de que la SDM tenga unos elevados niveles de estos marcadores, y que su elevación en el plasma del paciente dependa del volumen infundido, va en contra de que la autotransfusión cause deterioro ventricular. Lo que sí es cierto es que en los pacientes autotransfundidos la valoración de daño miocárdico por estos métodos debe ser analizada con cautela ya que pueden aparecer falsos positivos [40].
En un estudio retrospectivo, Flom- Halvorsen H.I. y cols. analizan 4916 pacientes coronarios intervenidos de forma consecutiva en los que se utilizó la ASDM de manera sistemática. Pese a las características del estudio, tiene interés por ser la serie más amplia publicada de pacientes en los que se ha empleado esta técnica. Las cifras de sangrado y el resto de las complicaciones clínicas que refieren están acorde con lo esperado. Se transfundió con sangre de banco a menos del 4% de los pacientes. Los autores postulan que hay una disparidad entre los hallazgos de laboratorio y las complicaciones clínicas que presentan los pacientes a los que se les realiza ASDM. Así, aunque se puedan demostrar ciertas alteraciones bioquímicas en los pacientes autotransfundidos, es difícil demostrar que éstas tengan una repercusión clínica significativa [28].
Eficacia
Una vez analizada la seguridad de la técnica, se analizará si su empleo es eficaz en el ahorro de sangre homóloga.
Numerosos estudios han investigado el problema y desde los esperanzadores resultados de los trabajos iniciales, que encontraban un ahorro del 50% en el empleo de sangre homóloga, poco a poco han ido apareciendo otros que demuestran un ahorro menor e incluso que no encuentran ninguna ventaja en su empleo.
Hay varios factores que pueden ayudar a entender esta disparidad de resultados. Por un lado, los protocolos de transfusión no son equiparables entre los distintos estudios, por otro, a lo largo de los años se han ido adoptando otras técnicas, enumeradas en la introducción de este artículo, que han hecho que el volumen de sangrado postoperatorio se reduzca. Conviene tener en cuenta que la mayor parte de los estudios prospectivos y randomizados existentes cuentan con un número pequeño de pacientes, con lo que la potencia estadística para detectar un potencial beneficio es pequeña. En la Tabla 3 se exponen los resultados de las publicaciones analizadas.

Tabla 3. Estudios que valoran la eficacia de la ASDM en el ahorro de sangre de banco. (Los números representan la referencia de los artículos recogidos en la bibliografía)
Schirmer U. y cols., en un trabajo de 1997, analizan el volumen de sangrado tras la cirugía cardiaca programada en su centro y concluyen que, sólo un 13% de los varones a los que se les practica un recambio valvular, y sólo un 8% del resto de los grupos de pacientes, sangran más de 400cc en las primeras 6 horas. El estudio postula que este volumen de drenado es insuficiente para que la aplicación rutinaria de la ASDM sea eficaz en el ahorro de sangre de banco [41]. Esta forma de abordar el problema nos puede dar una pista sobra las causas por las cuales hay publicaciones que no encuentran utilidad en la aplicación sistemática de esta técnica.
La mayoría de los artículos analizados concluyen que la ASDM es eficaz. De todos modos, es una medida que se debe integrar en una estrategia multidisciplinar que abarque todo el periodo perioperatorio [1]. Se han identificado varios factores que predicen la necesidad de transfundir: elevada edad, sexo masculino, anemia preoperatoria, baja superficie corporal y sangrado importante tras la intervención [30]. Como ya se ha expuesto, el 20% de los pacientes intervenidos consumen el 80% de la sangre transfundida [1]. Es en estos subgrupos de pacientes de alto riesgo para la transfusión donde los beneficios con el empleo de esta técnica son mayores [30].
Conclusiones
La ASDM es una más de las medidas a emplear para el ahorro de sangre de banco en cirugía cardiovascular, y es en el seno de un programa integral, que abarque todo el periodo perioperatorio, donde cobra auténtico sentido. La SDM contiene una cantidad importante de hematíes que no están significativamente dañados, mantienen su integridad estructural y metabólica y tienen una vida media normal.
Los factores de coagulación y las plaquetas están muy disminuidos en la SDM y los productos de degradación de la fibrina están muy elevados. No parece que la ASDM aumente de forma significativa el volumen de sangrado postquirúrgico, y no se ha podido demostrar que sea causa de coagulopatía o CID.
La ASDM no aumenta el número de complicaciones infecciosas ni renales.
La activación de la respuesta inflamatoria sistémica con el empleo de esta técnica no ha podido ser probada.
La ASDM no produce daño miocárdico aunque su reinfusión aumenta los niveles plasmáticos de CPK, CPK-MB, LDH, e incluso la Troponina-I, con lo cual la isquemia cardiaca medida con estos parámetros debe ser analizada con cautela, pues pueden aparecer falsos positivos.
Los estudios que analizan la eficacia de la técnica arrojan resultados dispares. En los subgrupos de pacientes de alto riesgo de transfusión (elevada edad, sexo masculino, anemia preoperatoria, reducida superficie corporal, sangrado postoperatorio importante) es donde se obtiene un mayor beneficio.
1418
References
- Ferraris VA, Ferraris SP. Limiting excessive postoperative blood transfusion after cardiac procedures. Heart Inst J 1995;22:216-30.
- Hardy JF, Belisle S, Janvier G, Samama N. Reduction in requirements for allogeneic blood products: nonpharmacologic methods. Ann Thorac Surg 1996;62(2):1935-43.
- Ohuchi H, Fukuda I. Reduction of homologous blood in elective cardiac surgery with miscellaneous autologous blood transfusion: especially with shortterm predonation method. Nippon Kyobu Geka Gakkai Zasshi 1996;44(7):891-8.
- Salas Millán J, de Vega NG, Carmona Aurioles J, Negri Arjona S, García-Vallejo JJ, Muñoz Gómez M. Autotransfusión postoperatoria en cirugía cardiaca. Características hematológicas, bioquímicas e inmunológicas de la sangre recuperada del drenaje mediastínico. Rev Esp Anestesiol Reanim 2001;48:122-30.
- Schmidt H, Lund JO, Nielsen SL. Autotransfused shed mediastinal blood has normal erythrocyte survival. Ann Thorac Surg 1996;62(1):105-8.
- Schmidt H, Kongsgaard UE, Geiran O, Brosstad F. Autotransfusion after open Heart surgery: quality of shed mediastinal blood compared to banked blood. Acta Anaesthesiol Scand 1995;39(8):1062-5.
- Schmidt H, Kongsgaard U, Kofstad J, Geiran O, Refsum HE. Autotransfusion after open heart surgery: the oxygen delivery capacity of shed mediastinal blood is maintained. Acta Anaesthesiol Scand 1995;39(6):754-8.
- Schmidt H, Folsgaard S, Mortensen PE, Jensen E. Impact of autotransfusion after coronary artery bypass grafting on oxygen transport. Acta Anaesthesiol Scand 1997;41(8):995-1001.
- Vertrees RA, Conti VR, Lick SD, Zwischenberger JB, McDaniel LB, Shulman G. Adverse effects of postoperative infusion of shed mediastinal blood. Ann Thorac Surg 1996;62:717-23.
- Walpoth BH, Volken U, Nydegger U, Jutzi H, Gersbach P, Leupi F, Schupbach P, Althaus U. Retansfusion of thoracic drainage blood: qualitative analysis. Helv Chir Acta 1990;57(2):385-8.
- Kongsgaard UE, Tollofsrud S, Brosstad F, Ovrum E, Bjornskau L. Autotransfusion after open heart surgery: characteristics of shed mediastinal blood and its influence on the plasma proteases in circulating blood. Acta Anaesthesiol Scand 1991;35(1):71-6.
- Nagamine S, Tabayashi K, Yamaki S, Haneda K, Suzuki Y, Mohri H. Clinical experience of autotransfusion system (ATS)—changes in free hemoglobin and haptoglobin. Kyobu Geka 1989;42(3):199-202.
- Schaff HV, Hauer JM, Bell WR, Gardner TJ, Donahoo JS, Gott VL, Brawley RK. Autotransfusion of shed mediastinal blood after cardiac surgery: a prospective study. J Thorac Cardiovasc Surg 1978;75(4):632-41.
- Hartz RS, Smith JA, Green D. Autotransfusion after cardiac operation. Assessment of hemostatic factors. J Thorac Cardiovasc Surg 1988;96(1):178- 82.
- Fuller JA, Buxton BF, Picken J, Harris RA, Davies MJ. Haematological effects of reinfused mediastinal blood after cardiac surgery. Med J Aust 1991;154(11):737- 40.
- Imawaki S, Maeta H, Shiraishi Y, Arioka I, Ugawa T, Tanaka S. Is it safe and available to transfuse directly the shed mediastinal blood after cardiac surgery?. Nippon Kyobu Geka Gakkai Zasshi 1994;42(1):31-7.
- Murphy GJ, Allen SM, Unsworth-White J, Lewis CT, Dalrymple-Hay MJ. Safety and efficacy of perioperative cell salvage and autotransfusion after coronary artery bypass grafting: a randomised trial. Ann Thorac Surg 2004;77(5):1553-9.
- Walpoth-Aslan BN, Walpoth BH, Rogulenko R, Friedli D, Regli B, Lanz M, Gygax E, Wuthrich P, Althaus U. Effect of postoperative retransfusion of autologous blood products on hemostasis in heart surgery. Schweiz Med Wochenschr 1996;126(45):1940-3.
- Griffith LD, Billman GF, Daily PO, Lane TA. Apparent coagulopathy caused by infusion of shed mediastinal blood and its prevention by washing of the infusate. Ann Thorac Surg 1989;47(3):400-6.
- de Varennes B, Nguyen D, Denis F, Ergina P, Latter D, Morin JE. Reinfusion of mediastinal blood in CABG patients: impact on homologous transfusions on rate of re-exploration. J Card Surg 1996;11(6):387-95.
- Lepore V, Radegran K. Autotrasfusion of mediastinal blood in cardiac surgery. Scand J Thorac Cardiovasc Surg 1989;23(1):47-9.
- Eng J, Kay PH, Murday AJ, Shreiti I, Harrison DP, Norfolk DR, Barnes I, Hawkey PM, Inglis TJ. Postoperative autologous transfusion in cardiac surgery. A prospective, randomised study. Eur J Cardiothorac Surg 1990;4(11):595-600.
- Bouboulis N, Kardara M, Kesteven PJ, Jayakrishnan AG. Autotransfusion after coronary artery bypass surgery: is there any benefit? J Card Surg 1994;9(3):314- 21.
- Axford TC, Dearani JA, Ragno G, MacGregor H, Patel MA, Valeri CR, Khuri SF. Safety and therapeutic effectiveness of reinfused shed blood after open heart surgery. Ann Thorac Surg 1994;57:615- 22.
- Morris JJ, Tan YS. Autotransfusion: is there a benefit in a current practice of aggressive blood conservation? Ann Thorac Surg 1994;58(2):502-7.
- Zhao K, Xiao M, Deng S. Autotrasfusion of shed mediastinal blood after open heart operation. Zhonghua Wai Ke Za Zhi 1996;34(8):497-9.
- Komiya T, Ban K, Yamazaki K, Date O, Nakamura T, Kanzaki Y. Blood conservation effect and safety of shed mediastinal blood autotransfusion after cardiac surgery. Jpn J Thorac Cardiovasc Surg 1998;46(10):961-5.
- Flom-Halvorsen HI, Ovrum E, Tangen G, Brosstad F, Ringdal MAL, Oystese R. Autotransfusion in coronary artery bypass grafting: disparity in laboratory tests and clinical performance. J Thorac Cardiovasc Surg 1999;118:610-7.
- Body SC, Birmingham J, Parks R, Ley C, Maddi R, Shernan SK, et al. Safety and efficacy of shed mediastinal blood transfusion after cardiac surgery: a multicenter observational study. Multicenter Study of Perioperative Ischemia Research Group. J Cardiothorac Vasc Anesth 1999;13(4):410-6.
- Martin J, Robitaille D, Perrault LP, Pellerin M, Page P, Searle N, el al. Reinfusion of mediastinal blood after heart surgery. J Thorac Cardiovasc Surg 2000;130(3):499-504.
- Kangli Z, Jianping XU, Shengshou HU, Quingyu WU, Yizhen W, Yinglong L. Autotransfusion of shed mediastinal blood after open heart surgery. Chin Med J 2003;116(8):1179-1182.
- Andersen AS, Schmidt H, Jarlov JO, Skov R. Autologous transfusion of shed mediastinal blood after coronary artery bypass grafting and bacterial contamination. Ann Thorac Surg 2001;72:1327-30.
- Dial S, Nguyen D, Menzies D. Autotransfusion of shed mediastinal blood: a risk factor for mediastinitis after cardiac surgery? Results of a cluster investigation. Chest 2003;124(5):1847- 51.
- Kongsgaard UE, Tollofsrud S, Brosstad F, Ovurm E, Bjornskau L. Autotransfusion after open heart surgery: characteristics of shed mediastinal blood and its influence on the plasma proteases in circulating blood. Acta Anaesthesiol Scand 1991;35(1):71-6.
- Westerberg M, Bengtsson A, Jeppsson A. Coronary surgery without cardiotomy suction and autotransfusion reduces the postoperative systemic inflammatory response. Ann Thorac Surg 2004;78(1):54-9.
- Schmidt H, Bendtzen K, Mortensen PE. The inflammatory cytokine response after autotransfusion of shed mediastinal blood. Acta Anaesthesiol Scand 1998;42(5):558-64.
- Kitano T, Hattori S, Miyakawa H, Yoshitake S, Iwasaka H, Noguchi T. Unwashed shed blood infusion causes deterioration in right ventricular function after coronary artery surgery. Anaesth Intensive Care 2000;28(6):642-5.
- Nguyen DM, Gilfix BM, Dennis F, Blank D, Latter DA, Ergina PL, et al. Impact of transfusion of mediastinal shed blood on serum levels of cardiac enzymes. Ann Thorac Surg 1996;62(1):109-14.
- Schmidt H, Mortensen PE, Folsgaard SL, Jensen EA. Cardiac enzymes and autotransfusion of shed mediastinal blood after myocardial revascularization. Ann Thorac Surg 1997;63(5):1288-92.
- Peivandi AA, Dahm M, Vulcu S, Peetz D, Hafner G, Oelert H. Troponin I concentrations of shed blood might influence monitoring of myocardial injury after coronary operations. Transfus Apheresis Sci 2001;25(3):157-62.
- Schirmer U, Hemmer W, Lindner KH, Goertz A, Schutz W, Georgieff M. Shed mediastinal blood in 500 elective cardiac surgery patients: is there enough for retransfusion routinely?. J Cardiovasc Surg (Torino) 1997;38(1):45-50.
- Schaff. HV, Hauer J, Gardner TJ, Donahoo JS, Watkins L Jr, Gott VL, el al. Routine use of autotransfusion following cardiac surgery: experience in 700 patients. Ann Thorac Surg 1979;27(6):493-9.
- Cordell AR, Lavender SW. An appraisal of blood salvage techniques in vascular and cardiac operations. Ann Thorac Surg 1981;31(5):421-5.
- Roberts SR, Early GL, Brown B, Hannah H 3rd, McDonald HL. Autotransfusion of unwashed mediastinal shed blood fails to decrease banked blood requirements in patients undergoing aortocoronary bypass surgery. Am J Surg 1991;162(5):477-80.
- Ward HB, Smith RR, Landis KP, Nemzek TG, Dalmasso AP, Swaim WR. Prospective, randomized trial of autotransfusion after routine cardiac operations. Ann Thorac Surg 1993;56(1):137-41.
- Schmidt H, Mortensen PE, Folsgaard SL, Jensen EA. Autotransfusion after coronary artery bypass grafting halves the number of patients needing blood transfusion. Ann Thorac Surg 1996;61(4):1177-81.
- Kilgore ML, Pacifico AD. Shed mediastinal blood transfusion after cardiac operations: a cost-effectiveness analysis. Ann Thorac Surg 1998;65(5):1248-54.








