El diagnóstico del enfisema pulmonar subclínico frecuentemente escapa a las pruebas funcionales respiratorias (pFP) y tomografía computarizada de alta resolución (TCAR). Proponemos que cambios en la extracción celular de oxígeno (ERO2) en el enfisema pulmonar subclínico anteceden a los cambios por TCAR o pFP. Se estudiaron con pFP, TCAR y ERO2 cuarenta adultos entre 20 y 72 años de edad (media 41.6 ± 4 años), con o sin tabaquismo, con o sin síntomas. Se determinó sensibilidad, especificidad y valores predictivos positivos y negativos para cada prueba, comparándose entre sí. La sensibilidad y especificidad para pFP fueron de 13 y 84%, para TCAR de 33 y 76% y para ERO2 de 85 y 67% (p < 0.001). La diferencia del ERO2 entre pacientes asintomáticos y sintomáticos (30% contra 41%, p < 0.001) fue significativa. Se concluyó que el diagnóstico del enfisema pulmonar subclínico debe incluir el estudio de ERO2.
Changes in the cellular oxygen extraction in subclinic pulmonary emphysema
The diagnosis of subclinic pulmonary emphysema frequently escapes to pulmonary function tests (PFt) and high resolution computed tomography (HRCT). We propose that this changes in the cellular extraction of oxygen (ERO2) in cubclinic pulmonary emphysema precedes to changes for HRCT or PFt. Here, we studied with pFP, TCAR and ERO2 forty adults between 20 and 72 years of age (average 41.6 ± 4 years), with or without tobacco smoke, with or without symptoms. The relationship of the emphysema was compared with each diagnostic test and sensibility, specificity and predictive valor positive and negative were calculated. The sensibility and specificity for PFt were of 13 and 84%, for HRCT 33 and 76% and for ERO2 of 85 and 67% (p <0.001). The ERO2 in asymptomatic patient and symptomatic (30% vs 41%, p <0.001) showed a significant difference, when was compared. We concluded that the diagnosis of subclinic pulmonary emphysema should include the ERO2 study.
Introducción
El enfisema pulmonar y la bronquitis crónica integran al EPOC, un complejo que representa un problema serio de salud mundial con 7.8% de prevalencia en pacientes de más de 40 años de edad [1]. La Sociedad Americana de Tórax define al enfisema pulmonar dentro de términos anatómicos como una dilatación anormal y permanente de los espacios aéreos distales al bronquio terminal, con destrucción de las paredes y fibrosis mínima, cuyo síntoma más frecuente es la disnea [2]. Esta enfermedad afecta más frecuentemente hombres (11.8%) que mujeres (8.5%) [3]. De acuerdo con los criterios de la Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica (GOLD, siglas en inglés), en el enfisema pulmonar la limitación al flujo aéreo es usualmente progresiva y se asocia con una respuesta inflamatoria anormal a partículas y gases tóxicos en los pulmones, especialmente al humo del tabaco [1].
La espirometría es la prueba más fácil, básica y utilizada para la exploración funcional respiratoria [1]. La evaluación espirométrica permite la confirmación de cualquier enfermedad respiratoria con síntomas sugestivos [4]. El diagnóstico es obtenido en base a pFP, procedimiento elegido por sobre el estudio histopatológico (estándar de oro) debido a no invasividad y reducción de los riesgos inherentes a la toracotomía [1]. El estudio del individuo con sospecha de enfisema pulmonar requiere de la historia de tabaquismo, examen físico exhaustivo, función respiratoria por espirometría (VEF1, CVF, VEF1/CVF), presión de gases en sangre arterial, PaO2, PaCO2, A-aDO2, RI, SO2c, PAO2, pletismografía transcutánea, estudio convencional radiográfico de tórax y tomografía computada de alta resolución (TCAR) [3].
El diagnóstico del enfisema pulmonar avanzado depende exclusivamente de los hallazgos clínicos, FEV1 reducido y pulso paradójico en correlación con pletismografía alterada; datos que en conjunto sugieren la severidad del atrapamiento de aire en la vía aérea [5]. Sin embargo, la espirometría sin el análisis de gases en sangre arterial falla en el diagnóstico del enfisema pulmonar temprano [1]. Incluso los criterios GOLD para la clasificación de la severidad de la EPOC, aceptan que pacientes con síntomas respiratorios crónicos expuestos a factores de riesgo (estadio 0) usualmente presentan espirometría normal [1]. Así, una espirometría anormal indica presencia de enfermedad, pero una espirometría normal no excluye la enfermedad como se observa en el enfisema subclínico. El área silente del enfisema subclínico (vías aéreas periféricas) puede estar afectada y la espirometría parecer normal [1]. Es más, factores como la edad y la obesidad (entre otros) dificultan el diagnóstico preciso del enfisema pulmonar en etapa subclínica. La FEV1 en sanos no fumadores disminuye de 25 a 30 ml por año después de los 25 a 30 años de edad [1]. Además, la FEV1 y la relación FEV1/FVC varían muy poco durante meses de observación [6]. Sujetos ancianos sin enfermedad pulmonar frecuentemente presentan disminución de la capacidad pulmonar vital, PFp disminuidas y disnea clínica variable [7]. La obesidad mórbida también afecta inversamente los volúmenes pulmonares, con reducción de la capacidad vital total, FEV1, FVC y la relación FEV1/FVC [8]. Los factores anteriores, agregados a una disminución lenta de FEV1 después de 20 a 30 años de instalación del enfisema, dificultan el diagnóstico en fases iniciales de la enfermedad en muchos pacientes [9].
Por otro lado, en pacientes con enfisema se ha observado un incremento en el estrés oxidativo relacionado con el inicio y progresión de las lesiones celulares que anteceden a los cambios anatómicos observados por TCAR. Los pacientes con enfisema temprano presentan una reducción variable de los valores sanguíneos de la presión arterial de O2 (PaO2) aun con FEV1 normales [10]. Por eso, la PaO2 ha sido previamente usada como un parámetro de hipoxia tisular en la evaluación inicial de la enfermedad pulmonar; sin embargo no está claro su papel en la comprensión de la oxigenación tisular [11]. En consecuencia, la oxigenación tisular no está alterada en pacientes con enfisema estable, mientras no exista compromiso en la capacidad de extracción de oxígeno (ERO2). Sin embargo, en el paciente con enfisema avanzado se observa un incremento en la diferencia arterial-venosa de O2 (Da-vO2), en el consumo celular de O2 y por lo tanto en la ERO2; estos cambios observados en reposo son más evidentes durante el ejercicio [12]. Otros parámetros que han sido utilizados en la evaluación de la oxigenación tisular son la saturación venosa de O2 (SvO2) y la presión venosa de O2; la SvO2 difiere en el sistema corporal y depende directamente de la ERO2 que a su vez varía con los requerimientos metabólicos. La ERO2 es la fracción liberada de O2 desde la microcirculación tisular y define el balance entre la entrega de O2 (DO2) y el consumo de O2 (VO2) [13]. En la mayoría de los tejidos la ERO2 es ajustable y bajo condiciones donde el DO2 está disminuida, esta tasa puede aumentar de 50 a 60 %, tal como se observa en el enfisema [13].
En el enfisema las alteraciones en la oxigenación de los tejidos están inducidas por el grado variable de obstrucción bronquial acompañado de hipoventilación alveolar distal y destrucción de paredes alveolares acompañada de flujo inadecuado de sangre para transportar los gases sanguíneos [13,14]. Aquí, nuestro objetivo es demostrar cambios en la extracción celular de oxígeno en pacientes con enfisema pulmonar en etapa subclínica, incluso antes de que los cambios anatómicos por TCAR o las modificaciones fisiológicas por pFP sean observados.
Material y métodos
Se realizó un estudio transversal y comparativo entre pFP, TCAR y cambios en la oxigenación celular en cuarenta pacientes de 40 años o más de edad, expuestos o no al humo del tabaco y con o sin síntomas clínicos de enfisema pulmonar.
Criterios de elegibilidad
Fueron elegidos voluntariamente hombres y mujeres mayores de 40 años de edad, expuestos o no a factores de riesgo como el humo del tabaco, humo de leña o trabajos en talleres de mantenimiento industrial; con o sin síntomas clínicos sugestivos de enfisema pulmonar. Fueron excluidos pacientes con diagnóstico establecido de enfisema pulmonar o con otra enfermedad pulmonar. El estudio fue realizado bajo la supervisión del Comité local de ética e investigación en salud 3001 con número de autorización R-2008-3001-7.
Pruebas de función pulmonar
Los sujetos fueron considerados sanos en ausencia de sintomatología y con pruebas funcionales pulmonares normales (VEF1 > 80 %, VEF1/CVF > 0.7) [2]. Fueron considerados en riesgo (estadio 0) en presencia de sintomatología clínica sugestiva de enfisema pulmonar pero con pFP normales y finalmente con enfisema pulmonar temprano (estadio I), cuando a la sintomatología se le agregaron pFP anormales (VEF1 ≥ 80 %) [1].
Tomografía computada de alta resolución
La TCAR se realizó con un equipo helicoidal de cuatro canales (Somatom Plus 4®, Siemens). Durante inspiración máxima se realizó un topograma de tórax desde el opérculo torácico hasta las bases pulmonares con secuencia de cortes a 10 mm x 10 mm respectivamente. El diagnóstico de enfisema pulmonar por TCAR se estableció con los siguientes criterios: presencia de opacidad en apariencia de vidrio despulido, pared bronquial engrosada, bulas, producción de moco en bronquios y bronquiolos, hiperinsuflación, manifestaciones de atrapamiento aéreo (estudios en exhalación), arteria central dilatada lo que indica hipertensión pulmonar arterial y linfadenopatía hiliar en respuesta a procesos infecciosos [15].
Extracción celular de oxígeno
La presión parcial y la saturación del O2 fue medida en sangre arterial (PaO2, SaO2) y venosa (PvO2, SvO2) con el gasómetro GEM® premier 3000. La hemoglobina (Hb) en g/dl fue cuantificada con el equipo automatizado Cell-Dyn 3700, Falcon®. Con estos valores se calculó el contenido de O2 arterial (CaO2 = Hb x SaO2 x 1,34 + PaO2 x 0,003) y venoso (CvO2 = Hb x SvO2 x 1,34 + PvO2 x 0,003) y con ellos el índice de extracción de oxígeno (ERO2 = [CaO2 – CvO2/CaO2] x 100). Los valores a nivel del mar considerados normales fueron: PaO2 (70 – 100 mmHg), SaO2 (94 - 100 %), PvO2 (40 mmHg), SvO2 (75 %), CaO2 (20 ml/dl), CvO2 (15 ml/dl) y ERO2 (23 – 32 %) [13,16,17].
Colección de los datos
Todos los pacientes fueron sometidos a estudios de pFP, TCAR y oxigenación celular. Cada metodología del estudio fue realizada por un médico especialista en el área e ignorando los resultados obtenidos con las otras metodologías para cada sujeto estudiado. Al final, todos los datos fueron condensados en tablas de contingencia, a partir de las cuales fueron realizados los análisis estadísticos.
Análisis estadístico
Nosotros aplicamos análisis estadísticos de tendencia central y dispersión para variables paramétricas. Las variables binomiales fueron inicialmente descritas conforme a la proporción de su presencia. En la comparación intra-grupo e inter-grupo se aplicaron los estadísticos t student y X2 para variables paramétricas y binomiales respectivamente. Los valores de ventaja en la predicción del enfisema pulmonar subclínico para cada prueba diagnóstica fueron obtenidos juntos con la sensibilidad, especificidad y valores predictivos positivos y negativos.
Resultados
Cuarenta pacientes fueron estudiados entre noviembre del 2007 y diciembre del 2008. Diecinueve fueron hombres (48%) y veintiuno mujeres (52%) con 41.6 ± 4 años de edad (rango: 20 a 72). Veinticinco pacientes fueron asintomáticos (63%) y quince (37%) mostraron combinaciones de diversos síntomas que sugirieron enfisema: disnea variable (n 11, 28 %), tos crónica (n 8, 20 %) y expectoración cotidiana (n 6, 15 %). Doce pacientes no tuvieron exposición activa al humo del tabaco o no fueron fumadores pasivos (30%) y veintiocho estuvieron expuestos (70 %) en promedio 12 ± 4 años con una intensidad media de 4 ± 2 paquetes de cigarrillos fumados al día.
Diagnóstico temprano del enfisema con pruebas de función pulmonar
En cuarenta pacientes estudiados, seis fueron positivos a enfisema pulmonar a través de pFP (15%). Las comparaciones entre pacientes con diagnóstico negativo y positivo a través de pFP: valor de FEV1 (p < 0.001), FVC (p < 0.001) y relación FEV1/FVC (p < 0.05) fueron estadísticamente diferentes. Sin embargo; la comparación de pFP entre pacientes sintomáticos y asintomáticos, no mostró diferencia estadística (tabla 1). El análisis de capacidad de las pFP para el diagnóstico de enfisema pulmonar asintomático mostró una sensibilidad baja (13%), detectando solo 2 pacientes en 15 con síntomas sugestivos. Una alta especificidad fue observada (84%) con positividad de 3 en 25 pacientes sin síntomas de enfisema. El valor predictivo positivo fue bajo en esta prueba (33%) y el valor predictivo negativo fue moderado (62%).

Tabla 1
Diagnóstico de enfisema temprano con tomografía computada de alta resolución
El diagnóstico temprano del enfisema por TCAR fue confirmado en once pacientes (cambios morfológicos compatibles) (28%). Seis de estos pacientes con diagnóstico positivo de enfisema pulmonar por TCAR fueron asintomáticos al momento del estudio (tabla 2). La lesión quística fue observada en diez de once pacientes con TCAR positiva para enfisema pulmonar (91%), pared bronquiolar-alveolar imperceptible en nueve veces (82%) y bronquiolo-arteriola centrales en ocho ocasiones (73%). En pacientes con diagnóstico de enfisema pulmonar temprano, la TCAR mostró una sensibilidad de 33 %, especificidad de 76%, valor predictivo positivo de 45 % y valor predictivo negativo de 66 %. La TCAR diagnosticó enfisema pulmonar en cinco pacientes con síntomas sugestivos y pFP normal. La figura 1, muestra la imagen tomográfica y el gráfico de la relación flujo/volumen de un paciente normal (panel A), de un paciente con enfisema pulmonar sintomático (panel B), de un paciente con tuberculosis pulmonar (panel C) y de un paciente con enfisema pulmonar asintomático y curva flujo/volumen normal (D).

Tabla 2
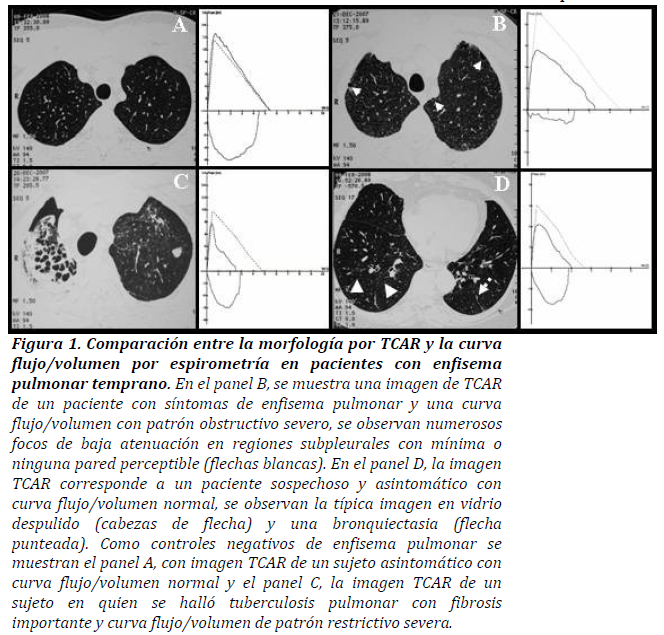
Figura 1. Comparación entre la morfología por TCAR y la curva flujo/volumen por espirometría en pacientes con enfisema pulmonar temprano. En el panel B, se muestra una imagen de TCAR de un paciente con síntomas de enfisema pulmonar y una curva flujo/volumen con patrón obstructivo severo, se observan numerosos focos de baja atenuación en regiones subpleurales con mínima o ninguna pared perceptible (flechas blancas). En el panel D, la imagen TCAR corresponde a un paciente sospechoso y asintomático con curva flujo/volumen normal, se observan la típica imagen en vidrio despulido (cabezas de flecha) y una bronquiectasia (flecha punteada). Como controles negativos de enfisema pulmonar se muestran el panel A, con imagen TCAR de un sujeto asintomático con curva flujo/volumen normal y el panel C, la imagen TCAR de un sujeto en quien se halló tuberculosis pulmonar con fibrosis importante y curva flujo/volumen de patrón restrictivo severa.
Difusión, transporte y extracción celular de oxígeno
En veinte de 40 pacientes se observaron cambios en la difusión, transporte y extracción de oxígeno (50%). Trece de quince pacientes con síntomas positivos para enfisema pulmonar temprano mostraron cambios en las pruebas de oxigenación celular (87%). En pacientes asintomáticos, estos cambios fueron observados solo en 7 ocasiones (47%). La comparación entre ambos resultados con la prueba exacta de Fisher y X2 con corrección de Yates mostró importante diferencia estadística (p < 0.001). El análisis individual de variables de la oxigenación celular mostró diferencia estadística (p < 0.001) en valores de SvO2, CvO2 y ERO2, cuando estos fueron comparados entre pacientes con enfisema pulmonar asintomáticos y sintomáticos (tabla 3). La relación entre enfisema pulmonar temprano y los cambios observados en la difusión, transporte y extracción de oxígeno mostró una sensibilidad de 85% especificad de 67%, valor predictivo positivo de 55 % y valor predictivo negativo de 90 %.
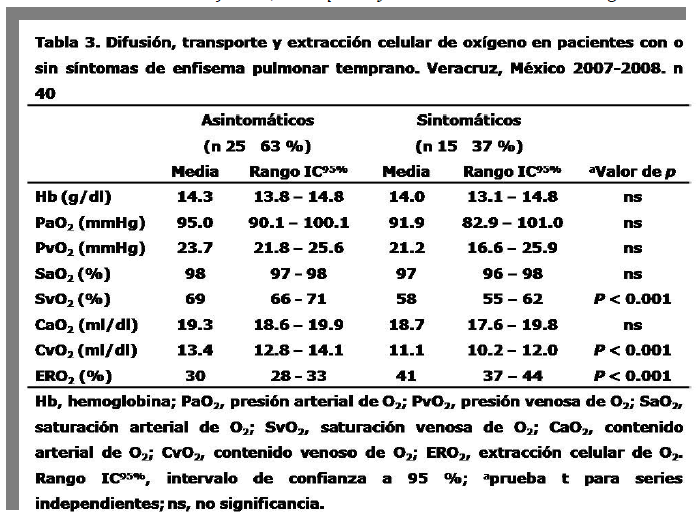
Tabla 3
Discusión
La enfermedad pulmonar obstructiva crónica (EPOC) es la principal causa de morbilidad y mortalidad crónica en todo el mundo [1]. El sello característico de la EPOC es la inflamación de las vías aéreas pequeñas (bronquitis crónica) y destrucción del parénquima pulmonar (enfisema). La consecuencia funcional de estas anormalidades es la limitación al flujo aéreo [2]. A pesar de los esfuerzos sumados de muchos países, la prevalencia y mortalidad por EPOC continúan al alza [1]. El mayor problema es la información incompleta acerca de sus causas y la subestimación de la prevalencia, especialmente en países en desarrollo. La Organización Mundial de la Salud establece 0.8 % de prevalencia de la EPOC en todo el mundo [2]. En países en desarrollo, el reporte PLATINO de acuerdo con los criterios GOLD, estimó una prevalencia de 7.8 % de EPOC en pacientes de más de 40 años de edad [1]. En este trabajo, usando los mismos criterios, nosotros obtuvimos el doble de prevalencia (15%). Nosotros consideramos que esta sobreestimación es debida al tamaño de la muestra.
Las pFP son por consenso mundial la herramienta de mejor elección para el diagnóstico, evaluación y seguimiento del enfisema pulmonar en sujetos con sintomatología evidente [1,4]. Sin embargo, las pFP poseen un bajo grado de correlación con manifestaciones clínicas (tos crónica, flemas y disnea) y anatomopatológicas (hipertrofia e incremento del número de glándulas secretoras de moco y destrucción del parénquima pulmonar) del enfisema [18].
Algunos sujetos con vía aérea obstruida no tienen enfisema severo y otros sujetos con enfisema no tienen limitación al flujo aéreo. Es más, se ha demostrado que los síntomas respiratorios pueden preceder por varios años el desarrollo de limitación al flujo aéreo. Las referencias en relación con los valores de sensibilidad de las pFP en el diagnóstico del enfisema temprano son escasas. Hay una relación positiva publicada de 15% entre pFP y el enfisema temprano [19]. Estas evidencias corresponden con los resultados obtenidos en este nuestro estudio, las pFP fueron capaces de diagnosticar 6 enfisemas pulmonares en 40 pacientes (15%). Nosotros obtuvimos hallazgos similares a los de diversos autores que opinan que las pFP ofrecen una baja capacidad diagnóstica en pacientes con enfisema pulmonar subclínico (sensibilidad 13%) y pobre posibilidad de predecir la enfermedad (valor predictivo positivo [PPV] de 33%). En el enfisema pulmonar temprano la complementación diagnóstica con TCAR resuelve parcialmente este problema [16].
La TCAR es un método rápido, no invasivo y seguro en el estudio anatómico pulmonar bajo condiciones de normalidad y en el diagnóstico de enfermedad infiltrativa aguda o crónica [16]. Nosotros descubrimos por TCAR once pacientes con enfisema pulmonar temprano (28%). En nuestro estudio, esta prueba diagnóstica mostró una sensibilidad de 33% y PPV de 45%. Es más, cinco pacientes con síntomas fuertemente sugestivos de enfisema pulmonar y con pFP negativas fueron identificados con enfisema pulmonar por TCAR. Sin embargo, en este estudio no fue posible identificar por TCAR a nueve pacientes sintomáticos (60%).
Se sabe que factores de riesgo como el humo del cigarro lesionan la célula del árbol bronquial por daño directo al DNA, estallido respiratorio con producción no regulada de radicales libres de oxígeno e incremento de ruptura del DNA, además de alterar las membranas de lipoproteínas [20]. El daño celular previo a la remodelación histológica es característico del enfisema pulmonar [15]. Así, el paciente es observado sin síntomas que definen a la enfermedad y con ausencia de cambios estructurales por TCAR. El diagnóstico de enfisema pulmonar temprano en pacientes asintomáticos se logra por TCAR cuando la remodelación histológica está bien diferenciada [16]. Por otro lado, las pFP han mostrado utilidad en el diagnóstico del enfisema pulmonar avanzado en pacientes sintomáticos [1].
En el enfisema, algunas áreas pulmonares presentan una derivación fisiológica muy intensa (con ventilación insuficiente para oxigenar la sangre de los capilares alveolares) de tal manera que la sangre venosa no es oxigenada (sangre derivada), y en otras áreas se manifiesta un espacio muerto fisiológico muy considerable (cuando la ventilación es alta pero el flujo sanguíneo es bajo), entonces hay mucho más oxígeno disponible en los alvéolos del que puede ser eliminado de los mismos por el flujo de sangre (desperdicio ventilatorio). Ambos trastornos disminuyen notablemente la efectividad de los pulmones como órganos para el intercambio de gases [13]. Nosotros proponemos que aumentos en la derivación fisiológica, desperdicio ventilatorio y estallido respiratorio intracelular inducen un incremento en las demandas metabólicas celulares (figura 2) durante la instalación del enfisema pulmonar. En este estudio, nosotros observamos que el incremento en las demandas metabólicas celulares fue reflejado en reducción de la SvO2 y el CvO2 e incremento de la ERO2. Los cambios en la extracción celular de O2 fueron observados en veinte de todos los pacientes estudiados (50 %) y el 89 % de los pacientes sintomáticos mostraron cambios significativos en la extracción celular de oxígeno.
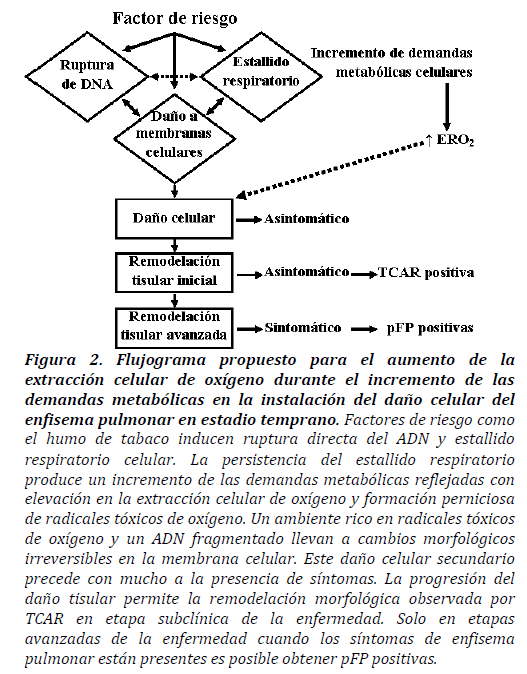
Figura 2. Flujograma propuesto para el aumento de la extracción celular de oxígeno durante el incremento de las demandas metabólicas en la instalación del daño celular del enfisema pulmonar en estadio temprano. Factores de riesgo como el humo de tabaco inducen ruptura directa del ADN y estallido respiratorio celular. La persistencia del estallido respiratorio produce un incremento de las demandas metabólicas reflejadas con elevación en la extracción celular de oxígeno y formación perniciosa de radicales tóxicos de oxígeno. Un ambiente rico en radicales tóxicos de oxígeno y un ADN fragmentado llevan a cambios morfológicos irreversibles en la membrana celular. Este daño celular secundario precede con mucho a la presencia de síntomas. La progresión del daño tisular permite la remodelación morfológica observada por TCAR en etapa subclínica de la enfermedad. Solo en etapas avanzadas de la enfermedad cuando los síntomas de enfisema pulmonar están presentes es posible obtener pFP positivas.
Agradecimientos
A la Dra. Silvia Cervantes Durand por su colaboración en las pruebas de función pulmonar, al Dr. Gabriel Lezama Suárez por su colaboración en la interpretación de imágenes de TCAR. A todos los químicos especialista en el laboratorio clínico por su invaluable ayuda en las pruebas bioquímicas.
1048
References
- Pauwels RA, Buist AS, Ma P, Jenkins CR, Hurd SS; GOLD Scientific Committee. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: National Heart, Lung, and Blood Institute and World Health Organization Global Initiative for Chronic Obstructive Lung Disease (GOLD): executive summary. Respir Care 2001;46(8):798-825.
- Viegi G, Pedreschi M, Pistelli F, Di Pede F, Baldacci S, Carrozzi L, Giuntini C. Prevalence of airways obstruction in a general population. European Respiratory Society vs American Thoracic Society definition. Chest 2000;117(5 suppl 2):339S-45S.
- Mannino DM, Buist AS. Global burden of COPD: risk factors, prevalence, and future trends. Lancet 2007;370(9589):765-73.
- Standardization of spirometry, 1994 update; American Thoracic Society. Am J Respir Crit Care Med 1995;152(3):1107-36.
- National Collaborating Centre for Chronic Conditions. Chronic obstructive pulmonary disease. National clinical guideline on management of chronic obstructive pulmonary disease in adults in primary and secondary care. Thorax 2004;59(Suppl 1):1-232.
- Calverley PM. COPD: early detection and intervention. Chest 2000;117(5 suppl 2):365S-71S.
- de Bisschop C, Marty ML, Tessier JF, Barberger-Gateau P, Dartigues JF, Guénard H. Expiratory flow limitation and obstruction in the elderly. Eur Respir J 2005;26(4):594-601.
- Bottai M, Pistelli F, Di Pede F, Carrozzi L, Baldacci S, Matteelli G, et al. Longitudinal changes of body mass index, spirometry and diffusion in a general population. Eur Respir J 2002;20(3):665-73.
- Wang ML, Gunel E, Petsonk EL. Design strategies for longitudinal spirometry studies: study duration and measurement frequency. Am J Respir Crit Care Med 2000;162(6):2134-8.
- Mohsenifar Z, Lee SM, Diaz P, Criner G, Sciurba F, Ginsburg M, Wise RA. Single-breath duffusing capacity of the lung for carbon monoxide: a predictor of PaO2, maximum work rate, and walking distance in patients with emphysema. Chest 2003;123(5):1394-400.
- Mithoefer JC, Holford FD, Keighley JF. The effect of oxygen administration on mixed venous oxygenation in chronic obstructive pulmonary disease. Chest 1974;66(2):122-32.
- Alpert JS, Bass H, Szucs MM, Banas J, Dalen JE, Dexter L. Effects of physical training on hemodynamics and pulmonary function at rest and during exercise in patients with chronic obstructive pulmonary disease. Chest 1974;66(6):647-51.
- Guyton AC. Physical bases of the gases replacement; oxygen difussion and carbone dyoxide across to respiratory membrane. in, Textbook of Medical Physiology. 11th edition. DW Saunder editors. Philadelphia 2005. pp 479-90.
- Taraseviciene-Stewart L, Voelke NF. Molecular pathogenesis of emphysema. J Clin Invest 2008;118(2):394-402.
- Newell JD, Hogg JC, Snider GL. Report of a workshop: quantitative computed tomography scanning in longitudinal studies of emphysema. Eur Respir J 2004;23(5):769–75.
- Samsel RW, Schumacker PT. Oxygen delivery to tissues. Eur Respir J 1991;4:1258-67.
- Schumacker PT, Cain SM. The concept of a critical oxygen delivery. Intensive Care Med 1987;13(4):223-9.
- Thurlbeck WM. Aspects of chronic airflow obstruction. Chest 1977;72(3):341-9.
- Calverley PM. COPD: Early detection and intervention. Chest 2000;117(5 suppl 2):365S-71S.
- Rytila P, Rehn T, Ilumets H, Rouhos A, Sovijarvi A, Myllarniemi M, et al. Increased oxidative stress in asymptomatic current chronic smokers and GOLD stage 0 COPD. Respir Res 2006;7:69.










