Resumen
La cefalea en racimos (CR) es una de las cefaleas más terriblemente invalidantes. Desde el punto de vista clínico los pacientes que la sufren describen un dolor atroz, lancinante referido a la región periocular y que se acompaña de una serie de síntomas y signos, fundamentalmente de disfunción autonómica, como lagrimeo, edema palpebral o rinorrea, por citar sólo algunos, que facilitan su diagnóstico. Sin embargo, a pesar de su característico perfil clínico continúa siendo pobremente reconocida y mal controlada. Más aún, a pesar de los avances existentes en el tratamiento de este tipo de cefalea, muchos de los pacientes, a pesar del sufrimiento que les comportan sus crisis, reciben tratamientos inespecíficos e ineficaces. El objetivo de la presente revisión consiste en aprender a identificar los correctos criterios diagnósticos de la CR y los diagnósticos diferenciales respectivos; comprender la fisiopatología de la CR, su tratamiento y pronóstico mediante la revisión de la literatura. Para ello se realizará una puesta al día de esta entidad revisando desde los mecanismos fisiopatológicos implicados hasta las nuevas técnicas de neuroimagen funcional utilizadas para su estudio o los más recientes avances en el tratamiento incluyendo la estimulación cerebral profunda sobre el hipotálamo en aquellos casos desesperados de cefalea en racimos refractaria a todo tipo de tratamiento médico.
Palabras clave: Cefalea en racimos. Cefaleas trigeminales con síntomas autonómicos. Cirugía del nervio trigémino. Estimulación hipotalámica. Hipotálamo
Cefalea en Racimos
Introducción
La cefalea en racimos (CR) es una entidad clínica de naturaleza esencial, de curso cíclico, que se conoce desde los escritos de Tulp en el siglo XVII, así como de Willis en 1671 [1]. Se caracteriza por la aparición de ataques de dolor periocular, estrictamente unilaterales, de gran intensidad junto con signos autonómicos locales homolaterales, como lagrimeo, rinorrea o edema palpebral [2]. La clasificación actual de la Internacional Headache Society (IHS) sitúa la CR en el apartado 3 junto al resto de cefaleas trigémino-autonómicas [3]. Se conoce también como Hemicránea angioparalítica, Faciocefalalgia autonómica, Vasodilatación simpática hemicefálica, Neuralgia de Horton, cefalea histamínica o cefalea en acúmulos (del inglés: Cluster headache) o en tandas, calificativos estos últimos que hacen referencia al agrupamiento de los ataques del dolor en periodos de tiempo que denominamos racimos. De esa manera quedan definidas las características cardinales de la CR: periodicidad de los ataques, dolor periocular de gran intensidad y signos autonómicos acompañantes. Aunque su frecuencia de aparición es baja, resulta crucial conocer su manejo terapéutico debido a que el dolor atroz que ocasiona es uno de los más invalidantes que se conocen. Acepciones del estilo de “cefalea en racimos” expresan de forma sumamente gráfica lo que su presencia puede conllevar a quienes la padecen.
Distinguimos dos formas de presentación. La forma episódica (CRE), en la cual se alternan los racimos con periodos libres de dolor que habitualmente se prolongan durante meses o años [3]; esta entidad mantiene unos criterios bien definidos y, por lo general, no ofrece problemas especiales en el diagnóstico o tratamiento. Por otro lado, la forma crónica (CRC) presente en el 10% de los casos, se caracteriza porque los ataques duran más de un año o porque los periodos asintomáticos son inferiores a un mes [3]. Una pequeña parte de ellos no responden al tratamiento médico, representado las formas de CRC refractaria que habitualmente conllevan un difícil manejo terapéutico. Este último tipo ha adquirido renovado interés en la actualidad dado el desarrollo de nuevas formas de tratamiento como la estimulación profunda cerebral sobre el hipotálamo.
Epidemiología y Factores
Predisponentes
La CR es el tipo de cefalea trigeminal con síntomas autonómicos más frecuente. Sin embargo, su frecuencia es mucho menor que otras cefaleas primarias, como la migraña o la cefalea tensional. La incidencia de la CR varía entre un 2.5 y 9.8 casos/100.000 personas-año. La prevalencia oscila, según los estudios, de 56 a 327/100.000 [4]. La enfermedad es más frecuente en el varón en los estudios epidemiológicos y aún más en las series clínicas. Sin embargo, estudios epidemiológicos recientes indican que la diferencia es menor, con una prevalencia de 338/100.000 para el varón frente a 217/100.000 en la mujer [4], lo que supone en realidad una diferencia de 2:1 a favor del varón [5]. La CR puede presentarse a cualquier edad, aunque es más frecuente entre la 2ª y la 5ª décadas de la vida. Es infrecuente en el niño y en el anciano aunque puede aparecer durante el primer año o en la octava década de la vida. La edad media de comienzo de la CRE es de 26 años, siendo la edad media de presentación superior en la CRC, situándose en 30 años. Diferentes estudios han sugerido una tendencia a presentarse la CRC en edades más avanzadas que la CRE. Este hecho parece especialmente cierto en el caso de las mujeres y para aquellos pacientes que desde el principio presentan CRC. La evolución a largo plazo es muy variable y la duración total de la enfermedad no se conoce con exactitud. Probablemente hay numerosas remisiones definitivas a lo largo de la vida de los pacientes. La experiencia clínica dice que los racimos se espacian hasta desaparecer en no pocos pacientes si se les sigue durante muchos años [2]. No es infrecuente que la enfermedad desaparezca un día para siempre sin que ningún marcador permita determinar si aparecerá y cuándo ocurrirá la remisión definitiva.
Por lo general su presentación es esporádica, aunque a veces es familiar y hereditaria con una transmisión que parece ser autonómica dominante con baja penetrancia en algunas familias, mientras que en otras es más probable una herencia poligénica, con una patogenia de carácter multifactorial [6]. El hecho es que del 7 al 20% de los familiares de los pacientes con CR sufren la enfermedad. Se ha calculado que los familiares de primer grado tienen una probabilidad de padecerla unas 5 a 39 veces mayor que los controles.
Lo habitual es no encontrar ningún factor casual, aunque los pacientes con CR tienen antecedentes de traumatismo craneoencefálico con más frecuencia que los controles y la enfermedad puede en ocasiones coincidir con otros procesos, como molares impactados, sinusitis maxilar o exéresis del globo ocular, cuyo papel etiopatogénico no está aclarado [7]. A diferencia de lo observado en la migraña, la menstruación, la menopausia y la terapia hormonal sustitutiva no representan factores desencadenantes de crisis en la CR. El alcohol es un precipitante del episodio doloroso durante las fases activas e igual puede suceder con ascender a una montaña o viajar en avión o tomar vasodilatadores y donantes de óxido nítrico como la nitroglicerina [8]. Cerca del 85% de los pacientes con CRC son fumadores. Sin embargo, no se ha comprobado que dejar de fumar se relacione con la desaparición de la CR [7]. Algunos autores sugieren que el tabaco actuaría como desencadenante del síndrome, probablemente en pacientes con una predisposición genética a padecerla.
Pero, sin duda alguna, el sueño es el desencadenante más poderoso del ataque y no es infrecuente que el dolor aparezca al poco de acostarse el paciente. Se dice que los ataques predominan de 1 a 2 de la madrugada, de 13 a 15 horas y a las 21 horas, constituyendo esta ritmicidad una de las características fundamentales de la CR [8,9].
La evolución de la cefalea en racimos es diversa. Definen sus variedades el número y duración de las fases activas y cuánto se prolongue la fase inactiva. En no pocos pacientes el primer racimo no se sigue de ningún otro durante los años siguientes de forma que su CR es inclasificable; no se puede saber si esta situación puede persistir de por vida o si aparecerá nuevos episodios tras un intervalo prolongado de ausencia de síntomas. No obstante, en el 80 al 90% de los pacientes se alternan periodos activos e inactivos, es decir, tienen la variedad episódica (CRE). Para poder diagnosticarla es necesario que el enfermo haya sufrido al menos dos racimos con una duración mayor de siete y menor de 365 días, y una remisión entre racimos de al menos un mes [2]. La realidad es que los racimos suelen durar de dos a ocho semanas suelen repetir con frecuencia anual o bianual. En algunos pacientes la duración de las fases activas e inactivas se mantiene constante durante muchos años, pero en otros existe una gran variabilidad de unos a otros racimos. En la variedad crónica (CRC), los ataques aparecen durante más de un año, sin remisiones o remisiones inferiores a un mes. Esta forma representa en torno al 10% de los casos en series epidemiológicas y clínicas. La frecuencia diaria de los ataques, uno al día o cada dos días, es menor que la variedad episódica; no obstante, en algunos enfermos alternan periodos con ataques infrecuentes y otros con dos a cuatro ataques diarios.
Una variedad se puede trasformar en la otra. La evolución a una forma de CRC se produce en un 3.8 a un 12.9 % de los pacientes con CRE [10]. Se habla de cefalea en racimos crónica secundaria (CRCS) cuando la fase crónica está precedida por una episódica, denominándose primaria (CRCP) cuando la cronicidad se establece ya desde el principio de la enfermedad. Uno de los puntos más importantes en una CR es poder predecir qué factores favorecen la trasformación de una CRE en una CRC. El factor más importante parece ser la duración de la enfermedad, de tal forma que cuando la enfermedad supera los 20 años el 20% de los casos de CRE se transforma en CRC. La duración de la fase episódica superior a 8 semanas es más frecuente entre los pacientes que presentarán una forma CRCS, y también hay más proporción de estos pacientes en aquellos cuyas fases inactivas duran menos de 6 meses; otros factores influyentes en el paso a CRCS son la presencia de al menos 4 síntomas disautonómicos acompañantes y cuando el primer episodio de CR acontece en mujeres con edad avanzada [11].
Rara vez se alternan fases episódicas, de semanas o meses de duración, con fases crónicas, de más de un año, en un mismo paciente, constituyendo lo que Granella et al denominaron forma combinada [12]. Kudrow llamó forma subcrónica a una CR episódica cuyas fases de remisión duran menos de seis meses, con la advertencia de que estos enfermos recuerdan más a los que padecen la forma crónica y deberían ser tratados como ellos [13]. Por último, se han definido los denominados minirracimos [14] que consisten en fases activas de unos pocos días de duración con dolores poco intensos. Suelen aparecer en los familiares de los pacientes como única manifestación y no en pocas ocasiones en pacientes con CRE entre uno y otro racimo. Estas variantes no están recogidas en la nueva clasificación de la IHS pero nos sugieren que la distinción entre CRE y CRC en ocasiones no es fácil y ciertos pacientes no se ajustan a los patrones establecidos.
Existen pocos estudios epidemiológicos que hayan tratado de buscar diferencias clínicas entre la CRE y CRC. Torelli et al [15] lograron reunir una serie de 69 pacientes con CRC, 31 con formas CRCS y 38 con CRCP. Estadísticamente, la edad de aparición era más temprana en las formas de CRCS y estos pacientes mostraban una mayor tendencia a haber presentado en el pasado ataques de larga duración (120-180 minutos); respecto al estilo de vida, los pacientes con CRCS mostraban una mayor frecuencia de hábito enólico, mientras que el hábito tabáquico era mas frecuente en el otro tipo. Se hallaron diferencias respecto a los signos y síntomas autonómicos que acompañaban al dolor de cabeza: en los pacientes con CRCP era más frecuente la sudoración facial y el edema palpebral, mientras que en los pacientes con CRCS era más frecuente la asociación con lagrimación, rinorréa, congestión nasal o ptosis. El antecedente de traumatismo craneal era más frecuente en las CRCS, especialmente el asociado con pérdida de conciencia.
Clínica
La publicación de los nuevos criterios de la IHS en el año 2004, modificó los criterios diagnósticos de la CRC. (Tabla I). En el año 1998 se exigía que el periodo sintomático perdurase durante un año o que el paciente presentase periodos libres de dolor inferiores a dos semanas, tiempo que ahora se prolonga a cuatro semanas. Destaca, independientemente de que se trate de una forma episódica o crónica, que la presencia de alguno de los síntomas de disautonomía no es imprescindible para el diagnóstico, pudiendo presentar una sensación de inquietud o agitación como única manifestación acompañante a la cefalea

Tabla I. Criterios diagnósticos de la clasificación ICHD-1 de la IHS 2004 para la cefalea en racimos y sus dos variantes.
El dolor es exclusivamente unilateral y suele afectar al mismo lado de la cabeza. Sólo un 14 % de los pacientes refiere afectación de ambos lados durante un mismo racimo y un 18% cambio de lado de un racimo a otro [8]. Por definición, el episodio de dolor dura de 15 a 180 minutos sin tratamiento. Se caracteriza por la presencia de crisis de dolor unilateral agudo o muy agudo, como una punzada, de localización retroocular (92%), y/o supraocular (46%) y/o temporal (70%) [8]. Habitualmente se describe como constante, sordo y de intensidad muy elevada, terebrante o atroz (“como si me clavaran un clavo”).
La intensidad del dolor aumenta con rapidez. El pico máximo se alcanza a los 5-10 minutos y suele persistir hasta los 45 minutos. Excepcionalmente puede llegar a las dos horas y media, y por lo general el dolor desciende forma también rápida. Hacia el final de este periodo y antes de la desaparición total del dolor pueden alternarse instantes de alivio con picos de dolor durante unos minutos. Durante el ataque existe una alodinia mecánica y es habitual que el enfermo tenga molestias al rozarse el cuero cabelludo o al tragar una vez desaparecido el dolor. Entre los ataques el enfermo queda libre de dolor, con sensación de bienestar, auque a veces persiste un resquemor más prolongado. Los ataques se repiten una o dos veces al día, pero la frecuencia se sitúa entre un ataque cada dos o tres días hasta 7 o 8 ataques diarios, siendo más frecuentes entre las 13-15 horas o 21-23 horas [9].
Durante los episodios de dolor el paciente evita la posición en decúbito porque incrementa aún más la intensidad del dolor. Al contrario que en la migraña, los pacientes no descansan y prefieren andar o sentarse un rato durante el ataque [2]. El dolor se puede irradiar a la dentadura, la garganta (donde se describe como el dolor del espasmo esofágico causado por una bebida muy fría) e inclusive a cuello y hombro. Algunos pacientes se tornan agresivos durante el ataque o rechazan a su familia.
Coincidiendo con el dolor aparecen signos autonómicos locales homolaterales: inyección conjuntival (77%), ptosis y/o edema palpebral (74%), cambios pupilares (miosis), enrojecimiento ocular, lagrimeo (91%), alteraciones sudorales en la frente y descarga o taponamiento nasal (90%); pueden aparecer signos autonómicos generales, como crisis de sudoración, bradicardia o incluso síncopes [10]. La exploración durante el ataque doloroso pone de manifiesto los signos autonómicos mencionados. Entre los ataques la exploración suele ser normal, aunque la ptosis y el enrojecimiento pueden continuar durante un tiempo variable. Es más raro ver los signos autonómicos durante toda la fase activa y aún más infrecuente encontrar un síndrome Horner incompleto permanente. El resto de la exploración es normal. En la tabla II se recogen claves clínicas de la CR que han de facilitar su diagnóstico.

Tabla II. Claves diagnósticas simplificadas cefalea en racimos.
El 2% de los pacientes de las series clínicas refiere sensaciones parestésicas o paresia en los miembros contralaterales u homolaterales a la cefalea que preceden o acompañan al dolor. Este tipo de pacientes se ha referido bajo el nombre de CR con aura o cefalea en racimos hemipléjica. En estos pacientes, ambos cefalea y fenómenos motores y sensitivos desaparecen cinco a diez minutos después de la inyección subcutánea de sumatriptan [16].
Los pacientes con CR tienen una elevada incidencia de úlcera duodenal y niveles de ácido gástrico elevados. La piel de la cara suele tener un aspecto áspero, tosco, parecida al de las naranjas (peau d´orange] y el pliegue nasolabial suele ser profundo. Los tratados clásicos hacían referencia al denominado síndrome leónratón, aludiendo a la frecuente presencia de arrugas prominentes, ceño fruncido, piel similar a da de una naranja y personalidad tímida y pasiva.
En resumen, la presencia de dolor ocular episódico acompañado de inyección conjuntival de más de 20 minutos de duración con una frecuencia mayor de a cinco crisis por día hace el diagnóstico de CR altamente sugestivo (Tabla II). Como veremos más adelante en ocasiones algunos fármacos empleados en la CR pueden provocar cambios sustanciales en la clínica del paciente. El ejemplo más conocido es el aumento de la frecuencia diaria de los ataques con el uso de sumatriptan (SMT) [16] o incluso la trasformación de una CRE en una CRC bajo el tratamiento crónico con esteroides [17].
Patogenia
En la actualidad la patogénesis de la CR sigue sin comprenderse. Una explicación coherente deber incluir una participación del sistema trigeminal (dada la localización del dolor), una hiperactividad parasimpática (por la lagrimación y rinorrea), y una hipoactividad simpática (por la miosis, enoftalmus y disminución de la sudoración). Finalmente se requiere la existencia de un mecanismo de regulación central debido al horario preferente con relación a la vigilia y el sueño
El mecanismo inmediato de la cefalea es mediado a través de los aferentes nociceptivos vasculares del trigémino [18] (sustancia P, péptido relacionado con el gen de la calcitonina- CGRP-) con eferencia refleja desde el tronco cerebral a través del nervio facial y del sistema parasimpático [19] (péptido intestinal vasoactivo-VIP- y otros). El CGRP y el VIP se encuentran elevados en la crisis aguda y sus niveles se normalizan tanto con la inhalación de oxígeno como con el SMT.
El aumento de la lagrimación, la congestión conjuntival, la descarga nasal y el enrojecimiento ocular tienen naturaleza parasimpática. El núcleo salival superior se estimula a través de un reflejo funcional puesto en marcha por la alteración trigeminal. Las fibras eferentes parasimpáticos viajan a través del nervio intermedio con el nervio facial hasta el ganglio geniculado; sus fibras vasomotoras pasan al nervio etmoidal para inervar los vasos sanguíneos cerebrales; las fibras secretomotoras inervan las glándulas mucosas nasales y lagrimales. Estas fibras contienen óxido nítrico y VIP, que aparece elevado en sangre venosa cerebral durante el ataque de dolor, lo que confirma la participación parasimpático responsable del aumento de secreción y en parte de la vasodilatación de las arterias cerebrales. La ptosis palpebral y la miosis son signos simpáticos de un síndrome de Horner incompleto, lo que sugiere la lesión de las fibras a partir de las neuronas de tercer orden situadas en la pared carotídea intracraneal, posiblemente en el seno cavernoso.
Desde hace tiempo ya se sospechó, que aparte de la intervención patogénica de la vía periférica trigeminal, debía existir un marcapasos central que explicara el ritmo con que aparecen ataques y racimos en esta enfermedad. Este marcapasos estaría localizado en el hipotálamo que gobierna los ritmos circadianos y no circadianos de la persona. Los datos más indicativos del papel del hipotálamo en la CR se han obtenido mediante técnicas de neuroimagen. Gracias a la PET puede observarse una activación de la materia gris del ventrículo ipsilateral durante la CR inducida por nitroglicerina [18], o bien, de manera espontánea durante un ataque de CR [20]. Además un estudio morfométrico realizado con tecnología de resonancia magnética muestra en los pacientes, fuera incluso de los racimos, un aumento de volumen del diencéfalo que corresponde al hipotálamo inferior [21] y que se superpone con los hallazgos encontrados en el PET. Otras evidencias indirectas que permiten inferir la presencia de disfunción hipotalámica provienen de estudios endocrinológicos en los que se han encontrado fluctuaciones en los niveles de hormonas como la testosterona, cortisol, melatonina y prolactina entre otras. Algunos de estos hallazgos pueden reflejar hiperactividad del eje hipotálamohipofisario- adrenal, en tanto que las alteraciones en la secreción de melatonina se podrían deber a alteraciones a nivel del núcleo supraquiasmático.
La evidencia actual sugiere que tanto en la CR como otras cefaleas trigémino-autonómicas existe un fenómeno de desinhibición central del arco reflejo trigémino-autonómico mediado aparentemente por un estado de hiperactividad funcional hipotalámica.
Diagnóstico diferencial
El diagnóstico de la CR es clínico y depende de la obtención detallada de la historia del paciente. Puede ser de ayuda que los testigos confirmen la frecuencia de los ataques, la rapidez de aparición y de resolución y la presencia de signos autonómicos durante los ataques.
Se recomienda el empleo de técnicas de imagen en los pacientes con CR, (resonancia magnética craneal) y de manera especial en las todas las formas de CRC o si existe algún síntoma o signo atípico que acompañe al dolor de cabeza [22]. Cuando se trata de un primer episodio de dolor, el diagnóstico diferencial es amplio pudiendo los síntomas y signos ser debidos a diversas entidades. Si el dolor es ocular hay que descartar distintos procesos:
• Enfermedades oculares que pueden producir signos de ojo rojo, aumento de la lagrimación o blefaroespasmo. Por ejemplo, glaucoma, conjuntivitis, iridociclitis o lesiones corneales.
• Procesos retroorbitarios, como por ejemplo, oftalmoplejia diabética, tumores y malformaciones del seno cavernoso, procesos inflamatorios a nivel del seno cavernoso (Síndrome de Tolosa y Hunt), tumores de silla turca con extensión extraselar o aneurismas de la comunicante anterior.
• Disección de carótida que puede causar síndrome de Horner junto a cefalea (cervicalgia) y cuyo diagnóstico se comprueba con técnicas de imagen o mediante técnicas de Doppler.
• Otras entidades que se han descrito con casos con perfil clínico similar a la CR son infarto bulbo raquídeo, cordón medular cervical o incluso malformaciones arteriovenosas y aneurismas cerebrales.
En cambio, si el dolor es maxilar o mandibular, el diagnóstico diferencial de la CR se centra en las lesiones dentarias, pulpitis o con la sinusitis maxilar; se diferencia porque hay dolor al golpear la pieza dental o dolor con el calor o frío. A menudo los pacientes son sometidos a Cirugías O.R.L .innecesarias (13%), o se le extraen piezas dentales (16%), antes de ser diagnosticados con de CR.
Cuando ya han aparecido varios episodios de dolor o incluso aparentes racimos, el diagnóstico diferencial es diferente. Por lo general, la cefalea no presenta todas las características propias de la CR, de forma que puede fallar el ritmo de los ataques, faltar los signos autonómicos, o aparecer en la exploración signos neurológicos de otra enfermedad. En estos casos podemos estar delante de tumores supratentoriales o de fosa posterior, malformaciones vasculares o sinusitis esfenoidales.
Si el enfermo joven presenta hipertensión arterial, se debe hacer un estudio de catecolaminas en orina para descartar la existencia de un feocromocitoma. La cefalea similar en cuanto a intensidad, empeoramiento postural, duración inferior a 1 hora, varias veces al día; se diferencia por ser bilateral occipital (se ha descrito CH occipital), pulsátil, acompañada de sudoración, palidez, taquicardia e H.T.A. (signos sistémicos).
La CR se ha de distinguir del resto de las cefaleas trigémino-autonómicas, caracterizadas por ataques de dolor ortbitotemporal intenso, episódico, de corta duración y unilateral, e importantes características autonómicas ipsilaterales. Distinguimos la hemicránea paroxística, la hemicránea crónica y el síndrome SUNCT (acrónimo inglés de cefalea neuralgiforme unilateral de breve duración con inyección conjuntival y lagrimeo). Estas cefalalgias se diferencian de la CR por la corta duración y la mayor incidencia de los ataques. Es interesante destacar que a medida que aumenta la incidencia de los ataques, su duración tiende a disminuir. A su vez, la diferenciación de la CR, tanto en su forma episódica como crónica, de otras hemicraneas paroxísticas tiene implicaciones terapéuticas importantes, ya que estas últimas responden dramáticamente a la indometacina [23]. El síndrome SUNCT, sin embargo no responde a la indometacina ni a los fármacos clásicamente utilizados en la CR. Se han descrito casos de buena respuesta con el empleo de fármacos anticonvulsivantes como el ácido valproico, topiramato o lamotrigina [24].
Recientemente se ha descrito una patología que en el futuro podría incluirse en el grupo de cefaleas trigémino autonómicas, la cual se denomina síndrome LASH (syndrome of long-lasting autonomic symtoms with hemicranea). Este síndrome se diferencia de la CR por la presencia de síntomas autonómicos de larga duración (tres o cuatro horas antes) que pueden persistir con cefalea hasta por tres días y por la respuesta exclusivamente al tratamiento con indometacina.
Es muy frecuente que la CR aparezca durante el sueño y se debe diferenciar de la cefalea hípnica, que puede ser primaria (comienzo tardío, cefalea global, ausencia de síndrome autonómico) o sintomática de una cefalea esencial o de una enfermedad general, como las insuficiencias cardiaca y respiratoria, o de la hipertensión intracraneal o una cefalea por abuso de medicación.
Tratamiento
Los fármacos empleados para tratar las formas de CRE y CRC son similares, si bien, ciertos medicamentos y sus posibles combinaciones pueden ser más útiles para tratar las formas crónicas. En el tratamiento de la CR distinguimos una terapia para yugular los ataques agudos y una terapia preventiva para evitar en lo posible la aparición de dolor o disminuir su duración, frecuencia e intensidad durante los periodos activos.
Siempre se debe comenzar recordando al paciente que debe suprimir los factores precipitantes del ataque en el caso de que los hubiere. Por ejemplo, los enfermos deben dejar el alcohol, sobre todo si padecen la forma crónica. También puede ser necesario suspender o modificar fármacos vasodilatadores. Algunos enfermos evitan dormir la siesta y otros procuran no viajar en avión o ascender a alturas durante los periodos activos. En aquellos pacientes que viajen a grandes alturas, se han notificado casos de buena respuesta a la acetazolamida durante 4 días, empezando 2 días antes. De forma adicional, se debe instar a los pacientes a evitar el tabaquismo debido al uso concomitante de medicamentos vasoconstrictores como triptanes o ergotamínicos.
Al igual que en la migraña, el tratamiento se puede dividir en tratamiento sintomático agudo de las crisis individuales y tratamiento profiláctico, el cual puede incluir una primera parte que denominamos fase de inducción.
Tratamiento del ataque.
El tratamiento agudo del ataque es común en las variedades episódica y crónica. En primer lugar, recordar que los A.I.N.E.S, los analgésicos comunes y los opiáceos no suelen tener ninguna efectividad en las crisis de CR. Las opciones de tratamiento se recogen en la tabla III.
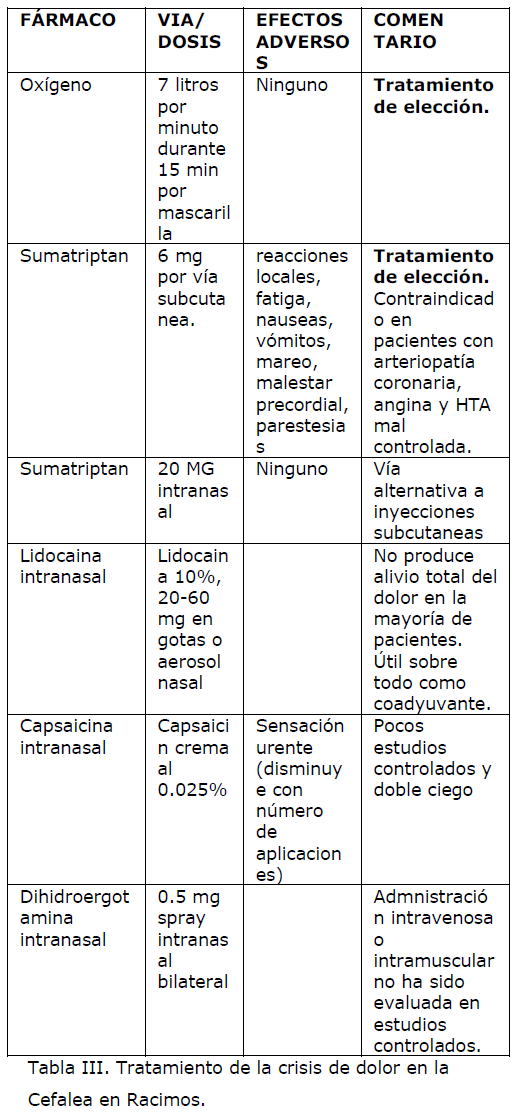
Tabla III. Tratamiento de la crisis de dolor en la Cefalea en Racimos.
Como se ha comentado el dolor máximo aparece a los pocos minutos lo que ha exigido que para conseguir un rápido alivio los tratamientos de elección en las crisis se administren por vía parenteral o incluso por inhalación. El tratamiento sintomático de elección es el SMT [25], un agonista selectivo de los receptores serotoninérgicos intracraneales (triptan) que disminuye la concentración en la vena yugular del PRGC, hace remitir con rapidez la vasodilatación y la inflamación neurógena en vasos y duramadre y bloquea la neurotransmisión nociceptiva en el sistema trigeminal, al mismo tiempo que hace remitir el dolor y los signos autonómicos. La eficacia del SMT por vía subcutánea es espectacular y está demostrada frente a placebo y otros medicamentos. Se administran 6 mg por dicha vía, obteniéndose una elevada biodisponibilidad, alcanzándose con rapidez niveles terapéuticos.
En la práctica diaria, este medicamento es efectivo en nueve de cada diez ataques y surte efecto en pocos minutos; aunque su efectividad es menor en los pacientes con CRC, el medicamento conserva su eficacia cuando se administra de forma diaria en los casos crónicos. Como la duración del ataque de CR es breve, el dolor no recidiva a pesar de que la vida media del SMT es corta. No existe taquifilaxia, de manera que conserva su eficacia cuando se administra a diario durante meses en las formas crónicas. No se aconseja administrarlo más de dos veces en 24 horas. El SMT está contraindicado en la hipertensión arterial no controlada, en la enfermedad coronaria y cuando el paciente tiene alguna vasculopatía. No se debe administrar con metisergida y no se debe administrar antes de 24 horas de haber utilizado un ergotamínico. Los efectos secundarios son habitualmente poco importantes: molestias en el lugar de inyección, parestesias en la cabeza o brazos, sensación de presión en el cuello o calor generalizado. Se ha referido excepcionalmente la aparición de un vasoespasmo coronario o un infarto de miocardio durante el tratamiento con SMT, por lo general inadecuadamente asociado a ergotamínicos.
En un estudio reciente, se ha demostrado la utilidad del SMT en aerosol nasal a dosis de 20 mg aplicado sobre la ventana nasal del lado doloroso o el indoloro [26]. El estudio sugiere que la vía de administración nasal puede servir de alternativa eficaz, de manera especial para aquellos pacientes que prefieren evitar la inyección subcutánea ya sea por efectos adversos locales o por el rechazo a utilizar esta vía. No obstante, el efecto sobre el dolor suele ser más débil y de efecto más lento que la forma subcutánea. Si el paciente rechaza la vía subcutánea se puede también optar por otras vías de administración mediante el empleo de otros triptanes. El zolmitriptan por vía oral (preferiblemente 10 mg) se ha mostrado efectivo en el 40% de los enfermos, frente al 20% de los controles [27]. Su eficacia es limitada en la práctica clínica cotidiana, pudiéndose, a su vez, optar por el zolmitriptan intranasal (5mg) que consigue la desaparición del dolor antes que el oxígeno.
El oxígeno se introdujo como terapia efectiva en el ataque agudo de la CR en la década de los cincuenta del siglo pasado [1]. La base racional de su uso es la corrección de la hipoxemia, que algunos consideran el hecho fundamental del ataque de CR, pero su acción es probablemente inespecífica por medio de vasoconstricción. Se administra mediante mascarilla que ocluya la nariz y boca a velocidad de 7 a 8 litros por minuto, durante al menos 15 minutos, con el enfermo sentado. A pesar de su efectividad, la terapia con oxígeno tiene un inconveniente práctico obvio y aunque hay disponibles equipos portátiles para su empleo en casa o en el trabajo la mayor parte los pacientes desestiman esta opción. Un estudio reciente evaluó la utilidad del oxígeno hiperbárico para el tratamiento de la CR. Se incluyeron 16 pacientes, 12 con CRE y 4 con CRC [28]. Sin embargo, no se obtuvo una respuesta eficaz en la reducción en la intensidad de la cefalea o en la interrupción del racimo en los pacientes con CRE ni CRC.
La administración de lidocaína, 20- 60 mg, en forma de gotas o aerosol nasal, produce una alivio leve o moderado al cabo de 1-10 minutos en un gran parte de los pacientes, aunque pocos consiguen un alivio completo del dolor [29].
La capsaicina aplicada intranasalmente en el lado sintomático parece eficaz en un número significativo de pacientes, tanto con formas episódicas como crónicas [30]. Este fármaco desensibiliza las neuronas del dolor mediante la depleción de sustancia P. Sin embargo, el efecto beneficioso no parece prolongado y los pacientes se hacen refractarios a ciclos terapéuticos consecutivos. Además la irritación local que provoca la administración del fármaco puede no ser tolerada por el paciente, siendo importante avisarle a este respecto. Las opciones del tratamiento agudo se recogen en la Tabla III.
Tratamiento preventivo
Se recomienda utilizar dos tratamientos profilácticos que se introducen simultáneamente pero cuya duración es distinta. El primero (inducción) emplea fármacos como esteroides o ergotamina, tiene un efecto rápido y se mantiene durante un periodo breve para dar tiempo a que el segundo tratamiento, de efecto más lento, haga su efecto. El segundo (mantenimiento) emplea fármacos como el verapamilo o el carbonato de litio, manteniéndose mientras dura el racimo.
Tratamiento preventivo de inducción.
El objetivo de esta modalidad de tratamiento es lograr una rápida supresión de las crisis así como la obtención de mayores periodos de remisión. Como se ha comentado, esta terapia consiste en la administración paralela de medicamentos con propiedades analgésicas con potenciales efectos adversos que limitan su uso prolongado con el inicio simultáneo de tratamientos preventivos.
Los esteroides constituyen el tratamiento profiláctico rápido de elección de la CRE. Una ventaja es que se pueden asociar a los triptanes y un inconveniente son sus efectos secundarios (osteonecrosis de cabeza femoral o psicosis) o sus contraindicaciones (hipertensión no controlada, diabetes, infecciones, úlcera gastroduodenal). Aunque su uso se ha extendido a la mayoría de pacientes con CRE no existen pautas que se puedan derivar de los resultados obtenidos en los ensayos clínicos, fundamentalmente porque estos han sido retrospectivos, no controlados y han utilizado pautas de administración muy dispares. No obstante, la práctica más extendida es administrarlos en pauta corta siendo la duración media de 4 semanas si se incluye la retirada progresiva. Se emplean por vía oral 60-80 mg de prednisona o 8 mg de dexametasona. En pacientes con racimo resistente se puede dar un bolo de metilprednisolona de 250 o 500 o 1000 gr/día por vía intravenosa entre uno y tres días, seguidos de pauta oral descendente de prednisona vía oral, la cual no se recomienda dure más allá de tres semanas. [31]
Se desaconseja el uso de corticoides en la CRC porque su empleo de manera continuada puede cronificar la cefalea [23]. No es infrecuente que la CRE se trate con corticoides y en no pocas ocasiones los dolores reaparecen al ir disminuyendo la dosis, de forma que el propio paciente o el médico vuelven a aumentarla, perpetuando el uso de los corticoides. En estas circunstancias, el paciente suele desarrollar una cefalea crónica que difiere en varios aspectos de la CR “clásica”: es de baja frecuencia y menor intensidad, no se acompaña de signos autonómicos y no responde al SMT subcutáneo. Cuando se les retira los corticoides pueden desarrollar un status de cefalea con intensa agitación. Este estado es difícil de manejar y requiere el empleo de tranquilizantes y analgésicos potentes, incluso mórficos, de tal manera que se suele requerir el ingreso del paciente.
La base racional para la utilización del tartrato de ergotamina es su acción sobre los receptores serotoninérgicos intracraneales y utilizarlo como medicación preventiva se debe a que la duración de su efecto es muy prolongada. Como se trata de un agonista sucio, sus efectos adversos son generales y mayores que con el SMT. Nunca debe administrarse en la fase aguda si se está usando como profiláctico ni concomitantemente el sumatriptan. Si el dolor siempre aparece al poco de dormirse, se aconseja uno a dos miligramos de tartrato de ergotamina al irse a la cama [32]. La posible aparición de ergotismo limita su utilización crónica, en concreto en las formas de CRC. Sin embargo, un estudio reciente [35], defiende su uso en las formas de CRC refractarias a tratamiento: 17 de 37 pacientes (46%) con CRC se encontraban libres de síntomas a los tres meses de iniciado el tratamiento; 4 (11%) habían presentado una mejoría parcial; en cambio en 16 (43%) el tratamiento no había modificado en curso de la enfermedad.
Por último, un fármaco de reciente uso como tratamiento de inducción es el naratriptan, 2,5 mg dos veces al día, aunque el empleo de este triptan tiene como principal inconveniente que impide el uso de sumatriptan para el alivio de las crisis de dolor.
Tratamiento preventivo de mantenimiento
Los pacientes con CRC reciben tratamiento preventivo de mantenimiento de manera indefinida o hasta presentar un periodo de tiempo libre de dolor igual o superior a seis meses. Los pacientes con formas CRE reciben este tratamiento mientras durante los racimos hasta presentar 2 semanas libres de dolor
De los tratamientos profilácticos prolongados, el verapamilo (VP) es el tratamiento de elección para su uso a largo plazo, tanto en la CRE como en la CRC [33]. Como fármacos de segunda línea se encuentran el carbonato de litio, neuromoduladores como el ácido valproico y topiramato o la metisergida.
La eficacia del verapamilo se ha comprobado en un estudio doble ciego controlado con placebo. El medicamento es bien tolerado y puede utilizarse en conjunción con SMT, ergotamínicos, corticoides u otros fármacos preventivos. Puede causar estreñimiento, edema en las piernas, mareo y cansancio, hipotensión y bradicardia. Estos efectos adversos pueden potenciar las alteraciones autonómicas generales de la CR estando contraindicado en pacientes con estas manifestaciones sobre todo si aparecen síncopes. Cuando se emplean dosis altas se debe vigilar la aparición de un bloqueo de rama cardiaco. Las dosis más utilizadas son de 120 mg de la formulación retardada tres veces al día, pero se aconseja llegar a 720 mg al día en casos refractarios o incluso dosis mayores. Recientemente se ha propuesto una pauta para individualizar el uso de VP no retardado con dosis máximas de 960 mg/día [34].
Como segundo fármaco de elección suele emplearse el carbonato de litio (CLI), el cual, tiene su principal indicación en la CRC. Se comienza con dosis de 200 mg cada doce horas y se suben 200 mg cada semana a diez días, hasta controlar los dolores, obtener una mejoría suficiente o alcanzar litemias en el nivel máximo del rango terapéutico. Se llegan a dar de 600 a 1200 mg al día o incluso más, repartidos en tres tomas. No obstante el CLI suele ser eficaz administrando dosis entre 600 y 900 mg, dosis que en general son inferiores a las empleadas en los trastornos psiquiátricos. En un metaanálisis sobre 28 ensayos clínicos, que incluían 468 pacientes, se demostró una respuesta eficaz en el 78% de los 304 pacientes con CRC [35]. La eficacia del litio en los pacientes con CRC parece mantenerse incluso más allá de los cuatro años de tratamiento continuado. Un estudio doble ciego comprobó la similar eficacia entre pacientes tratados con 360 mg de VP y 900 mg de CLI. El CLI está contraindicado en la insuficiencia renal crónica y en el hipotiroidismo y se debe evitar en pacientes con dieta hiponatrémica y en los que toman diuréticos, indometacina o diclofenaco. Los efectos secundarios más comunes son el temblor, diarrea, aumento de peso y edemas
La administración de 4-10 mg/día de metisergida reduce o previene la CR en el 60% de los pacientes. Los efectos adversos inmediatos son, en caso de producirse, leves [nauseas, calambres en extremidades inferiores o retención de líquidos). Sin embargo cuando se administra durante varios meses existe riesgo de aparición de fibrosis retroperitoneal, de tal forma que su uso en las formas crónicas es controvertido. No obstante, existen recomendaciones en el caso de que se elija este medicamento: puede administrase durante tres a seis meses si el racimo persiste mucho tiempo o si el paciente sufre CRC; pasado este tiempo, el tratamiento deberá interrumpirse durante cuatro semanas; algunas autores recomiendan realizar un TC o una RM abdominal, una radiografia de tórax y una determinación de creatinina sérica durante el periodo de descanso; si el paciente no presenta ningún signo de fibrosis, el tratamiento con metisergida puede continuar durante 3-6 meses, y una vez, pasado este tiempo se interrumpirá de nuevo [36].
Hering R et al comprobó en un estudio con 15 pacientes con CR en el año 1989, la eficacia del ácido valproico (VPA), con dosis entre 600-1200 mg, hallando una tasa de eficacia en un 73% de los pacientes [37]. Sin embargo, trabajos ulteriores han sido contradictorios, no demostraron una clara eficacia del VPA en la CR [38]. En la práctica clínica, el VPA puede ser considerado una opción terapéutica en aquellos casos de CRC refractaria cuando han fracasado el verapamilo o el litio. Se suele comenzar con dosis de 250 mg dos veces al día, pudiéndose alcanzar hasta 2 g día.
La gabapentina también puede ser utilizada como opción terapéutica en la CRC. En estudios abiertos ha proporcionado beneficio preventivo rápido (en menos de 8 días) a dosis de 900 mg diarios. En un trabajo con 12 pacientes diagnosticados de CR refractaria, (8 con CRE y 4 con CRC) se empleo GBP a dosis de 900 mg día [39]; todos los pacientes presentaron mejoría de los síntomas, y en un caso de un varón de 28 años con CRC se produjo una remisión completa de los síntomas. En otro caso [40], una mujer de 38 años con CRE refractaria a los tratamientos preventivos habituales (VP) consiguió una remisión completa con 1800 mg de GBP. Estos datos sugieren una utilidad de la GBP en la CR, aunque es difícil, dada la escasa casuística ofrecer recomendaciones sobre el modo de empleo de la GBP. Sin embargo, dada la seguridad del fármaco, sin prácticamente interacciones medicamentosas o efectos secundarios, parece razonable aconsejar su uso en los casos de CRC refractaria. Al igual que el VPA o la GBP, el topiramato (TPM) puede ser considerado como una opción terapéutica en los casos de CRC refractaria, asociado a otros fármacos [41]. La dosis efectiva se sitúa entre 50 mg y 150 mg al día; se ha de comenzar con 25 mg al día, aumentando la dosis con lentitud, por ejemplo 25 mg cada semana.
En base al papel crucial del hipotálamo en la génesis de los periodos sintomáticos, la puntualidad horaria de los ataques e incluso su posible labor como generador en si de la sintomatología, diversos investigadores han decidido utilizar melatonina como agente preventivo de la cefalea en racimos. La eficacia de 10 mg de melatonina ha sido evaluada en estudio doble ciego controlado con placebo [42]. Se comprobó una respuesta eficaz en cinco de los diez pacientes tratados con melatonina frente a ninguno de los diez tratados con placebo. Observaciones similares fueron obtenidas en dos casos de CRC refractarias al tratamiento médico que respondieron de manera completa a 9 mg de melatonina, con una remisión de los ataques después de ocho meses de seguimiento. Sin embargo, en otro estudio doble ciego controlado con placebo [43], no se encontraron diferencias significativas entre el grupo de pacientes tratados con melatonina y el grupo tratado con placebo. No obstante, al igual que ocurre con la GBP, la inocuidad de la melatonina y la existencia de algún resultado positivo, hace que sea recomendable su utilización en casos de CR rebelde al tratamiento convencional.
A su vez, existen otros posibles tratamientos, cuya eficacia en la CR se debe comprobar con nuevos estudios, sin que existan recomendaciones oficiales para su empleo y que pueden ser útiles en determinados casos de rebeldía al tratamiento habitual:
• El Frovatriptan, triptan de reciente aparición, cuya vida media es relativamente prolongada, se ha considerado útil como medicación preventiva de acuerdo con la práctica clínica, pero impide el uso de otro triptan, por ejemplo SMT, de forma sintomática [44].
• Se han publicado casos aislados de buena respuesta a la administración de toxina botulínica tipo A, de igual modo que ocurre con la migraña o cefalea tensional; sin embargo los resultados con contradictorios, habiéndose publicado igualmente casos de CRC refractaria y resultados negativos tras la administración de toxina botulínica [45].
• El Pizotifeno, es un potente antagonista serotoninérgico con acción antihistamínica y anticolinérgica. En estudios controlados frente a placebo mostró una adecuada eficacia en el 50% de los pacientes, pero eran estudios en pacientes que mostraban mayoritariamente CRE. La dosis diaria es de 1,5 mg repartida en tres tomas, hasta un máximo de 3 mg/día. Sus principales efectos secundarios son el aumento de peso y la sedación, que condicionan su uso en las formas crónicas [45].
• El uso de leuprolida, análogo sintético de la hormona liberadora de gonadotropina se ha empleado con éxito en un serie 30 pacientes vaorones con CR rebelde al tramiento habitual. Se consiguió una disminución de la intensidad (hasta el 63%) y duración de las crisis de dolor (de 94 a 9.4 minutos), la respuesta se comenzó a observar a los 10 días de iniciado el tratamiento. Se produjo disminución de lívido en seis pacientes(20%), siendo este el efecto secundario más frecuente [45].
Las claves terapéuticas de la CR se recogen en la tabla IV.

Tabla IV Claves terapéuticas y nivel de evidencia en el tratamiento de la Cefalea en Racimos.
Crc Refractaria
Un porcentaje pequeño de pacientes son refractarios a las medidas terapéuticas convencionales, pero dado el sufrimiento brutal al que están sometidos la búsqueda de alivio es inmensa. Alrededor de un 15% de los pacientes con CRC presentan mala respuesta a tratamientos en monoterapia. Estos pacientes pueden beneficiarse de un tratamiento mixto, empleando diferentes combinaciones de los fármacos anteriormente descritos. Por ejemplo, Kudrow recomendaba una triple terapia en pacientes refractarios, consistente en hasta 400 mg de VP, 900 de CLI y 2 de ergotamina. En el año 1999, un grupo de expertos en la CR recomendó posibles combinaciones, tanto para tratar las formas de CRE como las formas de CRC rebeldes al tratamiento en monoterapia. Se sugerían distintas posibilidades empleando, VP CLI, metisergida o pizotifeno. A este respecto, hay que recordar la idoneidad de utilizar otros fármacos, como el TPM, VPA, GBP o melatonina, fármacos más seguros que los empleados clásicamente.
En la actualidad ha resurgido de nuevo el interés por las técnicas quirúrgicas en el tratamiento de la CR. Debido a los riesgos inherentes en todo procedimiento quirúrgico, la cirugía se considera siempre como última medida terapéutica. El tratamiento quirúrgico está indicado en las formas de CRC refractaria cuando fallan todos los tratamientos médicos, si el dolor no ha cambiado de lado (estrictamente unilateral en la división oftálmica del trigémino), si no existe adicción a fármacos o un uso inadecuado de esteroides y el paciente no sufre trastornos psiquiátricos [46]. En la actualidad las intervenciones se realizan bien sobre la vía trigeminal o bien sobre el hipotálamo [47].
El tratamiento quirúrgico clásico se ha dirigido a la sección del trigémino a través de diferentes vías: rizotomía por radiofrecuencia o termocoagulación del ganglio de Gasser, inyección de glicerol en la cavidad de Meckel o a nivel del nervio supraorbitario o infraorbitario, radiocirugía con gammaknife, descompresión microvascular mediante craneotomia suboccipital o sección de la raíz trigeminal.
En la actualidad la rizotomía trigeminal por radiofrecuencia constituye en la mayoría de los centros hospitalarios la técnica quirúrgica de elección. La mortalidad es nula y la enfermedad recidiva a largo plazo sólo en uno de cada cinco pacientes. Se han publicado casos de remisión completa de los síntomas durante un periodo superior a 20 años [48]. En general, este procedimiento ha otorgado control del dolor a cerca del 70% de los pacientes aunque se han descrito tasas de recurrencia del 20% y fallos de hasta del 30%. Para que esta intervención sea efectiva se requiere que la analgesia conseguida tras la intervención sea completa. Si el dolor se localiza en la región orbitaria, se conseguirá un alivio de los síntomas produciendo lesiones a nivel de V1 y V2; por el contrario, si el dolor afecta a la región temporal o auricular, se requiere también lesionar V3. Complicaciones transitorias de la técnica incluyen diplopia, hiperacusia, cefalea punzante o desviación mandibular; complicaciones a largo plazo incluyen anestesia corneal, y en menos de un 4% de los casos, anestesia dolorosa (hipoestesia y disestesias mantenidas en el lado operado) [49]. La rizotomía trigeminal con glicerol es un procedimiento alternativo a la radioterapia. Entre sus ventajas se encuentran que no necesita anestesia general y la presencia de menores riesgos de anestesia corneal o queratitis. Sin embargo la tasa de recaídas es mayor.
En un estudio reciente, Jarrar et al, objetivaron una buena respuesta al tratamiento quirúrgico consistente en sección de la raíz sensitiva del nervio trigeminal a nivel de su salida en el tronco del encéfalo; 15 de los 17 pacientes estudiados (88%), experimentaron un alivio completo en el postoperatorio inmediato y cerca del 75% mostraron un efecto beneficioso a la largo plazo (media de seguimiento de los pacientes de seis años y medio). 10 de los 17 pacientes no requirieron utilizar fármacos preventivos. Posibles complicaciones de la técnica son ictus, debilidad de los músculos masticatorios, disestesias faciales y aparición de anestesia dolorosa [50].
Recientemente, se ha notificado que la estimulación del nervio occipital mayor podría considerarse como técnica alternativa en pacientes con CRC refractaria; Dodick et al consiguieron una buena respuesta en dos pacientes con CRC refractaria sometidos a dicho procedimiento en base a las observaciones de que el dolor de localización occipital en ocasiones aparece en al ataque agudo de CR y que el bloqueo del nervio occipital consigue yugular el episodio doloroso de una CR. [51].
En los últimos años, se ha ensañado la estimulación cerebral profunda para el tratamiento de la CRC refractaria utilizando como diana el hipotálamo posterior. Esta técnica se fundamenta en la activación de la zona periventricular del hipotálamo observada en el PET realizado en pacientes durante los ataques de CR. La efectividad se demuestra porque el dolor desaparece sólo cuando el sistema está activo e incluso se ha demostrado en un paciente sometido a estimulación profunda cerebral una ausencia de respuesta a nitroglicerina, la cual, en condiciones normales es capaz de desencadenar al ataque de dolor característico de la CR. Leone et al en el año 2003 [52] publicaron una serie de pacientes que presentaban CRC refractaria obteniendo resultados excelentes mediante la aplicación de esta técnica. Sin embargo, en el año 2005, Schoenen et al [53] no demostraron ni la efectividad ni la inocuidad de esta técnica en otra serie de pacientes. La respuesta no apareció en todos los pacientes tratados y la mortalidad y morbilidad no fueron despreciables: uno de los pacientes falleció por una hemorragia intracerebral y en otro la implantación del electrodo debió de ser interrumpida por la aparición de un ataque de pánico asociado con trastornos disautonómicos graves. Además, en todos los pacientes si se alcanzaba una determinada potencia (mayor de 1.5 V), los electrodos provocaban disfunción oculomotora con aparición de diplopia, lo cual limitaba su uso en aquellos pacientes que presentaban recaídas a largo plazo.
A diferencia de lo que ocurre con la estimulación profunda del núcleo subtalámico en la enfermedad de Parkinson, en la CR no existe ningún marcador, ni clínico ni neurofisiológico, que confirme la posición correcta del estimulador en el hipotálamo posterior. A su vez, mientras que en los pacientes con EP sometidos a cirugía esterotáxica es fácil comprobar el efecto terapéutico del estimulador, sin embargo, esto mismo es más difícil en los pacientes con CR, dado que los ataques son transitorios y fluctuantes a lo largo del tiempo.
Probablemente se requiere una mayor experiencia en la aplicación de la estimulación profunda cerebral del hipotálamo posterior pero sin duda, esta técnica supone un motivo de esperanza para aquellos pacientes condenados a sufrir CRC refractaria con una importante repercusión en su calidad de vida. De este modo se espera que en un futuro no muy lejano, ésta sea la técnica de elección para aquellos pacientes a los que se les hayan realizado procedimientos percutáneos trigeminales sin éxito y que sigan con su clínica invalidante
1270
References
- The International Classification of Headache Disorders. 2nd ed. Cephalalgia 2004 (suppl 1): 1-160.
- Black DF, Swanson JW, Stang PE. Decreasing incidence of cluster headache: a population-bases study in Olmsted county, Minnesota. Headache 2005; 45:220-3.
- Manzoni GC. Gender ratio of cluster headache over the years: a possible role of changes in lifestyle. Cephalalgia 1998; 18:138-42.
- Russell MB. Epidemiology and genetics of cluster headache. Lancet Neurology 2004; 3:279-83.
- Manzoni GC. Cluster headache and lifestyle: remarks on a population of 374 male patients. Cephalalgia 1999; 19:88-94.
- Bogucki A. Studies on nitroglycerin and histamine provoked cluster headache attacks. Cephalalgia 1990; 10:71-5.
- Rozen T, Edmeads J. Update in cluster headache. Neurology 2004; 19 (Suppl 3): 65-71.
- Pearce JM. Natural history of cluster headache. Headache 1993; 33:253-6.
- Torelli P, Cologno D, Cademartiti C, Manzoni GC. Possible predictive factors in the evolution of episodic to chronic cluster headache. Headache 2000; 40:798-803.
- Granella F, Micieli G, Zanferrari C, Cavallini A, Manzoni GC, Nappi GC. Natural history of cluster headache: an epidemiological study. Cephalalgia 1987; 7 (Suppl 6): 319-20.
- Sjaastad O, de Souza Carvalho D, Fragoso YD, Zhao JM. Cluster headache: on the significance of so called minibouts. Cephalalgia 1988; 8:121-6.
- Torelli, D Cologno, C Cademartiti, Manzoni GC. Primary and secundary chronic cluster headache: two separate entities?. Cephalalgia 2000; 20: 826-29.
- Hering-Hanit R. Alteration in nature of cluster headache during subcutaneous administration of sumatriptan. Headache 2000; 40:41-4.
- Alberca R, Franco E, Navarro A, Salinas E, Lozano P, Martínez E. Transformed cluster headache by chronic steroid treatment. Cephalalgia 1999; 19:432.
- Goadsby PJ, Edvinsson L. Human in vivo evidence for trigeminovascular activation in cluster headache. Brain 1994; 117:427-34.
- May A, Bahra A, Buchel C, et al. Hypothalamic activation in cluster headache attacks. Lancet 1998; 352:275-8.
- Sprenger T, Boecker H, Tolle TR, Bussone G, May A, Leone M. Specific hypothalamic activation during a spontaneous cluster headache attack. Neurology 2004; 62: 516-7.
- May A, Ashburner J, Buchel C. Correlation between structural and functional changes in brain in an idiopathic headache syndrome. Nat Med 1999; 5:836-8.
- Zakrzewska JM. Cluster headache: review of the literature. Br J Oral Maxillofac Surg 2001;39:103-13.
- Dodick DW. Indomethacin-responsive headache syndromes. Curr Pain Headache Rep 2004; 8:19-26.
- Goadsby PJ, Lipton RB. A review of paroxysmal hemicranias, SUNCT syndrome and other short-lasting headaches with autonomic features, including new cases. Brain 1997; 120: 193-209.
- Ekbom K.Treatment of cluster headache with sumatriptan. N Engl J Med 1991; 325:322-6.
- van Vliet JA, Bahra A, Martin V et al. Intranasal sumatriptan in cluster headache: randomized placebocontrolled double-blind study. Neurology 2003; 60:630-3.
- Barha A, Becker WJ, Blau JN. Efficacy of oral zolmitriptan in the acute treatment of cluster headache [abstract]. Cephalalgia 1999; 19:457.
- Nilsson Remahl AIM, Anskjön R, Lind F, Waldenlind E. Hyperbaric oxygen treatment of active cluster headache: a double-blind placebo-controlled cross-over study. Cephalalgia 2002; 22:730-9.
- Robbins L. Intranasal lidocaine for cluster headache. Headache 1995;35:83.84.
- Marks DR, Rapoport A, Padla D, Weeks R, Rosum R, Sheftell F, Arrowsmith F. A double-blind placebo-controlled trial of intranasal capsaicin for cluster headache. Cephalalgia 1993; 13:114- 116.
- Cianchetti C, Zuddas A, Marchei F. High dose intravenous methylprednisolone in cluster headache. J Neurol Neurosurg Psychiat 1998;64-418.
- Magnoux E, Zlotnik G. Outpatient intravenous dihydroergotamine for refractory cluster headache. Headache 2004; 44:249-55.
- Leone M, D´Amico D, Attanasio A et al. Verapamil is an effective prophilactic treatment for cluster headache. Results of double-blind multicenter study versus placebo. En Olesen J, Goadsby PJ editores. Cluster headache and related conditions. Oxford: Oxford University Press 1999.p.296-9.
- Blau JN, Engel HO. Individualizing treatment with verapamil for cluster headache patients. Headache 2004; 44:1013-8.
- Ekbom K. Lithium for cluster headache: reviuw of the literature and preliminary results of long-term treatment. Headache 1981; 21:132-9.
- Krabbe A. Limited efficacy of methisergide in cluster headache. A clinical experience. Cephalalgia 1989; 9:404-5.
- Hering R, Kuritzky A. Sodium valproate in the treatment of cluster headache: an open trial. Cephalalgia 1989; 9:195-8.
- El Amrani M, Massiou H, Bousser MG. A negative trial of sodium valproate in cluster headache: methodologycal issues. Cephalalgia 2002; 22:205-8.
- Tay BA, Ngan Kee WD, Chung DC. Gabapentin for the treatment and prophylaxis of cluster headache. Reg Anesth Med 2001; 26:373-5.
- Ahmed F. Chronic cluster headache responding to gabapentin: a case report. Cephalalgia 2000; 20:252-3.
- Láinez MJA, Pascual J, Pascual AM, et al. Topiramate in the prophylactic treatment of cluster headache. Cephalalgia 2003; 43: 784-9.
- Leone M, D´Amico D, Moschiano et al. Melatonin versus placebo in the prophylaxis of cluster headache: a double-blind pilot study with parallel groups. Cephalalgia 1996; 16:494-6.
- Pringsheim T, Magnoux E, Dobson CF et al. Melatonin as adjuntive therapy in the prophylaxis of cluster headache: a pilot study. Cephalalgia 2003; 23:193-6.
- Siow HC, Pozo-Rosich P, Silberstein SD. Frovatriptan for the treatment of cluster headache. Cephalalgia 2004; 24:1045-58.
- Speight TM, Avery GS. Pizotifen (BC- 105): a review of its pharmacological properties and its therapeutic efficacy in vascular headaches. Drugs 1972;3:159-203.
- Ekbom K, Solomon S. Management of cluster headache. En: Olesen J. Tfelt- Hansen P, Welch KWA. Eds The Headaches 2ª ed. Philadelphia: Lippincott Williams & Wilkins; 2000. p731-40.
- Rozen TD. Interventional treatment for cluster headache: a review of the options. Curr Pain Headache Rep 2002; 6:57-64.
- Taha JM, Tew JM. Long.term results of radiofrequency rhizotomy in the treatment of cluster headache. Headache 1995; 35:193-6.
- Onofrio BM, Campbell JK. Surgical treatment of chronic cluster headache. Mayo Clin Pro 1986; 61: 537-44.
- Jarrar R, Black D, Dodick DW, Davis D. Outcome of trigeminal nerve section in the treatment of chronic cluster headache. Neurology 2003; 60:1360- 2.
- Dodick DW, Trentman T, Zimmerman R, Eross EJ. Occipital nerve stimulation for intractable chronic primary headache disorder. Cephalalgia 2003; 23:701.
- Leone M, Francini A, Broggi G, Bussone G. Hypothalamic deep brain stimulation for intractable chronic cluster headache; a three year followup. Neurol Sci 2003; 24:143-5.
- Schoenen J, Di Clemente L, Vandenheede M et al. Hypothalamic stimulation in chronic cluster headache: a pilot study of efficacy and mode of action. Brain 2005; 128: 940- 7.









