Key words
postmenopausal women, diabetes, hypercholesterolemia, hormonal replacement therapy, pravastatin.
Introduccion
Se define la menopausia como el cese permanente de la menstruación, teniendo como promedio de edad 51 años al momento de su inicio [1]. Alrededor del 30 al 35% de las mujeres mayores de 55 años presentan hipercolesterolemia [1-2], presentando aumento de 16% en los niveles de triglicéridos, de 20% en el colesterol LDL y disminución de 25% en colesterol HDL [3,4]. A esto se le puede añadir el hecho que las mujeres diabéticas presentan un incremento en la aparición de dislipidemia [5], presentando hallazgos similares a lo descrito previamente (disminución del colesterol HDL y aumento del colesterol total, colesterol LDL y triglicéridos).
Algunos investigadores han comparado el efecto del uso de estrógenos solos o en combinación con una estatina para optimizar las concentraciones en el perfil de lípidos, debido a que con el uso de estrógenos equinos conjugados más acetato de medroxiprogesterona hay una disminución en los niveles de colesterol [6,7]. Darling y cols [8] compararon el uso de simvastatina contra TRH y su efecto sobre el perfil lipídico, encontrando una mejor respuesta en los pacientes que tomaron simvastatina. Posteriormente, Fak y cols [9] combinaron los dos tratamientos y los compararon contra la simvastatina sola. La respuesta fue mejor en el grupo que utilizó la combinación. Estos dos estudios se llevaron a cabo en mujeres posmenopáusicas sanas.
Por lo que respecta a mujeres posmenopáusicas diabéticas, se encuentran pocos estudios realizados: Friday K et al. [10], compararon el uso de estrógenos equinos conjugados contra placebo, la diferencia aunque no tan amplia, resultó significativa a favor de las personas con medicamento que con el placebo; Ng et al. [11], observaron en un estudio de 1 sólo grupo de pacientes sin comparación, que la pravastatina disminuye las concentraciones plasmáticas de lipoproteínas remanentes. Por tanto, debido a que la dislipidemia es un factor de riesgo para enfermedad coronaria [12] y dicha enfermedad supera la mortalidad producida por el cáncer de mama en las mujeres [13] e incluso a la misma enfermedad cardiovascular en los hombres [14,15], consideramos oportuno evaluar el efecto de la TRH mas la pravastatina sobre el perfil lipídico en este tipo de pacientes.
Material y métodos
De enero de 200 7 a abril de 200 8, se realizó un ensayo clínico abierto. De la consulta externa del servicio de Medicina Interna del Hospital General de Zona No. 1 del IMSS de Colima, México, se seleccionaron mujeres con los siguientes criterios de inclusión; edad de 50 a 65 años, diabetes mellitus tipo 2, menopausia (ultima menstruación ≥ 1 año), hipercolesterolemia (colesterol ≥ 200 mg/dl), con o sin útero, citología exfoliativa cervical normal (≤ 1 año), exploración médica de mama normal y sin antecedentes de terapia de reemplazo hormonal en los últimos 6 meses. A las pacientes que cumplieron los criterios de inclusión se les informó el objetivo del estudio y a las que aceptaron participar se les solicitó su consentimiento firmado. Todos los procedimientos realizados respetaron las normas éticas concordantes con la Declaración de Helsinki y el estudio fue aprobado por el Comité de Ética e Investigación del Hospital General de Zona No. 1 del IMSS de Colima, México. El tamaño de muestra se calculó de acuerdo a la fórmula de comparación de dos promedios para contraste de hipótesis, al resultado le agregamos un 20% por las pérdidas esperadas, por lo que la muestra final fue de ~ 15 pacientes por grupo. Posteriormente las pacientes fueron asignadas aleatoriamente a los siguientes grupos; grupo A tratamiento con pravastatina 20 mg al día vía oral más tratamiento habitual de su patología de fondo y grupo B pravastatina 20 mg al día + TRH (0.625 mg de estrógenos equinos conjugados + 2.5 mg de acetato de medroxiprogesterona) + tratamiento habitual de su patología de fondo. El tratamiento en ambos grupos fue de 8 semanas (Figura 1). Al inicio y final del estudio a todas las pacientes se les realizó determinaciones séricas de glucosa, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, deshidrogenasa láctica (DHL) y creatinina. Además se les determinó el peso, talla e índice de masa corporal (IMC).
Figura 1: Diagrama de flujo de las pacientes a través del estudio.
Análisis estadístico. Se utilizó estadística descriptiva como promedios, desviación estándar y porcentajes. Para la comparación de promedios y de acuerdo a la homogeneidad o no de las varianzas, utilizamos pruebas pareadas como t de Student o Wilcoxon y no pareadas como t de Student o U de Mann-Whitney respectivamente. La comparación de porcentajes de mejoría (parámetros normales al final del estudio) fue evaluado con las pruebas X2 o exacta de Fisher. Por último, determinamos la reducción de riesgo absoluto (RRA), riesgo relativo (RR), reducción de riesgo relativo (RRR), razón de momios (OR) y número necesario de pacientes a tratar (NNT) para los parámetros bioquímicos. En todas las pruebas estadísticas utilizamos un intervalo de confianza (IC) del 95% y se considero significancia estadística cuando p < 0.05.
Resultados
Resultados Como se observa en la Figura 1, el 100 % de las pacientes completaron el periodo de estudio. El promedio de edad de las pacientes fue de 59.6±3.8 años (intervalo 52 a 66 años), con un peso de 69.3±11 Kg (intervalo 47 a 86 Kg), talla de 1.53±6.0 m (intervalo 1.4 a 1.7 m), IMC de 28.6 ±4.3 Kg/ talla2 (intervalo 20-3 6 Kg/talla2). El 46.7% (n= 14) de las pacientes tuvieron cifras normales de glucosa (< 126 mg/dL) al inicio del estudio.
En la Tabla 1 se presenta la comparación de promedios entre los dos grupos de tratamiento y como se observa sólo hubo diferencia para el colesterol HDL y aunque el grupo B presentó un promedio estadísticamente mayor que el grupo A (p = 0.04), esta diferencia quizás fue debida al azar, ya que desde la determinación inicial existía una diferencia estadísticamente significativa entre los dos grupos (p = 0.00 8).
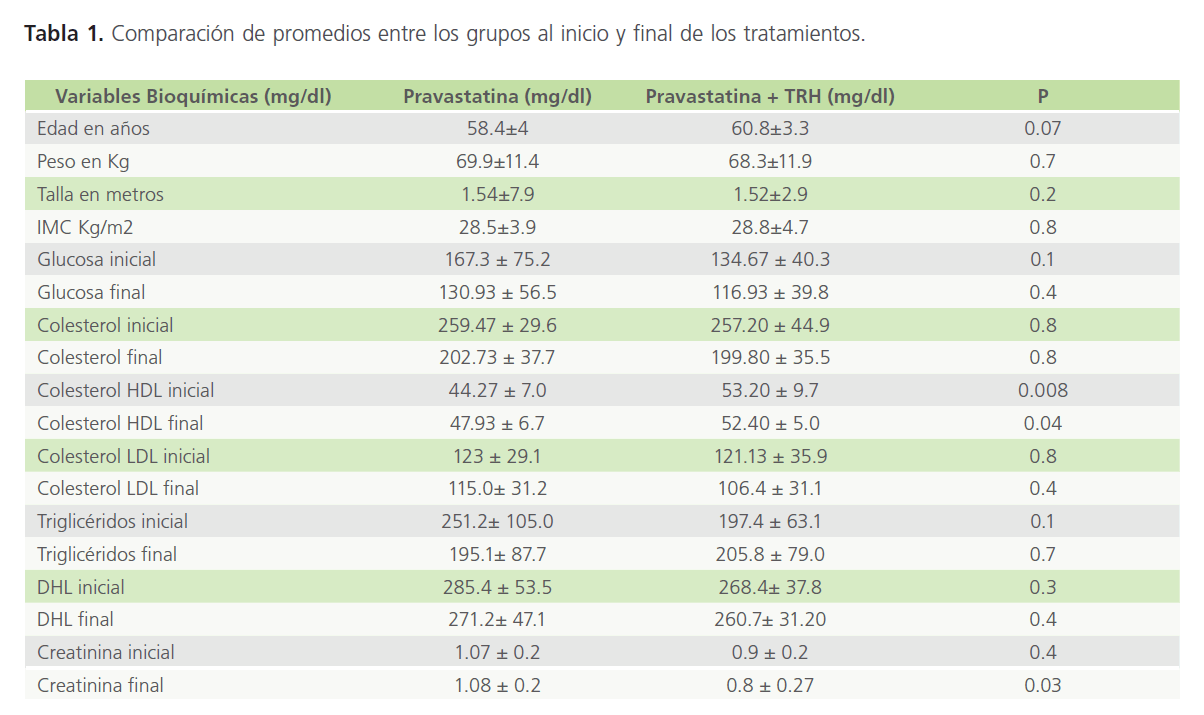
Tabla 1: Comparación de promedios entre los grupos al inicio y final de los tratamientos.
En la Tabla 2 se muestran las comparaciones pareadas de los parámetros bioquímicos y como se observa, el grupo A (pravastatina) presentó disminución estadísticamente significativa de glucosa, colesterol total y triglicéridos; así como incremento estadísticamente significativo de colesterol HDL. Mientras que el grupo B (TRH y pravastatina) todos los parámetros bioquímicos tendieron a disminuir, siendo esta disminución estadísticamente significativa para glucosa, colesterol total, colesterol LDL y creatinina.
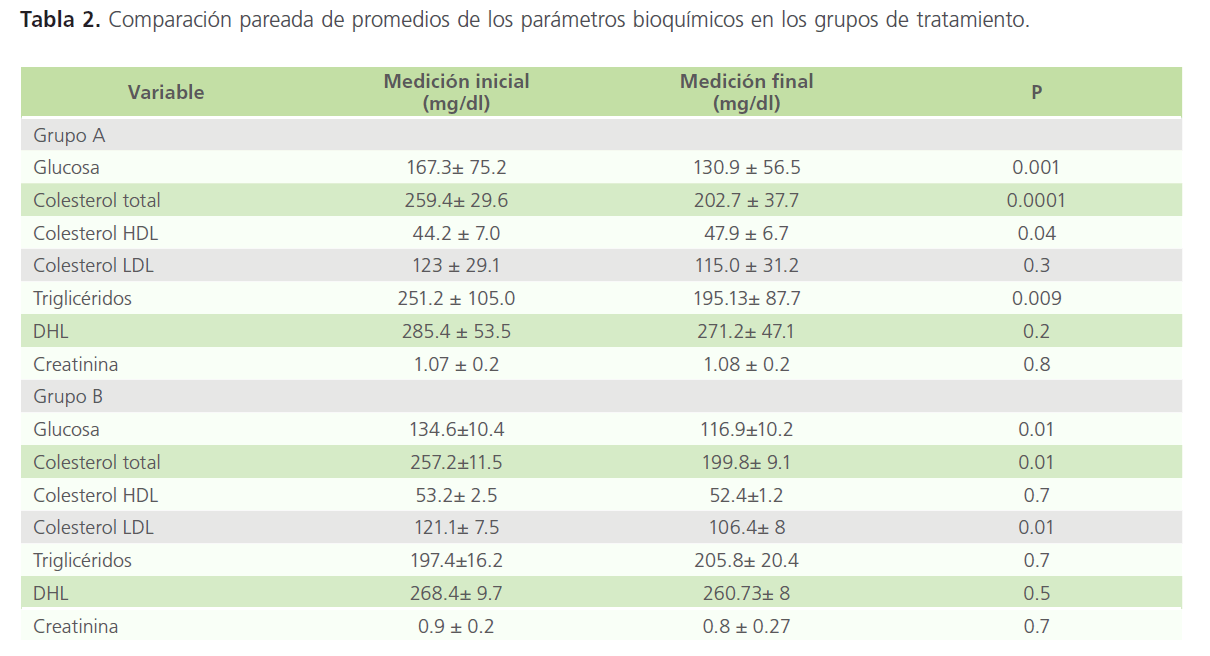
Tabla 2: Comparación pareada de promedios de los parámetros bioquímicos en los grupos de tratamiento.
También analizamos el porcentaje de pacientes que obtuvieron cifras normales de los parámetros bioquímicos al inicio versus final del estudio y observamos que ambos grupos mejoraron los parámetros bioquímicos en un porcentaje de 16% a 60%, sin embargo, el grupo de TRH + pravastatina presentó una disminución estadísticamente significativa del colesterol HDL (Tabla 3).

Tabla 3: Comparación de porcentajes de mejoría bioquímica entre los tratamientos.
Por último, como se observa en la Tabla 4, el NNT para la TRH + pravastatina fue de 4 a 15 pacientes.
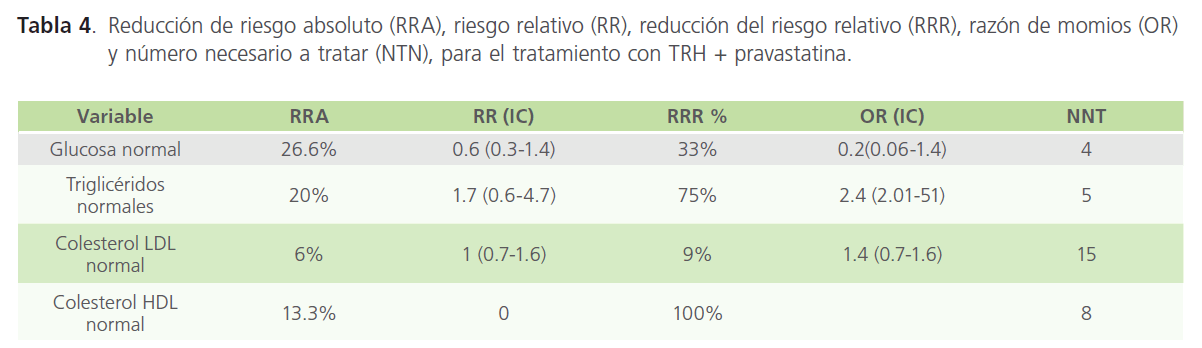
Tabla 4: Reducción de riesgo absoluto (RRA), riesgo relativo (RR), reducción del riesgo relativo (RRR), razón de momios (OR) y número necesario a tratar (NTN), para el tratamiento con TRH + pravastatina.
Discusión
La principal causa de muerte en mujeres adultas no es el cáncer de mama como se cree, sino la enfermedad coronaria, la cual produce en Estados Unidos de América 500 ,000 muertes por año [12]. En la población general la dislipidemia y menopausia son factores de riesgo independientes para enfermedad coronaria. Ahora bien, cuando existe asociación entre dislipidemia, menopausia y diabetes el riesgo de enfermedad cardiovascular se incrementa en forma importante y es deseable un tratamiento agresivo para su control [12].
La menopausia es un factor de riesgo cardiovascular porque existen alteraciones en el metabolismo de los lípidos y en algunas mujeres produce dislipidemia [16]. El mecanismo de la producción de la dislipidemia en la menopausia aún no ha sido aclarado del todo y los dos mecanismos propuestos son una disminución de la actividad de la lipoprotein lipasa (LPL) y/o deficiencia de los receptores de las lipoproteínas del hígado [16]. En modelos animales con terapia estrogénica se encontró un incremento o disminución de la actividad de LPL y nulo efecto sobre la actividad de los receptores de liproteínas del hígado; mientras que en humanos existe efecto nulo sobre la primera e incremento de la actividad de los receptores [17, 18]. Por lo que la terapia de reemplazo hormonal + sinvastatina en mujeres con menopausia e hipercolesterolemia mejora el perfil de lípidos, como fue demostrado en el estudio de Fak y cols, quienes reportaron a los 3 meses de tratamiento una disminución de 12% en colesterol total, 19% de colesterol LDL, 9% de triglicéridos y un incremento de 14% en el colesterol HDL [9]. En otro estudio comparativo entre sinvastatina y TRH + sinvastatina se encontró que esta última combinación disminuyó las cifras de colesterol total, colesterol LDL, lipoproteína (a) e incremento del colesterol HDL y triglicéridos .[8]. Sin embargo, en ambos estudios se observa que el efecto aditivo de TRH sobre las estatinas no es muy significativo, es decir, el efecto observado no se mantiene más de 3 meses
Sin embargo, aún no ha quedado claro que tipo de tratamiento es el adecuado para el control de la hipercolesterolemia en mujeres posmenopáusicas diabéticas y en la revisión de la literatura a nuestro alcance sólo hemos encontrado la utilización de estrógenos comparado con placebo [10]. Por otro lado, no se tiene evidencia sobre este manejo en la población mexicana y considerando que los resultados podrían variar de población en población, de ahí surge la necesidad e interés de realizar este estudio Por lo que nuestro trabajo estuvo enfocado en evaluar la eficacia del tratamiento sólo y combinado de la pravastatina y TRH para el control del perfil lipídico en mujeres posmenopáusicas con diabetes mellitus tipo 2. Un estudio posterior que ampliaría al presente, incluiría la evaluación de riesgo cardiovascular en dichas pacientes En nuestro estudio se encontró que la combinación de TRH + pravastatina, produjo disminución de glucosa del 23%, colesterol total 60%, colesterol LDL 13% triglicéridos 0%, colesterol HDL 20% y creatinina sérica Sin embargo, la terapia solo con pravastatina produjo porcentajes más altos de mejoría que la terapia combinada. La explicación a este fenómeno puede ser que las mujeres con diabetes mellitus presentan una reducción en la depuración de lípidos debido a que el receptor LDL-colesterol hepático es resistente o insensible a la terapia estrogénica [18]. Aunque, por otro lado, es importante resaltar el bajo NNT para la TRH + pravastatina, que fue de 4 a 15 pacientes (Tabla 4)
Si bien la terapia TRH + pravastatina podría tener efecto sobre los lípidos séricos, es necesario tomar cautela con este manejo, por el riesgo de cáncer mamario [19]. Aunque se ha reportado este riesgo con el uso de la terapia por 10 años. En el presente trabajo se utilizó por solamente 8 semanas.
Una limitante de nuestro trabajo es el escaso número de pacientes reclutados, estando latente la presencia del error tipo II, por lo que en futuros trabajos es recomendable incrementar el tamaño muestral. Por otro lado, en la tabla 1 llama la atención que en ambos grupos, hubo un descenso significativo de la glicemia al término del tratamiento. Ni la pravastatina ni la terapia de reemplazo hormonal deberían tener un efecto directo sobre este parámetro. Al momento, no se tiene una explicación para esta observación.
Por otro lado, en el presente estudio las pacientes tratadas con TRH + pravastatina presentaron disminución significativa en los valores de creatinina sérica. Estos resultados ya habían sido señalados en estudios previos y se cree que los estrógenos o progestágenos intervienen en el filtrado glomerular probablemente incrementado la excreción o secreción de creatinina [20, 21] Sin embargo, este hallazgo permanece incierto debido a que no fue el objetivo de este trabajo. Por lo que son necesarios más estudios al respecto, incluyendo además otras variables importantes, tales como mortalidad, infartos al miocardio y enfermedades cardiovasculares, que en el presente reporte por el tiempo corto de observación, no fue factible su inclusión.
Conclusión
En este este estudio se demostró que el tratamiento sustitutivo de TRH más pravastatina no tuvo efecto aditivo en la mejoría del perfil de lípidos en mujeres diabéticas postmenopáusicas y con hipercolesterolemia
617
References
- Sempos, Ct, Cleeman, Ji., Carroll,MD. et al. Prevalence of high blood cholesterol among USadults: An update based on guidelines from the second report of the National Cholesterol Education Program Adult Treatment Panel. JAMA 1993; 269: 3009-14.
- Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults. Summary of the second report of the National Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II). JAMA 1993; 269: 301-23.
- Poehlman, ET.,Toth, MJ., Ades, PA., Rosen, CJ. Menopause-associated changes in plasma lipids, insulin-like growth factor I and blood pressure: a longitudinal study. Eur J Clin Invest. 1997; 27: 322-6.
- Carr, MC. The emergence of the metabolic syndrome with menopause. J ClinEndocrinolMetab. 2003; 88: 2404-11.
- Van Venrooij, FV., Van de Ree, MA., Bots, ML., Stolk, RP., Huisman, MV., Banga, JD., Dali Study Group. Aggressive Lipid Lowering Does Not Improve Endothelial Function in Type 2 Diabetes: the Diabetes Atorvastatin Lipid Intervention (DALI) Study: a randomized, double-blind, placebo-controlled trial. Diabetes Care 2002; 25: 1211-6
- Davidson, MH.,Testolin, LM., Maki, KC., Von Duvillard, S., Drennan, KB. A comparison of estrogen replacement, pravastatin, and combined treatment for the management of hypercholesterolemia in postmenopausal women. Arch Intern Med. 1997; 157: 1186-92.
- Andersson, B., Mattsson, LA., Hahn, L. et al. Estrogen replacement therapy decreases hyperandrogenicity and improves glucose homeostasis and plasma lipids in postmenopausal women with noninsulin-dependent diabetes mellitus. J ClinEndocrinolMetab. 1997; 82: 638-43.
- Darling, GM., Johns, JA.,MCCloud, PI., Davis, SR. Estrogen and progestin compared with simvastatin for hypercholesterolemia in postmenopausal women. N Eng J Med. 1997; 337: 595-601.
- Fak, AS., Erenus, M., Tezcan, H. et al. Effects of simvastatin only or in combination with continuous combined hormone replacement therapy on serum lipid levels in hypercholesterolaemic post-menopausal women. Eur Heart J. 2000; 21: 190-7.
- Friday, KE., Dong, C., Fontenot RU. Conjugated Equine Estrogen Improves Glycemic Control and Blood Lipoproteins in Postmenopausal Women with Type 2 Diabetes. J ClinEndocrinolMetab. 2001; 86: 48-52.
- Ng, TW., Watts, GF., Stuckey, BG. et al. Does pravastatin increase chylomicron remnant catabolism in postmenopausal women with type 2 diabetes mellitus.ClinEndocrinol. (Oxf). 2005; 63(6): 650-6.
- Third Report of the National Cholesterol Education Program (NCEP). Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002; 106: 3143-421.
- American Heart Association. Heart Disease and Stroke Statistics-2005Update Dallas: American Heart Association. 2005. [Consultado 27 de marzo de 2008].
- Mosca, L., Linfante, AH., Benjamin, EJ. et al. National study of physician awareness and adherence to cardiovascular disease prevention guidelines. Circulation 2005; 111: 499-510.
- chnatz, PF., Schnatz, JD. Dyslipidemia in menopause: Mechanisms and Management. ObstetGynecolSurv. 2006; 61: 608-13.
- Van Beek, AP., De Ruijter-Heijstek, FC.,Erkelens, DW., De Bruin, TW. Menopause is associated with reduced protection from postprandial lipemia. ArteriosclerThrombVasc Biol. 1999; 19: 2737-41.
- Demacker, PN.,Mol, MJ., Stalenhoef, AF. Increased hepatic lipase activity and increased direct removal of very-low-density lipoprotein remnants in Watanabe heritable hyperlipidaemic (WHHL) rabbits treated with ethinyloestradiol. Biochem J. 1990; 272: 647-51.
- Masding, MG.,Stears, AJ., Burdge, GC., Wootton, SA., Sandeman, DD. Premenopausal Advantages in Postprandial Lipid Metabolism Are Lost in Women With Type 2 Diabetes. Diabetes Care 2003; 26: 3243-9.
- Beral, V., Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003; 362: 419-27.
- Ahmed, SB., Culleton, BF.,Tonelli, M. et al. Alberta Kidney Disease Network. Oral estrogen therapy in posmenopausal women is associated with loss of kidney function. Kidney Int. 2008; 74: 370-6.
- Maric, C., Sullivan, S. Estrogens and the diabetic kidney. Gend Med. 2008; 5: S103-13.,










