Key words
HeLa, Stress, Gamma Rays, Heat, Hydrogen Peroxide.
Introducción
La capacidad de los organismos para enfrentar y sobrevivir a los cambios adversos en su medio ambiente, representa un aspecto integral de la evolución. En el reino animal, existen numerosos ejemplos de organismos, los cuales han utilizado vías únicas que les permiten continuar sobreviviendo en un medio ambiente hostil e incompatible con el sostenimiento de la vida. La respuesta celular de los organismos a estos cambios en su medio ambiente, es a través de las proteínas de choque calórico (hsp) que proveen protección a la célula durante y/o después de recobrarse de la agresión del medio ambiente. [1,2]
Las proteínas de choque calórico y/o chaperonas moleculares se induce su expression en respuesta a señales estresantes y son esenciales en el control y regulación de la apoptosis así como, en el crecimiento normal de las células. [3] Las Hsp, incluidas las chaperonas moleculares, se expresan de manera constitutiva y ubicua en las células eucariotas y procariotas. [4,5,6] En condiciones adversas, la función de éstas proteínas es proteger a la célula del daño producido por el estrés, mediante la unión a proteínas parcialmente desnaturalizadas, disociando agregados de proteínas y regulando el doblez correcto y la traslocación intracelular de proteínas sintetizadas de novo, así como, facilitar la degradación de proteínas anormales. [7,8,9] Las proteínas de estrés son inducidas por varios agentes estresantes, [10] entre los que están: la hipoglucemia, la anoxia, el calor, el frío, el etanol, el peróxido de hidrogeno, iones de metales pesados, arsenicales, infecciones con ciertos virus, [11,12,13] la radiación ultravioleta, la radiación electromagnética de baja frecuencia, los campos intensos de radiación ionizante [14,15] y los campos de radiación gamma de baja intensidad. [16]
En el estudio de los riesgos generados por la exposición a niveles bajos de radiación ionizante de naturaleza ambiental o artificial, [17] se ha encontrado que bajas dosis de radiación ionizante benefician el crecimiento, desarrollo y fertilidad de animales, así mismo coadyuvan a su longevidad, siendo estos efectos, una medida de ajuste a las condiciones ambientales. [18]
La radiación cuando interacciona con los sistemas biológicos, y en particular con las células que los constituyen, se da en: 1). Membrana, provocando alteraciones osmóticas; 2). Citoplasma, donde la radiación ionizante interacciona con la molécula de agua produciendo iones o radicales libres, y pueden llegar a producir peróxido de hidrógeno o hidroxiperóxido hiperoxidante, compuestos altamente tóxicos; 3). En núcleo, puede en algunos casos, romper la molécula de DNA y alterar su función. [19]
La radiación ionizante al interaccionar con la célula, produce proteínas desnaturalizadas debido a la ionización de la molécula de agua y a la generación de radicales libres, por lo que el estrés en la célula induce un incremento en la expresión de las Hsp70; lo anterior ha sido reportado para dosis gamma de 400 y 1000 Gy. [20] Se ha visto en células de ratón que al ser expuestas a campos de radiación ionizante se presenta el fenómeno de apoptosis, debido a que se expresan proteasas especificas para histona H1 con la consecuente fragmentación del DNA. [21] En timocitos de ratones BALB/c cuando son irradiados, la hsp70 juega un papel citoprotector al regular la no expresión de la proteína p53 y Bax, ambas involucradas en la apoptosis celular ; [22] mientras que en esplenocitos de ratón, cuando son sometidos a un preacondicionamiento a bajas dosis de radiación gamma (15 cGy) y posteriormente se someten a dosis más altas (6 Gy) existe una reducción de la muerte celular (apoptosis) debido a una respuesta adaptativa a través de la hsp70. [23]
Debido a que el papel principal de las Hsp es proteger a los organismos de los efectos tóxicos del calor y otras formas de estrés, [24,25] en el presente estudio nos enfocamos a estudiar el papel de la hsp70 cuando las células HeLa son estresadas con dosis bajas de radiación gamma, la cual, genera por ionización radicales libres con la consecuente formación de agentes oxidantes, así mismo, comparar este estrés con un agente oxidante conocido como es el peróxido de hidrógeno y otro estresor como es el calor que se conoce que induce la sobreexpresión de la hsp70. [26]
Material y métodos
Línea celular y cultivo: Las células HeLa (células epiteliales de humano) se obtuvieron de la American Type Culture Collection. Estas células se sembraron en medio de cultivo DMEM suplementado con 100 U/ml de penicilina, estreptomicina 100 μg/ ml (In Vitro, México), 0.08 U/ml de insulina (Eli Lilly, México, D.F.) y 10 % de suero fetal Bovino (Gibco BRL, Grand Island, N.Y. 16000-028), a 37°C en botellas de plástico desechables (Costar 3151, Cambridge, Ma.) con una atmósfera de 5% de CO2 y 95% humedad relativa. Las células, sembradas a confluencia, se despegaron del sustrato con una solución de tripsina al 0.05% y EDTA al 0.05% (In Vitro, México, D.F.), se resuspendieron en CDMEM y se sembraron a confluencia (5X103 células por cm2 ) en cajas de cultivo. [27]
Estrés celular y marcaje metabólico: Para inducir la expresión de las proteínas de choque calórico Hsp70, las células HeLa incubadas a 37°C, se expusieron a un campo de rayos gamma de 0.03 cGy-h -1 proveniente de una fuente de 137Cs, a cuatro diferentes tiempos: 30, 40, 50 y 60 min. Así mismo, otro lote de células se estresaron con calor manteniéndolas por 1 hora a diferentes temperaturas: 37, 40, 42 y 44 ºC; otro conjunto de células se estresaron con peróxido de hidrógeno a una concentración de 800 y 1200 μM durante 1 hora a 37°C. Para determinar la expresión de nuevas proteínas Hsp sintetizadas durante el estrés, las células se colocaron en un medio de cultivo con metionina marcada con 35S (Amersham Laboratories, Buckinghamshire, England, UB2688), cuya actividad específica fue de 1.85x105 Bq/ml.
Lisis celular: Después de los tratamientos estresantes, las células se lavaron con 1 ml de solución buffer fosfato (PBS) frío pH de 7.2 (Gibco BRL, Grand Island NY, USA, 21300-058), se lisaron con 200 μl de una solución de lisis que contiene: Tritón X-100 al 1%, (Merck West Germany), NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 (Gibco BRL Grand Aisland NY), mas 1 mM de PMSF (sigma chemical Co, St Louis MO, USA). [28] El lisado celular, se centrifugó por 10 minutos a 14000 rpm recuperándose el sobrenadante (fracción soluble) y el precipitado (fracción insoluble).
Determinación de proteínas: Mediante el método de Bradford (1976)., [29] se determinó la cantidad total de proteína de cada condición experimental para su posterior caracterización por PAGESDS.
Electroforesis en geles de poliacrilamida (PAGE-SDS): Se realizó al 10%, mediante la técnica descrita por Laemmli (1970). [30]
Inmunotransferencia: Las proteínas en los geles de poliacrilamida, se transfirieron a una membrana de nitrocelulosa, (Amersham Hybond-C # RPN303C), utilizando la técnica de Towbin et al. (1979). [31]
Inmunodetección: El papel de nitrocelulosa conteniendo las proteínas, se incubó por 24 h. en solución bloqueadora (3% de leche descremada Sbelty de Nestlé en PBS). Después, la membrana de nitrocelulosa se lavó 3 veces con solución de PBS. Luego se incubó por 1 h. con un anticuerpo monoclonal contra la Hsp70 (Sigma Chemical, St Louis, USA, H-5147), para después lavarse en forma alternada por 5 veces con solución de PBS y PBSTween- 20. Posteriormente, la membrana se incubó durante 1 h. con un segundo anticuerpo conjugado a peroxidasa (Sigma Chemical, St Louis, USA, A-9044). Pasado el tiempo de incubación, se procedió a lavar en la forma anteriormente señalada, para después agregar a la membrana, un reactivo quimioluminiscente, ECL (Amersham Laboratories, Buchinghamshire, England, RPN2106), que al reaccionar con la peroxidasa emite luz, la cual, se detectó mediante una placa fotográfica (Dupont de Neumors USA). Para el revelado de la película se utilizó revelador Kodak GBX # 616-0832 y fijador Kodak GBX # 616-2911.
Autoradiografía y Densitometría: La membrana de nitrocelulosa fue expuesta a una placa radiográfica(Eastman Kodak Co, Rochester, NY, USA, 870-1302) por 45 días, con el fin de visualizar las proteínas marcadas radioactivamente (35S-metionina). Las autoradiografías obtenidas con la marca de 35Smetionina y las reveladas por inmunoblot con ECL, fueron leídas utilizando un densitómetro óptico (Eagle Eye, Estategene Mitsubishi). Para determinar la cantidad de proteína sintetizada de nuevo durante el estrés, el valor obtenido de 35S se dividió entre el obtenido por ECL.
Análisis estadístico: A cada banda de proteína Hsp70 obtenida por Western blot bajo las condiciones de estrés por radiación, peróxido de hidrógeno y calor, se le realizó densitometría, y a los valores numéricos obtenidos de esta, se le obtuvo la media y su desviación.
Resultados y discusión
En el presente trabajo, se estudió el efecto estresante producido en células HeLa por los rayos gamma, el peróxido de hidrógeno y el calor, a través de la expresión de la hsp70. La tolerancia que presentan los organismos a un agente estresante, puede ser natural o inducida, [8] donde participa la síntesis de las Hsp como un mecanismo de respuesta celular. [32]
Las células HeLa en condiciones normales de cultivo, expresan de manera constitutiva a la proteína Hsp70, y cuando son expuestas a campos de radiación gamma, se incrementa su expresión. La cantidad de Hsp70 expresada en las células HeLa, está en función al tiempo de exposición a los rayos gamma (Figura 1, Tabla 1, Figura 2B). Esta misma respuesta celular, se ha observado en linfocitos humanos expuestos a campos bajos de radiación gamma [16] y campos más intensos. [20] Se conoce que una de las funciones de la hsp70 en condiciones de estrés, es unirse a péptidos y proteínas dañadas para evitar su agregación, contribuyendo en su reparación y con ello proteger a la célula del agente estresor en cuestión. [8,33] Además, la Hsp70 es fundamental en el preacondicionamiento a cierto agente estresante, debido a que la inducción de la Hsp70 se correlaciona con la protección a daños subsecuentes. [11,34,35]

Figura 1. Inmunodetección: ECL. Expresión de la proteína Hsp70 en células HeLa expuestas a rayos gamma y peróxido de hidrógeno. C (Células control). A y B (Células tratadas con 800 μM y 1200 μM de peróxido de hidrógeno). 30, 40, 50, 60 minutos (células expuestas a un campo de rayos gamma).

Tabla I. Valores relativos de proteína Hsp70 expresada en células HeLa con dos estresores, rayos gamma y peróxido de hidrógeno. Estos valores fueron obtenidos por densitometría de cada banda de proteína obtenida por Western blot (Figura 1).
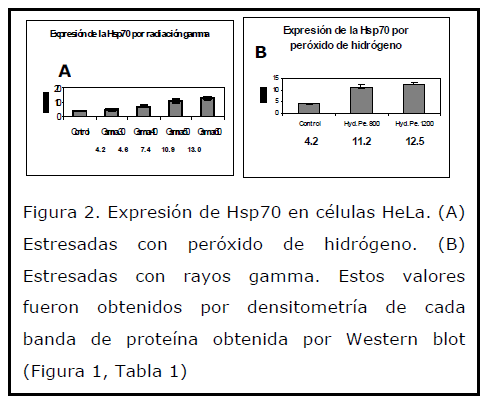
Figura 2. Expresión de Hsp70 en células HeLa. (A) Estresadas con peróxido de hidrógeno. (B) Estresadas con rayos gamma. Estos valores fueron obtenidos por densitometría de cada banda de proteína obtenida por Western blot (Figura 1, Tabla 1)
La sobreexpresión de la hsp70 también se explica por la formación de radicales libres generados a partir de la molécula de agua vía radiólisis; dichos radicales libres se unen y forman entre otros, moléculas reductoras como el peróxido de hidrógeno que producen la desnaturalización de las proteínas, siendo éste mecanismo de desnaturalización, el que dispara la respuesta al estrés a nivel celular con la consecuente expresión de las Hsp. [36]
Para demostrar en este trabajo lo antes reportado y hacer una correlación entre el estrés por radiación gamma y el inducido por un agente oxidante, las células HeLa fueron estresadas con peróxido de hidrógeno, donde se observó, un incremento en la expresión de la proteína Hsp70. El nivel de proteína Hsp70 se incrementó conforme se aumentó la concentración de peróxido de hidrógeno (Figura 1, tabla 1, Figura 2A), que es congruente con lo reportado por Cotto et al. (1997). [37] Con lo anterior, observamos que la sobreexpresión de hsp70 inducida con peroxido de hidrógeno, es similar al encontrado por rayos gamma. También se ha reportado, que la sobrexpresión de las Hsp confiere protección contra la acción del peróxido de hidrógeno (H2O2) y de oxiradicales generados por drogas anticancerígenas. [12,13, 38-42].
En el presente estudio, utilizamos un estresor control como es el calor, el cual, se conoce que induce la sobreexpresión de la hsp70, [26,43,44] así, las células HeLa se sometieron a diferente temperatura, encontrando un incremento de la Hsp70 conforme se aumentaba la temperatura (Figuras 3, tabla 2).
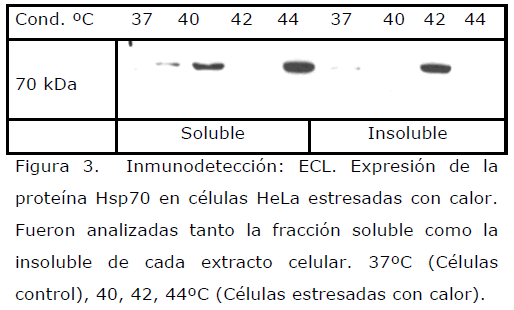
Figura 3. Inmunodetección: ECL. Expresión de la proteína Hsp70 en células HeLa estresadas con calor. Fueron analizadas tanto la fracción soluble como la insoluble de cada extracto celular. 37ºC (Células control), 40, 42, 44ºC (Células estresadas con calor).
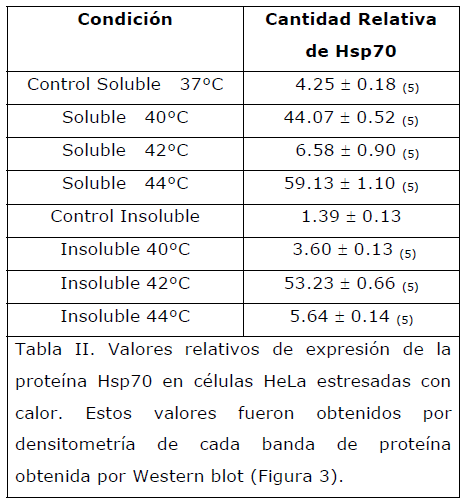
Tabla II. Valores relativos de expresión de la proteína Hsp70 en células HeLa estresadas con calor. Estos valores fueron obtenidos por densitometría de cada banda de proteína obtenida por Western blot (Figura 3).
Es evidente que existe un incremento mayor de la hsp70 cuando las células son estresadas con calor, fenómeno reportado en células estresadas con hipertermia, [11,26,34] mientras que con peroxido de hidrógeno, el nivel de expresión es similar al encontrado por rayos gamma, recordando que durante la interacción de la radiación con la molécula de agua, se producen radicales libres y la subsiguiente producción de peróxido de hidrógeno en la célula, por lo que podemos decir que las concentraciones usadas de peroxido son suficientes para inducir un daño similar al encontrado por el estrés producido por la radiación gamma en las células HeLa.
Con el fin de determinar, si los agentes estresantes utilizados en el presente trabajo inducían la desnaturalización de proteínas celulares y con ello cambio en sus propiedades bioquímicas de ser solubles en su estado nativo e insolubles cuando se desnaturalizan, con un consecuente cambio en la localización de la hsp70, ya que esta asiste durante el estrés en la ayuda tanto a proteínas solubles pero en mayor proporción a proteínas desnaturalizadas o insolubles; razón por la cual, las células HeLa estresadas por rayos gamma, peróxido de hidrógeno y calor, se les analizaron cambios en la localización de las Hsp tanto en la fracción soluble como la insoluble, en donde se encontró: La radiación gamma y el peroxido de hidrógeno inducen un incremento de la hsp70 en las células HeLa a nivel de fracción soluble (datos anteriormente descritos). En el caso de la fracción insoluble, al analizar la localización y expresión de la proteína Hsp70, ésta no se encontró en células estresadas con radiación gamma y con peróxido de hidrógeno, indicándonos que éstos estresores al nivel y concentración utilizados, no inducen un daño severo que induzca un gran cantidad de proteínas desnaturalizadas.
En cambio con calor, estresor utilizado en el presente estudio como control, ya que un inductor de la expresión de la hsp70, [26,43,44] se observó que en la fracción soluble, la hsp70 solo se encontró a los 37, 40 y 44ºC, existiendo una ausencia de la Hsp70 a los 42°C, mientras que en la fracción insoluble, la hsp70 solo se encontró a 42ºC (Figura 4).
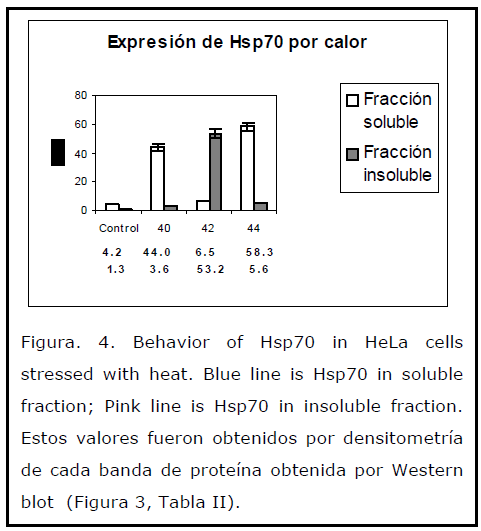
Figura. 4. Behavior of Hsp70 in HeLa cells stressed with heat. Blue line is Hsp70 in soluble fraction; Pink line is Hsp70 in insoluble fraction. Estos valores fueron obtenidos por densitometría de cada banda de proteína obtenida por Western blot (Figura 3, Tabla II).
Lo anterior nos muestra que existe un daño importante en las proteínas a los 42ºC, donde la Hsp70 se encuentra asociada a ellas, y que de alguna manera han perdido su características bioquímicas de ser solubles, encontrándolas solamente en la fracción insoluble. Las proteínas dañadas por el calor son reparadas y otras degradadas a través de las Hsp, y debido a esta función, es por lo que se observan cambios en la localización y sobreexpresión de la Hsp70 en las fracciones soluble e insoluble, ya que se ha visto, que las Hsp protegen a la célula durante el estrés, facilitando la reparación o degradación de proteínas dañadas después de un evento estresante. [45] Estudios hechos en mitocondrias se ha encontrado algo similar, donde el choque térmico protege selectivamente a las mitocondrias con una correlación estrecha entre el grado de protección mitocondrial y la concentración de Hsp70. [46] Esta protección es confirmada en ratas expuestas a choque térmico previo a una perfusión cardiaca con peróxido de hidrógeno, donde provocó aumento en la concentración de la Hsp70. [47]
Es necesario realizar estudios más profundos sobre la distribución de esta proteína en la células cuando son estresadas por calor a 42°C, y sobre todo, ver con que tipo de proteínas sensibles a calor se encuentra asociada la hsp70.
Conclusiones
Los rayos gamma son un agente estresante en células HeLa, cuya respuesta ante este campo de radiación es a través de la expresión de la proteína Hsp70. La cantidad de Hsp70 expresada está en función del tiempo de exposición a los rayos gamma. Así mismo, se observó que el comportamiento en la expresión de la Hsp70 por rayos gamma, es similar al producido por el peróxido de hidrógeno, mientras con calor, el daño es más severo con un cambio en la distribución de la hsp70 de la fracción soluble a la insoluble a los 42°C.
Agradecimientos
Proyecto apoyado por CONACYT al Dr. Sergio Hugo Sánchez Rodríguez contrato: 499100-5-I31456-N.
1178
References
- Welch WJ, Kang SH, Beckmann PR, Mizzen AL. Response of Mammalian Cells to Metabolic Stress: Changes in Cell Physiolgy and Structure/Function of Stress Proteins. Current Topics in Microbiology an 1991;167:31-50.
- Nollen, E.A.A. and Morimoto, R.I. Heat shock response: cellular and molecular responses to stress, misfolded proteins, and diseases associated with protein aggregation. In Wiley Encyclopaedia of Molecular Medicine. John Wiley and Inc., 2002; pp: 1553- 1563.
- Jolly, C. and Morimoto R.I. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J. Natl Cancer Inst.. 2000;92: 1564-72.
- Lindquist S, and Craig EA. The Heat Shock Proteins. Annual Review of Genetics. 1988;22:631-637.
- Morimoto RI, and Milaski KL. Stress Proteins in Biology and Medicine. Cold Spring Harbor Laboratory Press, 1990; pp. 1-36.
- Iwama GK, Thomas PT, Forsyth RB, Vijayan MM. Heat Shock Proteinexpression in Fish. Reviews in Fish Biology and Fisheries. 1998;8:35- 56.
- Goodman R, Blank M. Magnetic Field Stress Induces Expression of hsp 70. Cell Stress Chaperones.1998;3:79-88.
- Parsell DA, Lindquist S. Heat shock proteins and stress tolerance. En: The biology of heat shock proteins and molecular chaperones. Eds. RI Morimoto, A Tissieres, S Georgopoulos. Cold Spring Harbor Laboratory Press, 1994; pp. 457-493.
- Leppa S, Sistonen L. Heat shock response pathopysiological implications. Annals of Medicine. 1997;29:73-78.
- Lin H, Li H, Blank M, Head M, Goodman R. Magnetic Field Activation of Protein-DNA Binding. Journal of Cell Biochemistry. 1998;70:279-303.
- Guerreiro VJr., Raynes DA. Synthesis of Heat Stress Proteins in Lymphocytes from Livestock. J Anim Sci. 1990;68:2779-2783.
- Ciocca DR, Oesterreich S, Chammess GC, McGuire WL, Fuqua SAW. Biological and clinical implications of heat shock protein 27000 (hsp27): a review. Journal of National Cancer Institute. 1993;85(19):1558-1569.
- Garrido, C., Gurbuxani, S., Ravagnan, L. and Kroemer, G. Heat shock proteins: endogenous modulators of apoptotic cell death. Biochem. Biophys. Res. Commun.2001;286:433- 442.
- Feder ME, Hoffmann GE. Heat-shock Proteins, Molecular Chaperones, and the Stress Response: Evolutionary and Ecological Physiology. Annual Review of Physiology. 1999;61:243-282.
- Saran M, Bors W. Radiation Chemistry of Physiological Saline Reinvestigated: Evidence that Chloride-derived Intermediates Play a Key Role in Cytotoxicity. Radiation Resesarch. 1997;147:70-77.
- Vega-Carrillo HR., Bañuelos- Valenzuela R., Manzanares-Acuña E., SĂ¡nchez-RodrĂguez SH. Response of human lymphocytes to low gamma ray doses. Alasbimn Journal. 2001;3(12).
- Parson PA. Low Level Exposure to Ionizing Radiation: Do Ecological and Evolutionary Considerations Imply Phantom Risks? Perspectives in Biology and Medicine. 1999;43:57-68.
- Parson PA. Hormesis: an Adaptative Expectation with Emphasis on Ionizing Radiation. Journal of Applied Toxicology. 2000;20:103-112.
- Granier R, Gambini denis-Jean.Applied radiobiology and radiation protection. Ed. Ellis Horwood Series.1990.
- Sierra-Rivera E, Voorhees GJ, Freeman ML. Gamma Irradiation Increases hsp-70 in Chinese Hamster Ovary Cells. Radiation Research. 1993;135:40-45.
- Gaziev AI, Kutsyi MP. Gammairradiated DNA activates histone H1- specific proteinase of rat liver nuclei. Int Radiat Biol. 1992;61(2):169-174.
- Gordon SA, Hoffman RA, simmons RL, Ford HR. Induction of heat shock protein 70 protects thymocytes against radiation induced apoptosis. Arch Surg. 1997;132(12):1277-1282.
- Kang CM, Park KP, Cho CK, Seo JS, Park WY, Lee SJ, Lee YS. Hspa4 (HSP70) is involved in the radioadaptative response: results from mouse splenocytes. Radiat Res. 2002;157(6):650-655.
- Lyashko VN, Vikulova VK, Chernicov VG, Ivanov VI, Ulmasov KA, Zatsepina OG, Evgen’ev MB. Comparison of the heat shock response in ethnically and ecologically different human population. Proceedings of National Academy of Sciences of the USA 1994;91:12492-12495.
- Morimoto RI. Regulation of the Heat Shock Transcriptional Response Cross Talk Between a Family of Heat Shock Factors, Molecular Chaperones and Negative Regulator. Genes and Development. 1998;12:3788-3796.
- Hendrick JP, Harti FU. Molecular chaperone functions of heat-shock proteins. Annual Review of Biochemistry. 1993;62:349-384.
- Diaz-Latoud C, Diaz JJ, Fabre-Jonca N, Kindbeiter K, Jean-Madjar JJ, Arrigo AP. Herpes Simplex Virus Us11 Protein Enhances Recovery of Protein Synthesis and Survival in Heat Shock Treated HeLa Cells. Cell Stress & Chaperones. 1997;2:119- 131.
- Harlow E, Lane D. Antibodies. A laboratory manual. Cold Spring Harbor Laboratory. Cold Spring Harbor, N.Y. 1998.
- Bradford MM. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227:680-685.
- Towbin HT, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrilamide gels to nitrocellulose sheets: Procedure and some aplications. Procceding of the National Academy of Sciences USA. 1979;76:4350-4354.
- Morimoto RI, Tissieres A, Georgopoulos C. The biology of the heat shock proteins and molecular chaperones. New York: Cold Spring Harvor Laboratory Press,1994; pp-610.
- Karlin S, Brocchieri L. Heat Shock Protein 70 Family: Multiple SĂ©quense Comparisons, Function and Evolution. J Molecular Evolution. 1998;47:565-577.
- Donati Y, Slosman DO, Polla BS. Oxidative injury and the heat shock response. Biochem Pharmacol. 1990;32:104-113.
- Turman MA, Kahn DA, Rosenfeld SL, Apple CA, Bates CM. Characterization of Human Proximal Tubular Cells after Hypoxic Preconditioning: Constitutive and Hypoxia-induced Expression of Heat Shock Proteins Hsp70 (A, B and C), Hsc70 and Hsp90. Biochemical and Molecular Medicine. 1997;60:49-58.
- Freeman ML, Borrelli MJ, Meredith MJ, Lepock JR. On the Path to the Heat Shock Response: Desestabilization and Formation of Partially Folded Protein Intermediates, a Consequence of Protein Thiol Modification. Free Radical Biology & Medicine.1999;26:737-745.
- Cotto JJ, Fox SG, Morimoto RI. HSF1 Granules: A Novel Stressinduced Nuclear Compartment of Human Cells. J Cell Sci. 1997;110: 2925-2934.
- Garrido C, Mehlen P, Fromentin A, et al. Inconstant association between 27-kDa heat shock protein (Hsp27) content and doxorubicin resistance in human colon cancer cells. Eur J Biochem. 1996;237:653- 9.
- Oesterreich S, Weng Ch, Qiu M, Hilsenbeck S, Osborne C, Fuqua S. The small heat shock protein hsp27 is correlated with growth and drug resistance in human breast cancer cell lines. Cancer Res. 1993;53:4443-4448.
- Hettinga J, Lemstra w, Meijer C, et al. Heat-shock protein expression in cisplatin-sensitive and resistant human tumor cells. Int J Cancer. 1996;67:800-807.
- Garrido C, Ottavi O, Fromentin A, et al. Hsp27 as a me-diator of confluence-dependent resistance to cell death in-duced by anticancer drugs. Cancer Res. 1997;57:2661- 2667.
- Bonnal C, Calvo F. Resistance to antineoplastic treatments: mechanisms, clinical value. C. R. Seances Soc Biol Fil. 1996;190-4: 455-66.
- Harti FU. Molecular chaperones in cellular protein folding. Nature. 1996;381:571-580.
- Pennisi E. Expanding the eucariotes cast of chaperones. Research News Science. 1996;272:1613-1614.
- Kopecek P, Altmannova K, Weigl E. Stress proteins: Nomenclature, division and functions. Biomed. Papers. 2001;145(2): 39-47.
- Lill R. and Neupert W. Mechanism of protein import across the mitochondrial outer membrane. Trends Cell Biol. 1996;6: 56-61.
- Polla BS, Kantengwa S, Francois D, Salvioli S, Franceschi C, Marsac C, Cossarizza A. (1996) Mitochondria are selective targets for the protective effects of heat shock against oxidative injury. Proc Natl Acad Sci. 1996;93: 6458-6463.











