Keywords
Sistemic Lupus Erythematosus, Ro60, PCNA, Cellular stress, p53, HSP.
Introduction
El Lupus Eritematoso Sistémico (LES) es una enfermedad clínicamente heterogénea, de origen autoinmune y caracterizada por la presencia de autoanticuerpos dirigidos contra antígenos nucleares y citoplásmicos [1,2]. Las afecciones cutáneas son la segunda manifestación clínica más frecuente en pacientes con LES debido a la fotosensibilidad [3-6].
En el LES, las ribonucleoproteínas Ro/SSA y La/SSB son las más asociadas con fotosensibilidad, ya que en estos pacientes se han encontrado autoanticuerpos contra ellas [7-9]. La unión de autoanticuerpos puede hacer a las células más susceptibles a citotoxicidad celular dependiente de anticuerpos, lo que podría inducir las lesiones de piel en LES y LECS (Lupus Eritematoso Cutáneo Subagudo) [3,6].
La relación entre autoinmunidad y estrés ambiental está determinada tanto por los factores físicos como químicos. En los factores físicos tenemos la radiación ultravioleta (UV) y el ozono, y en los factores químicos tenemos la presencia de elementos tales como el mercurio (Hg), Yodo (I), y solventes orgánicos, entre otros, que claramente impactan al sistema inmune y conducen a inmunopatologías. Además, existe la posibilidad de que las sustancias químicas ambientales puedan influir en la inducción y exacerbación de las enfermedades autoinmunes [10]. Ejemplo de ello es la fotosensibilidad, que es uno de los síntomas más frecuentes por exposición a la luz UV proveniente de la radiación solar, la cual induce lesiones cutáneas en pacientes con Lupus Eritematoso (LE) debido a sus múltiples efectos en los tejidos. Las moléculas blanco de la luz UV incluyen el ADN, ARN, proteínas y lípidos, además de ocasionar reorganización del citoesqueleto [3,6,11]. Así mismo, el Hg puede ocasionar tanto auto- inmunidad como inmunosupresión [12], por modificar a las proteínas celulares, estimulando así una respuesta de células B inducida por células T contra las proteínas modificadas y nativas, tal es el caso de la proteína nucleolar fibrilarina. En modelos animales se ha observado que el Cloruro de Mercurio (HgCl2) genera anticuerpos contra la membrana basal glomerular, conduciendo a deposición de complejos inmunes, provocando glomerulonefritis y proteinuria [10]. Estudios realizados en diversas cepas de ratones, han demostrado que la exposición a Hg inorgánico puede inducir autoinmunidad sistémica semejante al Lupus [12,13].
El estrés físico por calor, afecta las funciones celulares que incluyen: inhibición de la síntesis de ADN, la transcripción, el procesamiento de ARN, la traducción, inhibición de la progresión del ciclo celular, desnaturalización y agregación de proteínas, incrementa la degradación de proteínas a través de las vías proteosomal y lisosomal, desorganización de los componentes del citoesqueleto, reducción del ATP celular y cambios en la permeabilidad de la membrana que llevan a un incremento intracelular del Na+, H+ y Ca2+ [14]. En las células de mamíferos, el choque calórico no letal produce cambios en la expresión génica. Ésta respuesta está asociada temporalmente con un aumento de las proteínas de choque calórico (HSP, por sus siglas en ingles). Con exposiciones al calor cada vez más severas, el choque calórico conduce a la activación del programa apoptótico y, en extremo, a la necrosis celular [14-17].
En el estrés oxidativo, las especies reactivas de oxígeno (ERO) son radicales altamente reactivos e inestables que contienen oxígeno. Bajo ciertas condiciones, la producción de ERO es aumentada y el nivel o actividad de los antioxidantes es reducido, produciendo estrés oxidativo. Además de las ERO generadas durante el metabolismo, los organismos también generan radicales libres cuando se exponen a agentes medioambientales como la radiación UV, smog, humo de tabaco y agentes cíclicos redox, que incluyen algunos pesticidas y medicamentos para el tratamiento del cáncer [18].
El estrés alcohólico con etanol puede afectar al hígado, los músculos, el páncreas y las células nerviosas. El etanol promueve la generación de ERO e interfiere con los mecanismos de defensa del organismo contra estos compuestos a través de cambios en la proporción NAD+/NADH, producción de acetaldehído, deficiencia de oxígeno en los tejidos, en el sistema inmune aumenta la producción de citocinas, incrementa la habilidad de las endotoxinas para entrar en el torrente sanguíneo e hígado, incrementa la actividad de la enzima citocromo P450 2E1 (CYP2E1), la cual metaboliza el alcohol y otras moléculas, y además genera ERO en el proceso, incrementa los niveles de hierro libre en la célula, lo que puede promover la generación de ERO, disminuye enzimas y químicos antioxidantes como el glutatión (GSH) mitocondrial y la vitamina E, además se produce el radical 1-hidroxi-etilo derivado del alcohol [18,19].
En general, durante el estrés se afecta la homeostasis celular conduciendo a la expresión de un gran número de proteínas que corrigen el daño en las proteínas y el ADN. Una de estas proteínas es p53, que es una fosfoproteína nuclear supresora de tumores conocida también como el guardián del genoma [20-22]. En células normales no expuestas a estrés, los niveles y la actividad de p53 son muy bajos, pero debido al estrés, esta proteína es activada, pudiendo de esta forma participar en varios procesos celulares, como el arresto del ciclo celular, la reparación del ADN, la apoptosis y la angiogénesis, entre otros [23-25]. Esta proteína desempeña un papel importante regulando la respuesta celular a diversos tipos de estresores, ya sean genotóxicos o no [23]. p53 funciona mediante dos mecanismos, como un factor de transcripción o bien interaccionando directamente con proteínas implicadas en procesos como la apoptosis [23,24].
Una proteína que indica que una célula esta replicando su ADN es el antígeno nuclear de proliferación celular (PCNA, por sus siglas en ingles), la cual es una proteína acídica nuclear no histona que funciona como asistente en la síntesis de ADN necesaria para la actividad catalítica de la enzima ADN polimerasa delta [26-28]. PCNA es requerido para la replicación, y en condiciones normales y de estrés para la reparación del ADN [29-31].
Así, observamos que los organismos son afectados por su entorno ambiental, el cual tiene una variedad de factores que pueden producir estrés, crucial en muchos niveles de la adaptación y organización biológica [32]. La respuesta celular al estrés ha sido asociada principalmente con mecanismos de protección durante condiciones que perturben la integridad de las proteínas y daño al ADN [33]. La piel es el principal órgano blanco de los estresores ambientales [34,35], donde una serie de xenobióticos han sido asociados con enfermedades autoinmunes humanas [10]. Tal es el caso del LE, en el que la fotosensibilidad es uno de los síntomas más frecuentes y la luz UV ha sido relacionada con las afecciones cutáneas en esta enfermedad [3,6,11,36].
Debido a esto, nosotros decidimos evaluar en el presente estudio la expresión del antígeno Ro60, que es blanco de autoanticuerpos en pacientes con LES y de las proteínas PCNA y p53 reparadoras del ADN, en piel de ratones sometidos a diferentes estresores. Nuestro objetivo fue determinar la expresión de las proteínas Ro60, p53, PCNA y HSP70 en la piel de ratones Balb/c neonatos expuestos a estresores como la luz UV, el calor (40 °C), HgCl2, peróxido de hidrogeno (H2O2), alcohol, camptotecina y cicloheximida.
En este estudio se utilizó como sensor de estrés a la proteína HSP70 ya que se expresa de manera constitutiva en todas las células, y su síntesis se incrementa por la exposición a varias formas de estrés [37,38,39].
Material y Métodos
Modelo Animal: Se utilizaron ratones Balb/c neonatos de 3 días de nacidos. Los ratones Balb/c se mantuvieron en condiciones óptimas en bioterio.
Inducción de Estrés Celular: Un lote de ratones neonatos fue sometido individualmente a estrés físico con luz UV por 20 min (Black-Ray lamp UVL-56, con una dosis total de 5-30 mJ/cm2) [40], calor a 40 °C durante 3 h; estrés químico por vía intraperitoneal, se les inyecto HgCl2 5 μM, H2O2al 0.2 %, Etanol al 10 %, camptotecina 20 μM y cicloheximida 20 μM dejándolos por 3 h. Tanto la camptotecina como la cicloheximida se utilizaron como drogas inductoras de apoptosis (SIGMA ®. Sigma-Aldrich, Inc. Saint Louis, Missouri, USA. 2008) [41].
A otro lote de ratones neonatos se le inyectó vía intraperitoneal un inhibidor de caspasa 3 AC-DEVD-CMK (Caspase 3 Inhibitor III. 218750, Calbiochem) y 2 h después los ratones fueron sometidos individualmente a las condiciones estresantes antes mencionadas. En cada lote se tuvo un ratón neonato control sin ser expuesto a algún agente estresante ni a inhibidor de caspasa 3.
Obtención de Piel de Ratones Balb/c Neonatos: Los ratones neonatos tanto control como estresados se inmovilizaron por baja temperatura (4°C), y se obtuvo su piel por el método de disección con el fin de obtener un extracto antigénico para ensayos de Western blot.
Lisis Celular, Cuantificación de Proteínas y PAGE-SDS: A la piel obtenida de los ratones neonatos control y los sometidos a condiciones estresantes, se les añadió 1 mL de buffer de lisis que contiene: Triton X-100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 e inhibidor de proteasas 1 mM (PMSF; P-7626, Sigma Chemical Co, St Louis MO, USA). En frió, las pieles con el buffer de lisis se homogenizaron mediante ultrasonido. El lisado se centrifugó por 10 min a 14,000 r.p.m, el sobrenadante se recuperó y se determinó la concentración de proteínas [42]. La cuantificación de proteínas se realizó mediante la técnica descrita por Bradford [43], de cada condición experimental 25 μg de proteína fueron caracterizados por electroforesis en geles de poliacrilamida (PAGE-SDS) al 12.5%, de acuerdo a la técnica descrita por Laemmli [44].
Western blot y Análisis: Las proteínas en los geles de poliacrilamida- SDS se transfirieron a papel de nitrocelulosa (RPN303C, Amersham Laboratories, Buckinghamshire, England), como describió Towbin y cols. [45]. Después, para identificar a las proteínas de interés, los blot se trataron con un anticuerpo específico contra Ro60 (suero humano monoespecífico de un paciente con LES), dilución 1:500, un anticuerpo monoclonal contra p53 (13-4100; Invitrogen, USA), dilución 1:200, un anticuerpo monoclonal contra PCNA (13-3900, ZYMED), dilución 1:1200, un anticuerpo contra HSP70 (Sigma H-4149), y un anticuerpo monoclonal específico contra alfa-tubulina como proteína control (T-5168, Sigma Chemical Co., St Louis Mo, USA), dilución 1:500. Como segundos anticuerpos se utilizaron un anti-IgG de humano y un anti-IgG de ratón conjugados a peroxidasa, dilución 1:1000, seguidos por un sistema de detección quimioluminiscente (ECL Western Blottin Detection Reagents; RPN2106, Amersham Biosciences, Little Chalfont, Buckinghamshire, England), que fue detectado en películas radiográficas (Eastman Kodak Co, Rochester, NY, USA, 870-1302) en tiempos de 1 y 5 min.
Proteína Alfa-Tubulina. La proteína alfa-tubulina es un componente de los microtúbulos (filamentos del citoesqueleto), y en el presente estudio se utilizó como una proteína constitutiva que no sufre cambios aparentes por el estrés celular, lo anterior con el fin de estar seguros que durante la caracterización de las proteínas por PAGE-SDS, se estuviera poniendo la misma cantidad de proteína y que solo los cambios en la expresión de Ro60, PCNA y p53 se debieran al estrés.
Análisis densitométrico de Ro60, p53, PCNA y HSP70: Las bandas de proteínas Ro60, p53, PCNA y HSP70 detectadas por autorradiografía bajo condiciones normales (control) y de estrés, se analizaron por densitometría (Bio-Rad, Chemy- Doc), con el fin de cuantificar las cantidades de proteínas.
Análisis Estadístico. Los resultados obtenidos de las densitometrías de las bandas de proteínas, se expresaron como media ± error estándar de la media (sem), donde n=3 es el número de observaciones.
Resultados
Modificación de la Proteína Ro60 en Piel de Ratones sometidos a Estrés
Cuando se analizó la expresión de la proteína Ro60 en las muestras de piel de ratones control, observamos dos bandas, mientras que en los sometidos a estrés, el número de bandas aumentó, pudiendo observarse hasta cinco de ellas, como es el caso de la muestra de piel sometida a HgCl2 (Figura 1), lo que nos indica una modificación en el patrón de expresión de la proteína Ro60 por estrés. La expresión de Ro60 aumentó con los estresores luz UV, calor (40 °C), HgCl2, H2O2 y etanol, siendo más notable este aumento con la luz UV, mientras que con las drogas apoptóticas camptotecina y cicloheximida su expresión fue menor comparada con los otros estresores e incluso con el control (Gráfica 1). Al utilizar un inhibidor de caspasa 3, se observa una reducción del bandeo de Ro60 en todas las condiciones tanto control como de estrés (Figura 1, Grafica 1).

Figura 1: Expresión de la proteína Ro60 en la piel de ratones sometidos a estrés. Análisis por Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.

Gráfica 1: Expresión de la proteína Ro60 en la piel de ratones sometidos a estrés. Densitometrías de las bandas de Ro60 obtenidas por Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Expresión de la proteína PCNA en Piel de Ratones sometidos a estrés
Al observar cambios en la expresión y modificación del antígeno Ro60 por diversos estresores, nos dimos a la tarea de investigar si estos estresores alteraban la continuidad del ciclo celular medido a través de PCNA. Para analizar el PCNA, las muestras de piel de los ratones estresados se sometieron a Western blot-ECL (Figura 2). Los resultados obtenidos muestran que hubo una discreta caída en la expresión de PCNA debido al estrés, siendo más notable con Calor, Camptotecina y Cicloheximida estas dos últimas conocidas por inhibir la síntesis de ADN y proteínas (Gráfica 2). Al utilizar un inhibidor de caspasa 3, se observó una reducción de esta proteína en todas las condiciones tanto control como de estrés (Figura 2, Gráfica 2).

Figura 2: Expresión de la proteína PCNA en la piel de ratones sometidos a estrés. Análisis por Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
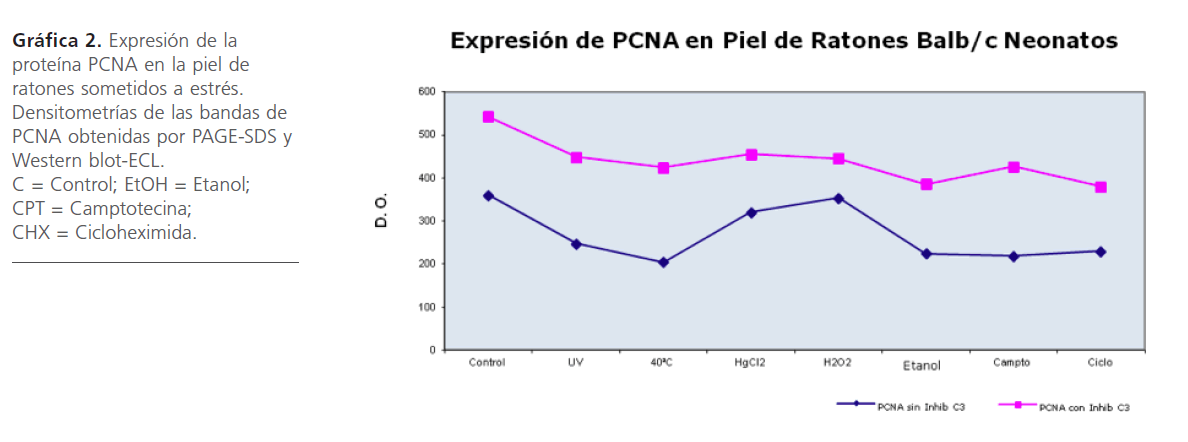
Gráfica 2: Expresión de la proteína PCNA en la piel de ratones sometidos a estrés. Densitometrías de las bandas de PCNA obtenidas por PAGE-SDS y Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Expresión de la Proteína p53 en Piel de Ratones Sometidos a Estrés
Debido a los cambios presentados en la expresión del antígeno Ro60, así como los cambios en la expresión de PCNA, el siguiente paso fue monitorear a la proteína p53, considerada el guardián del genoma y una proteína clave en el paro o continuidad del ciclo celular. El objetivo fue ver si los estresores inducen cambios en su expresión, ya que esta se relaciona con correcciones en el ADN o bien, como un factor que induce apoptosis. Cuando analizamos la expresión de la proteína p53 en las muestras de piel de ratones sometidos a estrés, observamos cambios notables en la expresión de esta proteína involucrada en el control del ciclo celular y la apoptosis. Se encontró que la expresión de p53 debido a los estresores fue muy discreta, sobre todo con luz UV, H2O2 y etanol, mientras que en el resto de las condiciones su expresión fue mayor, siendo más notable con el calor, el HgCl2 y las drogas camptotecina y cicloheximida (Figura 3, Gráfica 3). Al utilizar un inhibidor de caspasa 3, se observó una reducción de esta proteína en todas las condiciones tanto control como de estrés (Figura 3, Gráfica 3).

Figura 3: Expresión de la proteína p53 en la piel de ratones Balb/c neonatos sometidos a estrés. Análisis por PAGE-SDS y Western blot- ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida. Tubulina = Proteína que no altera su expresión por estrés.

Gráfica 3: Expresión de la proteína p53 en piel de ratones Balb/c neonatos sometidos a estrés. Densitometrías de las bandas de p53 obtenidas por PAGE-SDS y Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Gráfica 1. Expresión de la proteína Ro60 en la piel de ratones sometidos a estrés. Densitometrías de las bandas de Ro60 obtenidas por Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Figura 2. Expresión de la proteína PCNA en la piel de ratones sometidos a estrés. Análisis por Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Estrés medido a través del biomarcador HSP70
Finalmente, en el presente estudio utilizamos como sensor de estrés un biomarcador que es la HSP70, esta proteína de estrés térmico, es expresada en todas las células de manera constitutiva y su síntesis se incrementa por varias formas de estrés. Encontramos que todos los factores físicos y químicos utilizados inducen la sobreexpresión de esta proteína (Gráfica 4).

Gráfica 4: Expresión de la proteína HSP70 en piel de ratones Balb/c neonatos sometidos a estrés. Densitometrías de las bandas de HSP70 obtenidas por PAGE-SDS y Western blot-ECL. C = Control; EtOH = Etanol; CPT = Camptotecina; CHX = Cicloheximida.
Discusión
En el presente trabajo se analizó la expresión de las proteínas Ro60, PCNA, p53 y HSP70 en la piel de ratones Balb/c neonatos cuando fueron expuestos a diversos agentes estresantes.
Como resultados, se observó que la expresión de Ro60 en la piel de los ratones sometidos a estrés se incremento con luz UV, calor, HgCl2, H2O2 y etanol. Todos los estresores produjeron un incremento en la expresión de Ro60 con respecto al control. Este resultado coincide con lo reportado por Sánchez-Rodríguez y col. [7] donde observan que la proteína Ro60 se incrementa de forma significativa en cultivos de células HEp-2 sometidos a luz UV-A (366 nm), y a estrés calórico.
Sin lugar a dudas los mecanismos de daño celular de estos estresores son distintos, pero todos contribuye a la expresión de antígenos modificados en la piel de los ratones, lo que puede ser similar en los pacientes con Lupus cuando se exponen a la radiación solar donde reciben dosis importantes de luz UV y calor [46], donde la fotosensibilidad por UV es uno de los síntomas más frecuentes en LES, existiendo una relación entre la exposición a la luz solar y las manifestaciones cutáneas [3,6,11]. Lo anterior tiene relación con un estudio realizado con biopsias de piel de pacientes con LE fotosensible, con LE no fotosensible y de individuos normales, donde se determinó la expresión de las proteínas Ro52, Ro60 y La48, así como la presencia de anticuerpos circulantes dirigidos contra ellas, observándose que la expresión de Ro52, Ro60 y La48 es mayor en la piel de pacientes con LE fotosensible que en pacientes con LE no fotosensible e individuos normales, además que existe una fuerte correlación entre la expresión de estos antígenos y la presencia de títulos altos de autoanticuerpos circulantes dirigidos contra ellos, lo que conduce a la fotosensibilidad en pacientes con LE. También se ha observado que la sobreexpresión de Ro60 en pacientes con LE fotosensibles puede ser particularmente importante, ya que en las muestras de piel de estos pacientes tomadas de sitios expuestos al sol, Ro60 se incrementa a diferencia de aquellos sitios no expuestos [47]. Esto mismo se ha observado conotros antígenos como Sm, U2-B y La como consecuencia de la acumulación intracelular de ERO, así como una relocalización de los antígenos y la subsecuente inducción de apoptosis y necrosis en un modelo experimental con queratinocitos [48].
En este estudio se observa también, que el suero de pacientes con LES reconoce a la proteína Ro60, así como también a otras proteínas modificadas bajo condiciones de estrés, por lo que postulamos que existe una expresión diferenciada del antígeno Ro60 debido al estrés produciendo isoformas del mismo, y que sus productos modificados son reconocidos por los anticuerpos presentes en el suero de pacientes con LES. Una de estas isoformas de Ro60 es la proteína Ro52, ya que se ha visto que proviene de la fragmentación de Ro60, y que el antígeno Ro52 es una ligasa involucrada en la ubiquitinación, cuya sobreexpresión produce disminución de la proliferación celular y aumento de la apoptosis [49]. Lo anterior es reforzado en este estudio por el hecho de que el patrón de Ro60 que se observó con la luz UV, calor, HgCl2, H2O2 y etanol, es similar al obtenido con las drogas camptotecina y cicloheximida las cuales son inhibidoras de la replicación y de la síntesis de proteínas respectivamente, y que en modelos celulares in vitro se ha demostrado que inducen apoptosis [50].
En este estudio antes de inducir estrés en los ratones, se utilizó un inhibidor de caspasa 3, observando una disminución en el número de bandas reconocidas por los anticuerpos anti-Ro60 presentes en el suero de pacientes con LES. Esto nos indica que es posible que los estresores activen la vía apoptótica induciendo cambios antigénicos, que dañan a la proteína Ro60 y la fragmenta en otras isoformas como Ro52, y que con un inhibidor de caspasa 3 no aparece dicho bandeo. Estudios previos reportan que el incremento de Ro60 y Ro52 en pacientes con Síndrome de Sjögren y LES pueden ser los responsables del aumento en la apoptosis, que permite la exposición de autoantígenos, pérdida de la tolerancia inmunológica y la producción de anticuerpos autorreactivos [49].
La activación anormal de las vía apoptoticas desempeñan un papel importante en la iniciación y propagación de LES, donde se propone que durante la apoptosis se produce la formación de pequeñas vesículas en las que son concentrados antígenos como Ro60, Ro52 y calreticulina, y la formación de grandes cuerpos apoptóticos que contienen autoantígenos como La, Ro60, nucleosomas y antígeno RNP70. La presencia de un mayor número de células apoptóticas en un ambiente proinflamatorio puede conducir a una disminución en la remoción de restos apoptóticos por las células fagocíticas vía no inflamatoria, y a un aumento en su captación y procesamiento por las células dendríticas [3,6,51].
Por otro lado, cuando analizamos la expresión de la proteína p53 en la piel de los ratones sometidos a los diferentes estresores utilizados, no observamos expresión de esta proteína con luz UV, esto debido a que el tiempo de exposición (20 min) fue corto, y probablemente a que la dosis de luz UV utilizada (5-30 mJ/cm2) fue baja, ya que en otros estudios realizados en piel han mostrado un aumento en la expresión de esta proteína con luz UV al utilizar tiempos de exposición más prolongados y dosis más altas [52], Así mismo, Qin y col. [53] utilizando explantes de piel humana normal a varias dosis de luz UV observaron un incremento de p53 dependiente de la dosis.
En cambio, con el choque calórico (40 °C) observamos un aumento en la expresión de p53, estos resultados coinciden con los observados en un estudio realizado con melanocitos humanos normales en donde se compararon los efectos del calor (42 °C por 1 h durante 3 días) y de la luz UVB (20 mJ/ cm2), observando un aumento en la expresión de p53 y una disminución de la proliferación celular en ambas condiciones, sugiriendo que la expresión sostenida de p53 dispara la respuesta apoptótica después de daño al ADN, y que el calor comparte actividades biológicas dañinas semejantes a la luz UVB [46].
De igual forma, el HgCl2 induce un aumento en la expresión de p53, lo cual puede explicarse por la demostración de que el ion Hg2+ al unirse a los residuos de cisteína puede provocar que p53 natural adopte una conformación alterada [54], y porque se conoce que las proteínas p53 mutadas o alteradas son más estables y tienden a acumularse en el núcleo celular debido a que no activan la expresión de la proteína MDM2 requerida para su degradación [23]. Por otro lado, los ratones que fueron administrados con HgCl2 murieron aproximadamente a las 2.5 h, demostrando la agresividad y el efecto de este agente estresante en el organismo.
Cuando se utilizó el H2O2 la expresión de p53 fue menor en comparación con la producida por los otros estresores, posiblemente porque el periodo de exposición fue corto, ya que otros estudios demuestran con células IMR-90 (fibroblastos de pulmón de feto humano) tratadas con H2O2 durante 2 h, un incremento en la proteína p53 siendo su expresión dosis dependiente [55].
Al utilizar la camptotecina, droga inhibidora de la topoisomerasa I, observamos un notable aumento en la expresión de p53, lo cual coincide con un estudio llevado a cabo en fibroblastos de ratón NIH-3T3, donde se observó un incremento a partir de 30 min hasta las 6 h que duró el estudio. Asimismo, se sugirió que este incremento en la activación de p53 puede resultar, al menos en parte, de un aumento en la vida media de la proteína y el consecuente aumento en su concentración intracelular [56].
Con la droga cicloheximida también observamos un aumento importante en la expresión de la proteína p53, contrario a lo observado previamente por otros autores, pues se ha demostrado que en células NIH-3T3 esta droga (13 μM por 2 h) elimina cualquier señal de p53, y que el pretratamiento de las células con cicloheximida inhibe completamente el aumento de p53 causado por estresores como H2O2 y camptotecina [56]. También en células IMR-90 se ha observado que la inducción de p53 producida por el H2O2 es inhibida por la cicloheximida [55]. En otro estudio se observó que células HEp-2 tratadas con cicloheximida no presentan apoptosis inducida por deprivación de suero fetal bovino, en donde se encuentra involucrada la acción de p53, ya que estas droga inhibe la síntesis de p53 y su fosforilación, previniendo así la muerte celular [57].
Cuando utilizamos el inhibidor de caspasa 3, previo a someter a los ratones Balb/c neonatos a diferentes estresores, se observó una baja expresión de p53, lo cual es un dato muy significativo y hacen falta estudios posteriores para determinar el mecanismo mediante el cual se produce este efecto.
Al analizar la expresión de PCNA en ratones sometidos a luz UV y calor, tanto con inhibidor de caspasa 3 como sin inhibidor, disminuye su expresión, lo cual es coincidente con lo publicado por Balajee [58] que menciona que en cultivos de células CS-B después del daño con luz UV, disminuye la expresión de PCNA.
En el presente estudio se utilizo como biomarcador de estrés a la proteína HSP70. Se observo un incremento de la HSP70 debido al estrés producido por la luz UV, calor, HgCl2, H2O2 y etanol, donde este incremento ayuda a la supervivencia celular debido a las funciones de la HSP70, la cual fue descubierta por Ritossa en 1960 [39]. Esta proteína se expresa de manera constitutiva y ubica en las células eucariotas y procariotas [39,59,60], su función es en el plegado y transporte intracelular de proteínas sintetizadas de novo, y durante el estrés, repara los daños de proteínas mediante la unión a proteínas parcialmente desnaturalizadas, disociando agregados de proteínas y regulando el doblez correcto [60,61].
Conclusiones
Los estresores ambientales son un factor determinante en la aclimatación, adaptación y selección de las especies, por esta razón se determinó el efecto de la luz UV, calor, HgCl2, H2O2, etanol, camptotecina y la cicloheximida, sobre la expresión de las proteínas Ro60, PCNA, p53 y HSP70 en la piel de ratones Balb/c neonatos.
Se observó que la expresión de Ro60 es modificada por agentes inductores de estrés, con un incremento de autoantígenos, donde el patrón de expresión de Ro60 es muy similar al observado con los estresores, y a su vez, estos son similares al patrón obtenido con las drogas inductoras de apoptosis camptotecina y cicloheximida, por lo que se puede considerar que los mecanismos de daño inducido por los agentes productores de estrés celular pudieran estar relacionados con la activación de las vías de apoptosis. La utilización de un inhibidor de caspasa 3 y los cambios en el patrón de expresión de p53 y PCNA confirman la posible activación de la vía apoptótica. Estos eventos de estrés pueden estar relacionados en pacientes con LES con fotosensibilidad.
Agradecimientos
Este trabajo fue financiado por CONACYT-SIVILLA, Proyecto No. 9601172, responsable Dr. Sergio Hugo Sánchez-Rodríguez.
663
References
- Manson JJ, Rahman A. Systemic lupus erythematosus. Orphanet Journal of Rare Diseases. 2006;1:6.
- Allam R, Sayyed SG, Kulkarni OP, Lichtnekert J, Anders HJ. Mdm2 Promotes Systemic Lupus Erythematosus and Lupus Nephritis. J AM Soc Nephrol. 2011;22(11):2016-27.
- Orteu CH, Sontheimer RD, Dutz JP. The pathophysiology of photosensitivity in lupus erythematosus. Photodermatol Photoimmunol Photomed. 2001;17:95-113.
- Sánchez-Rodríguez SH, Barajas-Vásquez GE, Ramírez-Alvarado ED, Moreno-García A, Barbosa-Cisneros OY. Lupus eritematoso: enfermedad autoinmune sistémica y órgano específica. Rev Biomed. 2004;15:173-180.
- Werth VP. Cutaneous Lupus. Insights into Pathogenesis and Disease Classification. Bulletin of the NYU Hospital for Joint Diseases. 2007;65(3):200-204.
- Lin JH, Dutz JP, Sontheimer RD, Werth VP. Pathophysiology of Cutaneous Lupus Erythematosus. Clinic Rev Allerg Immunol. 2007;33:85-106.
- Sánchez-Rodríguez SH, Herrera-Van OD, Avalos-Díaz RE, Herrera- Esparza R. Ro and La ribonucleoproteins become self-aggregated by cell stress. Reumatismo. 2007;59(4):292-298.
- Fernández AA, Quintana LG, Félix RJ, Rondón F, Sánchez A, Méndez P, Rojas A, Rojas C, Iglesias GA. Historia de los autoanticuerpos. Aplicación clínica de los autoanticuerpos en Lupus Eritematoso Sistémico. Rev Mex Reumat. 2004;19(6):381-396.
- Furukawa F. Antinuclear antibody-keratinocyte interactions in photosensitive cutaneous lupus erythematosus. Histology and Histopathology. 1999;14(2):627-633.
- Powell JJ, Van de Water J, Gershwin ME. Evidence for the Role of Environmental Agents in the Initiation or Progression of Autoimmune Conditions. Environmental Health Perspectives. 1999;107(5):667-672.
- Manson JJ, Isenberg DA. The pathogenesis of systemic lupus erythematosus. The Journal of Medicine. 2003;61(11):343-346.
- Via CS, Nguyen P, Niculescu F, Papadimitriou J, Hoover D, Silbergeld EK. Low-Dose Exposure to Inorganic Mercury Accelerates Disease and Mortality in Acquired Murine Lupus. Environmental Health Perspectives. 2003;111(10):1273-1277.
- Pollard KM, Pearson DL, Hultman P, Deane TN, Lindh U, Kono DH. Xenobiotic Acceleration of Idiopathic Systemic Autoimmunity in Lupus-Prone BXSB Mice. Environmental Health Perspectives. 2001;109(1):27-33.
- Sonna LA, Fujita J, Gaffin SL, Lilly CM. Effects of heat and cold stress on mammalian gene expression. J Appl Physiol. 2002;92(4):1725-1742.
- Barajas-Vásquez GE, Baldwin-Sevilla C, Barbosa COY, Sanchez- Rodriguez SH. Las proteínas de estrés calórico HSP60, 70 y 90 participan en la adaptacion de los caprinos a las zonas áridas. REDVET (Revista Electrónica Veterinaria). 2005;VI(3)
- Sánchez-Rodríguez, Ramírez-Alvarado ED, Barajas-Vásquez GE, Cardona-Félix CS. El efecto estresante del tabaco, alcohol, sobrepeso y exceso de ejercicio físico, es manifestado a través de la expresión de la HSP70. Archivos de Medicina. 2006;2(4).
- Basurto Frausto MG, Luna Sánchez B, Moreno García A, Barbosa Cisneros OY, Sánchez-Rodríguez SH. Sobreexpresión de la HSP25, 27 y 70 en tejido intestinal y muscular de rata infectada con Tricinella spiralis. Archivos de Medícina. 2008;4(3):1
- Wu D, Cederbaum AI. Alcohol, Oxidative Stress, and Free Radical Damage. Alcohol Research & Health. 2003;27(4):277-284.
- Conde de la Rosa L, Moshage H, Nieto N. Estrés oxidativo hepatocitario y hepatopatía alcoholica. Revista Española de Enfermedades Digestivas. 2008;100(3).
- Levine AJ, Momand J, Finlay CA. The p53 tumour suppressor gene. Nature (Lond). 1991;351:453-456.
- Efeyan A, Serrano M. p53: Guardian of the Genome and Policeman of the Oncogenes. Cell Cycle. 2007;6(9):1006-1010.
- Lacroix M, Toillon RA, Leclercq G. p53 and breast cancer, an update. Endocrine-Related Cancer. 2006;13:293-325.
- Vousden KH, Lane DP. p53 in health and disease. Nat Rev Mol Cell Biol. 2007;8(4):275-283.
- Liebermann DA, Hoffman B, Vesely D. p53 Induced Growth Arrest versus Apoptosis and it is Modulation by Survival Cytokines. Cell Cycle. 2007;6(2):166-170.
- Bravo R, Frank R, Blundell PA, Macdonald BH. Cyclin/PCNA is the auxiliary protein of DNA polymerase delta. Nature. 1987;326:515-517.
- Zhao H, Ho P, Lo Y, Espejo A, Bedford MT, Hung M, Wang S. interaction of proliferation Cell Nuclear Antigen (PCNA) with c-Abl in Cell Proliferation and Response to DNA Damages in Breast Cancer. PLoS One. 2012;7(1).
- Tan Z, Wortman M, Dillehay KL, Seibel WL, Evelyn CR, Smith SJ, et al. Small-molecule targeting of proliferating cell nuclear antigen chromatin association inhibits tumor cell growth. Mol Pharmacol. 2012 Jun;81(6):811-9.
- Jaskulski D, deRiel J.K, Mercer W.E, Calbretta B, Baserga R. Inhibition of cellular proliferation by antisense oligodeoxynucleotides to PCNA cyclin. Science. 1988; 240:1544-1546.
- Schultz-Norton JR, Gabisi VA, Ziegler YS, McLeod JR, Yates JR, Nardulli AM. Interaction of estrogen receptor with proliferating cell nuclear antigen. Nucleic Research. 2007;35(15):5028-5038.
- Starzalka W, Ziemienowicz A. Proliferation cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation. Annals of Botany. 2011; 107:1127-1140
- SØrensen JG, Loeschcke V. Studying stress responses in the postgenomic era: its ecological and evolutionary role. Journal of Biosciences. 2007;32(3):447-456.
- Kültz D. Evolution of the cellular stress proteome: from monophyletic origin to ubiquitous function. The Journal of Experimental Biology. 2003;206:3119-3124.
- Tortora GJ, Derrickson B. Principios de Anatomía y Fisiología. 11a ed. España: Editorial Médica Panamericana; 2006. pp. 656-658, 147, 159, 160.
- English JSC, Dawe RS, Ferguson J. Envionmental effects and skin disease. British Medical Bulletin. 2003;68:129-142.
- Golan TD, Elkon kB, Gharavi AE, Krueger JG. Enhanced membrane binding of autoantibodies to cultured keratinocytes of systemic lupus erythematosus patients after ultraviolet B/ultraviolet A irradiation. J
- Clin Invest. 1992; 90(3):1067–1076. 37. Bañuelos-Valenzuela R, Sánchez-Rodríguez SH. La proteína de estrés calórico HSP70 funciona como un indicador de adaptación de los bovinos a las zonas áridas. REDVET. (Revista electrónica de Veterinaria) 2005;VI(3).
- Sánchez-Rodríguez SH, Ramírez AE, Barbosa CO. El estrés impuesto por los rayos Gamma, peróxido de hidrógeno y calor es amortiguado por cambios en la expresión y localización de la HSP70 en células Hela. Archivos de Medicina. 2007:3(3).
- Sánchez-Rodríguez SH. El estrés calórico y su amortiguamiento a través de las proteínas de estrés HSP. Revista electrónica de Veterinaria. REDVET. 2007;8(12B).
- Leverkus M, Yaar M, Eller MS, Tang EH, Gilchrest BA. Posttranscriptional regulation of UV induced TNF-a expression. J Invest Dermatol. 1998;110:353-357.
- Meléndez-Gómez C, Kouznetsov V. Alcaloides quinolínicos: importancia biológica y esfuerzos sintéticos. Universitas Scientiarum. 2005;10(2):5-18.
- Harlow E, Lane D. “Antibodies a laboratory manual”. Cold Spring Harbor Laboratory. Cold Spring Harbord, N.Y. 1988.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical. Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680-685.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrilamide gels nitrocellulose sheets: procedure and applications. Proc. Natl. Acad. Sci. USA. 1979; 76: 4350-4354.
- Nakazawa K, Sahuc F, Damour O, Collombel C, Nakazawa H. Regulatory Effects of Heat on Normal Human Melanocyte Growth and Melanogenesis: Comparative Study with UVB. J Invest Dermatol. 1998;110:972-977.
- Ioannides D, Golden BD, Buyon JP,Bystryn JC. Expression of SS-A/ Ro and SS-B/La Antigens in Skin Biopsy Specimens of Patients With Photosensitive Forms of Lupus Erythematosus. Arch Dermatol. 2000;136:340-346.
- Lawley W, Doherty A, Denniss S, Chauhan D, Prujin, van Venrooii WJ, Herbert K. Rapid lupus autoantigen relocalization and reactive oxygen species accumulation following ultraviolet irradiation of human keratinocytes. Rheumatology (Oxford). 2000 Mar;39(3):253-61.
- Espinosa A, Zhou W, Ek M, Hedlund M, Brauner S, Popovic K, Horvath L, Wallerskog T, Oukka O, Nyberg F, Kuchroo VK, Wahren-Herlenius M. The Sjögren’s Syndrome-Associated Autoantigen Ro52 Is an E3 Ligase That Regulates Proliferation and Cell Death. The Journal of Immunology. 2006;176:6277-6285.
- Ramírez-Sandoval R, Sánchez-Rodríguez SH, Herrera-Vanoostdam D, Ávalos-Díaz E, Herrera-Esparza R. Antinuclear antibodies recognize cellular autoantigens driven by apoptosis. Joint Bone Spine. 2003;70(3):187-197.
- Carreño LJ, Pacheco R, Gutiérrez MA, Jacobelli S, Kalergis AM. Disease activity in systemic lupus erythematosus is associated with an altered expression of low-affinity Fcγ receptors and costimulatory molecules on dendritic cells. Immunology. 2009 November;128(3):334–341.
- Ouhtit A, Muller HK, Davis DW, Ullrich SE, McConkey D, Ananthaswamy HN. Temporal events in skin injury and the early adaptive responses in ultraviolet-irradiated mouse skin. American Journal of Pathology, 2000;156(1):201-207.
- Qin JZ, Chaturvedi V, Denning MF, Bacon P, Panella J, Choubey D, Nickoloff BJ. Regulation of Apoptosis by p53 in UV-irradiated Human Epidermis, Psoriatic Plaques and Senescent Keratinocytes. Oncogene. 2002;21:2991-3002.
- Hainaut P, Milner J. A Structural Role for Metal Ions in the “Wild-Type” Conformation of the Tumor Suppressor Protein p53. Cancer Research. 1993;53:1739-1742.
- Chen QM, Bartholomew JC, Campisi J, Acosta M, Reagan JD, Ames BN. Molecular analysis of H2O2-induced senescent-like growth arrest in normal human fibroblasts: p53 and Rb control G1 arrest but not cell replication. Biochem J. 1998;332:43-50.
- Tishler RB, Calderwood SK, Coleman CN, Price BD. Increases in Sequence Specific DNA Binding by p53 Following Treatment with Chemotherapeutic and DNA Damaging Agents. Cancer Research. 1993;53:2212-2216.
- Bai J, Cederbaum AI. Cyclohexamide Protects Hep-2 Cells from Serum WithDrawal-Induced Apoptosis by Decresing p53 and Phosphorylated p53 Levels. The Journal of Pharmacology and Experimental Therapeutics. 2006;319(3):1435-1443.
- Balajee AS, Dianova I, Bohr VA. Oxidative damage-induced PCNA complex formation is efficient in xeroderma pigmentosum group A but reduced in Cockayne syndrome group B cells. Nucleic Acids Research. 1999;27(22): 4476-4482.
- Morimoto RI, Milaski KL. In Stress Proteins in Biology and Medicine. Cold Spring Harbor. 1990;332-359.
- Lindquist S, Craig EA. The heat shock proteins. Annu. Rev. Genet. 1988;22:631-637.
- Urlich HF, Hayer-Harl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science. 2002;295:1852-1858.












