Introducción
La artritis reumatoide (AR) es una enfermedad autoinmunitaria inflamatoria crónica, que afecta predominantemente a las articulaciones diartrodiales, aunque es de naturaleza sistémica y puede afectar a estructuras extraarticulares [1]. La AR es una enfermedad agresiva que conduce a la destrucción articular y al deterioro funcional irreversible en un elevado porcentaje de pacientes. Aunque el deterioro radiológico y funcional progresa durante todo el curso de la enfermedad, la máxima velocidad de desarrollo de las lesiones radiológicas y del compromiso funcional ocurre durante los primeros 2 años de evolución [2,3].
La mayoría de los reumatólogos coinciden en afirmar que actualmente todavía existe una parte de la población que está mal diagnosticada o que recibe un diagnóstico tardío, si bien está demostrado que un diagnóstico precoz y correcto, y la instauración rápida del tratamiento son de la máxima relevancia para inducir la remisión durante los primeros meses de evolución de la AR [4], obtener un mejor pronóstico y, por tanto, incidir positivamente en la calidad de vida de los pacientes.
La AR es la causa más frecuente de artritis crónica en los países occidentales, teniendo una distribución mundial con una prevalencia global aproximada cercana al 1%. En España la AR afecta al 0,5% de la población adulta (aproximadamente 200.000 personas) [5]. Las estimaciones relativas a la incidencia de la AR van desde 4,3-6,3 casos cada 100.000 hombres adultos hasta 10,0-12,8 casos cada 100.000 mujeres adultas, y la incidencia aumenta con la edad en ambos sexos [6]. La AR suele aparecer en torno a los 40-45 años, aunque también los niños y los ancianos pueden padecerla [7].
El curso clínico de la AR es progresivo y se asocia a una disminución de la calidad de vida, así como a un aumento de la morbilidad y la mortalidad [8]. El 50% de los pacientes con AR son incapaces de trabajar después de 10 años de aparecer la enfermedad, y además, la esperanza de vida se reduce unos 5 años en las mujeres y unos 7 años en los hombres. La mortalidad excesiva normalmente es a causa de las enfermedades asociadas [9].
Los estudios sobre la carga social que conlleva la AR han demostrado los siguientes aspectos [10]:
• Existen indicios radiológicos de destrucción de las articulaciones en el 70% de los pacientes 2 años después del diagnóstico de la enfermedad.
• Entre el 15% y el 20% de los pacientes diagnosticados recientemente requerirán artroplastia por destrucción articular en un plazo de 5 años.
• 10 años después del comienzo de la AR, más del 50% de los pacientes sufre discapacidad grave; 15 años después de su aparición sólo el 40% puede trabajar [11].
• Se estima que la prevalencia de depresión entre los pacientes con AR oscila entre el 14% y el 43%.
Tratamiento actual de la AR
Las terapias actuales en el tratamiento de la AR se resumen en la tabla 1. Debido a que la AR es una enfermedad inflamatoria, la primera línea terapéutica suele constar de medicamentos que suprimen la inflamación, como los antiinflamatorios no esteroideos (AINEs) y los glucocorticoides [1]. Estos fármacos actúan de forma rápida y mejoran el dolor y la tumefacción causada por la AR pero deben ser prescritos, ya desde el inicio, junto a fármacos antirreumáticos modificadores de la enfermedad (FAMEs), que son compuestos que actúan de forma más lenta, mejorando no sólo los síntomas sino también la progresión clínica y radiográfica. Los FAMEs han demostrado capacidad para enlentecer o detener la progresión de la AR y, entre ellos, hay que destacar por su eficacia y rapidez de acción el metotrexato [13]. Asimismo, los fármacos modificadores de la respuesta biológica (agentes biológicos) están dirigidos a paliar el efecto de los mediadores inflamatorios en el tejido dañado por la AR.
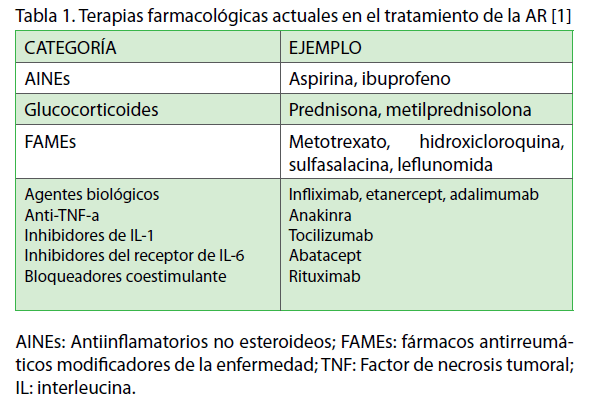
Tabla 1. Terapias farmacológicas actuales en el tratamiento de la AR [1]
AINEs: Antiinflamatorios no esteroideos; FAMEs: fármacos antirreumáticos modificadores de la enfermedad; TNF: Factor de necrosis tumoral; IL: interleucina.
Diversos estudios han demostrado que las respuestas a los FAMEs son mejores en los pacientes con AR en los estadios tempranos de la enfermedad [14,15]. El metotrexato es el FAME que se usa con mayor frecuencia en la terapia contra la AR, sobre todo en los pacientes que presentan elevada actividad [14]. Una vez prescrito el metotrexato como terapia de la AR, la probabilidad de cambiar a otro FAME es baja ya que este agente presenta una elevada tasa de retención en comparación con otros fármacos [16,17].
El tratamiento inicial con fármacos biológicos inhibidores del factor de necrosis tumoral (anti-TNF) más metotrexato está justificado en pacientes con inicio reciente en los que se sospeche una evolución especialmente agresiva [18]. En estos casos, la combinación de cualquiera de los tres antagonistas del TNF disponibles comercialmente (etanercept, infliximab o adalimumab), junto con el metotrexato ha resultado ser más efectiva que la monoterapia [19-21]. Estudios controlados en pacientes con AR de inicio reciente, han demostrado que el tratamiento precoz con cualquier antagonista del TNF, especialmente si se combina con metotrexato, es capaz de inducir remisión duradera en una proporción de pacientes considerable, así como evitar el desarrollo de lesiones radiográficas o de detener su progresión.
Diversos estudios han demostrado que la administración subcutánea de metotrexato presenta algunas ventajas respecto a la administración intramuscular u oral. Así, las inyecciones subcutáneas presentan una seguridad y eficacia equivalentes a las inyecciones intramusculares pero son menos dolorosas [22-24]. Asimismo, las inyecciones subcutáneas de metotrexato, dependiendo de la dosis, presentan una concentración pico en plasma y un área bajo la curva mayor que con la administración oral, siendo su administración bien tolerada y no produciendo toxicidad local [25,26], además de haber demostrado ser más eficaz [27]. En este sentido, un ensayo clínico doble-ciego aleatorizado y enmascarado (n=384) demostró que tras 6 meses de tratamiento con 15 mg de metrotexato semanal por vía subcutánea u oral, significativamente más pacientes tratados con metotrexato subcutáneo que con metotrexato oral presentaron una respuesta ACR20 (78% vs. 70%) y ACR70 (41% vs. 33%) [27]. Los pacientes en los que la enfermedad tenía más de 12 meses de duración mostraron una respuesta ACR20 superior (89% con metotrexato subcutáneo vs. 63% con metotrexato oral). Siguiendo el protocolo, los pacientes que no respondieron a la medicación (14%) cambiaron el tratamiento de metotrexato oral a memetotrexato subcutáneo a la misma dosis de 15 mg, o bien incrementaron la dosis de metotrexato subcutáneo de 15 mg a 20 mg, y presentaron una tasa de respuesta ACR20 adicional del 30% y del 23%, respectivamente. Nathan et al. [28] demostraron que la mayoría de los pacientes que conseguían la remisión de la enfermedad con la administración de metotrexato subcutáneo preferían continuar con esta vía de administración que pasar a la administración oral. Dos estudios recientes observacionales prospectivos llevados a cabo en Reino Unido han demostrado que metotrexato subcutáneo es más eficaz que metotrexato oral y se tolera bien en los pacientes con AR, incluso en los casos en los que la enfermedad es más crónica [29,30]. Así, en el estudio de Hameed et al. [29] se observó que un grupo de pacientes con AR en los que el metotrexato oral era ineficaz y cambiaron a metotrexato subcutáneo (n=40) mejoraron la puntuación DAS28 media de 4,8 a 4,2 (p= 0,006). Además, 4 pacientes consiguieron la remisión de la enfermedad con metotrexato subcutáneo (DAS28 < 2,6). En el mismo estudio el grupo de pacientes que pasaron a recibir metotrexato subcutáneo debido a la intolerancia al metotrexato oral (n=63) mejoraron la puntuación DAS28 media de 4,1 a 3,0 (p= 0,0001). Asimismo 15 pacientes consiguieron la remisión de la enfermedad con metotrexato subcutáneo y 6 pacientes que habían conseguido la remisión con metotrexato oral consiguieron mantenerla con metotrexato subcutáneo (DAS28 < 2,6). De forma similar, Keidel y Chan [30] demostraron que en los pacientes con AR que cambiaban de metotrexato oral a subcutáneo, principalmente por intolerancia o ineficacia del metotrexato oral, se observó una disminución media a los 3 meses en los valores de proteína C reactiva de –13,8 mg/L, de velocidad de sedimentación globular de –13,3 mm/h y de DAS28 de –0,99. Además, el efecto se mantuvo durante los 6 meses de seguimiento. No se observaron acontecimientos adversos en el 91% de los pacientes tratados con metotrexato subcutáneo, y sólo el 9% experimentó náuseas transitorias tras la inyección.
Beneficios de seguridad de las jeringas precargadas de metotrexato
El metotrexato es un fármaco clasificado dentro de los fármacos citotóxicos. Por este motivo, es necesario manipularlo con precaución, ya que la mayoría de los citotóxicos han demostrado propiedades mutagénicas, carcinogénicas, teratogénicas y embriotóxicas en modelos animales.
Siguiendo la ley de prevención de riesgos laborales [31], y a fin de proporcionar protección y seguridad al personal manipulador así como prevenir la contaminación medioambiental, las comunidades autónomas han elaborado diversos protocolos de actuación para el personal manipulador de metotrexato. En Castilla y León, por ejemplo, únicamente se permite la administración extrahospitalaria de metotrexato con la jeringa precargada de Metoject® ya que es la presentación que aporta una mayor seguridad al reducir el riesgo de entrar en contacto con el producto.
El Servicio de Salud de Castilla-La Mancha también ha elaborado un protocolo para el manejo de metotrexato en Atención Primaria. Así, aconsejan que se usen jeringas precargadas en lugar de la presentación en vial solución y ésta a su vez es preferible al vial liofilizado, dado que la reconstitución del medicamento constituye una circunstancia de riesgo añadido de exposición por la posibilidad en la formación de aerosoles. Se considera que a mayor manipulación del producto se tiene mayor posibilidad de contaminación del ambiente y del trabajador.
El protocolo de actuación al manipular metotrexato elaborado por la Sociedad Catalana de Seguridad y Medicina del Trabajo es muy parecido al descrito en las otras comunidades. Así, recomiendan la utilización de una presentación en jeringa precargada ya que, al no requerir manipulación exógena de la sustancia, reduce notoriamente las posibilidades de producción de derrames accidentales y de generación de residuos sobrantes lo que, indudablemente debe interpretarse como un aporte positivo de Metoject®.
Del mismo modo, la existencia de diversas preparaciones de Metoject®, con diferentes dosis del fármaco adaptables a las necesidades de cada paciente, constituye una forma muy eficaz de individualización de las dosis del fármaco, evitando, de forma prácticamente total, la posibilidad de errores en la administración de la cantidad de fármaco prescrita por el facultativo. La prevención de errores de dosificación es importante, ya que un exceso de dosis puede producir toxicidad y la administración de una dosis demasiado baja puede producir falta de eficacia. Por tanto, el desarrollo de las jeringas precargadas de Metoject® con dosis específicas (7,5, 10, 15, 20 y 25 mg) y un código de colores identificativo para cada dosis, aportan una mayor seguridad, tanto a los pacientes como al personal sanitario. Además, permiten simplificar el cumplimiento terapéutico, la dispensación y la administración.
Ventajas de la nueva presentación de Metoject® 50 mg/ml
Hasta la actualidad sólo existía en el mercado la jeringa precargada de Metoject® a una concentración de 10 mg/ml, siendo necesario inyectar al paciente un volumen de líquido que, para la administración subcutánea es, en dependencia de la dosis, elevado (entre 0,75 y 2,5 ml). Recientemente ha sido autorizada en España la nueva presentación de Metoject® 50 mg/ml, cuya concentración permite que el volumen de líquido a inyectar sea 5 veces inferior (entre 0,15 y 0,50 ml en dependencia de la dosis prescrita). Metoject® 50 mg/ml se administra por vía subcutánea y está indicado en el tratamiento de la AR activa en pacientes adultos, en la artritis psoriásica grave en pacientes adultos, y en la psoriasis grave e incapacitante que no responde adecuadamente a otros tratamientos tales como fototerapia, PUVA y retinoides.
Un estudio de biodisponibilidad comparativo entre Metoject® 10 mg/ ml y Metoject® 50 mg/ml demostró que la biodisponibilidad del metotrexato contenido en Metoject® 50 mg/ml vs. Metoject® 10 mg/ml fue del 98%, y la biodisponibilidad del 7-hidroximetotrexato (metabolito principal derivado del metotrexato) con Metoject® 50 mg/ml vs. Metoject® 10 mg/ml fue del 95% (datos de archivo). Por tanto, la biodisponibilidad de Metoject® 50 mg/ml en inyección subcutánea es prácticamente igual a la de Metoject® 10 mg/ml, ya que las curvas farmacocinéticas son superponibles. Respecto a la tolerabilidad local se observó que fue muy buena, y no se produjeron casos de picor, edema o hematoma.
La nueva presentación de Metoject® 50 mg/ml presenta una sustancial ventaja, ya que al ser 5 veces más concentrada permite reducir 5 veces el volumen a inyectar al paciente con AR. Metoject® 50 mg/ml contiene una aguja subcutánea acoplada que conlleva una mayor seguridad y comodidad, y es más delgada, lo cual comporta un menor dolor durante la inyección. Metoject® 50 mg/ml también presenta una escala impresa en el cuerpo de la jeringa que proporciona la posibilidad de inyectar dosis intermedias de 0,05 en 0,05 ml, es decir, de 2,5 en 2,5 mg.
Un reciente estudio evaluó el nivel de preferencia de los pacientes al recibir tratamiento con Metoject® 10 mg/ml o 50 mg/ml. El diseño del estudio fue abierto, cruzado y multicéntrico, e incluyó a 132 pacientes de 18-75 años con AR activa (DAS28>2,6) a pesar de ser tratados con metotrexato oral durante al menos 6 semanas [32]. A los pacientes se les administró una dosis de 20 mg cada semana por vía subcutánea durante 6 semanas (las 3 primeras semanas Metoject® 10 mg/ml y las 3 últimas semanas Metoject® 50 mg/ml). Los resultados demostraron que en la semana 7 el 93% de los pacientes preferían utilizar a partir de entonces la jeringa precargada de Metoject® 50 mg/ml, mientras que sólo el 2,3% preferían Metoject® 10 mg/ml (el 4,7% restante no fue evaluable), siendo la diferencia altamente significativa (p<0,0001) [32]. En la figura 1 se puede observar que, al final del estudio, el 90,6% de los pacientes que recibieron Metoject® 50 mg/ml evaluaron globalmente el nivel de satisfacción como “bueno” o “muy bueno”, y el 1,6% lo calificó como “malo” o “muy malo” [32]. En cambio, el 34,4% de los pacientes tratados con Metoject® 10 mg/ml mostraron un nivel de satisfacción global “bueno” o “muy bueno”, y el 17,2% lo calificaron como “malo” o “muy malo”. Estas diferencias observadas entre las dos formulaciones fueron estadísticamente significativas (p<0,0001) [32]. Asimismo, el 89,1% de los pacientes evaluó la aguja subcutánea acoplada de la jeringa de Metoject ® 50 mg/ml como una “ventaja” o “gran ventaja”, y el 3,1% como una “desventaja” o “gran desventaja” [32]. El 87,5% de los pacientes destacó la ventaja que aporta el volumen inferior que contiene la jeringa de Metoject® 50 mg/ml respecto Metoject® 10 mg/ml, mostrándose “de acuerdo” o “completamente de acuerdo”, y el 1,6% se mostró en desacuerdo [32]. Utilizando la escala visual analógica, la evaluación global de los pacientes en relación a la manejabilidad de la jeringa fue de 63,5 mm con Metoject® 10 mg/ml y aumentó significativamente hasta 95,0 mm con Metoject® 50 mg/ml (p<0,0001) [32].
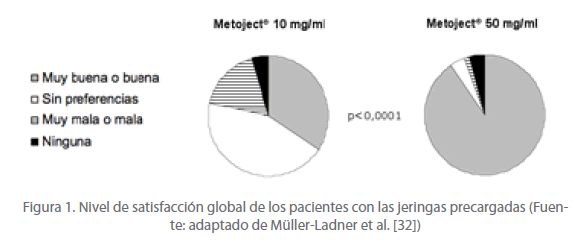
Figura 1. Nivel de satisfacción global de los pacientes con las jeringas precargadas (Fuente: adaptado de Müller-Ladner et al. [32])
Por otro lado, Müller-Ladner et al. [32] también evaluaron el nivel de satisfacción de los médicos. Así, la evaluación global sobre la manejabilidad de la jeringa fue de 82,0 mm en la escala visual analógica con Metoject ® 10 mg/ml, y aumentó hasta 96,0 mm al administrar Metoject® 50 mg/ml (p<0,0001) (figura 2). Los médicos y las enfermeras también consideraron que la aguja subcutánea acoplada de la jeringa de Metoject ® 50 mg/ml supone una “ventaja” o “gran ventaja” [32]. Asimismo, el 87,5% de los médicos y enfermeras resaltaron que el menor volumen que contiene la jeringa de Metoject® 50 mg/ml respecto a Metoject® 10 mg/ml representa una ventaja, y se mostraron “de acuerdo” o “completamente de acuerdo”, y el 12,5% no observó diferencias [32]. La evaluación global para Metoject® 50 mg/ml de los médicos y enfermeras fue “buena” (18,8%) o “muy buena” (81,2%), y para Metoject® 10 mg/ ml fue “buena” en el 31,3% de los casos, “muy buena” en el 12,5% y sin preferencias en el 50% [32]. Finalmente, en el estudio se observó que la tolerabilidad local y general de ambas presentaciones fue buena y comparable.
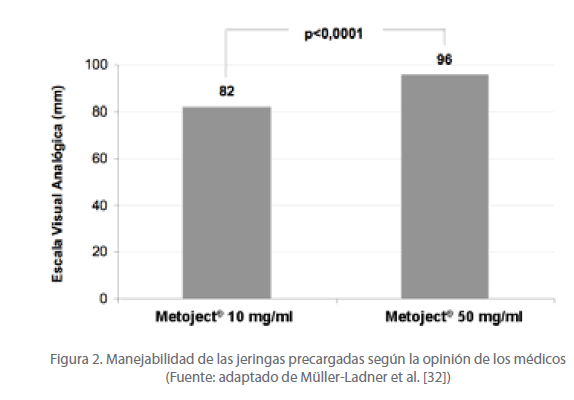
Figura 2. Manejabilidad de las jeringas precargadas según la opinión de los médicos (Fuente: adaptado de Müller-Ladner et al. [32])
Carga económica de la AR
Ruiz-Montesinos et al. observaron que el coste mediano anual por paciente con AR fue de 3.845 € [12]. Así, el coste global anual estimado para la AR atendida en unidades de reumatología de hospitales públicos españoles es de 590.110.000 €. De los costes globales, el 74% correspondió a costes directos y el 26% a costes indirectos. El 81% del coste directo fue por gasto médico y, de éste, el 56% por fármacos, el 11% por hospitalización, el 21% correspondió a visitas médicas y el 12% a pruebas de laboratorio y complementarias. El principal componente del coste indirecto fue la invalidez, que supuso el 66% del total.
Mera et al. [33] sugirieron que la carga económica por consumo de fármacos en la AR es muy variable, y observaron que el mayor coste lo producía el uso de terapia anti-TNF. Un 94% de los pacientes empleaban algún FAME, el más común de ellos metotrexato, y un 21% tratamiento combinado con más de un FAME. El coste medio anual para tratar una AR con fármacos exclusivos para artritis fue de 342,8 € sin el empleo de fármacos anti-TNF, aunque con amplias variaciones (6,47- 2.910 €). Con la inclusión de fármacos para enfermedades concomitantes, gastroprotección y aquellos que usan anti-TNF el coste anual por paciente fue de 2.587 €.
En este sentido, en un reciente estudio se estimó el coste del tratamiento de los pacientes con AR y también se observó que la terapia anti-TNF conlleva un elevado coste [34]. Así, el coste farmacológico anual por paciente se estimó en 11.849 € si recibían terapia anti-TNF, y en 1.000 € si eran tratados con Metoject®. Es interesante resaltar que el tratamiento temprano y adecuado de la AR con FAMEs tales como el metotrexato retrasa el uso de anti-TNF [13], lo cual puede reducir considerablemente la carga económica asociada a la enfermedad.
Crespo et al. [34] realizaron un estudio farmacoeconómico en el que compararon la eficiencia de utilizar el metotrexato subcutáneo (Metoject ®) con respecto al metotrexato oral en el manejo de pacientes con AR en España. El modelo estimó la efectividad a largo plazo del tratamiento de la AR en función de los datos de la literatura y de la opinión de expertos, y se combinó con información de los costes en España. Los resultados del estudio demostraron que la razón de coste (sólo costes farmacológicos) por año de vida ajustado por calidad (AVAC) ganado con Metoject® fue de 25.173 € a 35.807 € a los 5 años y de 19.056 € a 25.351 € para toda la vida. Al tener en cuenta los costes directos de la AR se observó que el coste-efectividad a los 5 años fue de 29.682 a 42.175 €/AVAC ganado y para toda la vida fue de 22.514 a 29.848 €/ AVAC ganado. Por tanto, los costes adicionales de Metoject® respecto a metotrexato oral se ven compensados por su mejora en efectividad, expresada en términos de AVAC, revelando que Metoject® es un tratamiento eficiente para la AR en el Sistema Nacional de Salud. El análisis de sensibilidad del estudio mostró que el 68%, 77% y 87% de los casos tratados con Metoject® estaban por debajo de los umbrales de costeefectividad de 30.000 €, 35.000 € y 45.000 €/AVAC ganado, respectivamente. Consecuentemente, Metoject® es un medicamento eficiente según los cánones establecidos (figura 3).
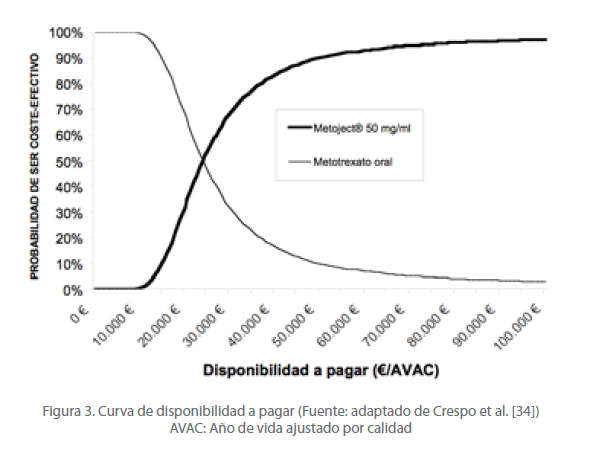
Figura 3. Curva de disponibilidad a pagar (Fuente: adaptado de Crespo et al. [34]) AVAC: Año de vida ajustado por calidad
Recientemente se ha llevado a cabo en España una aproximación económica que ha intentado enfatizar las ventajas de leflunomida respecto a Metoject® [35]. Sin embargo, el diseño de este estudio y los supuestos en los que se basaba presentaban ciertas limitaciones que fueron criticadas posteriormente en una carta al editor [36]. Así, se evidenció que la eficacia de Metoject® es mayor que la de metotrexato oral y, por tanto, es inviable equiparar sus eficacias para compararlo con leflunomida [27,29,30]. Por otro lado, como los costes adicionales de Metoject ® respecto a metotrexato oral se ven compensados por su mejora en efectividad, cabe esperar que esto mismo ocurra si comparásemos Metoject® respecto a leflunomida.
Recomendaciones de la Sociedad Española de Reumatología y repercusiones sobre la evolución del mercado de los metotrexatos
Hasta el presente año 2010 en el mercado español se disponía de metotrexato oral 2,5 mg, metotrexato vial 25 mg/ml y la jeringa precargada de Metoject® 10 mg/ml. En la figura 4 se detallan las ventas en mg/año de las distintas formas de metotrexato desde el año 2000 al año 2009 [37]. Las ventas totales de metotrexato fueron creciendo de forma constante hasta el año 2008 y se estabilizaron en el año 2009. La causa de el constante aumento de las ventas de metotrexato hasta el año 2008 puede haber sido el cada vez mayor protagonismo de este fármaco en el tratamiento de la AR, tal como se observa en las sucesivas actualizaciones del consenso de la Sociedad Española de Reumatología (SER) sobre terapia biológica en la AR [38] publicadas en los años 2002 [39], 2004 [40], 2006 y[13] 2010 [41].
El primer consenso de la SER [38] sobre la terapia con inhibidores del TNF en la AR resaltó la necesidad de iniciar el tratamiento utilizando al menos dos de los FAME más relevantes (en monoterapia o terapia combinada) y sólo se debía cambiar al tratamiento con anti-TNF si el paciente no respondía a los FAME o existía toxicidad a ellos. Además, recomendaba que uno de los FAME fuese el metotrexato por su rapidez de acción, buena eficacia y tolerabilidad. Por otro lado, el consenso sugería que se evitase el uso indiscriminado de anti-TNF por su elevado coste y por la falta de un conocimiento amplio de sus posibles efectos secundarios al administrarlos de forma prolongada.
Posteriormente, la primera actualización del consenso de la SER en el año 2002 [39] enfatizó la importancia de instaurar el tratamiento con FAME lo antes posible para evitar la progresión de la enfermedad. Asimismo, se recomendaba que en caso de que la terapia con metotrexato oral fuese ineficiente, el clínico considerase, por su mayor biodisponibilidad, la posibilidad de su administración por vía subcutánea [42]. El consenso también resaltó la necesidad de comprobar que el paciente hubiese sido tratado correctamente antes de iniciar el tratamiento con anti-TNF.
No fue hasta la segunda actualización del consenso de la SER en el año 2004 [40] donde se destacó que, aunque los fármacos anti-TNF podían administrarse en monoterapia, varios estudios controlados doble ciego con etanercept e infliximab indicaban que ambos eran más eficaces cuando se administraban junto con metotrexato a dosis altas (15 a 20 mg semanales) [43,44]. Además, también recomendaban asociar adalimumab con metotrexato. Por otro lado, si un agente anti-TNF se utilizaba en monoterapia, antes de cambiar a otro anti-TNF se debía considerar la posibilidad de añadir al tratamiento metotrexato en escalada rápida de dosis. La combinación de antagonistas del TNF con metotrexato a dosis terapéuticas era la pauta más aconsejable en este consenso, a no ser que el paciente presentase toxicidad o intolerancia al metotrexato. Por tanto, es a partir del año 2004 cuando la SER recomienda el uso de metotrexato tanto en las etapas iniciales de la AR como durante la evolución de la enfermedad, ampliando así su recomendación de uso de manera muy importante (figura 4).
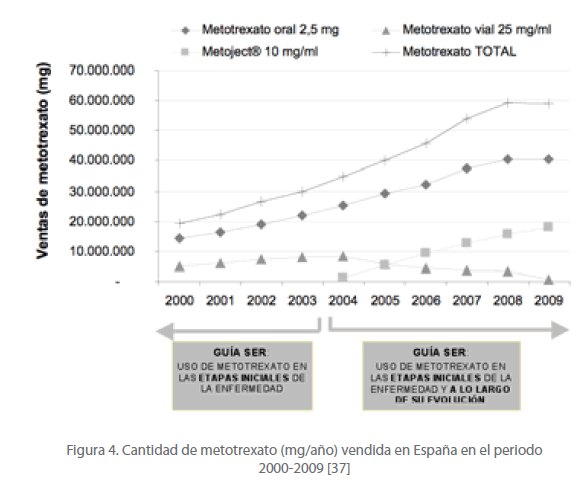
Figura 4. Cantidad de metotrexato (mg/año) vendida en España en el periodo 2000-2009 [37].
La tercera actualización del consenso de la SER en el año 2006 [13] añadió que estudios controlados en pacientes con AR de inicio reciente habían demostrado que el tratamiento precoz con cualquier anti-TNF, especialmente si se combinaba con metotrexato, era capaz de inducir remisión duradera en una proporción de pacientes considerable, así como evitar el desarrollo de lesiones radiográficas o de detener su progresión [45-47]. Además, el consenso contemplaba la posibilidad de iniciar directamente el tratamiento con un agente anti-TNF en combinación con metotrexato, o en monoterapia en caso de contraindicación a este último, en pacientes con AR de inicio reciente en quienes se sospechase una evolución especialmente agresiva [18].
Recientemente se ha publicado la última actualización del consenso de la SER en la que se reafirman las recomendaciones de los consensos anteriores aportando nuevas evidencias clínicas [41]. Así, por ejemplo, resaltan que en caso de ser necesario el uso de terapia anti-TNF, la combinación de ésta junto a metotrexato es la pauta más aconsejable; y que no existen estudios controlados que demuestren que la combinación de un FAME distinto de metotrexato y anti-TNF mejore la eficacia de éstos. Por otro lado comentan que, en pacientes con AR de inicio, rituximab en combinación con metotrexato es superior al metotrexato en monoterapia, aunque dicha indicación no está aprobada en Europa [48]. Asimismo, en los pacientes con respuesta insuficiente a metotrexato, la combinación de éste con abatacept es superior desde el punto de vista clínico y radiológico al metotrexato en monoterapia (no obstante, abatacept no está indicado como terapia biológica de primera línea en Europa) [49]. Y, en los pacientes con respuesta insuficiente a los anti-TNF, abatacept combinado con metotrexato se ha demostrado clínicamente superior al metotrexato en monoterapia [50].
Por tanto, el consenso de la SER ha ido modificando el posicionamiento de metotrexato en el tratamiento de la AR, y actualmente recomiendan el uso de metotrexato no sólo en los estadios iniciales de la enfermedad sino también a lo largo de toda su evolución.
Conclusiones
1. La AR disminuye la calidad de vida de los pacientes y aumenta la morbimortalidad, conllevando una elevada carga social y económica.
2. En el tratamiento de la AR los FAME (entre ellos metotrexato) suelen prescribirse inicialmente junto con los AINEs y los glucocorticoides. El tratamiento inicial con anti-TNF más metotrexato está justificado en pacientes con inicio reciente en los que se sospeche una evolución especialmente agresiva. Las guías actuales recomiendan el uso del FAME metotrexato no sólo en los estadios iniciales de la AR sino a lo largo de toda la evolución de la enfermedad debido a su elevada eficacia y rapidez de acción.
3. La administración subcutánea de metotrexato presenta ventajas respecto a su administración intramuscular y es más eficaz que metotrexato oral.
4. Las jeringas precargadas de metotrexato (Metoject®) presentan las siguientes ventajas:
• Metoject® disminuye el riesgo de contaminación ambiental y del trabajador con metotrexato, que es un agente citotóxico.
• La existencia de diversas dosificaciones de Metoject® evita errores enla administración de la cantidad de fármaco.
• Los costes adicionales de Metoject® respecto a metotrexato oral se ven compensados por su mejora en efectividad, revelando que Metoject ® es un tratamiento de la AR eficiente para el Sistema Nacional de Salud.
5. La nueva presentación de Metoject® 50 mg/ml, 5 veces más concentrada, presenta las siguientes ventajas respecto a Metoject® 10 mg/ ml:
• Aumenta la comodidad del paciente.
• La biodisponibilidad de Metoject® 50 mg/ml es equivalente a la de Metoject® 10 mg/ml (98%) y presenta una buena tolerabilidad local.
• El 93% de los pacientes prefieren ser tratados con Metoject® 50 mg/ml en lugar de Metoject® 10 mg/ml.
• La manejabilidad de la jeringa es valorada como significativamente mejor con Metoject® 50 mg/ml que con Metoject® 10 mg/ml, tanto desde el punto de vista del paciente como de los médicos o enfermeras.
823
References
- Gaffo A, Saag KG, Curtis JR. Treatment of rheumatoid arthritis. Am J Health Syst Pharm 2006;63:2451-65.
- Sherrer YS, Bloch DA, Mitchell DM, Young DY, Fries JF. The development of disability in rheumatoid arthritis. Arthritis Rheum 1986;29:494-500.
- Plant MJ, Jones PW, Saklatvala J, Ollier WE, Dawes PT. Patterns of radiological progression in early rheumatoid arthritis: results of an 8 year prospective study. J Rheumatol 1998;25:417-26.
- Andréu JL, Silva L, Sanz J, Muñoz P. Optimización del tratamiento clásico de la artritis reumatoide. Reumatol Clin 2006;2(Suppl 2):S1-8.
- Carmona L, Villaverde V, Hernandez-Garcia C, Ballina J, Gabriel R, Laffon A. The prevalence of rheumatoid arthritis in the general population of Spain. Rheumatology 2002;41:88–95.
- Carbonell J, Cobo T, Balsa A, Descalzo MA, Carmona L; SERAP Study Group. The incidence of rheumatoid arthritis in Spain: results from a nationwide primary care registry. Rheumatology (Oxford) 2008;47:1088-92.
- Gabriel SE, Crowson CS, O’Fallon WM. Mortality in rheumatoid arthritis: have we made an impact in 4 decades? J Rheumatol 1999;26:2529-33.
- Brooks PM. Rheumatoid arthritis: aetiology and clinical Features. Medicine 2006;34:379-82.
- Sociedad Española de Reumatología (SER). Actualización de la guía de práctica clínica para el manejo de la artritis reumatoide en España. 2007. Disponible en URL: https://www.ser.es.
- Blumberg SN, Fox DA. Rheumatoid arthritis: guidelines for emerging therapies. Am J Manag Care 2001;7:617-26.
- Ruiz-Montesinos MD, Hernández-Cruz B, Ariza-Ariza R, Carmona L, Ballina J, Navarro-Sarabia F, et al. Análisis de costes en una cohorte de enfermos con artritis reumatoide atendidos en área especializada de reumatología en España. Reumatol Clin 2005;1:193-9.
- Rodríguez-Valverde V, Cáliz-Cáliz R, Álvaro-Gracia Álvaro JM, Marenco de la Fuente JL, Mulero Mendoza J, Tornero Molina J, et al. III Actualización del Consenso de la Sociedad Española de Reumatología sobre terapia biológica en la artritis reumatoide. Reumatol Clin 2006;2 (Suppl2):S52-9.
- Aletaha D, Smolen JS. The rheumatoid arthritis patient in the clinic: comparing more than 1,300 consecutive DMARD courses. Rheumatology (Oxford) 2002;41:1367-74.
- Anderson JJ, Wells G, Verhoeven AC, Felson DT. Factors predicting response to treatment in rheumatoid arthritis: the importance of disease duration. Arthritis Rheum 2000;43:22-9.
- Wolfe F, Hawley DJ, Cathey MA. Termination of slow acting Antirheumatic therapy in rheumatoid arthritis: a 14-year prospective evaluation of 1017 consecutive starts. J Rheumatol 1990;17:994–1002.
- de la Mata J, Blanco FJ, Gomez-Reino JJ. Survival analysis of disease modifying antirheumatic drugs in Spanish rheumatoid arthritis patients. Ann Rheum Dis 1995;54:881–5.
- Smolen JS, Van der Heijde DM, St.Clair EW, Emery P, Bathon JM, Keystone E, et al. Predictors of joint damage in patients with early rheumatoid arthritis treated with high-dose methotrexate with or without concomitant infliximab. Arthritis Rheum 2006;54:702-10.
- Bathon JM, Martin RW, Fleischmann RM, Tesser JR, Schiff MH, Keystone EC, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. N Engl J Med 2000,343:1586-93.
- Breedveld FC, Weisman MH, Kavanaugh AF, Cohen SB, Pavelka K, van Vollenhoven R, et al. The PREMIER study: A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006,54:26-37.
- St Clair EW, van der Heijde DM, Smolen JS, Maini RN, Bathon JM, Emery P, et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: a randomized, controlled trial. Arthritis Rheum 2004;50:3432-43.
- Arthur V, Jubb R, Homer D. A study of parenteral use of methotrexate in rheumatic conditions. Journal of Clinical Nursing 2002;11:256-63.
- Brooks PJ, Spruill WJ, Parish RC, Birchmore DA. Pharmacokinetics of methotrexate administered by intramuscular and subcutaneous injections in patients with rheumatoid arthritis. Arthritis Rheum 1990;33:91-4.
- Zackheim HS. Subcutaneous administration of methotrexate. J Am Acad Dermatol 1992;26:1008.
- Balis FM, Mirro J, Reaman GH, Evans WE, McCully C, Doherty KM, et al. Pharmacokinetics of subcutaneous methetrexate. J Clin Oncol 1988;6:1882-6.
- Hoekstra M, Haagsma C, Neef C, Proost J, Knuif A, van de Laar M. Bioavailability of higher dose methotrexate comparing oral and subcutaneous administration in patients with rheumatoid arthritis. J Rheumatol 2004;31:645-8.
- Braun J, Kästner P, Flaxenberg P, Währisch J, Hanke P, Demary W, et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis: results of a six-month, multicenter, randomized, double-blind, controlled, phase IV trial. Arthritis Rheum 2008;58:73-81.
- Nathan DM, Iser JH, Gibson PR. A single center experience of methotrexate in the treatment of Crohn’s disease and ulcerative colitis: a case for subcutaneous administration. J Gastroenterol Hepatol 2008;23:954-8.
- Hameed B, Jones H, Hunt K. Subcutaneous methotrexate is superior to oral methotrexate in the treatment of rheumatoid arthritis. SAT0129. Ann Rheum Dis 2009;68:584.
- Keidel SM, Chan A. Parenteral methotrexate use in patients with chronic rheumatoid arthritis is effective and produces a lasting response. SAT151. Ann Rheum Dis 2009;68 (Suppl 3):592.
- Ley 31/95 de 8 de noviembre, de Prevención de Riesgos Laborales. (Boletín Oficial del Estado, número 269, de 10-11-95).
- Müller-Ladner U, Rockwitz K, Brandt-Jürgens J, Haux R, Kästner P, Braun J, et al. Tolerability and Patient/Physician Satisfaction with Subcutaneously Administered Methotrexate Provided in Two Formulations of Different Drug Concentrations in Patients with Rheumatoid Arthritis. Open Rheumatol J 2010;4:15-22.
- Mera A, Blanco J, Caamaño M. Aproximación al coste de tratamiento farmacológico de la artritis reumatoide en España. An Med Interna 2003;20:114-21.
- Crespo C, Brosa M, Galván J, Carbonell J, Maymó J , Marenco JL, et al. Análisis farmacoeconómico de Metoject® en el tratamiento de la artritis reumatoide en España. Reumatol Clin 2010. doi:10.1016/j.reuma.2009.11.001.
- García Ruiz JA, Montesinos Gálvez AC, Pérez Costillas L, Rebollo P. Comparación de leflunomida y metotrexato subcutáneo en el tratamiento de la artritis reumatoide: una aproximación basada en el número de pacientes que es necesario tratar. Reumatol Clin 2009;5:66–70.
- Galván J. Estudio coste-efectividad de leflunomida frente a metotrexato. Reumatol Clin 2009;5:291-2.
- Álvaro-Gracia JM, Andreu JL, Batlle E, Carreño L, Figueroa M, Gómez JJ, et al. Consenso de la Sociedad de Reumatología sobre la terapia con inhibidores de TNF en la artritis reumatoide. Rev Esp Reumatol 2000;27:352-4.
- Álvaro-Gracia JM, Andreu JL, Ballina FJ, Batlle E, Cáliz R, Carbonell J, et al. Actualización del consenso de la Sociedad Española de Reumatología sobre la terapia con agentes inhibidores del TNF en la artritis reumatoide. Rev Esp Reumatol 2002;29:51-5.
- Rodríguez-Valverde V, Álvaro-Gracia JM, Andreu JL, Batlle E, Tornero J. Segun- Aceptado tras revision externa










