Palabras clave
Escherichia coli, patogenicidad, plásmidos de patogenicidad, resistencia al complemento, plásmido ColV iss+.
Material and Methods
Detection of gen iss was performed by amplification of a gene fragment by PCR. The bactericidal effect of the serum was analyzed by bacterial viability assays RS4 (ColV iss+) and its isogenic strain plsmidos cured RS4 (ColV-) in the presence of supplemented serum, also decomplemented serum. The results showed that the wild strain iss+ RS4 ColV showed greater resistance to the bactericidal action of complement regarding RS4 ColV- cured isogenic, suggesting that this effect is caused by the presence of plasmid ColV iss+.
Keywords
Escherichia coli, pathogenicity, pathogenicity plasmids, complement resistance, plasmid ColV iss+.
Introducción
El sistema del complemento tiene un papel central en la resistencia contra infecciones microbianas participando tanto en la inmunidad innata como en la inmunidad adquirida. La acción de defensa del complemento ocurre a través de diferentes formas, entre las más importantes están la opsonización de los microorganismos facilitando la fagocitosis y la formación de lesiones en el agente blanco a través del complejo de ataque a la membrana. La excesiva activación del complemento es inhibida por proteínas regulatorias las cuales protegen al huésped del ataque de su propio complemento [1].
Por su parte, las bacterias patogénicas tienen capacidad de contrarrestar las defensas inmunes del hospedero y establecer así una infección. En particular los mecanismos de resistencia al complemento se han clasificado en tres amplias clases: a) Factores microbianos que protegen contra la muerte media da por el complemento por inactivación enzimática de una o más proteínas componentes del sistema del complemento. b) Producción microbiana de estructuras homólogas a proteínas del hospedero que regulan la actividad del complemento o producción de superficies bacterianas con capacidad de modular este sistema. c) Barreras físicas tales como estructuras bacterianas que ayudan a evadir el sistema inmune previniendo la muerte mediada por el complemento [1].
Escherichia coli patogénica, ocasiona diversas enfermedades en humanos y en animales domésticos, estas enfermedades pueden ser intestinales o extra-intestinales. En las aves E. coli ocasiona una enfermedad respiratoria o aerosacultistis que puede complicarse y causar una infección generalizada llamada colisepticemia la cual provoca grandes pérdidas económicas en la industria avícola a nivel mundial debido a la mortalidad y morbilidad [2]. Escherichia coli patogénica aviar (APEC por sus siglas en inglés) tiene diferentes factores de virulencia, incluyendo aquellos que confieren capacidad de adherirse al tracto respiratorio, los que permiten la multiplicación bacteriana a través de la expresión de sideróforos de hierro, los relacionados con la actividad anti-fagocítica y los que confieren resistencia al complemento [3, 4].
Diversas estructuras en APEC han sido asociadas a la resistencia a la acción bactericida del suero, entre ellas la cápsula K1, el Lipopolisacárido (LPS) y varias proteínas de membrana externa como OmpA, Trat, Iss [5, 6, 7]. Algunos estudios han asociado la resistencia al suero mediado por Iss con la virulencia [8, 9].
Por otra parte, algunas cepas APEC pueden contener el plásmido ColV, el cual además de codificar para la colicina V, puede portar diferentes genes asociados la patogenicidad, confiriendo virulencia en las cepas que portan este plásmido [10]. Esteplásmido es altamente heterogéneo en tamaño, capacidad conjugativa, patrones de restricción y los genes que posee. Johnson et al. [11] secuenciaron y analizaron el plásmido pAPECO2ColV y encontraron que tiene una isla de virulencia de 93 kDa conteniendo a iss entre otros genes. El objetivo de este trabajo fue detectar la presencia del gen iss en el plásmido ColV de una cepa APEC y determinar su participación en la resistencia a la acción lítica del complemento.
Material y Métodos
Cepas bacterianas: Se utilizó la cepa de E. coli patogénica aviar RS4 (APEC-RS4) aislada de pulmón de un pollo con colisepticemia. En las pruebas de colicinogenia se utilizaron como cepas control E. coli K12 711 sensible a todas las colicinas y E. coli B188 mutante resistente a la colicina V.
Detección fenotípica del plásmido ColV: APECRS4 se sembró en aislamiento en cultivo puro en agar MacConkey, incubando 18 h a 37°C, se seleccionaron colonias aisladas que se clonaron por triplicado, una en agar MacConkey y dos de agar LTC (Extracto de levadura-triptona-calcio) y se incubaron por 18 h a 37°C. Posteriormente, los cultivos de las placas de LTC se inactivaron con vapores de cloroformo durante 15 min y se dejaron airear por 15 min. A cada una de estos se le agregó una capa de 4.5 ml de LTC semisólido licuado conteniendo 0.1 ml de cada una de las cepas indicadoras de colicinogenia respectivamente que fueron crecidas previamente en caldo nutritivo por 18 h. La lectura de los resultados se realizó en base a los halos de inhibición de crecimiento.
Aislamiento de DNA plasmídico: Se utilizó el método de lisis alcalina con algunas modificaciones [12]. Brevemente, APEC-RS4 se inoculó en 7 ml de caldo Luria y se incubó en agitación por 18 h a 37°C, posteriormente se centrifugó a 4500 rpm por 10 min y el paquete celular se resuspendió en 200 μL de GTE (50 Mm Glucosa, Tris-HCl 25 Mm pH 8, EDTA 100 Mm) y se dejó reposar 5 min, luego se agregaron 200 μL de NAOH /SDS (NaOH 0.2 N, 1% peso /vol/ SDS) se mezcló y se colocó sobre hielo 5 min, enseguida se le agregaron 200 μL de acetato de potasio 5 M, se mezcló y se centrifugó 10 min a 12000 rpm y se recuperó el sobrenadante a partir del cual se hicieron dos extracciones agregando un volumen igual de fenol-cloroformo-alcohol isoamílico (24:24:1 vol/vol), luego se mezcló por inversión y se dejó reposar en hielo 1 min y se centrifugó a 12000 rpm 5 min. Se recuperó la fase acuosa y el DNA cromosómico se precipitó con 240 μL de NaCl 5 M manteniendo en hielo durante 2 h, pasado este tiempo se centrifugó a 12000 rpm por 10 min y el sobrenadante se transfirió a un tuboal cual se agregó 1 ml de etanol absoluto frío incubando a -20 °C por 30 min. Luego se centrifugó a 12000 rpm y el tubo se invirtió sobre papel secante, una vez evaporados los restos de etanol el DNA plasmídico se resuspendió en buffer TE.
Cuantificación de DNA y electroforesis: La concentración y pureza del DNA se midió por densidad óptica (DO) a 260 y 280 nm. La integridad del DNA plasmídico se verificó por electroforesis en geles de agarosa al 0.9 % en buffer TAE visualizando las bandas obtenidas por tinción con bromuro de etidio.
Detección del gen iss en el plásmido ColV: Se realizó por la técnica de reacción en cadena de la polimerasa utilizando oligonucleótidos específicos: Directo: 5’ cagcaacccgaaccacttgatg 3’ y Reverso: 5’ agcattgccagagcggcagaa 3’, para la amplificación de un producto de 323 pb del gen iss. Se utilizó un kit comercial (Sigma Chemical) con las siguientes mezclas de reacción de 5 μl de buffer PCR 10x, 200 μM de cada DNTP, 0.5 μM de cada uno de los iniciadores, 50 ng de DNA plasmídico y 0.05 U/μl de DNA Taq polimerasa en un volumen final de 50 μl. Las etapas del proceso de amplificación fueron: 94°C por 4 min, seguida 30 ciclos a 94°C por 1 min, 59°C por 1min, 72°C por 2 min y la extensión final a 72°C por 10 min. Los productos de amplificación se verificaron por electroforesis en geles de agarosa al 2%.
Curación de plásmidos: Se utilizó como agente curante el dodecil sulfato de sodio (SDS). APEC-RS4 se sembró en 1ml de caldo nutritivo, se incubó a 37°C durante 18 h. Posteriormente se obtuvieron alícuotas de 50 μl de este cultivo las cuales se inocularon en 5 ml de caldo nutritivo-10% SDS, nuevamente se incubó a 37°C durante 18 h en condiciones estáticas, luego se hicieron diluciones decimales en una solución buffer de fosfatos (PBS), de las cuales se sembraron 100 μl en agar MacConkey y se incubaron bajo las mismas condiciones. A partir de colonias aisladas se realizó la prueba de la colicinogenia para corroborar la pérdida del plásmido ColV.
Obtención de complemento: Se obtuvo a partir de suero de un pollo sano, el cual se separó por centrifugación se hicieron alícuotas de 1 ml que se mantuvieron en congelación hasta su uso.
Ensayos de resistencia al complemento: Se realizó de acuerdo al ensayo descrito por Nishio [13]. Brevemente, las cepas APEC-RS4 (ColV iss+)y su isogénica curada APEC-RS4 (ColV-), se sembraron en 1 ml de caldo LB 18 h a 37ºC, y se resembraron 200 μl en 5 ml de medio LB estéril y se incubaron durante 2.5 h en agitación a 37ºC, se ajustó a una D.O de 0.3 a 620 nm en medio de cultivo LB, se tomaron 500 μl de cada una de las suspensiones bacterianas y se agregaron 500 μl de suero de pollo, y se incubaron a 37ºC durante 0,15 y 30 min, una vez transcurrido cada lapso de tiempo se tomaron 100 μl de la muestra, se hicieron diluciones decimales y se sembraron agar MacConkey incubando por 18 h a 37ºC. Se cuantificaron las UFC/ml. El ensayo se realizó tres veces de manera independiente por duplicado.
Resultados
Curación de Plásmidos y análisis de Colicinogenia: APEC-RS4 produjo la colicina V, indicativo de la presencia del plásmido ColV. Después del proceso de curación de plásmidos se observó la pérdida de la producción de la colicina V (Fig. 1).
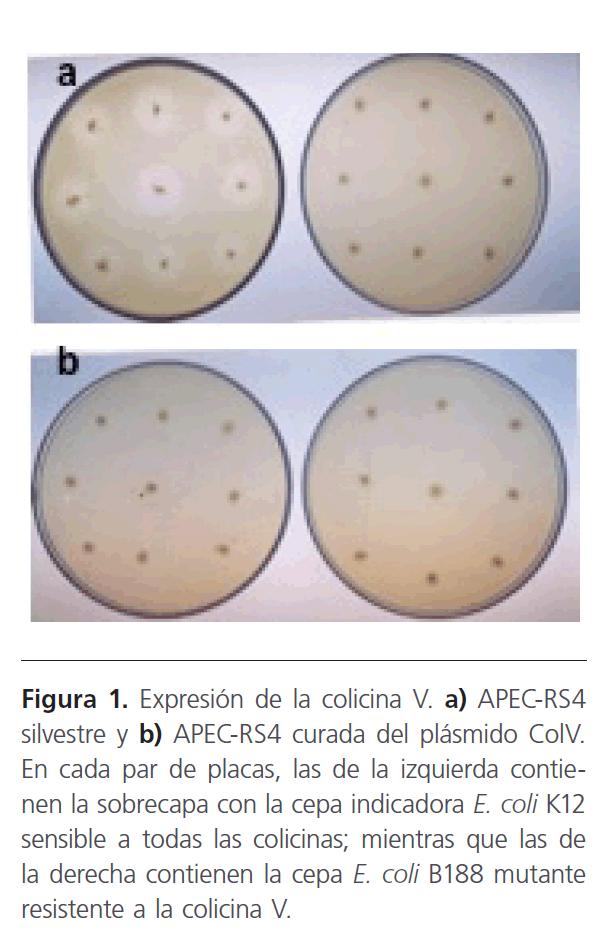
Figura 1: Expresión de la colicina V. a) APEC-RS4 silvestre y b) APEC-RS4 curada del plásmido ColV. En cada par de placas, las de la izquierda contienen la sobrecapa con la cepa indicadora E. coli K12 sensible a todas las colicinas; mientras que las de la derecha contienen la cepa E. coli B188 mutante resistente a la colicina V.
Detección del Geniss en APEC-RS4: Al realizar la reacción de PCR para el fragmento del gen iss a partir del DNA plasmídico de APEC-RS4 se observó el producto de PCR esperado de 323 pb (Fig. 2).
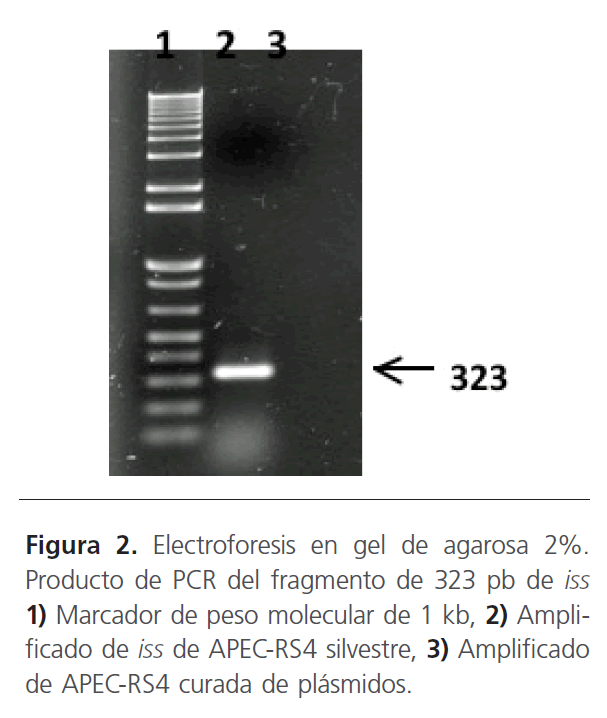
Figura 2: Electroforesis en gel de agarosa 2%. Producto de PCR del fragmento de 323 pb de iss 1) Marcador de peso molecular de 1 kb, 2) Amplificado de iss de APEC-RS4 silvestre, 3) Amplificado de APEC-RS4 curada de plásmidos.
Analisis de Resistencia a la acción bactericida del Complemento
De acuerdo a los ensayos de viabilidad celular APECRS4 ColV iss+ mostró mayor resistencia al suero de pollo que su isogénica curada APEC-RS4 ColV- (Fig. 3).
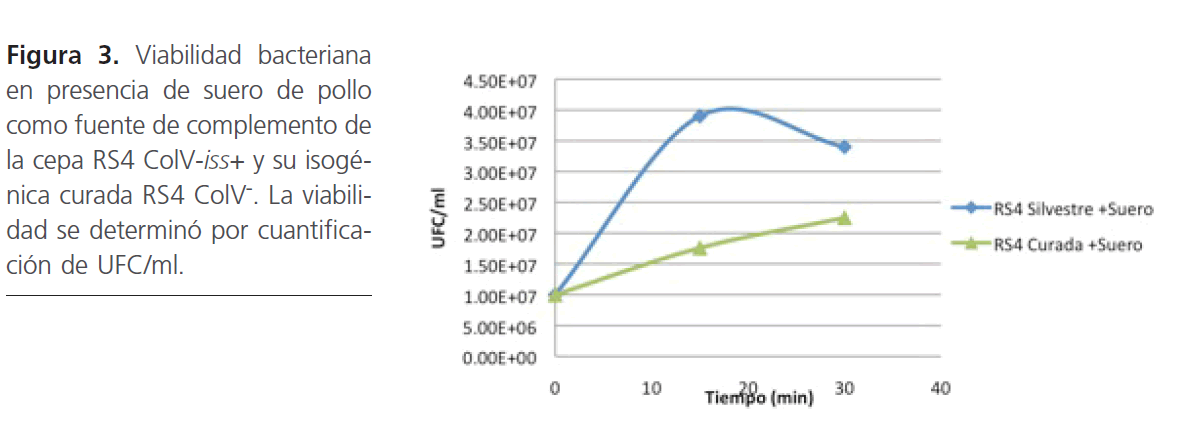
Figura 3: Viabilidad bacteriana en presencia de suero de pollo como fuente de complemento de la cepa RS4 ColV-iss+ y su isogénica curada RS4 ColV-. La viabilidad se determinó por cuantificación de UFC/ml.
Discusión
Las bacterias poseen diversos mecanismos de resistencia a la acción del complemento, en este trabajo se analizó la participación del plásmido ColV que porta el gen iss de la cepa silvestre APEC-RS4 en la resistencia a la acción lítica del complemento mediante un ensayo de viabilidad bacteriana, tomando como antecedente los trabajos previos que demuestran la participación de Iss en este evento [8,9].
El plásmido ColV está implicado con el aumento de la virulencia y diversos estudios asocian la virulencia con la capacidad de resistencia a la acción bactericida del suero determinada por este plásmido [14]. Se ha reportado en una cepa APEC la presencia de una isla de patogenicidad en particular en el pAPEC-O2-ColV, esta región es fundamental en la virulencia y en ella se han localizado entre otros el gen iss [11]. En general, los microorganismos tienen mecanismos para resistir la acción del complemento en los que se incluye la inactivación enzimática de proteínas componentes del sistema del complemento, la producción microbiana de estructuras homólogas a proteínas del huésped que regulan la actividad del complemento y la presencia de estructuras bacterianas que actúan como barreras espaciales y físicas que previenen la muerte mediada por el complemento. En las enfermedades ocasionadas por Escherichia coli patogénica aviar, es indiscutible que la bacteria evade los mecanismos de defensa inmune presentes en los diferentes microambientes dentro del huésped para sobrevivir y proliferar.
El hallazgo más importante de este trabajo es que la cepa APEC-RS4 pColV iss+ mostró ser más resistentes a la acción del suero en comparación con la cepa isogénica curada del plásmido ColV de acuerdo a los ensayos de viabilidad celular; lo que sugiere que la resistencia bacteriana al suero es mediada por la presencia del plásmido ColV iss+ ya que en el análisis comparativo se utilizó la cepa isogénica curada del plásmido ColV (ColV-) sin capacidad de sintetizar colicina V. Esto indica un papel fundamental de este plásmido en la resistencia a la acción bactericida del suero.
Será importante en un futuro realizar estudios detallados que nos permitan definir el mecanismo exacto por el cual Iss media la resistencia al complemento ya que hasta el momento solo se ha sugerido que estas proteínas bloquean las etapas finales del complejo de ataque de membrana preferentemente que su formación [15].
Además la presencia de iss y de su producto de expresión podrían utilizarse como marcadores en la detección de cepas patogénicas [16,17] y en la diferenciación de éstas y de E. coli de biota normal, lo que significaría que la técnica de amplificación podría aprovecharse para tal fin.
Conclusiones
El plásmido ColV que contiene el gen iss de la cepa APEC-RS4 pColV confirió resistencia a la acción bactericida del suero de pollo, de acuerdo a los análisis de viabilidad bacteriana cuando esta se comparó con la cepa isogénica curada del plásmido ColV.
505
References
- Pier, GB., Jeffrey, BL., Wetzler, LM. Innata Immunity. Immunology, infection and immunity. Ed. ASM. 2004; pp. 29-32.
- Dho-Moulin, M., Fairbrother, JM. Avian pathogenic Escherichia coli (APEC). Vet Res. 1999; 30: 299-316.
- Pluschke, G., Mayden, A., Levine, R. Role of the capsule and the O antigen in resistance of O18: K1 Escherichia coli to complement-mediated killing. Infect Immun. 1983; 42: 907- 913.
- La Regione, R., Woodward, M. Virulence factors of Escherichia Coli serotypes associated with avian colisepticemia. Res Vet Sci. 2002; 73: 27-35.
- Chaffer, M., Heller, E., Schwartzberg, B. Relationship between resistance to complement, virulence and outer membrane proteins patterns in pathogenic EscherichiacoliO2 isolates. Vet Microbiol. 1999; 64: 323-332.
- MacPeake, S., Smyth, J., Ball, H. Characterization of avian pathogenic Escherichia coli (APEC) associated with colisepticemia compared to fecal isolates from healthy birds. Vet Microbiol. 2005; 110: 245-253.
- Rodriguez-Siek, K., Giddings, C., Doetkott, C., Jonhson, T., Nolan, L. Characterizing the APEC pathotype. Vet Res. 2005; 36: 241-256.
- Mellata, M., Dho-Moulin, M., Dozois, C., Curtiss III, R., Brown, P., Arne, P., Breee, A., Desaultes, C., Fairbrother, J. Role of virulence factors in resistance of avian pathogenic Escherichia coli to serum and pathogenicity. Infect Immun. 2003; 71: 536- 540.
- Nolan, L., Horne, S., Giddings, C., Foley, S., Johnson, T., Lynne, A., Skyberb, J. Resistance to serum complement, issand virulence of avian Escherichia coli. Vet Res. 2003; 27: 101-110.
- Clancy, J., Savage, C. Another colicin V phenotype: in vitro adhesion of Escherichia coli to mouse intestinal epithelium. Infect Immun. 1981; 32: 343-350.
- Jonshon, J., Siek, E., Jonshon, J., Nolan, K. DNA sequence of a ColV plasmid and prevalence of selected plasmid-encoded virulence genes among avian Escherichia coli strain. J Bacteriol. 2006; 188: 745-758.
- Engeonrecht, J., Brent, R., Kaderbhai, M. Escherichia coli, plasmid and bacteriophages. Current Protocols in Molecular Biology. Ed John Wiley. New York, 1993.
- Nishio, M., Okada, N., Miki, T., Haneda, T., Hirofumi, D. Identification of the outer-membrane protein PagC required for the serum resistance phenotype in Salmonella enteric serovarcholeraesuis. Microbiol. 2005; 151: 863-873.
- Tivendale, K., Allen, J., Ginns, C., Crabb, B., Browning, G. Association of is sans iucA, but nor tsh with plasmid mediates virulence of avian pathogenic Escherichia coli. Infect Immun. 2004; 72: 6554-6560.
- Binns, MM.,Mayden, J., Levine, RP. Further characterization of complement resistance conferred on Escherichia coli by the plasmid genes traT of R100 and iss of ColV, I-K94. Infect Immu. 1982; 35: 654-659.
- Johnson, J., Wannemuehler, M., Nolan, L. Evolution of the iss gene in Escherichia coli. Appl Environ Microbiol. 2008; 74: 2360-2369.
- Lynne, A., Steven, L., Nolan, L. Immune Response to Recombinant Escherichia coli Iss Protein in Poultry. Avian Dis. 2006; 50: 273- 276.








