Keywords
Enterocolitis; Colitis; Typhlitis; Cancer; Neutropenia; Child
Introducción
La enterocolitis neutropénica (EN) también llamada tiflitis, síndrome ileocecal o enteropatía necrozante, es una enfermedad inflamatoria que involucra el íleon terminal, ciego, con o sin compromiso del colón y con alto riesgo de necrosis y perforación [1,2]. Por consenso [3] el término más correcto es el de enterocolitis neutropénica, dado que describe la localización, que no es exclusiva del ciego así como la patogenia del proceso. Se caracteriza por fiebre, dolor abdominal y aumento del grosor de la pared intestinal en el contexto del paciente neutropénico. Se ha descrito típicamente en pacientes con leucemias después de la quimioterapia. Sin embargo, se ha encontrado en otras condiciones como linfomas, mieloma, anemia aplásica, SIDA, trasplante de médula ósea u órganos sólidos e incluso en el debut de procesos oncológicos antes de cualquier tratamiento [3].
Epidemiología
Actualmente hay pocos datos sobre la incidencia, factores de riesgo y pronóstico de la enterocolitis neutropénica en niños [4,5]. En Colombia se desconoce la incidencia de la enfermedad ya que los pocos estudios disponibles se limitan a la población adulta. Las series reportadas entre 1993-2009 describen incidencias entre 1.7%-16.2% (Tabla 1). Se espera que esta incidencia vaya en aumento por el uso creciente de regímenes de quimioterapia más intensivos, el aumento en la supervivencia de estos pacientes, y por la optimizaciòn de las estrategias diagnósticas (uso sistemático de ecografía y/o TAC abdominal). La incidencia varía según el tipo de neoplasia a tratarse. Se ha descrito màs frecuentemente en pacientes que reciben quimioterapia para leucemias agudas y menor incidencia en quienes recibieron quimioterapia para tumores sólidos [6]. En pediatría se ve con mayor frecuencia en la leucemia aguda, en especial de estirpe mieloide (40%-60%) [7-9], durante la terapia de inducción.
| Series de casos de Enterocolitis Neutropénica en Pediatría |
| Autor |
Casos |
Incidencia |
Mortalidad |
| Sloas et al.[12] |
24 |
11.60% |
8.30% |
| Schllater et al.[3] |
12 |
- |
8.30% |
| McCarville et al.[5] |
83 |
2.50% |
2.50% |
| Hobson et al. [1] |
8 |
1.70% |
- |
| Rizzati et al. [6] |
188 |
16.20% |
11.70% |
| Mullassery et al.[3] |
40 |
11.60% |
0% |
| Moran et al.[4] |
42 |
5% |
0% |
Tabla 1: Series de casos de Enterocolitis Neutropénica en pediatría.
La mortalidad descrita en las series publicadas hasta el 2009 oscila entre el 0-11.7% (Tabla 1) siendo màs frecuente en mujeres [10]. La principal causa de muerte se debe a perforación intestinal y sepsis [11].
Etiología
Dada la gran variedad de microrganismos que se han aislado, no se puede definir un agente causal específico, se podría considerar una probable etiología polimicrobiana. Katz y cols [1] reportaron bacteremia en 84% de los pacientes con EN y fungemia solo en el 16%. Moran y cols encontraron bacteremia en el 23% de los casos [4]. En pacientes intervenidos quirúrgicamente se han aislados bacilos Gram negativos, cocos Gram positivos, enterococos, Clostridium spp y citomegalovirus. Los hongos (Candida albicans y Aspergillus fumigatus) son causa de EN hasta en 6.2% de los casos [13,14].
Factores predisponentes
Moran y cols, en su serie de 42 pacientes encontraron que la EN fue más frecuente en aquellos pacientes con leucemia mieloide aguda y linfoma de Burkitt. Los factores de riesgo encontrados con mayor significancia estadística fueron: mucositis, historia de trasplante de médula ósea y antecedente de quimioterapia 2 semanas previas al evento [4]. En otras series, una edad mayor de 16 años al momento del diagnóstico de cáncer, también se consideró como factor de riesgo para EN [15].
A pesar que se ha buscado una asociación entre el tipo de Quimioterapia recibida y la aparición de EN no se ha logrado demostrar en ninguna serie una asociación estadísticamente significativa con ningún medicamento [16].
Fisiopatología
El ciego es la porción del intestino que más frecuentemente se afecta por su distensibilidad y flujo sanguíneo limitado [14,17], le siguen el colon ascendente y descendente, íleon y otras partes del intestino delgado (Figura 1) [11].
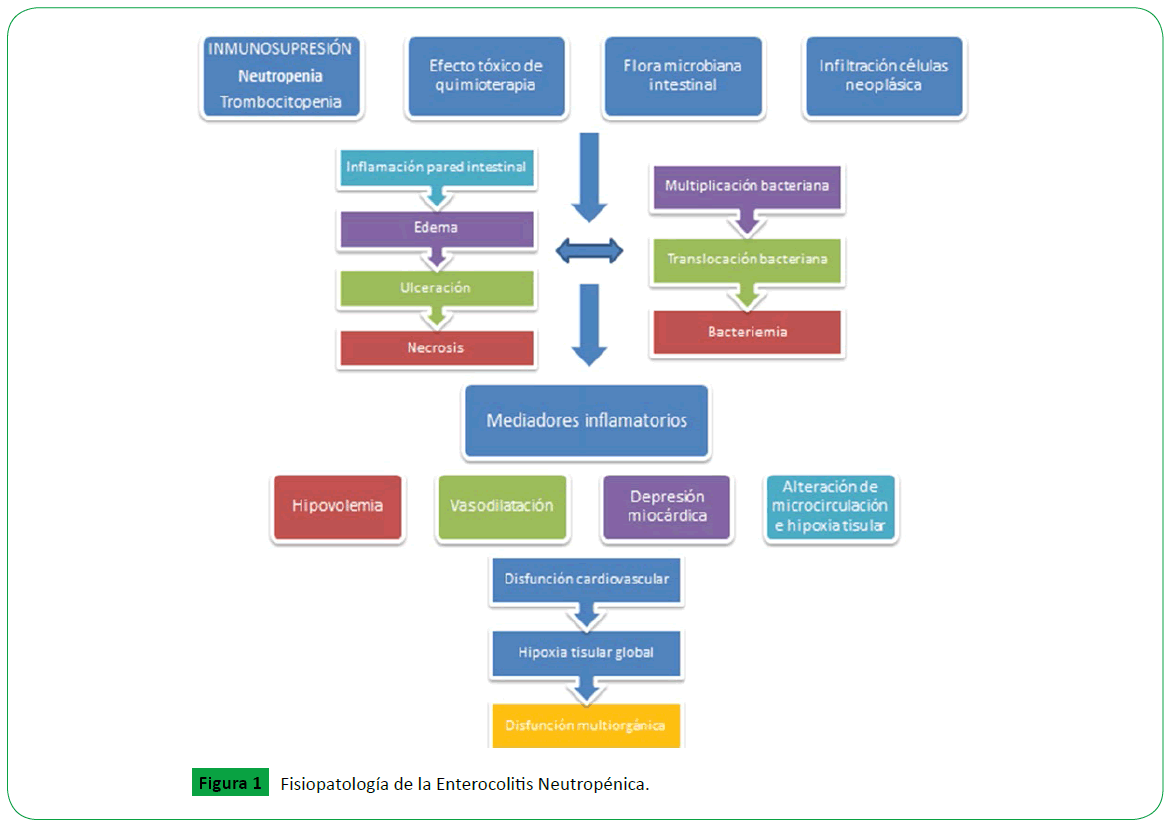
Figure 1: Fisiopatología de la Enterocolitis Neutropénica.
El desarrollo de la enfermedad parece resultar de la combinación de múltiples factores: los efectos citotóxicos de los fármacos quimioterápicos, neutropenia, trombocitopenia y en algunos casos infiltración neoplásica de la pared intestinal (que durante el tratamiento quimioterápico lleva a ulceración) pueden llevar a lesiòn que resulta en disrupción de la mucosa intestinal. Todos estos factores facilitan la multiplicación de bacterias y producción de endotoxinas a nivel local, con subsecuente bacteremia, necrosis y hemorragia [18].
Macroscópicamente, el primer cambio consiste en la aparición de edema en la mucosa intestinal que llega a comprometer toda la pared, facilitando el desarrollo de hipoperfusión. Luego, aparecen ulceraciones mucosas, hemorragia focal y necrosis transmural que finalmente favorecen la translocación bacteriana y la perforación intestinal [11].
Microscópicamente, se evidencia edema, ausencia de leucocitos en la pared intestinal, congestión vascular de la mucosa y en algunos casos necrosis focal o extensa acompañada de hemorragia a nivel de la submucosa, colonización bacteriana y en ocasiones colonización por hongos (Figura 2) [19,20].
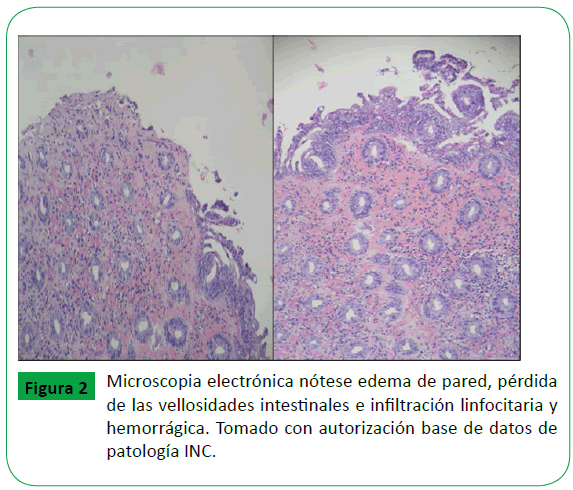
Figure 2: Microscopia electrónica nótese edema de pared, pérdida de las vellosidades intestinales e infiltración linfocitaria y hemorrágica. Tomado con autorización base de datos de patología INC.
Manifestaciones clinicas
En la práctica puede ser difícil diferenciar la EN de otras condiciones gastrointestinales infecciosas y no infecciosas. Los síntomas a menudo se presentan 10 a 14 días después del inicio de la quimioterapia [11]. Un paciente con neutrófilos absolutos menores de 500/mm3 con dolor abdominal y fiebre es muy probable curse con EN. Los signos y síntomas más comunes en pediatría de acuerdo a una de las series más grandes (McCarville y cols) son: dolor abdominal (91%), fiebre (84%), distensión (82%), nauseas (75%), diarrea (72%), vómito (68%) y disminución de los ruidos intestinales (62%), en algunos casos indistinguible de la apendicitis. A pesar de lo anterior, la sintomatología es tan variada que estudios postmortem revelan hallazgos de colitis en 10%-26% de los pacientes con leucemia aguda sin haber presentado manifestaciones clínicas claras [1,21]. Dentro de los hallazgos paraclínicos Moran y cols reportaron hipokalemia, hipoalbuminemia e hiperbilirrubinemia, como las alteraciones bioquímicas más frecuentes en pacientes con EN.
Abordaje clinico
Se ha considerado que dada la forma de presentación y la rápida progresión de la enfermedad no es fácil llegar a un diagnóstico temprano. Es por esto que debe hacerse una detallada historia clínica haciendo especial énfasis en las manifestaciones gastrointestinales, tiempo de evolución y datos de última quimioterapia recibida.
En el examen físico se deben buscar signos de hipoperfusión tisular; alteraciones del sensorio y del llenado capilar, taquicardia ó diferencias entre pulsos centrales y periféricos, como los primeros signos sugestivos de choque compensado y que requieren intervención inmediata. El hallazgo de hipotensión en niños es un signo tardío de choque.
Al mismo tiempo, debe realizarse un tamizaje de infección que incluya hemograma para evaluar la severidad de la neutropenia, anemia y trombocitopenia. Es imprescindible contar con marcadores inflamatorios como la proteína C reactiva, procalcitonina, y en algunos centros IL-8. Deben tomarse hemocultivos, electrolitos, función renal y hepática.
Herramientas diagnósticas
En general la estabilidad hemodinámica del paciente es de suma importancia para escoger la modalidad de imagen a utilizar; la TAC de abdomen contrastada (imagen de elección) y la ecografía abdominal son el pilar del diagnóstico imagenológico. La radiografía de abdomen tiene utilidad limitada ya que muestra hallazgos inespecíficos (Tabla 2).
| Técnica |
TAC abdomen contrastada |
Ecografía de abdomen total |
| Utilidad |
Permite diagnóstico diferencial. Orienta manejo (médico vs quirúrgico) |
Permite diagnóstico rápido en pacientes con inestabilidad hemodinámica que no pueden ser llevados a TAC. |
| Hallazgos |
Engrosamiento focal o difuso de pared intestinal, colección líquida, cambios inflamatorios en tejidos blandos pericecales, nodularidad mural, ascitis, neumatosis intestinal. |
Engrosamiento de pared intestinal, colección líquida, ascitis. |
| Limitaciones |
Altas dosis de radiación ionizante. Riesgo de nefrotoxicidad por medio de contraste. Necesidad de sedación en niños pequeños. Puede sobrestimar el engrosamiento de la pared intestinal. Falsos negativos 15%. |
Observador dependiente. Hallazgos para definir pronóstico son controvertidos. Falsos negativos 23%. |
Tabla 2 Imágenes diagnósticas en Enterocolitis Neutropénica [15,22-25].
Los pacientes capaces de tolerar el transporte a la exploración por TAC se beneficiarán de una modalidad de imagen más detallada en comparación con el ultrasonido. La TAC también ayudar a reducir el diagnóstico diferencial mediante la caracterización de la extensión y la naturaleza de la lesión (Figura 3). Los pacientes hemodinámicamente inestables pueden entonces beneficiarse de un diagnóstico rápido con ultrasonido, el cual se puede realizar a la cabecera del paciente [14].
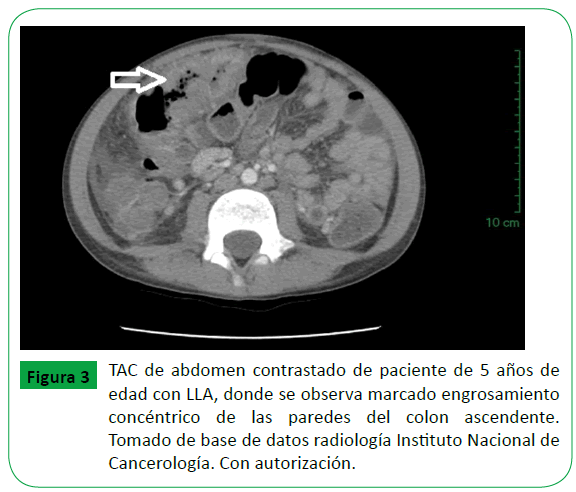
Figure 3: TAC de abdomen contrastado de paciente de 5 años de edad con LLA, donde se observa marcado engrosamiento concéntrico de las paredes del colon ascendente. Tomado de base de datos radiología Instituto Nacional de Cancerología. Con autorización.
Dentro de los hallazgos imagenológicos descritos en la Tabla 2, el grosor de la pared intestinal se ha utilizado como criterio diagnóstico para EN. Gorchluter y Dávila consideran que un diámetro de pared intestinal mayor de 4 mm es sugestivo de enterocolitis, incluso en la edad pediátrica. McCarville y cols consideran en este grupo etario un espesor anormal mayor de 3 mm.
Gorchluter y cols [26] proponen los siguientes criterios diagnósticos, no validados en pediatría:
1. Fiebre
2. Dolor abdominal
3. Evidencia de engrosamiento de pared intestinal mayor de 4 mm en medición transversal, sobre más de 30 mm en medición longitudinal, por US o TAC, en cualquier segmento.
Definiciones de caso para EN [1,3,12,13,27-30]:
Confirmado: Detección de microrganismos patógenos dentro de la luz intestinal después de resección quirúrgica o presencia de microrganismos patógenos en circulación sistémica y/o peritoneo, con evidencia imagenológica de neumatosis, engrosamiento o necrosis hemorrágica por TAC abdominal o inspección quirúrgica del ciego. Debe tenerse en cuenta el diagnóstico diferencial (Tabla 3).
| Diagnósticos diferenciales |
| Gastroenteritis aguda |
| Apendicitis aguda |
| Pancreatitis |
| Mucositis intestinal |
| Aspergiloma |
| Candidiasis visceral |
| Infiltración leucémica |
| Absceso perianal |
| Colitis por citomegalovirus |
| Efectos tóxicos de la quimioterapia |
| Intususcepción y vólvulos |
| Colitis pseudomembranosa |
| Colitis isquémica |
| Colecistitis |
| Enfermedad inflamatoria intestinal |
Tabla 3 Diagnósticos diferenciales en Enterocolitis Neutropénica.
Probable: Manifestaciones clínicas compatibles y evidencia imagenológica de edema de pared intestinal, neumatosis o necrosis hemorrágica en la pared del ciego o colon ascendente, sin confirmación microbiológica o quirúrgica.
Posible: Manifestaciones clínicas compatibles sin evidencia imagenológica de edema de pared intestinal del ciego o colon ascendente, sin confirmación microbiológica o quirúrgica.
Aproximacion Inicial, Estabilizacion y Tratamiento
Los niños con sospecha clínica de EN necesitan una aproximación rápida que permita la estabilización de constantes vitales para favorecer una adecuada perfusión tisular, enfocando el acercamiento inicial de manejo en miras a evaluar el estado de hidratación, detectar precozmente signos de choque y realizar una reanimación hídrica vigorosa con metas y objetivos claros para la primera hora de intervención y las siguientes 6 horas. Dentro de los pilares fundamentales del manejo conservador se encuentra el reposo intestinal, la sonda nasogástrica, el inicio temprano de antibióticos empíricos y por supuesto la analgesia. A continuación describiremos cada uno de los aspectos planteados para el tratamiento (Tabla 4).
| Metas para estabilización inicial |
| Mejorar presión de perfusión tisular y evitar progresión del cuadro clínico |
| Normalizar FC y TAS |
| Indique bolos de cristaloides. Se debe colocar una dosis de 20 cc/kg hasta 60 cc/kg o hasta que aparezcan crépitos o hepatomegalia. Luego coloque líquidos de base con cristaloides. |
| Vigile hipoglicemia en menores de 2 años. No ponga soluciones dextrosadas a menos de que exista Dxt menor a 60 mg/dl. |
| Las primeras seis horas busque adecuada saturación venosa central de oxígeno (>70% y buen índice cardíaco (3,3-6,6l/min/1,73).No retrase el inicio de inotrópicos. |
Tabla 4 Metas para estabilización inicial [32].
Monitoreo
Se deben registrar las constantes vitales e idealmente conectar al paciente a un monitor para vigilancia permanente de ritmo cardíaco y sus alteraciones. Es indispensable la administración de oxígeno por sistema de alto flujo que optimice el aporte, ya que es muy frecuente que los niños con EN debuten en estado de choque ya sea hipovolémico (por pérdidas digestivas aumentadas) o séptico. De la misma manera debe garantizarse la presencia al menos de dos accesos venosos periféricos de gran calibre y tan pronto como sea posible asegurar un acceso venoso central, sin que este sea un obstáculo para el inicio de soporte inotrópico [31].
Estabilización
Se buscará ofrecer bolos de cristaloides isotónicos a necesidad indicando bolos de 20 cc/kg (puede requerir cuatro, cinco o más) hasta la aparición de signos de sobrecarga (hepatomegalia o crépitos en la auscultación) o que se alcance una mejor perfusión tisular. Existen otros objetivos primarios en la estabilización inicial que deben alcanzarse rápidamente (Tabla 4).
Reposo intestinal
En la literatura revisada no hay recomendaciones sobre el tiempo de ayuno o un periodo fijo de reposo intestinal. Schlatter y cols describen en su serie de 12 pacientes con EN, ayuno hasta por 12 días, con una media de duración de 7 días [3]. Se debe orientar al clínico por la severidad y extensión de la EN, en algunos centros se espera un reposo de 48 horas después de la resolución de los síntomas principales con un buen control de la estabilidad hemodinámica.
En algunos artículos se reporta que la recuperación de la función gastrointestinal se correlaciona con la resolución de la neutropenia. En niños manejados de manera conservadora, el 100% de los pacientes recolectados toleraban la alimentación enteral en los primeros 9 días después de la resolución de la neutropenia, pero aún no existe consenso al respecto de cuál puede ser el mejor tiempo de ayuno para estos pacientes [33].
Manejo dietario
La prevalencia de malnutrición en pacientes pediátricos hospitalizados está bien establecida e implica mayor estancia hospitalaria y mortalidad. En los niños críticamente enfermos que ingresan a la unidad de cuidado intensivo con diagnóstico de EN, se recomienda un tamizaje para identificar la pre-existencia de desnutrición y definir riesgo. Con esta valoración se desarrollará el plan de cuidado o soporte parenteral que amerite, dado que estarán sin vía enteral por un periodo estimado de 5 a 7 días en casos no complicados. Se deben estimar los requerimientos energéticos con las ecuaciones comúnmente utilizadas en pediatría, en caso de no contar con calorimetría indirecta [34].
Una adecuada nutrición parenteral es esencial para prevenir el estado hipermetabólico y soportar mecanismos de defensa para mejorar el pronóstico global de estos pacientes. Se debe considerar el uso de glutamina, ya que este es un aminoácido esencial involucrado en el trasporte de nitrógeno y en la regulación del estado acido base a nivel de la mucosa intestinal [34,35].
Antibióticos
La mayoría de información acerca del tratamiento de la EN se basa en estudios descriptivos o retrospectivos sobre experiencia clínica. Dentro del manejo médico y las recomendaciones antibióticas para pacientes con EN, la Guía de la Sociedad Americana de Infectología recomienda cubrir los gérmenes mas comúnmente asociados en esta patología, principalmente los gérmenes Gram positivos y Gram negativos como la Pseudomonas spp, Clostridium difficile y especies fúngicas como Candida spp (Tabla 5) [36].
| Antibioticos |
Dosificacion |
| Monoterapia |
| Piperacilina Tazobactam |
300-400 mg/kg/día IV dividido en 4 dosis Max 16 gramos/día |
| Imipenem Cilastatina (Uso limitado en niños por sus efectos adversos a nivel del SNC) |
60-100 mg/kg/día IV divido en 4 dosis Max 2-4 gramos/día |
| Meropenem |
60-120 mg/kg/día IV dividido en 3 dosis Max 6 gramos/día |
| Combinado |
| Cefepime |
150 mg/kg/día IV dividido en 3 dosis Máximo dosis 2 gramos/dosis |
| Metronidazol |
30 mg/kg/día IV dividido en 4 dosis Máximo dosis 4 gramos/dosis |
Tabla 5 Antibióticos en Enterocolitis Neutropénica [14].
La monoterapia con piperacilina tazobatam o carbapenémicos son una buena opción para EN, reservando estos últimos para gérmenes BLEE (+). Cuando se decide utilizar terapia combinada, el esquema cefepime con metronidazol es muy popular por su amplio espectro y cubrimiento contra gérmenes anaerobios. Dentro del tratamiento combinado la escogencia de otro betalactámico con acción anti-pseudomona con un aminoglucósido es una alternativa favorable que debe considerarse a la luz de la condición clínica del paciente. La duración del esquema antibiótico debe basarse en la resolución de los signos clínicos de infección y la recuperación del conteo leucocitario [14].
Factor estimulador de colonias de granulocitos
Se ha planteado el uso de estimulador de colonias de granulocitos (G-CSF) en pacientes adultos con neutropenia profunda, falla multiorgánica y neumonía acompañada de infección fúngica invasiva. Su uso aún está en debate en pediatría, ya que no hay estudios prospectivos o retrospectivos que soporten su uso [37].
Manejo quirúrgico
Siempre es importante tener en cuenta que los niños con esta enfermedad pueden requerir intervención quirúrgica en cualquier momento de la evolución de la misma. La causa más frecuente de intervención es la perforación intestinal y se asocia con mal pronóstico. Evalue signos clínicos de manera permanente y tenga en cuenta las indicaciones descritas en la Tabla 6.
| Indicaciones |
| Perforación intestinal |
| Obstrucción intestinal |
| Sangrado persistente a pesar de corrección de coagulopatía |
Tabla 6 Indicaciones de manejo quirúrgico en Enterocolitis Neutropénica [37].
Conclusiones
La EN en pediatría es una entidad poco documentada con incidencia y prevalencia variables. En nuestro medio no hay datos epidemiológicos de la enfermedad, lo que obliga a iniciar su estricto reporte.
Ante la triada típica de neutropenia, fiebre y dolor abdominal, es necesario realizar de manera precoz imágenes diagnósticas. La tomografía computarizada de abdomen es la mejor ayuda imagenológica a la fecha, para evidenciar los cambios en la pared intestinal afectada por EN. La ecografía abdominal se reserva para pacientes inestables hemodinamicamente que no podrán ser llevados a TAC.
Hoy en día el manejo conservador reporta tasas de éxito hasta del 100%, incluye un monitoreo continuo con medidas de estabilización inicial, soporte hídrico, reposo intestinal, sonda nasogástrica, soporte parenteral y antibiótico empírico de amplio espectro dirigido a los gérmenes más comunes en EN. La conducta quirúrgica queda limitada a situaciones específicas como perforación/obstrucción intestinal y sangrado que no mejore a pesar de la corrección de la coagulopatía.
Por otra parte durante la revisión de la literatura no se encontró evidencia en cuanto al momento ideal para el inicio del estímulo enteral en EN, por lo que se hace necesario plantear estudios prospectivos que describan cuales son los determinantes clínicos e imagenológicos que oriente esta conducta.
20425
References
- Katz JA, Wagner ML, Gresik MV, MahoneyDH ,Fernbach DJ (1990) Typhlitis. An 18-year experience and postmortemreview. Cancer 65: 1041-1047.
- Wade DS, Nava HR, Douglass HO (1992)Neutropenic enterocolitis. Clinical diagnosis and treatment. Cancer 69: 17-23.
- Schlatter M, Snyder K, Freyer D (2002) Successfulnonoperativemanagement of typhlitis in pediatriconcologypatients. J PediatrSurg 37: 1151-1155.
- Moran H, Yaniv I, Ashkenazi S, Schwartz M, Fisher S, et al. (2009) Riskfactorsfortyphlitis in pediatricpatientswithcancer. J PediatrHematolOncol 31: 630-634.
- McCarville MB, Adelman CS, Li C, Xiong X, Furman WL, et al. (2005) Typhlitis in childhoodcancer. Cancer104: 380-387.
- Rizzatti M, Brandalise SR, de Azevedo AC, Pinheiro VRP, Aguiar SDS (2010) Neutropenic enterocolitis in children and youngadultswithcancer: prognosticvalue of clinical and imagefindings. PediatrHematolOncol 27: 462-470.
- Martínez L, Sastre UA, de Victoria OML, Fernández SA, López GJC, et al. (1997) La enterocolitis neutropénica en el niño con cáncer. AnEspPediatr 46: 367-371.
- Shamberger R, Weinstein H, Delorey M, Levey R (1986) The medical and surgicalmanagement of typhlitis in childrenwithacutenonlymphocytic (myelogenous) leukemia. Cancer 57: 603-639.
- Durán PEG, Rivera BC, Banda LMI,Collazo JJ, Lujano NLA, et al. (2008) Enterocolitis neutropénica en pacientes con neoplasia hematológica. MedIntMex 24: 89-95.
- Cunningham SC, Fakery K, Bass BL, Napolitano LM (2005) Neutropenic enterocolitis in adults: Case series and review of theliterature. DigDisSci 50: 215-220.
- Durán-pérez EG, Lujano-nicolás LA, Ornelas-escobedo E, Abdo JM (2010) Enterocolitis neutropénica. RevMedHosp Gen Mex 73: 202-208.
- Sloas MM, Flynn PM, Kaste SC, Patrick CC (1993) Typhlitis in childrenwith carecer: A 30-year experience. ClinInfectDis 17: 484-490.
- Gorschlüter M, Mey U, Strehl J, Ziske C, Schmidt-wolf IGH (2005) Neutropenic enterocolitis in adults : Systematicanalysis of evidencequality. Eur J Haematol 73: 1-13.
- Cloutier RL (2010) Neutropenic enterocolitis. HematolOncolClin N Am 24: 577-584.
- Fernández-Sarmiento J, Araque P, Yepes M, Mulett H, Tovar X (2016) Correlationbetween arterial lactate and central venouslactate in childrenwith sepsis. CriticalCare Res Pract 2016: 1-5.
- El-Matary W, Soleimani M, Spady D, Belletrutti M (2011) Typhlitis in childrenwithmalignancy: A single center experience. J PediatrHematolOncol 33: e98-e100.
- Frick MP, Maile CW, Crass JR, Goldberg ME, Delaney JP (1984) Computedtomography of neutropenic colitis. AJR 143: 763-765.
- Davila ML (2006) Neutropenic enterocolitis. CurrOpinGastroenterol 22: 44-47.
- Dosik GM, Luna M, Valdivieso M, McCredie KB, GehanEA , et al. (1979) Necrotizing colitis in patientswithcancer. Am J Med 67: 646-656.
- Cardona AF, Combariza JF, Reveiz L, Ospina EG, Poveda PM, et al. (2004) Características clínicas y microbiológicas de la colitis neutropénica en adultos con neoplasias hematológicas del Instituto Nacional de Cancerología de Bogota D. C. (Colombia). EnfermInfeccmicrobialClin 22: 462-466.
- Wagner ML, Rosenberg HS, Fernbach DJ, Singleton EB (1970) Typhlitis: A complication of leukemia in childhood. Am J RoentgenolRadiumTherNuclMed 109: 341-350.
- McCarville MB (2006) Evaluation of typhlitis in children: CT versus US. PediatrRadiol 36: 890-891.
- Siğirci A, Akinci A, Ozgen U, Ozen M (2006) Neutropenic enterocolitis (typhlitis) associatedwithinfectiousmononucleosis. PediatrRadiol 36: 155-157.
- Baud C, Saguintaah M, Veyrac C, Couture A, Ferran JL, et al. (2004) Sonographic diagnosis of colitis in children. EurRadiol 14: 2105-2119.
- Ojala AE, Lanning FP, Lanning BM (1997) AcuteLymphoblasticLeukemia, 271: 266-271.
- Kaur H, Loyer EM, David CL, Sawaf H, DuBrow RA, et al. (2008) Radiologicfindings in taxaneinduced colitis. Eur J Radiol 66: 75-78.
- Thompson AE, Marshall JC, Opal SM (2005) Intraabdominalinfections in infants and children: Descriptions and definitions. PediatrCritCareMed 6: S30-S35.
- Walsh MC, Kliegman RM (1986) Necrotizingenterocolitis:Treatmentbasedonstagingcriteria. PediatrClin N Am 33: 179-201.
- Otaibi AA, Barker C, Anderson R, Sigalet DL (2002) Neutropenic enterocolitis (typhlitis) afterpediatricbonemarrowtransplant. J PediatrSurg 37: 770-772.
- Fernandez SJ (2009) Enfoque del niño septico en urgencias. Una aproximación que requiere metas claras. CCAP 9: 29-35.
- Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, et al. (2001) Earlygoal-directedtherapy in thetreatment of severe sepsis and septic shock. N Engl J Med 345: 1368-1377.
- Baerg J, Murphy JJ, Anderson R, Magee JF (1997) Neutropenicenteropathy: A 10-year review. J PediatrSurg34: 1068-1071.
- Mehta NM, Compher C (2009) A.S.P.E.N. clinicalguidelines: Nutritionsupport of thecriticallyillchild. J Parenter Enteral Nutr 33: 260-276.
- Wernerman J (2003) Glutaminedepletion in criticallyillpatients. CurrOpinCritCare 9: 279-285.
- Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, et al. (2011) Clinicalpracticeguidelineforthe use of antimicrobialagents in neutropenicpatientswith cáncer. ClinInfectDis 52: e56-e93.
- Davila ML (2007) Neutropenic enterocolitis: Currentissues in diagnosis and management. CurInfectDisRep 9: 116-120.
- van de Wetering MD, Kuijpers TW, Taminiau JAJM, Ten Kate FJW, Caron HN (2003) Pseudomembranous and neutropenic enterocolitis in pediatriconcologypatients. SuppCare Can 11: 581-586.








