Research - (2022) Volume 18, Issue 8
Esteatohepatitis no alcohólica: De la fisiopatología al diagnóstico.
Mauxi Ospino-Rodriguez1,
Erick Licona-Vera2*,
Maria Raad-Sarabia2,
Catalina Betancur-Vasquez3 and
Libardo Gomez-Alvarez4
1Medicina Interna, Universidad Simón Bolívar, Barranquilla-Atlántico, Colombia
2Medicina Interna, Universidad del Sinu, Cartagena-Bolívar, Colombia
3Medicina General, Universidad CES, Medellín-Antioquia, Colombia
4Medicina General, Universidad Metropolitana, Barranquilla-Atlántico, Colombia
*Correspondence:
Erick Licona-Vera, Medicina Interna, Universidad del Sinu,
Colombia,
Email: ,
Received: 29-Jul-2022, Manuscript No. ipadm-22-13075;
Editor assigned: 01-Aug-2022, Pre QC No. ipadm-22-13075(PQ);
Reviewed: 15-Aug-2022, QC No. ipadm-21-13075;
Revised: 19-Aug-2022, Manuscript No. ipadm-21-13075(R);
Published:
26-Aug-2022, DOI: 10.36648/1698-9465.22.18.1554
Abstract
La enfermedad por hígado graso no alcohólico se caracteriza por el acumulo de grasa en >5% de los hepatocitos; el espectro de la enfermedad se divide en dos grandes grupos donde encontramos el hígado graso no alcohólico y, por otro lado, la esteatohepatitis no alcohólica siendo ambas un mismo espectro de la enfermedad. La esteatohepatitis no alcohólica (EHNA) se caracteriza por la presencia de daño hepatocelular, asociada a inflamación y algún grado de fibrosis a nivel hepático por lo que se constituye como un factor de riesgo para cirrosis y carcinoma hepatocelular. A continuación, se presenta una revisión de la EHNA desde su fisiopatogenia hasta las nuevas técnicas de diagnóstico.
Keywords
Hígado graso, Esteatohepatitis, Esteatosis hepática no
alcohólica, FibroScan, Biopsia hepática.
Introduction
La enfermedad por hígado graso no alcohólico se caracteriza por
el acumulo de grasa en >5% de los hepatocitos; el espectro de la
enfermedad se divide en dos grandes grupos donde encontramos
el hígado graso no alcohólico y, por otro lado, la esteatohepatitis
no alcohólica siendo ambas un mismo espectro de la enfermedad
[1].
La Esteatohepatitis no Alcohólica (EHNA) se caracteriza por
la presencia de daño hepatocelular, asociada a inflamación y
algún grado de fibrosis a nivel hepático por lo que se constituye
como un factor de riesgo para cirrosis y carcinoma hepatocelular
[2,3]. La fisiopatogenia del EHNA no es muy clara, se han
propuestos múltiples teorías que orientan la posibilidad que
sea una consecuencia de la esteatosis hepática simple o que
sea producto de una respuesta de novo a la lipotoxicidad por lo que se continúa pensando en un origen multifactorial con pobre
claridad y certeza hasta la fecha; se han descrito como factores
de riesgo asociados la dieta, la adiposidad, la citotoxicidad por
ácidos grasos, los factores genéticos, entre otros [3,4]. Debido
a la creciente pandemia de obesidad y sindrome metabólico
la prevalencia de EHNA ha aumentado en los últimos años, sin
embargo, al ser una enfermedad relativamente asintomática
la prevalencia en la población general varía dependiendo de
los grupos poblacionales y los criterios diagnósticos utilizados
para definirla; las primeras estimaciones de la prevalencia de
EHNA provienen de estudios de autopsias, en los que se halló
esteatohepatitis en el 18,5% de los individuos obesos y en el 2,7%
de los individuos delgados [5].
Histopatológicamente se requieren de una serie de criterios para
hacer diagnostico; entre ellos la presencia de esteatosis, lesión
del hepatocito, inflamación y fibrosis, y basado en el grado de
fibrosis e inflamación se realiza una clasificación y estadificación
histológica de la cirrosis como via final [2]. Se cuenta con un gran
abanico de métodos diagnósticos, como Gold Estándar dado su
mejor sensibilidad y especificidad se encuentra la biopsia para
determinar la estirpe histológica y en los últimos años se han
descrito nuevas técnicas no invasivas para el diagnóstico de
EHNA basándose en pruebas moleculares y de biomarcadores.
En el presente manuscrito se realiza una revisión del estado
actual de la esteatohepatitis alcohólica con énfasis importante
en su fisiopatología para comprender mejor el fundamento de
las nuevas pruebas diagnósticas basadas en biología molecular.
Fisiopatogenia
La EHNA es una patología multifactorial cuya fisiopatogenia no
está del todo clara y en la que se ven involucradas múltiples
hipótesis que actúan de forma paralela e interrelacionadas
como la resistencia a la insulina, lipotoxicidad, estrés oxidativo,
inflamación y recientemente se han descrito factores genéticos y
cambios en el microbiota intestinal.
Resistencia a la Insulina
Los ácidos grasos que llegan al hígado provienen principalmente
de dos fuentes; en primer lugar, de la lipolisis de los triglicéridos
en el tejido adiposo, proceso que se encuentra regulado
por la acción de la insulina y, en segundo lugar, a partir de la
glucosa/fructosa que se obtiene por lipogénesis. Una vez en el
hígado se metabolizan principalmente por B-oxidación o por reesterificación
para formar triglicéridos; esta eliminación de ácidos
grasos a través de la formación de triglicéridos se considera
una respuesta protectora a un suministro de ácidos grasos que
supera la capacidad de metabolizarlos (Figura 1). Cuando ocurre
resistencia a la insulina, el tejido adiposo contribuye a la EHNA
a través de la lipolisis desregulada, lo que da lugar a un gran
suministro elevado de ácidos grasos al hígado que supera su
capacidad de metabolizarlos [6-8].
Factor Dietario
A partir del metabolismo de la glucosa y la fructosa se
obtienen ácidos grasos saturados, los cuales experimentan a
nivel mitocondrial en el hígado el proceso de B-oxidación y
re-esterificación. Con la B- oxidación se degradan los ácidos grasos saturados que son tóxicos para el hepatocito, y con la reesterificación
se forman triglicéridos y grasas de reserva (Figura
1) [8]. Para que la lipogénesis de novo se presente se requiere de
la activación de los factores de transcripción SREBP1 y ChREBP y
la posterior inducción de enzimas ACC1, FAS, E-CoA de las que
depende la reacción bioquímica. La creciente ingesta de bebidas
endulzadas con fructosa son un importante factor de riesgo para
EHNA; estudios en ratones han demostrado que la fructosa que se
absorbe a nivel intestinal de forma desregulada es transportada
hasta el hígado a través de la circulación portal sin ningún tipo
de restricción, donde mediante la lipogénesis se forman gran
cantidad de ácidos grasos saturados (Figura 2). Ademas, estas
grandes cantidades de fructosa ingeridas tienen la capacidad de
inhibir la B-oxidación de los ácidos grasos en la mitocondria lo
que disminuye el ATP conllevando a acumulo de ácidos grasos
saturados y con ello a lesión del hepatocito, aumento de ADP e
IMP, estrés en el retículo endoplásmico, disfunción mitocondrial,
inflamación y fibrosis [9].
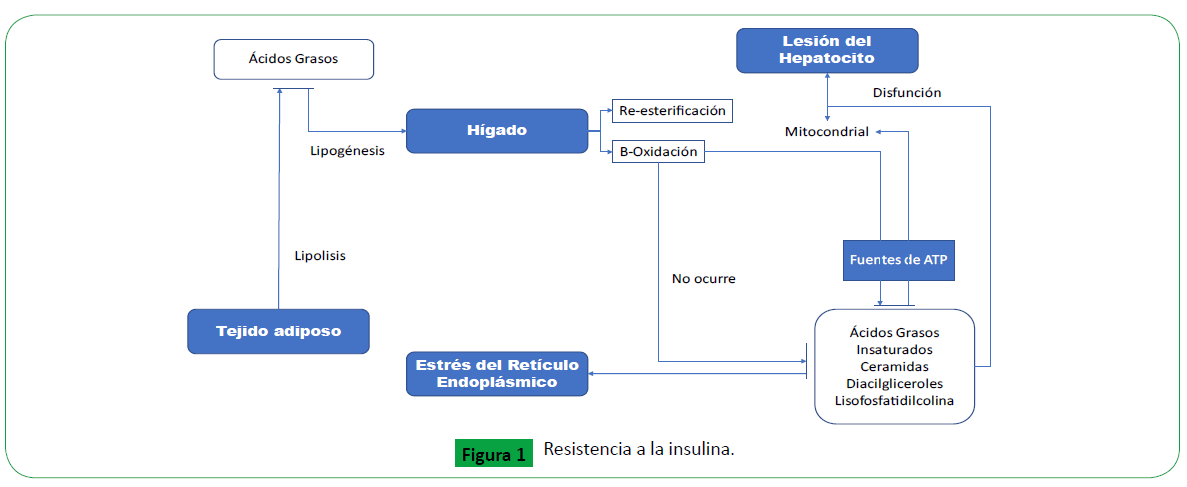
Figure 1. Resistencia a la insulina.
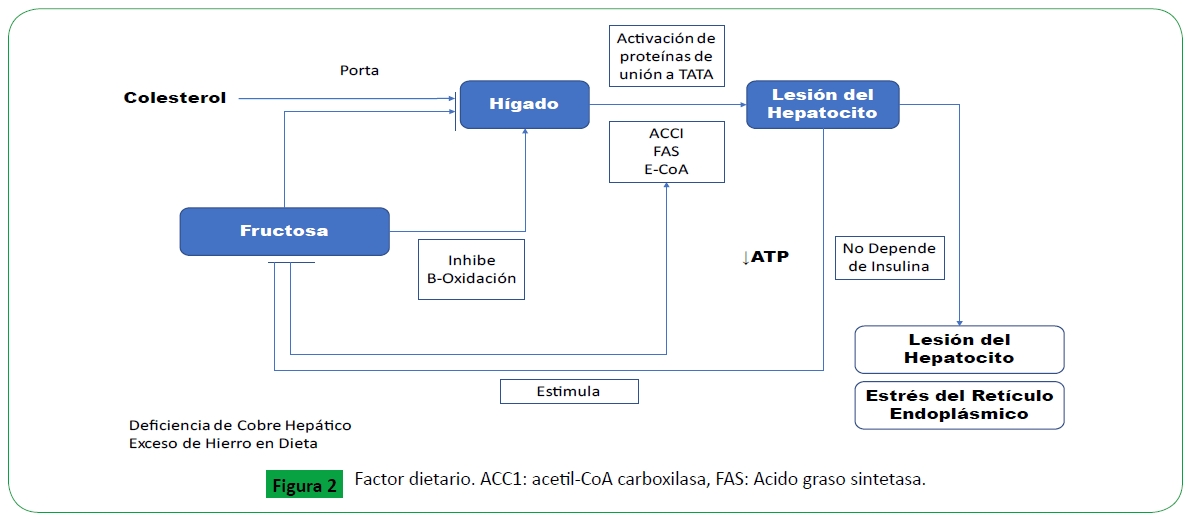
Figure 2. Factor dietario. ACC1: acetil-CoA carboxilasa, FAS: Acido graso sintetasa.
Por otro lado, el aumento del colesterol en la dieta es un factor
de riesgo para EHNA debido a que la captación hepática de
colesterol LDL se produce sin restricción, lo que da lugar su
depósito en los hepatocitos y la generación de células de Kupffer
espumosas desencadenando en procesos inflamatorios a nivel
hepático y promoviendo la fibrosis (Figura 2) [10,11].
Lipotoxicidad
Los ácidos grasos saturados (ceramidas, diacilgliceroles,
lisofosfatidilcolina), pueden desencadenar lesión celular
mediante 2 mecanismos:
Al tener la capacidad de regular la expresión de los receptores de
muerte celular (FAS, DR5, TRAIL-R y TNFR1) terminan activando
estos receptores a nivel de hepatocito y con ello lesionando la
célula (muerte extrínseca) [11].
El estrés oxidativo en el retículo endoplásmico, determinado
por la sobrecarga de lípidos, induce activación de las vías de
señalización (respuesta proteica desplegada) con la finalidad de
establecer la homeostasis pero al prolongar esta actividad se
activa las vías de la apoptosis lo que lleva a lesión del hepatocito
mediada por Caspasa 2, activación del JNK y XBP1, producción
de ROS, y disfunción de la mitocondria (muerte intrínseca) [11].
Inflamación
La activación de las células de Kupffer es crucial en EHNA.
Se han identificado 2 fenotipos de Celulas de Kupffer: M1
proinflamatorio y M2 inmunoregulador. Las M1 se expresan en
respuesta a los PAMPs, que al interactuar con TLR estimulan
secreción de citoquinas proinflamatorias como IL-1B, IL-12,
TNF, CCL2, CCL5; a su vez responde a los DAMPs, los cuales se
producen por mayor lesión del hepatocito, y se encargan de
perpetuar la inflamación y activación de células de Kupffer. Todo
esto conduce a la activación del inflamosoma como complejo
multiproteico requerido para inicio de señales inflamatorias y
que está asociado con la piroptosis de los hepatocitos [12].
Las células de Kupffer expresan TLR4, planteamiento sugerido
porque el número de macrófagos TLR4 + se incrementa
notablemente en pacientes con NASH, lo que lleva a agotamiento de estas células favoreciendo la esteatosis y la necro inflamación,
así como la expresión hepática de TNF y los marcadores de
fibrosis, como TGFβ1 y colágeno α1.
Fibrosis
Las células estrelladas son susceptibles a la estimulación por
varios compuestos presentes en el hígado que finalmente
conducen a la fibrosis:
1. Las citoquinas CCL2 y CCL5 activan las células estrelladas,
iniciando una respuesta fibrogenica.
2. La Caspasa 2 se encontró tanto en NASH de humanos como
en experimentales, como un factor profibrogenico [3].
3. Los hepatocitos en globo producen una proteína que se ha
demostrado promueve la fibrosis tisular y se está estudiando
si promueve la fibrosis a través de su efecto directo sobre las
células estrelladas [4].
Microbiota
La microbiota intestinal produce energía para el huésped al
convertir polisacáridos en acido grasos y estimular la lipogénesis
a nivel hepático. La evolución del microbiota humano, no es
más que el reflejo de la dieta rica en glucosa, fructosa y grasa
saturadas, además de el sedentarismo y el uso indiscriminado
de antibióticos. Se han demostrado en estudios clínicos y
experimentales que una microbiota alterada (disbiosis) o el
sobrecrecimiento bacteriano en el intestino delgado puede
conducir a un aumento de la permeabilidad intestinal lo que
conlleva a traslocación de endotoxinas al torrente sanguíneo
que llegaran al hígado e inducirán respuesta inflamatoria a
través de la activación de PAMPs por lo tanto esto representa
un mecanismo adicional de patogénesis de NASH [13] Figura 3.
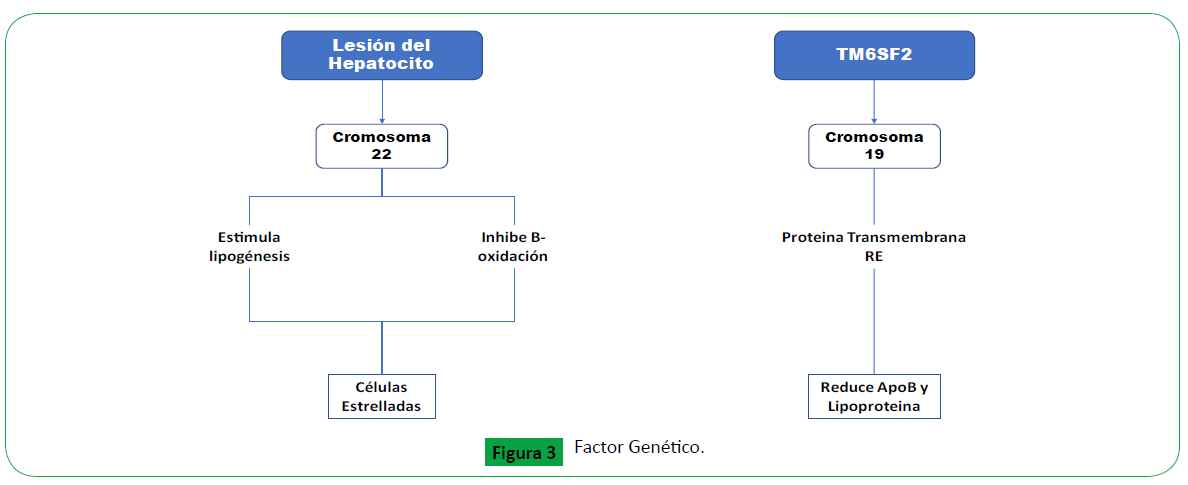
Figure 3. Factor Genético.
Factor Genético
La importancia del factor genético en EHNA se ha descrito
recientemente en los estudios con pacientes gemelares. Se han
identificado 2 variantes genéticas, localizadas en cromosoma 22
y 19 respectivamente con la aparición y progresión de NASH.
La variante PNPLA3: se asocia con un mayor contenido de lípidos
hepáticos y predispone a la enfermedad hepática asociada a
hígado graso, desde la esteatosis simple hasta la esteatohepatitis,
la fibrosis y la hepatocarcinoma. Además se ha demostrado que
esta variante se expresa en las células estrelladas, lo que indicaría
que las activa y promueve la fibrosis [3,8].
La variante TM6SF2: se correlaciona con esteatosis y mayor riesgo
de fibrosis avanzada, independientemente de otros factores
asociados como diabetes u obesidad. A su vez al ser una proteína
transmembrana que se encuentra en el retículo endoplásmico,
funciona como un transportador de lípidos cuando está presente
en su forma basal; pero cuando es la variante la que está presente
disminuye los niveles de lipoproteínas y apolipoproteínas B y
aumenta los depósitos de triglicéridos a nivel hepático [3,8].
Histopatologia
Los criterios histológicos mínimos que se requieren para hacer
diagnóstico de EHNA son:
1. Esteatosis
2. Lesión de hepatocito
2.1 Hepatocito en globo
2.2 Apoptosis
3. Inflamación lobular, localizada típicamente en zona acinar 3.
4. Otras que no son necesarias para diagnóstico, pero pueden
estar presentes
4.1 Fibrosis
4.2 Cirrosis
4.3 Megamitocondrias
4.4 Núcleos glucogenados
4.5 Cuerpos de Mallory-Denk
1. Esteatosis
Se clasifica en macrovesicular y microvesicular. En la
macrovesicular una sola gota de grasa o pequeñas gotas de
grasa bien definidas ocupan el citoplasma de los hepatocitos
empujando el núcleo hacia la periferia; en la microvesicular
pequeñas gotas de lípido ocupan el citoplasma y su núcleo
está ubicado en el centro del hepatocito. La macrovesicular es
más frecuente, generalmente comienza en la zona 3 aunque su
localización panacinar también puede presentarse con esteatosis
severa [14-18].
2. Lesión de Hepatocito
El aspecto del hepatocito en “globo aerostático” es característico,
ya que su presencia se ha asociado con enfermedad más agresiva
y alta incidencia de cirrosis, además se ha relacionado con
características del síndrome metabólico [14-17]. Los hepatocitos
en globo están agrandados, con un citoplasma pálido, inflamado,
con un gran núcleo prominente; esto puede ser secundario a
la presencia de esteatosis microvesicular [19]. Se cree que la
forma en globo es secundaria a la alteración del citoesqueleto de
filamento intermedio, donde la citoqueratina 8 y 18 se rompen y
se dispersan a la periferia. Los cuerpos apoptóticos (característica
de muerte celular programada) son comunes en EHNA y se
identifican en las tinciones de rutina, y por inmunohistoquímica
para los fragmentos de queratina 18 [14-17].
3. Inflamación Lobular
Consiste en un infiltrado de células inflamatorias mixtas,
compuesta por linfocitos, algunos eosinófilos y células de Kupffer,
aunque ocasionalmente se encuentran polimorfos rodeando
al hepatocito en globo en una lesión llamada “satelitosis”. La
satelitosis es más común en la esteatohepatitis alcohólica [16,20].
Tabla 1 El índice de METAVIR incluye la suma de la puntuación
asignada al grado de actividad inflamatoria observada en la
muestra (0-4; siendo, 0 sin actividad y 3 o 4 la actividad considerada
grave), además de la proporcionada por la estadificación, que
representa la cantidad de fibrosis: 0 (sin cicatrices), 1 (cicatrices
mínimas), 2 (la cicatrización ha ocurrido y se extiende fuera de
las áreas que contienen vasos sanguíneos), 3 (puentes de fibrosis extendiéndose y conectándose con otras áreas que contienen
fibrosis) y 4 (cirrosis).
Diagnostico
En la literatura, se han descrito diferentes métodos diagnósticos
de la EHNA y cirrosis.Desde métodos diagnósticos invasivos
hasta métodos diagnósticos no invasivos que vienen cambiando
el paradigma diagnóstico y reflejan el estado inflamatorio y
fibrótico del hígado con gran rendimiento diagnostico [21].
Marcadores invasivos de EHNA y Cirrosis
Biopsia
La biopsia de hígado ha sido considerada el principal estándar de
referencia para diagnóstico de EHNA y cirrosis, además, determina
pronostico. Es imprescindible para diferenciar entre hepatitis
alcohólica grave y cirrosis alcohólica descompensada y, de igual
forma, cuando hay sospecha de cirrosis hepática de etiología
desconocida para confirmar el diagnóstico y conocer su posible
causa. Sin embargo, presenta múltiples limitaciones como el alto
costo, error en la calidad de la muestra, la variabilidad inter e
intra observados y los riesgos asociados a el procedimiento por
lo que en la actualidad no es un auténtico estándar de oro [22].
Existen diferentes métodos de puntuación histológica para
reporte de la biopsia, sin embargo, Metavir tiene mayor
correlación clínica, imagenológica y pronóstica (ver Tabla 1).
| Nivel |
Esteatosis |
Inflamación en globo |
Inflamación Intraglobular |
Inflamación portal |
| Leve(Grado 1) |
Hasta 66% |
Zona 3 ocasional |
PM dispersos +/- linfocitos |
Leve o ausente |
| Moderada(Grado 2) |
Cualquier grado |
Evidente, predomina la zona 3 |
PM dispersos e inflamación crónica |
Leve a moderada |
| Severa(Grado 3) |
Panacinar |
Evidentes y desorden, en zona 3 |
PM dispersos +/- inflamación crónica leve |
Leve a moderada |
| Etapa 1: Zona 3 Fibrosis perisinusoidal / pericelular, focal o extensa |
| Etapa 2: Zona 3 Fibrosis perisinusoidal / pericelular + fibrosis periportal focal o extensa |
| Etapa 3: Zona 3 Perisinusoidal / Fibrosis pericelular + fibrosis portal + fibrosis de puente |
| Etapa 4: Cirrosis |
Tabla 1. Clasificación y Estadificación METAVIR Histológica del EHNA.
Marcadores no invasivos de EHNA y Cirrosis
Teniendo en cuenta las limitaciones que tiene la biopsia como
Gold Estándar para el diagnóstico de EHNA en los últimos años
se han desarrollado biomarcadores y estudios de imagen no
invasivos para diagnóstico y estadificación de la fibrosis hepática,
entre ellos:
1. Biomarcadores sanguíneos que reflejan la fisiopatogenia del
NASH
2. Biomarcadores bioquímicos directos e indirectos
3. Métodos de imagen evaluando rigidez y elasticidad
Biomarcadores Sanguíneos
La complejidad de la fisiopatogenia aun no del todo clara de EHNA
ha llevado al estudio de múltiples marcadores que reflejan las
vías de la enfermedad más allá de las transaminasas debido a que
los niveles séricos de estas sirven como parámetro para evaluar la enfermedad hepática crónica incluida EHNA sin embargo sus
niveles aislados no son predictivos de esta patología (Tabla 2)
[23].
| Tipo de biomarcador |
Marcador |
Ventajas |
Desventajas |
| Marcadores de Apoptosis |
Fragmento de CK18 |
Mayor nivel de evidencia, disponible comercialmente, se correlaciona con mejoría histológica |
Sensibilidad deficiente, precisión limitada en aislamiento |
| Marcadores de Inflamación |
PCR
FNT
IL-8
CXCL-10 |
Correlaciona con actividad inflamatoria, están disponible comercialmente |
No es válido como marcador diagnóstico, influenciado por la inflamación sistémica |
| Productos de Oxidación de Lípidos |
11-HETE
9/13 HODE
13 OXO-ODE
LA 13-HODE |
Buena precisión en estudios pequeños |
Poco validados |
| Enzimas Liposomales |
Catepsina D |
Disponible comercialmente, alto grado de precisión, fiable |
Mayoría de validaciones son en población bariátrica, alto costo, se desconoce si es dinámico a los cambios histológicos |
CK18, citoqueratina 18; PCR, proteína C reactiva; CXCL10, ligando de quimiocina CXC 10; diHETrE, ácido dihidroxi-eicosatrienoico; HETE, ácido hidroxiicosatetraenoico; HODE, ácido hidroxioctadecadienoico; LA, ácido linoleico; oxo-ODE, ácido oxo-octadecadienoico.
Tabla 2. Biomarcadores Sanguíneos
La citoqueratina 18 es la principal proteína dentro del
hepatocito y se escinde durante su muerte lo que conlleva a su
liberación extracelular por lo que es útil como biomarcador de
daño hepático sin embargo debido a su baja sensibilidad (66%)
y especificidad (82%) no es lo suficientemente precisa para su
clínico [24-26].
Teniendo en cuenta la modesta precisión de estos biomarcadores
de forma individual se han creado paneles donde se combinan
estas pruebas para aumentar utilidad diagnostica (EHNA test), sin
embargo, existe falta de validación en diferentes grupos étnicos y
/o poblaciones de cirugía no bariátrica [27-29].
Biomarcadores Bioquímicos Directos
Respecto a los biomarcadores de fibrosis tienen la ventaja de
que al poder realizar las mediciones repetidamente sin afectar
el estado del hígado (lo que no siempre ocurre con la biopsia)
permite la supervisión de la progresión de la enfermedad o su
regresión como parte del seguimiento ya sea de la historia natural
del padecimiento hepático o como resultado de los regímenes de
tratamiento. Las pruebas incluyen la medición de:
•Transaminasas: El valor predictivo de la relación AST/ALT se
ha validado en algunas formas de hepatitis aguda y crónica,
y/o esteatosis esta relación es ≤ 1, mientras que en la hepatitis
alcohólica una relación AST/ALT es a menudo >2 [30].
•Trombocitopenia: Es un marcador valioso para cirrosis, puede
estar relacionada con mecanismos tales como hiperesplenismo,
mielo supresión por virus de la hepatitis C (VHC), disminución
de la producción de trombopoyetina y el desarrollo de procesos
autoinmunes, sin embargo, la evaluación conjunta de la
relación AST/ALT y el recuento de plaquetas (PLT) tiene un valor
diagnóstico alto para la cirrosis (70-90%) (30). El recuento de
plaquetas puede ser un signo indirecto de hipertensión portal
cuando se asocia a la medición en kPa de la elastografía, es
decir, valores por elastografía menores de 20 kPa con plaquetas
>150.000 es muy baja la probabilidad de tener hipertensión
portal, por tanto, se recomienda seguimiento endoscópico y no
inicio de profilaxis primaria [31,32].
•Péptido carboxilo-terminal de la pro-colágena tipo I y péptido
amino-terminal de la pro-colágena tipo IIIb (PIIINP): Durante
la fibrogénesis, los niveles de colágena tipo I pueden aumentar
hasta 8 veces; además, la relación I/III también cambia de 1:1 en
el hígado sano, a 1:2 en cirrosis. Sin embargo, hasta el 50% de las personas sanas pueden tener alterado el índice, por sí solo no es
un buen método predictor de fibrosis [30].
•Colágeno tipo IV: En la hepatitis C, el punto de corte para el
diagnóstico en la etapa F2 se estableció en 110 ng/ml y para
predecir la etapa F3 en 130 ng/ml. La combinación de este
marcador y PIIINP da resultados de sensibilidad y especificidad
del 88% [31].
•Ácido Hialuronico (HA): En un estudio realizado en pacientes
con enfermedad de hígado graso no alcohólico, el HA fue
seleccionado como el mejor marcador para fibrosis, con un
AUROC de 0.97 y con una especificidad y sensibilidad del 88-95%
y 86-100% respectivamente, para este grupo. Sin embargo, se ha
reportado que su valor predictivo positivo es menor (61%) que el
valor predictivo negativo (98-100%), concluyendo que la utilidad
principal de este marcador reside en que es posible descartar
fibrosis avanzada y cirrosis dependiendo de su nivel sérico [31].
•Proteína 4 asociada a microfibrillas: Ceguera et al, demostraron
que la proteína 4 asociada a microfibrillas mostró niveles séricos
de diagnóstico de alta precisión para la predicción de cirrosis en
un grupo control (individuos sanos) comparado con un grupo de
pacientes con Virus de la Hepatitis C (AUROC=0.97, p<0.0001)
con una sensibilidad del 91.6% y una especificidad del 95.6%,
así como en el estadio F0 comparado con el F4 (AUROC=0.84,
p<0.0001), y en etapas F0-F3 vs F4 (AUROC=0.76, p<0.0001) [30].
Biomarcadores indirectos (Puntuaciones
compuestas)
Varias pruebas de suero que incluyen marcadores directos de
remodelación de la matriz extracelular y marcadores directos
de daño hepático (pruebas hepáticas, transaminasas, recuento
de plaquetas) se han conjugado para elaborar puntuaciones
combinadas que responden a diferentes preguntas clínicas
como la estadificación de la fibrosis, el diagnóstico de cirrosis,
la presencia de hipertensión portal y pronóstico de pacientes
con cACLD. Los resultados de estas puntuaciones indirectas son
predictores de fibrosis F4 [32].
El FibroTest (FT, patentado por Biopredictive, París, Francia) fue
el primer multicomponente que combinó los datos resultantes de
diversas pruebas y tiene un rendimiento similar en la predicción
de la supervivencia a 5 años de la rigidez hepática mediante
elastografía transitoria en una gran cohorte de pacientes con
Virus de hepatitis C [33,34].
Tabla 3 El objetivo de estos puntajes indirectos de fibrosis hepática
es estimar el posible estadio de correspondiente con el índice
histológico Metavir y la cantidad de fibrosis relacionada con las
determinaciones, sin embargo, deben siempre correlacionarse y
complementarse con otras medidas no invasivas o invasivas para
dar el diagnóstico de cirrosis hepática [35].
| Índices serológicos de multicomponentes |
| Estudio |
Prueba serológica |
Sensibilidad (%) |
Especificidad (%) |
| APRI |
AST/Plaquetas |
89 |
75 |
| PGA |
Tiempo de protombina, GGT, apolipoproteína A1 |
91 |
81 |
| PGAA |
Tiempos de protrombina, GGT, apolipoproteína A1, α2-macroglobulina |
66 |
72 |
| Forns |
Edad, plaquetas, GGT, colesterol |
94 |
51 |
| FibroTest |
Edad, genero, GGT, bilirrubinas, α2-macroglobulina, apolipoproteína A1, haptoglobina |
75 |
85 |
| HepaScore |
Edad, género, bilirrubina, GGT, ácido hialurónico, γ2-macroglobulina |
71 |
84 |
| FIB-4 |
Plaquetas, ALT, AST, edad |
70 |
74 |
| FibroIndex |
Plaquetas, AST, GGT |
78 |
74 |
| FibroMeter |
Plaquetas, AST, edad, γ2- macroglobulina, tiempos de protrombina, ácido hialurónico, urea |
81 |
84 |
Tabla 3. Puntajes indirectos de fibrosis
Métodos imagenológicos: Determinan rigidez hepática no
invasivo
La elastografia (ET) es la medición de la rigidez o elasticidad de
un tejido y utiliza un pulso mecánico de vibración y una onda de
ultrasonidos. La velocidad de propagación de la onda elástica
es proporcional a la rigidez del tejido (cuanto más duro sea el
tejido más rápido se propaga la onda). El resultado se expresa en
unidades de kilopascal (kPa) [36].
El método comercializado que utiliza la ET para medir la
rigidez del hígado se denomina FibroScan (FS). La rigidez o
elasticidad hepática, medida con el FS, en sujetos sanos es de
aproximadamente 5,5±1,6 kPa [37].
Los valores superiores a 10 kPa sugieren Enfermedad hepática
crónica avanzada y los valores superiores a 12.5 kPa tiene una
precisión de más del 90% en la detección de cirrosis. Los valores
≥21 kPa son altamente específicos de hipertensión portal
clínicamente significativa y se asocian con un mayor riesgo de
descompensación clínica de la cirrosis y con un mayor riesgo
de hepatocarcinoma. La ET permite evitar la biopsia hepática
en el 90% de los pacientes con cirrosis y hasta en el 70% de los
pacientes con fibrosis significativa cuando se combina con otros
métodos no invasivos [36].
La ET puede estimar el GPVH como medida indirecta de hipertensión
portal, es decir, cuando la ET es <20 kPa y un recuento de plaquetas >150×10 9/L puede descartar grandes várices esofágicas en
pacientes compensados lo que conduce a una reducción en el
número de endoscopias innecesarias para detectar las várices,
disminución del uso de betabloqueadores y generar medidas de
tamizaje y seguimiento a estos pacientes sin intervenirlos [37].
Por otra parte, la ET también puede predecir la correlación con el
riesgo de descompensación, es decir, el riesgo descompensación
es nulo (VPN=100%) en pacientes con ET <21 kPa [38].
FibroScan: CAP (Parámetro de atenuación
controlada)
El parámetro de atenuación controlada (CAP), una medida no
invasiva obtenida con FibroScan, se ha desarrollado para la
evaluación de la esteatosis hepática como medida diagnóstica y
pronóstica (58-64). El CAP corresponde a la pérdida de energía
en forma de ultrasonidos y que viaja a través del medio, es
decir, la intensidad de los ultrasonidos emitidos disminuye
exponencialmente con la profundidad a través del hígado. El CAP
se mide con la sonda M a 3.5 MHz a una profundidad de entre
25 y 65 mm, es expresado en decibeles por metro (dB/m) y en el
mismo volumen de hígado que la ET. La puntuación CAP fluctúa
entre los 100 y los 400 dB/m [38].
El CAP puntúa según el grado de esteatosis hepática desde S0
hasta S3, correlacionando los dB/m con el posible porcentaje de
grasa a nivel de los hepatocitos en la histología, es decir [39].
1. S0: <5% infiltración grasa en hígado.
2. S1: 5-33% infiltración grasa en hígado.
3. S2: 33-66% infiltración grasa en hígado.
4. S3: <67% infiltración grasa en hígado.
Ahora cuando se correlaciona los resultados del CAP medido por
FibroScan con el grado de infiltración grasa en hígado, se realiza
en base a los siguientes parámetros:
1. S0: <206.5 dB/m
2. S1: 206.5-232.5 dB/m
3. S2: 232.5-282.5 dB/m
4. S3 >282.5 dB/m [13].
CONCLUSION
La esteatohepatitis no alcohólica es una enfermedad de alta
prevalencia actualmente debido a la cada vez mas frecuente
presencia de sindrome metabólico en nuestra población. La
fisiopatogenia aún no está establecida completamente, sin
embargo, se ha asociado de forma recurrente con la presencia de
obesidad, lipotoxicidad y resistencia a la insulina como fenómenos
que finalmente conducen al daño hepático y la fibrosis. El
diagnostico de esta patologia tiene como Gold Estándar el uso de
la biopsia hepática que permite determinar, a su vez, una probable
causa y pronostico; sin embargo, debido a las limitaciones de
este procedimiento se han descrito en la actualidad métodos no
invasivos que permiten un diagnostico certero de esta enfermedad
basándonos en parámetros bioquímicos, moleculares y de imagen
que permiten una aproximación temprana de la enfermedad y por
lo tanto favorecen su abordaje terapéutico.
Referencias
- Dufour JF, Scherer R, Balp MM, McKenna SJ, Janssens N, Lopez P, et al. The global epidemiology of nonalcoholic steatohepatitis (NASH) and associated risk factors-A targeted literature review. Endocr Metab Sci 2021;3.
Google Scholar, Cross Ref
- Caligiuri A, Gentilini A, Marra F. Molecular pathogenesis of NASH. Int J Mol Sci 2016;17(9):1575.
Indexed at, Google Scholar, Cross Ref
- Melzer OA, Rothkopf MM, Ganjhu L. Nonalcoholic fatty liver disease. Metab Med Surg 2014:115-132.
- Williams CD, Stengel J, Asike MI, Torres DM, Shaw J, Contreras M, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: A prospective study. Gastroenterology 2011; 140(1):124-131.
Indexed at, Google Scholar, Cross Ref
- McCullough AJ. Pathophysiology of nonalcoholic steatohepatitis. J Clin Gastroenterol 2006;40(S1):S17-S29.
Indexed at, Google Scholar, Cross Ref
- Kitade H, Chen G, Ni Y, Ota T. Nonalcoholic fatty liver disease and insulin resistance: New insights and potential new treatments. Nutrients 2017; 9(4):387.
Indexed at, Google Scholar, Cross Ref
- Friedman SL, Neuschwander-Tetri BA, Rinella M, Sanyal AJ. Mechanisms of NAFLD development and therapeutic strategies. Nat Med 2018;24(7):908-922.
Indexed at, Google Scholar, Cross Ref
- Haas JT, Miao J, Chanda D, Wang Y, Zhao E, Haas ME, et al. Hepatic insulin signaling is required for obesity-dependent expression of SREBP-1c mRNA but not for feeding-dependent expression. Cell Metab 2012.
Indexed at, Google Scholar, Cross Ref
- Min HK, Kapoor A, Fuchs M, Mirshahi F, Zhou H, Maher J, et al. Increased hepatic synthesis and dysregulation of cholesterol metabolism is associated with the severity of nonalcoholic fatty liver disease. Cell Metab 2012;15(5):665-674.
Indexed at, Google Scholar, Cross Ref
- Ioannou GN. The Role of Cholesterol in the Pathogenesis of NASH. Trends Endocrinol Metab 2016;27(2):84-95.
Indexed at, Google Scholar, Cross Ref
- Fuchs M, Sanyal AJ. Lipotoxicity in NASH. J Hepatology 2012;56(1):291-293.
Indexed at, Google Scholar, Cross Ref
- Peverill W, Powell LW, Skoien R. Evolving concepts in the pathogenesis of NASH: Beyond steatosis and inflammation. Int J Mol Sci 2014; 15(5):8591-8638.
Indexed at, Google Scholar, Cross Ref
- Straub BK, Schirmacher P. Pathology and biopsy assessment of non-alcoholic fatty liver disease. Dig Dis 2010; 28(1):197-202.
Indexed at, Google Scholar, Cross Ref
- Brunt EM, Tiniakos DG. Histopathology of nonalcoholic fatty liver disease. World J Gastroenterol 2010; 16(42):5286-5296.
Indexed at, Google Scholar, Cross Ref
- Kleiner DE. Histopathology, grading and staging of nonalcoholic fatty liver disease. Minerva Gastroenterol Dietol 2018.
Indexed at, Google Scholar, Cross Ref
- Takahashi Y, Fukusato T. Histopathology of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. World J Gastroenterol 2014; 20(42):15539-15548.
Indexed at, Google Scholar, Cross Ref
- Bedossa P. Pathology of non-alcoholic fatty liver disease. Liver Int 2017;37(S1):85-89.
Indexed at, Google Scholar, Cross Ref
- Lackner C, Gogg-kamerer M, Zatloukal K, Stumptner C, Brunt EM, Denk H. Ballooned hepatocytes in steatohepatitis : the value of keratin immunohistochemistry for diagnosis. J Hepatol 2008; 48(5):821-828.
Indexed at, Google Scholar, Cross Ref
- Brunt EM, Kleiner DE, Wilson LA, Unalp A, Behling CE, Lavine JE, et al. Portal chronic inflammation in nonalcoholic fatty liver disease (NAFLD): a histologic marker of advanced NAFLD-clinicopathologic correlations from the Nonalcoholic Steatohepatitis Clinical Research Network. Hepatology 2009; 49(3):809-820.
Indexed at, Google Scholar, Cross Ref
- Velázquez Abente S, Girala Salomón M. Etiology, stage and complications of liver cirrhosis in a reference hospital in Paraguay. Rev Virtual la Soc Paraguaya Med Interna 2018.
Google Scholar, Cross Ref
- Sumida Y, Nakajima A, Itoh Y. Limitations of liver biopsy and non-invasive diagnostic tests for the diagnosis of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. World J Gastroenterol 2014;20(2):475-485.
Indexed at, Google Scholar, Cross Ref
- Wong VWS, Adams LA, de Lédinghen V, Wong GLH, Sookoian S. Noninvasive biomarkers in NAFLD and NASH-current progress and future promise. Nat Rev Gastroenterol Hepatol 2018; 15(8):461-478.
Indexed at, Google Scholar, Cross Ref
- Eguchi A, Wree A, Feldstein AE. Review Biomarkers of liver cell death. J Hepatol 2014; 60(5):1063-1074.
Indexed at, Google Scholar, Cross Ref
- Vuppalanchi R, Jain AK, Deppe R, Yates K, Masuoka HC, Neuschwander-tetri BA, et al. Relationship between changes in serum levels of keratin 18 and changes in liver histology in children and adults with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol 2014;12(12):2121-2130.
Indexed at, Google Scholar, Cross Ref
- Kwok R, Tse Y, Wong GL, Ha Y, Lee AU, Ngu MC, et al. Systematic review with meta-analysis : non-invasive assessment of non-alcoholic fatty liver disease-the role of transient elastography and plasma cytokeratin-18 fragments. Aliment Pharmacol Ther 2014; 39(3):254-269.
Indexed at, Google Scholar, Cross Ref
- Poynard T, Ratziu V, Charlotte F, Messous D, Munteanu M, Imbert-bismut F, et al. Diagnostic value of biochemical markers ( NashTest ) for the prediction of non alcoholo steato hepatitis in patients with non-alcoholic fatty liver disease. BMC Gastroenterol 2006; 6: 34.
Indexed at, Google Scholar, Cross Ref
- Younossi ZM, Jarrar M, Nugent C, Randhawa M, Afendy M. A Novel Diagnostic Biomarker Panel for Obesity-related Nonalcoholic Steatohepatitis ( NASH ). Obes Surg 2008; 18(11):1430-1437.
Indexed at, Google Scholar, Cross Ref
- Walenbergh SMA, Houben T, Rensen SS, Bieghs V, Hendrikx T, Gorp PJ Van, et al. Plasma cathepsin D correlates with histological classifications of fatty liver disease in adults and responds to intervention. Sci Rep 2016;6:38278.
Indexed at, Google Scholar, Cross Ref
- Cequera A, García de León Méndez MC. Biomarcadores para fibrosis hepática, avances, ventajas y desventajas. Rev Gastroenterol México 2014;79(3):187-199.
Indexed at, Google Scholar, Cross Ref
- Procopet B, Berzigotti A. Diagnosis of cirrhosis & portal hypertension: Imaging, non-invasive markers of fibrosis & liver biopsy. Gastroenterology Rep 2017; 5(2):79-89.
Indexed at, Google Scholar, Cross Ref
- Berzigotti A. Advances and challenges in cirrhosis and portal hypertension. BMC Med 2017; 15(1):200.
Indexed at, Google Scholar, Cross Ref
- Kamath PS, Mookerjee RP. Individualized care for portal hypertension: Not quite yet. J Hepatol 2015; 63(3):543-545.
Indexed at, Google Scholar, Cross Ref
- Adams LA, George J, Bugianesi E, Rossi E, De Boer WB, van der Poorten D, et al. Complex non-invasive fibrosis models are more accurate than simple models in non-alcoholic fatty liver disease. J Gastroenterol Hepatol 2011; 26(10):1536-1543.
Indexed at, Google Scholar, Cross Ref
- Poynard T, Munteanu M, Deckmyn O, Ngo Y, Drane F, Castille JM, et al. Validation of liver fibrosis biomarker (FibroTest) for assessing liver fibrosis progression: Proof of concept and first application in a large population. J Hepatol 2012; 57(3):541-548.
Indexed at, Google Scholar, Cross Ref
- Carrión JA. Utilidad del Fibroscan® para evaluar la fibrosis hepática. Gastroenterol Hepatol 2009.
Indexed at, Google Scholar, Cross Ref
- Aller R, Fernández-Rodríguez C, lo Iacono O, Bañares R, Abad J, Carrión JA, et al. Consensus document. Management of non-alcoholic fatty liver disease (NAFLD). Clinical practice guideline. Gastroenterol Hepatol 2018; 41(5):328-349.
Indexed at, Google Scholar, Cross Ref
- Mikolasevic I, Orlic L, Franjic N, Hauser G, Stimac D, Milic S. Transient elastography (FibroScan®) with controlled attenuation parameter in the assessment of liver steatosis and fibrosis in patients with nonalcoholic fatty liver disease - Where do we stand? World J Gastroenterol 2016;22(32):7236-7251.
Indexed at, Google Scholar, Cross Ref
- Andrade P, Rodrigues S, Rodrigues-Pinto E, Gaspar R, Lopes J, Lopes S, et al. Diagnostic Accuracy of Controlled Attenuation Parameter for Detecting Hepatic Steatosis in Patients with Chronic Liver Disease. GE Port J Gastroenterol 2017; 24(4):161-168.
Indexed at, Google Scholar, Cross Ref








