Key words
T. spiralis, Heat shock protein, Hsp70
IntroducciÓn
La triquinelosis es una enfermedad zoonótica causada por diferentes especies, subespecies y cepas de nematodos del género Trichinella. P [1] P La triquinosis es una enfermedad parasitaria que afecta a mamíferos silvestres (jabalís, venados, linces, zorros, osos, lobos, roedores entre otros, y algunas aves depredadoras como la lechuza y el halcón rojo) y domésticos (cerdos, perros, gatos, ratas, entre otros), que se transmite de forma accidental al hombre por la ingesta de carne o productos cárnicos crudos o insuficientemente cocinados procedentes de animales infectados, sobre todo de cerdo. El agente causal de la enfermedad es el nematodo Trichinella spiralis. En cuanto a su distribución, se trata de una enfermedad cosmopolita. P [2-6]
El ciclo biológico de T. spiralis, muestra que el parásito se puede encontrar en un hospedador intermediario y en uno definitivo. En este ciclo, el hombre aparece involucrado como hospedador accidental. El ciclo biológico de T. spiralis incluye tres fases: a nivel intestinal, sistémico y muscular, cuyos estadíos correspondientes son; adultos, larva recién nacida (LRN) y larva infectante (LI). P [3,7]
Durante el ciclo biológico de T. spiralis, se ha encontrado que este nematodo secreta enzimas o proteasas, las cuales, son específicas de las fases del desarrollo del ciclo biológico del parásito, P [8-12] P cuyos cambios en el modelo de expresión y secreción de las proteasas durante los estadíos del nematodo, podrían estar relacionados con la falla de las barreras mecánica y humoral del hospedador, ayudando a que el parásito se aloje en el hospedador. P [13]
La presencia de proteasas ha sido descrita en larvas alojadas en músculo P [13-15] P y en adultos de 6 días de edad P [8] P e histoquímicamente en larvas recién nacidas de 48 a 72 horas de edad. P [13]
La larva alojada en el músculo es conocida como larva infectante (LI), cuando un animal se infecta, las LI penetran en los enterocitos y sufren un proceso de mudas (L2, L3, L4 y adulto). P [16] P Se establecen en un nicho de colágeno a pH ácido y los productos de excreción/secreción de la larva en estado muscular indican que el parásito secreta proteasas en ese estadío para facilitar el establecimiento intestinal como ocurre con otros nematodos intestinales. P [17,18] P Setenta y dos horas post-infección, hembras y machos copulan y días después comienza la producción de larvas recién nacidas, estas migran vía vasos linfáticos y/o por los capilares para establecerse en músculo.
Es posible que la migración de las larvas recién nacidas sea también facilitada por proteasas. P [13] P La actividad fibrinolítica mostrada por las larvas adultas (de 3 a 6 días de edad) y las larvas recién nacidas podría indicar un papel anticoagulante para facilitar la migración de las larvas recién nacidas por el sistema sanguíneo; esta actividad ha sido previamente descrita también en otras helmintiasis y asociada con estos procesos. P [9,19] P La migración puede ser también facilitada por la degradación de la inmunoglobulina G que ha sido mostrada en productos de excreción/secreción en nematodos de 3 días de edad, así como en larvas recién nacidas lo que constituye una evasión común al sistema inmune del hospedador y que ha sido descrita en otros parásitos. P [20] PHay que hacer notar también la incapacidad de los nematodos de 6 días de edad para degradar inmunoglobulina G, P [9] P esta situación puede ser explicada por el hecho de que el parásito evade la respuesta inmune humoral del intestino con proteasas contra inmunoglobulina G que son descargadas por los adultos antes de los 6 días post-infección y que son guardadas en el tejido intestinal, así como por la habilidad de las larvas recién nacidas para degradar inmunoglobulina G. La misión de los adultos de 6 días de edad es facilitar la migración de las larvas recién nacidas con la producción de proteasas contra fibrinógeno. P [21]
Los organismos responden al estrés por infecciones parasitarias y otro tipo de agentes estresantes a través de una familia de proteínas altamente conservada conocida como proteínas de estrés térmico (Hsp; heat shock proteins). Las Hsp representan el 2-15% del total de las proteínas celulares, están altamente conservadas en los organismos procariotes y eucariotes. P [22]
Las Hsp fueron descritas por primera vez por Ritossa (1962) P [23] P en células de las glándulas salivales de Drosophila melanogaster. Tissiéres y Col. (1974) P [24] P demostraron que la desnaturalización o agregado de proteínas durante el estrés, se acompaña de un aumento en la síntesis de novo de Hsp. El inductor más potente es el calor, así como las infecciones microbianas, radiaciones ultravioleta, cambios en la osmolaridad, agentes oxidantes, pH, nutrientes, presencia de sustancias tóxicas como etanol, metales pesados; algunos antibióticos, rayos gamma de baja intensidad, exposición a análogos de aminoácidos y glucosa, oxido nítrico, hormonas, P [25-28] P enfermedades autoinmunes como el lupus eritematoso sistémico, P [29] P por privación de agua y alimento, P [30] P inflamación, fiebre, citotoxinas y anoxia entre otros. P [31]
Bajo condiciones fisiológicas, las Hsp tienen influencia en la síntesis, transporte y degradación de proteínas; P [32,33] P bajo condiciones estresantes, actúan como moléculas chaperonas. P [34] P Cabe señalar, que la sobreexpresión de chaperonas moleculares incluyendo miembros de la familia de Hsp70 y pequeñas proteínas de estrés en Drosophila y C. elegans han mostrado que extienden la duración de la vida de estos organismos, donde se han implicado a los factores de shock térmico (HSF) como reguladores de la longevidad. P [35-37]
Por lo anterior y debido a sus funciones vitales, las Hsp se utilizan como marcadores de daño por estrés en enfermedades, P [38,39] P en estudios de eficacia de drogas, P [40] P en estudios ecotoxicológicos, P [41] P y como constituyente de vacunas. P [42,43]
En el presente estudio, el objetivo fue determinar si T. spiralis secreta compuestos bioactivos in vitro, cuya acción en células epiteliales MDCK inducen estrés, medido a través de la expresión de la Hsp70.
Material y MÉtodos
Animales, infección y lugar de alojamiento: Se utilizaron 5 ratas Long Evans hembras con una edad promedio de dos meses y medio, con un peso aproximado de 250 gramos. Cada animal fue infectado con 500 LI de T. spiralis por vía oral y se sacrificaron 30 días post-infección. Los animales se mantuvieron en condiciones normales de Bioterio.
Obtención de LI por la Técnica de Digestión Artificial: Las LI viables se obtuvieron de ratas Long Evans infectadas con T. spiralis, de las cuales al sacrificarlas, se obtuvo el tejido muscular que fue molido. Se pesaron 60 gramos de carne y se colocaron en un costal de tela de tul, el cual se introdujo en un embudo de separación para ser sometida a digestión con jugo gástrico artificial, preparado con 1 litro de agua destilada conteniendo pepsina a una concentración de 10,000 U, 3% de HCL 0.2 N (pepsina 3.5 grs. más 7 ml de HCL), teniéndolo en incubación por 24 horas a 37º C para recolectar el paquete larvario, mismo que fue resuspendido en una solución tamponada de fosfatos (PBS)(Gibco BRL, Grand Island NY, USA, 21300-58). P [44]
Inducción de los compuestos secretores de LI de T. spiralis: El paquete larvario se dividió en 3 partes iguales, a los que se les agrego medio de cultivo CDMEM. Después fueron sometidos a 3 diferentes temperaturas. Una fue tomada como control (temperatura ambiental, 21°C), otra como factor de disminución del metabolismo (4°C) y la otra como inductora de secreción simulando la temperatura de un hospedador mamífero (37°C). Cada 24 horas, se les cambio el medio de cultivo por medio fresco, y el obtenido se filtró y se utilizó sobre cultivos de células MDCK.
Cultivo celular: Las células Madin Darby canine kidney (MDCK) fueron obtenidas de la American Type Culture Collection (MDCK, CCL 34). Las células entre los pasajes 60 y 80 fueron crecidas a 37P o PC en botellas de plástico desechables (Costar 3151, Cambridge, Ma) con una atmósfera de 95% de humedad y 5% de COB2B (SteriCult 200, Forma Scientific, Ohio) y 20 ml de medio basal de cultivo Dulbecco's modificado por Eagle's (DMEM; D1152, Sigma Chemical Co. St. Louis, Mo.) con penicilina (100 U/ml), estreptomicina (100 μg/ml; In vitro, México), insulina (0.08 U/ml; Eli Lilly, México), y 10% de suero fetal bovino certificado (FBS) (Gibco BRL, 16000- 028, Grand Island, N.Y.). Las células fueron levantadas del sustrato con tripsina EDTA (In Vitro, México) y sembradas a confluencia. Pasada una hora en la cual la mayoría de las células se había pegado al plástico, el medio fue removido y remplazado con medio fresco y se cultivaron por 24 horas. Después a las células se les cambió el medio, el cual fue remplazado por el obtenido de los nematodos a diferente temperatura y se incubaron a 37°C por 3 horas.
Obtención de Extracto celular soluble e insoluble: Las células MDCK cultivadas en los medios obtenidos de LI a diferente temperatura por 3 horas, se lavaron 3 veces con solución amortiguadora de fosfatos (PBS; pH de 7.2)( (Gibco BRL, Grand Island NY, USA, 21300-058), se le añadió 1 ml de buffer de lisis que contiene: Triton X-100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 e inhibidor de proteasas 1 mM, PMSF (Sigma Chemical Co, St Louis MO, USA, P-7626). En frío, las células MDCK con el buffer de lisis se homogenizaron. El lisado se centrifugó por 10 minutos a 1600 g y el sobrenadante fue recuperado y se determinó la concentración de proteínas. P [45] P Este mismo procedimiento se utilizó para obtener un extracto total de LI de T. spiralis. La cuantificación de proteína se realizó mediante la técnica descrita por Bradford (1976). P [46] P De cada condición experimental, 30 μg de proteína fueron caracterizados en geles de poliacrilamida (PAGE-SDS al 10%) de acuerdo a la técnica descrita por Laemmli (1970). P [47]
Western Blot y análisis: Las proteínas en los geles de poliacrilamida-SDS fueron transferidas a papel de nitrocelulosa (Amersham Laboratories, Buckinghamshire, England, RPN303C), como describió Towbin et al. (1979). P [48] P Después, para identificar a las proteínas Hsp, el blot fue tratado con anticuerpos monoclonales específicos contra la proteína Hsp70 (Sigma Chemical Co, St Louis MO, USA, H-4149) con una dilución 1:1000. Un anticuerpo anti-IgG de ratón conjugado a peroxidasa (Sigma Chemical Co, St Louis MO, USA, A-9044) dilución 1:1500, fue usado como segundo anticuerpo, seguido por un sistema de detección quimioluminiscente (ECL, RPN2106, Amersham, Little Chalfont, Buckinghamshire, England), que fue detectado en una película radiográfica BioMax (Eastman Kodak Co, Rochester, NY, USA, 870-1302) en un tiempo de 1 minuto.
Determinación de la cantidad de Hsp70: Las autoradiografías obtenidas por el método de ECL se analizaron por densitometría (Eagle Eye, Estratagene Mitsubishi) con el fin de cuantificar la cantidad de proteína.
Análisis estadístico: La banda de proteína Hsp70 obtenida bajo las condiciones de temperatura (21, 4 y 37°C), fue analizada por densitometría, y los resultados obtenidos fueron expresados como media ± s.e.m., donde n es el número de observaciones.
Resultados
Análisis de compuestos bioactivos secretados por T.spiralis (in vitro).
Uno de los objetivos fundamentales de este trabajo fue analizar el grado de estrés que ejercen los compuestos secretados por el nematodo T. spiralis sobre células epiteliales MDCK. Para ello, del tejido muscular de ratas infectadas con T. spiralis, se obtuvieron LI por digestión artificial, se colocaron en medio de cultivo y se expusieron a diferente temperatura.
Demostramos que in vitro y a diferente temperatura, los nematodos secretan compuestos bioactivos. Los compuestos bioactivos secretados por los nematodos in Vitro, reaccionan con un suero de rata infectada con T. spiralis por 30 días, dando un patrón muy similar al obtenido utilizando extracto total de T. spiralis. Dichos compuestos secretados por T. spiralis son inmunogénicos con rango de peso molecular que va de los 20 a los 200kDa. La concentración de estos compuestos secretados es mayor cuando el nematodo se encuentra a temperatura de 37°C (Figura 1).
Figura 1. Inmunodetección de compuestos secretados in vivo e in vitro por T. spiralis a diferente temperatura. (A) Patrón electroforético de extracto total de T. spiralis. (B) Patrón electroforético del medio de cultivo obtenido de la incubación con T. spiralis a diferente temperatura. Ambos se inmunodetectaron utilizando un suero de rata infectada por 30 días.
Expresión de Hsp70 en células MDCK inducida por compuestos bioactivos secretados por T. spiralis in vitro.
Con el fin de analizar el grado de estrés inducido por los compuestos bioactivos secretados por T. spiralis in vitro, se realizaron cultivos de células epiteliales MDCK a confluencia (Figura 2), después de 24 horas se les agregó medio de cultivo donde estuvieron incubados los nematodos de T. spiralis y se dejaron por 3 horas más.
Figura 2. Cultivo de células epiteliales MDCK sembradas a confluencia y crecidas a 37P o PC con una atmósfera de 95% de humedad y 5% de COB2
Después las células se lisaron y caracterizaron sus proteínas por PAGESDS, Western Blot y se inmunodetectó la expresión de la Hsp70 en la fracción soluble; así mismo se analizó la expresión de la Hsp70 en la fracción insoluble o del citoesqueleto para determinar posibles cambios en la distribución de la Hsp70, ya que estos compuestos bioactivos secretados por el nematodo podrían estar afectando la integridad del citoesqueleto, y la Hsp70 podría estar uniéndose a componentes del citoesqueleto para corregir el daño. Se encontró que los compuestos bioactivos secretados por T. spiralis inducen estrés en las células MDCK, cuya respuesta es a través de la expresión de la Hsp70 tanto en la fracción soluble como en la insoluble, sobre todo de las sustancias provenientes del medio de cultivo donde estuvieron los nematodos a 37°C. (Figura 3).
Figura 3. Expresión de la Hsp70 en células MDCK incubadas con el medio obtenido de los cultivos de T. spiralis a diferente temperatura (4, 21, 37°C). S = Fracción soluble; I = Fracción insoluble. Análisis por Western blot e inmunodetección con un anticuerpo anti-Hsp70 y reveladas por quimioluminiscencia (ECL).
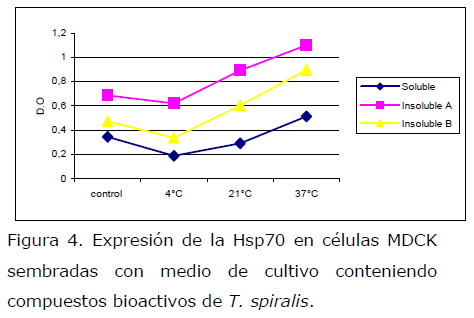
A las bandas de proteína obtenidas por Western blot e inmundetectadas con un anticuerpo contra la Hsp70 utilizando quimioluminiscencia, se les realizó densitometría y los valores obtenidos se presentan en la tabla 1, cuyos resultados fueron graficados para su análisis (Figura 4).
Tabla 1. Densitometría de las bandas de proteína Hsp70 obtenidas por Western blot y reveladas por quimioluminiscencia.
Figura 4. Expresión de la Hsp70 en células MDCK sembradas con medio de cultivo conteniendo compuestos bioactivos de T. spiralis.
Los compuestos bioactivos secretados por T. spiralis que inducen estrés en las células MDCK, su proteína Hsp70 se ve disminuida en la fracción soluble en células cultivadas en medio que contenía triquinas a 4°C (baja temperatura) y 21°C (temperatura ambiente) y se sobreexpresa a 37°C (temperatura corporal de un hospedador), mientras que en la insoluble (Banda A y Banda B), la expresión fue mayor a 21 y 37°C. Ambas bandas pertenecen a proteínas del citoesqueleto que probablemente sean alteradas por estos compuestos ya sea de manera directa o indirecta (Tabla 1, Figura 4).
DiscusiÓn
Es conocido que las proteasas presentes en extractos crudos de T. spiralis así como en los productos de excreción/secreción, son enzimas implicadas durante las fases del ciclo biológico del parásito, y son específicos para cada estado de desarrollo de T. spiralis. P [8-10,18,49]
Tomando como fundamento lo anterior, en el presente trabajo nuestro objetivo fue determinar si T. spiralis secreta compuestos bioactivos in vitro, cuya acción en células epiteliales MDCK es inducir estrés, medido a través de la expresión de la Hsp70.
Demostramos que in vitro y a diferente temperatura, los nematodos secretan compuestos biológicamente activos. Los compuestos biológicamente activos secretados por los nematodos in Vitro, reaccionan con un suero de rata infectada con T. spiralis por 30 días, dando un patrón muy similar al obtenido utilizando extracto total de T. spiralis. Esto coincide con lo encontrado por otros autores donde han encontrado productos proteicos de secreción/excreción en los diferentes estadíos biológicos de T. spiralis. P [8-12] P Hay que resaltar que el patrón inmunogénico obtenido por PAGE-SDSWester blot de compuestos secretados in vitro presentan un rango amplio, con pesos moleculares que van de los 20 a los 200 kD.
Posteriormente, al analizar si los compuestos secretados por T. spiralis inducían estrés sobre las células epiteliales MDCK medido a través de la expresión de la Hsp70 tanto en la fracción soluble como en la insoluble, esta última relacionada con el citoesqueleto, encontramos que los compuestos secretados por T. spiralis tienen actividad biológica ya que inducen estrés en las células MDCK, sobre todo aquellas que provenían de un medio de cultivo donde se mantuvieron los nematodos a 37°C. Esta sobreexpresión de la Hsp70 se observó tanto en la fracción soluble, como en la insoluble.
En el presente trabajo encontramos de manera constitutiva la expresión de la proteína Hsp70, miembro que se encuentra en todas las células tanto procariotas como eucariotas, con una distribución ubicua. P [50-54] P La función de esta proteína es proteger al organismo de los efectos tóxicos del calor y otras formas de estrés.P [55] P La Hsp70 se sobreexpresa para ayudar en la reparación de polipéptidos que se desnaturalizan durante el estrés hipertérmico u otras formas de estrés. P [53,56] P Además la Hsp70 tiene la función de estabilizar la estructura de las proteínas cuando está en competencia entre un estado desplegado y un estado de ensamblaje.P [22]
Numerosos trabajos han establecido el papel de la Hsp70 en la prevención de la apoptosis, ejercido esencialmente por intermedio de una protección contra los radicales libres de oxígeno, P [57,58] P así como contra la citotoxicidad del factor de necrosis tumoral alfa (TNF-α).P [59]
En este trabajo se demuestra que efectivamente los compuestos secretados por T. spiralis in vitro tienen actividad biológica, ya que inducen estrés en los cultivos de células epiteliales MDCK medido por la sobreexpresión de la Hsp70. Por los resultados encontrados, suponemos que la secreción de proteasas, es el mecanismo que el parásito utiliza in vivo para establecerse en el intestino, reproducirse y que las larvas recién nacidas crucen la barrera epitelial para pasar a la linfa y de ahí a tejido muscular, ya que es conocido que las proteasas secretadas por el nematodo, son específicas de las diferentes fases de desarrollo del parásito.P [11,12]
Nosotros creemos que algunos de los compuestos bioactivos secretados por T. spiralis in vitro, son proteasas las cuales tienen su acción sobre componentes del complejo de unión presentes en todas las células epiteliales, y al desestabilizarlo se altera el citoesqueleto ya que este se encuentra anclado a algunos componentes del complejo de unión, con lo que lo desestabiliza y abre las uniones intercelulares permitiendo el paso del parásito hacia linfa. Lo anterior se concluye debido a que encontramos un aumento de la Hsp70 asociada al citoesqueleto en las células MDCK expuestas al medio de cultivo donde se encontraban los nematodos.
Podemos concluir que T. spiralis normalmente secreta compuestos bioactivos contra los cuales, el hospedador produce anticuerpos. Dentro de estas sustancias, es posible que se encuentren proteínas con actividad enzimática que rompan la estabilidad epitelial cuya función principal es ser una barrera selectiva.
Los compuestos secretados por T. spiralis se incrementan conforme el nematodo se encuentra a temperaturas óptimas de crecimiento es decir, a 37°C. Posiblemente, T. spiralis cruza la barrera epitelial a nivel intestinal ayudado por compuestos bioactivos de secreción/excreción y así causar enfermedad.
Agradecimientos
Apoyo del CONACYT. Dr. Sergio Hugo Sánchez Rodríguez. Contrato: 499100- 5-I31456-N.
BibliografÍa
- TVignau ML. Triquinosis. Ciencia hoy en línea. 2004;14:58-65.
- Despommier D. Trichinella spiralis. Apple Trees Productions, New York, 2004.
- Álvarez de Sotomayor RMB. La Triquinosis. Revista de Ciencias Naturales. 2005;2.
- Krivokapich SJ, Molina V, Bergagna HF, Guarnera EA. Epidemiological survey of Trichinella infection in domestic synantrhopic and sylvatic animals from Argentina. J. Helminthol. 2006;80(3):267.
- Reiterova K, Kincekova J, Snabel V, Marucci G, Pozio E, Dubinsky P. Trichinella spiralis-outbreak in the Slovak Republic. Infection. 2007;35(2):89-93.
- Pozio E. World distribution of Trichinella ssp. infections in animals and humans. Vet Parasitol. 2007;149:3-21.
- Despommier D, Gwadz WR, Hotez JP. Parasitic disease. Springer Verlag. Third edition. 1994. pp. 32-40.
- Polzer M, Conradt V. Identification and partial characterization of the proteases from diferent developmental stages of Schistocephalus solidus (cestoda: Pseudophyllidea). Int. J. Parasitol. 1994;24:967-973.
- Todorova VK, Knox DP, Kennedy MW. Proteinases in the excretory/secretory products (ES) of adult Trichinella spiralis. Parasitology. 1995;111:201-208.
- Vázquez LC, Armas SC de, Jiménez PC, Rodríguez CF. Proteolytic activity of the Gymnorhynchus gigas plerocercoid: purification and properties of a collagenase from the crude extract. Parasitol. Res. 1999;85:64-70.
- McKerrow JH, Dohenhoff MJ. Schistosoma proteases. Parasitol. Today. 1988;4:334-340.
- Britton C, Knox DP, Canto GJ, Urquhart GM, Kennedy MW. The secreted and somatic proteinases of the bovine lungworm Dictyocaulus viviparus and their inhibition by antibody from infected and vaccinated animals. Parasitology. 1992;105:325-333.
- Moczon T, Wranicz M. Trichinella spiralis proteinases in the larvae. Parasitol. Res. 1999;85:47-58.
- Criado FA, Armas SC de, Jiménez PC, Casado EN, Jiménez GA, Rodríguez CF. Proteolytic enzymes from Trichinella spiralis larvae. Vet. Parasitol. 1992;45:133-140.
- Armas SC, Jiménez PC, Jiménez GA, Bernadina WE, Rodríguez CF. Purification and preliminary characterization of a protease from the excretion-secretion products of Trichinella spiralis muscle-stage larvae. Vet. Parasitol. 1995;59:157-168.
- Soulé C. Etude du parasite. In: La Trichinellose: une Zoonose en Évolution. C. Soulé and J. Dupoy- Camet (Eds.), Office International des Epizooties, Paris, France. 1991. pp. 7-42.
- Kennedy MW, Tierney J, Ye P, McMongale FA, Macintosh A, McLaughlin D, Smith JW. The secreted and somatic antigens of the third stage larva of Anisakis simplex and the antigenic relationship with Ascaris suum, A. lumbricoides and Toxocara canis. Mol. Biochem. Parasitol. 1998;31:35-46.
- Rodríguez-Fuentes GB, Cedillo- Rivera R, Fonseca-Liñán R, Argüello-García R, Muñoz O, Ortega-Pierres G, Yépez-Mulian L. Giardia duodenalis: analysis of secreted porteases upon trophozoite-epithelial cell interaction in vitro. Mem. Inst. Oswaldo Cruz. 2006;101(6):693- 696.
- Hotez PJ, Nguyen LT, McKerrow JH, Cerami A. Isolation and characterization of a proteolytic enzyme from the adult hookworm Ancylostoma caninum. J. Biol. Chem. 1985;260:7343- 7348.
- Matsumoto K, Yakamoto T, Kamata R, Maeda H. Pathogenesis of serratial infection: activation of Hageman factor-prekallicrein cascades and serratia protease. J. Biochem. 1984;96:739.
- Ros MRM, Vazquez LC, Gimenez PC, Armas de SC, Rodríguez CF. A study of proteases throughout the life cycle of Trichinella spiralis. Folia Parasitol. 2000;47(1):49-54.
- Nollen EAA, Morimoto RI. Heat shock response: cellular and molecular responses to stress, misfolded proteins, and diseases associated with protein aggregation. In Wiley Encyclopedia of Molecular Medicine. Inc. 2002. pp: 1553- 1563.
- Ritossa F. A new puffing pattern induced by temperature shock and DNP in Drosophila. Experiential. 1962;18:571-573.
- Tissiéres A, Mitchell HK, Tracy U. Protein synthesis in salivary glands of Drosophila melanogaster. Relation to chromosome puffs. J. Mol. Biol. 1974;84:389-398.
- Nover L. Inducers of HSP synthesis: heat shock and chemical stressors. In L. Nover (Ed). Heat Shock Response. CRC Press. Boca Raton, Florida. 1991. pp.5-40.
- Morimoto IR. Regulation of the heat shock transcriptional response: cross talk between a family of the shock factors, molecular chaperones, and negative regulators. Genes and Development. 1998;12:3788- 3796.
- Vega-Carrillo HR, Bañuelos- Valenzuela R, Manzanares-Acuña E, Sánchez-Rodríguez SH. Response of human lymphocytes to low gamma ray doses. Alasbimn Journal. 2001;3(12).
- Bañuelos-Valenzuela R, Sánchez- Rodríguez SH. La proteína de estrés calórico hsp70 funciona como un indicador de adaptación de los bovinos a las zonas áridas. REDVET. 2005;VI(3).
- Villalobos-Hurtado R, Sánchez- Rodríguez SH, Avalos-Díaz E, Herrera Esparza R. Possibile ruolo di hsp70 nel trasporto di autoantigeni alla giunzione dermo-epidermica nel lupus eritematoso sistemico. possible role of hsp70 in autoantigen shuttling to the dermo-epidermal junction in systemic lupus erythematosus. Reumatismo. 2003;55(3):155-158.
- Barajas-Vásquez GE, Baldwin- Sevilla C, Barbosa-Cisneros OY, Sánchez-Rodríguez SH. Las proteínas de estrés calórico hsp60, 70 y 90 participan en la adaptación de los caprinos a las zonas áridas. REDVET. 2005;VI(3).
- Brenner BG, Wainberg MA. Heat shock protein-based therapeutic strategies against human immunodeficiency virus type I infection. Infect. Dis. Obstet. Gynecol. 1999;7:80-90.
- Terlecky SR. Hsp70s and lysosomal proteolysis. Experientia. 1994;50:1021-1025.
- Beissinger M, Buchner J. How chaperones fold proteins. Biol Chem. 1998;379:245-259.
- Forreiter C, Nover L. Heat induced stress proteins and the concept of molecular chaperones. J Biosci. 1998;23:287-302.
- Tatar M, Khazaeli AA, Curtsinger JW. Chaperoning extended life. Nature. 1997;390:30.
- Yokoyama K, Fukumoto K, Murakami T, Harada S, Hosono R, Wadhwa R, Mitsui Y, Ohkuma S. Extended longevity of Caenorhabditis elegans by knocking in extra copies of Hsp70F, a homolog of mot-2 (mortalin)/mtHsp70/Grp75. FEBS Lett. 2002;516:53–57.
- Walker GA, Lithgow GJ. Lifespan extension in C. elegans by a molecular chaperone dependent upon insulin-like signals. Aging Cell. 2003;2:131.
- Macario AJL. Heat-shock proteins and molecular chaperones: implications for pathogenesis, diagnostics and therapeutics. Int J Clinical Lab Res. 1995;25:59- 70.
- Merino S, Martínez J, Barbosa A, Møller AP, de Lope T, Pérez J, Rodríguez CF. Increase in a heat shock protein from blood cells in response of nestling house martins (TDelichon urbicaT) to parasitism: an experimental approach. Oecologia. 1998;116:343-347.
- Tosi P, Visani G, Ottaviani E, Gibellini D, Pellacani A, Tura S. Reduction of heat-shock protein- 70 after prolonged treatment with retinoids: biological and clinical implications. Am J Hematol. 1997;56:143-150.
- Eckwert H, Alberti G, Koehler HR. The induction of stress proteins (HSP) in TOniscus asellusT (Isopoda) as a molecular marker of multiple heavy metal exposure: I. Principles and toxicological assessment. Ecotoxicology. 1997;6:249-262.
- Newport GR. Heat shock proteins as vaccine candidates. Immunology. 1991;3:17-24.
- Ferraz JC, Stavropoulos E, Yang M, Coade S, Espitia C, Lowrie DB, Colston MJ, Tascon RE. A Heterologous DNA Priming- Mycobacterium Bovis BCG Boosting Immunization Strategy Using Mycobacterial Hsp70, Hsp65, and Apa Antigens Improves Protection against Tuberculosis in Mice. Infection and Immunity. 2004;72:6945- 6950.
- Del Río A, Herrera RM, Herrera R. “Triquinosis experimental I: extracción de antígenos y procedimiento para detectar anticuerpos”, Arch. Invest. Med. 1986;17:359-367.
- Harlow E, Lane D. “Antibodies a laboratory manual”. Cold Spring Harbor Laboratory. Cold Spring Harbord, N.Y. 1988.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical. Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrilamide geles nitrocellulose sheets: procedure and applications. Proc. Natl. Acad. Sci. USA. 1979;76:4350- 54.
- Robinson MV, Massie DH, Connolly B. Secretion and processing of a novel multidomain cystatin-like protein by intracellular stages of Trichinella spiralis. Mol. Biochem. Parasitol. 2007;151(1):9-17.
- Lindquist S. The heat shock response. Annu Rev Biochem. 1986;55:1151-1191.
- Hendrick JP, Harti FU. Molecular chaperone functions of heatshock proteins. Annual Review of Biochemistry. 1993;62:349-384.
- Harti FU. Molecular chaperones in cellular protein folding. Nature. 1996;381:571-580.
- Ciocca DR, Oesterreich S, Chammess GC, McGuire WL, Fuqua SAW. Biological and clinical implications of heat shock protein 27000 (Hsp27): a review. Journal of National Cancer Institute. 1993;85:1558-1569.
- Jolly C, Morimoto R. I. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J. Natl. Cancer Inst. 2000;92:1564- 72.
- Lyashko VN, Vikulova VK, Chernicov VG, Ivanov VI, Ulmasov KA, Zatsepina OG, Evgen’ev MB. Comparison of the heat shock response in ethnically and ecologically different human population. Proceedings of National Academy of Sciences of the USA. 1994;91:12492-12495.
- Kopecek P, Altmannova K, Weigl E. Stress proteins: Nomenclature, division and functions. Biomed. Papers. 2001;145(2):39-47.
- Garrido C, Gurbuxani S, Ravagnan L, Kroemer G. Heat shock proteins: endogenous modulators of apoptotic cell death. Biochem. Biophys. Res. Commun. 2001;286:433- 442.
- Mallouk Y, Vayssier TM, Bonventre JV, Polla BS. Heat shock protein 70 and ATP as partners in cell homeostasis. Int. J. Mol. Med. 1999;4:463-474.
- Ip SP, Che CT, Kong YC, Ko KM. Effects of schisandrin B pretreatment on tumor necrosis factor-alpha induced apoptosis and Hsp70 expression in mouse liver. Cell Stress Chaperones. 2001;6:44-48.
1107