Introducción
El reconocimiento de lo propio y lo no propio por el sistema inmune es de importancia para el entendimiento de la autoinmunidad, donde el rompimiento de la tolerancia a antígenos propios es el rasgo más común. El Lupus Eritematoso Sistémico (LES) es una enfermedad multisistémica de origen autoinmune caracterizada por un conjunto de autoanticuerpos, especialmente antinucleares y daño mediado por complejos inmunes. El LES es una enfermedad que presenta un alto índice de mortalidad. En los pacientes con LES que presentan un compromiso renal, la expectativa de vida es más pobre [1-5]. Se ha encontrado en biopsias renales de pacientes con Lupus con compromiso renal, daño celular e infiltrado, un incremento en la expresión de las citosinas TNF-α e IL-6 [6].
Muchas enfermedades renales se caracterizan por un infiltrado de células mononucleares/monocitos o células T que frecuentemente participan en la respuesta inflamatoria. Las células proveen diversos factores como el factor de necrosis tumoral (TNF) de los monocitos/macrófagos, Fas ligando, radicales libres de oxígeno y óxido nítrico, capaces de inducir apoptosis celular del parénquima renal; a su vez el TNF-α puede promover la inflamación por dos mecanismos: lisis de células apoptóticas y la liberación activa de citosinas pro-inflamatorias como IL-6 e IL-1β [7].
La función de TNF en inmunidad es la proliferación celular, diferenciación y apoptosis; juega además un papel fundamental en orquestar la respuesta inflamatoria innata en vertebrados. Localmente, TNF dispara la expresión de quimiosinas y citosinas, que promueven la adhesión, extravasación, atracción y activación de leucocitos en el sitio de infección. Después, facilita la transmisión de la inmunidad innata a adquirida por aumento de la presentación de antígenos y la co-estimulación de células T. Los pacientes con LES, cuando producen bajos niveles de TNF-α, son más propensos a desarrollar nefritis, complicación asociada con la presencia de anticuerpos anti-ds DNA [8]. En consecuencia, es posible que altos niveles de TNF-α protejan contra nefritis lúpica [9]. El TNF-α aumenta la producción de mediadores de la inflamación como la ciclooxigenasa (COX)-2, Prostaglandina E2 (PGE2) y el óxido nítrico [10].
El óxido nítrico funciona como una molécula señalizadora y efectora en una gran variedad de procesos patológicos y fisiológicos. El óxido nítrico puede ser un potente mediador del proceso inflamatorio o de apoptosis [11]. El óxido nítrico es sintetizado a partir de la L-arginina a través de la óxido nítrico sintetasa (NOS) [12]. Se han identificado dos isoformas constitutivas calcio-dependientes: la endotelial (eNOS) o tipo III, la neural (nNOS) o tipo I y la forma calcio-independiente (iNOS) o tipo II inducible, que se activa en respuesta a estímulos inmunológicos tales como: interferón gdamma (IFN-?), factor de necrosis tumoral alfa (TNF-α) y lipopolisacárido bacteria (LPS) [13-16]. El glomérulo normalmente expresa la NOSe. Sin embargo, bajo condiciones inflamatorias por complejos inmunes la forma inducible (NOSi) es sobrerregulada [17]. En LES, se ha demostrado que la producción del óxido nítrico se correlaciona con la actividad de la enfermedad [18,19].
Otros mensajeros intracelulares que regulan numerosas respuestas biológicas son las citosinas proinflamatorias IL-1, IL-6 que junto con el TNF-α inducen desde el hígado la liberación de proteínas de fase aguda, promoviendo la eliminación de autoantígenos de la circulación [20]. Trabajos llevados a cabo en pacientes con LES, revelan niveles significativamente altos de TNF-α e IL-6 en suero, en biopsias de riñón de pacientes con Nefritis lúpica, la producción local de IL-6 se presenta a lo largo del glomérulo y del túbulo. También se ha encontrado IL-6 en la orina, por lo que se considera puede servir como un marcador para el diagnóstico [9].
El impacto de la apoptosis en la producción celular y homeostasis ha sido ampliamente reconocido, las anormalidades en la apoptosis pueden causar enfermedades tales como cáncer, autoinmunidad y posiblemente desordenes degenerativos [21,22]. La apoptosis implica la participación de una célula en su propia muerte. Se han identificado cuatro grupos principales de moléculas involucradas en el proceso de apoptosis, estas son: caspasas, proteínas adaptadoras, las cuales controlan la activación de caspasas iniciadoras, miembros de la superfamilia de receptores para factor de necrosis tumoral (TNFR) y miembros de la familia de proteínas Bcl-2 [23,24].
La apoptosis en riñón puede ser inducida por células renales mesangiales, del epitelio renal tubular y del endotelio glomerular o de los leucocitos infiltrantes. La enfermedad renal puede ser iniciada por isquemia, toxinas exógenas o mediadores de daño tisular, como los complejos inmunes, quienes son responsables del daño inicial. Por otra parte, la progresión de la enfermedad renal puede ser consecuencia de una tasa elevada de apoptosis en el parénquima renal que al final dejará atrofia glomerular o tubular ocasionada por la presencia de células inflamatorias [25].
El TNF-α en células del epitelio glomerular y células mesangiales induce apoptosis. La activación de Fas, radicales de oxígeno y anticuerpos anti-Thy1 inducen apoptosis en células mesangiales. Mientras que el TNF-α, la activación de Fas, la inhibición de la proteína cinasa C, nefrotoxinas y ceramida inducen apoptosis en células tubulares [26].
La eliminación de células inflamatorias por apoptosis puede contribuir a resolver la inflamación y su falla puede contribuir a la persistencia del proceso inflamatorio [27,28]. Las citosinas expresadas por las células renales, como TNF-α y Fas ligando pueden contribuir a la progresión de la enfermedad renal a través de la prolongada sobrevivencia o activación de macrófagos y linfocitos T [29]. La expresión de factores letales como TNF-α y Fas ligando se incrementa en varios tipos de daño renal, donde se ha observado un incremento en la expresión de Fas, Bcl2 y Bax en células mesangiales en glomerulonefritis proliferativa [30].
Cuando se altera la homeostasis celular por agentes estresantes, se ha observado la expresión de un grupo de proteínas conocidas como proteínas de choque calórico (heat shock proteins, Hsp). Las Hsp, son una familia de proteínas altamente conservadas que se expresan de de manera constitutiva y ubicua bajo condiciones normales en células procariotas y eucariotas, pero su expresión se eleva cuando el medio ambiente celular es alterado (temperatura elevada, UV, inanición, infecciones virales, lupus, etc.). Dichas proteínas han sido clasificadas de acuerdo a su peso molecular en varias familias (Hsp10,27,33,47,60,70,90,110) [31-37] y cada una posee una función específica; así la Hsp27 funciona como una proteína antiapoptótica, y también juega un papel fundamental en el mantenimiento del citoesqueleto durante una lesión subletal del podocito, la que podría ser un objetivo terapéutico en nefropatías glomerulares [38]; mientras que la Hsp60 es altamente inmunogénica, ya que se ha visto que es blanco importante de los anticuerpos anti-células endoteliales, especialmente en vasculitis asociada con enfermedades autoinmunes sistémicas, donde puede acelerar la actividad de procaspasa 3, induciendo a las células endoteliales a la apoptosis [39]. Otro estudio en ratones híbridos Nueva Zelanda con enfermedad tipo lupus, demostró que la Hsp70 es receptor de la 15-Deoxiespergualina, originando inmunosupresión en la progresión de las anormalidades inmunológicas en dichos ratones [40].
Debido a lo anterior es importante entender las alteraciones fisiológicas a nivel renal en LES y poder prevenir las complicaciones a largo plazo, por lo que en este trabajo, se buscó determinar el papel de TNFα e IL-6 en la alteración de los procesos homeostáticos de las células renales como son la producción de óxido nítrico, estrés celular y activación de procesos de muerte celular, explorando las moléculas que participan en estas vías. Por lo anterior, es importante aclarar el papel que juegan las citosinas inflamatorias IL-6 y TNF-α en la inducción de la expresión de las enzimas, como la NOSe y NOSi, que aumentan la concentración de óxido nítrico, el cual, altera la homeostasis celular induciendo estrés y posiblemente la apoptosis. Así, el objetivo del presente estudio fue medir la expresión de NOSe, NOSi, citrulina, nitritos/nitratos, Hsp60, Hsp70, y la posible activación de apoptosis vía Fas-L y caspasa 8 en células renales MDCK bajo el efecto de IL-6 y TNF-α.
Material y Métodos
Cultivo de células MDCK
Las células Madin Darby Canine Kidney (MDCK) fueron obtenidas de la American Type Culture Collection (MDCK, CCL 34). Las células fueron crecidas a 37°C en botellas de plástico (Costar 3151, Cambridge, Ma), con una atmósfera del 95% de aire y 5% de CO2 (SteriCult 200, Forma Scientific, Ohio) en medio de cultivo Dulbecco’s modificado por Eagle´s (Gibco BRL, 16000-028, Grand Island, N.Y) conteniendo penicilina (100 U/ml), estreptomicina (100 μg/ml; In vitro, México), insulina (0.08 U/ml; Eli Lilly, México) y 10% de suero fetal bovino certificado (FBS) (Gibco BRL, 16000-028, Grand Island, N.Y.). Las células fueron levantadas con tripsina-EDTA (In Vitro, México) y sembradas a confluencia en cajas petri [41]. Las células se cultivaron con concentraciones de 200 pg/ml de TNF-α (Sigma Chemical Co, St Louis MO, USA, T-6674) y de 125 pg/ml de IL-6 (Sigma Chemical Co, St Louis MO, USA, I-1395) y un control sin las citosinas antes mencionadas. Posteriormente se extrajeron 100 μl de medio de cultivo a las 24 y 48 horas, para determinar la producción de nitritos/nitratos.
Determinación de la producción de óxido nítrico en el medio de cultivo de las células MDCK inducido por TNF-α e IL-6 (ELISA). Se utilizó la prueba de Griess que mide indirectamente la producción de óxido nítrico por la formación de nitritos, que se cuantifican mediante una reacción colorimétrica. Se colocaron cantidades iguales del reactivo 1% de sulfanilamida, 0.1% de naftiletileno diamina dihidrocloridio (Sigma Chemical Co, St Louis MO, USA, N-9125), 2.5 % de H3PO4 y medio de cultivo antes y después de haber sometido los cultivos al efecto de TNF-α e IL-6. Se leyeron las muestras a 550 nm [42,43].
Obtención de anticuerpos anti-citrulina: Acoplamiento del aminoácido citrulina a Albúmina Sérica Bovina (ASB). En un tubo de vidrio se colocaron 10 mg de ASB (Sigma Chemical Co, St Louis MO, USA, A-9056) más 2 ml de amortiguador de Borato pH=10. Se agitó suavemente y se agregaron 10-15 mg del péptido citrulina (Sigma Chemical Co, St Louis MO, USA, C-7629). Después se agregó lentamente 1 ml de solución de glutaraldehído 0.3%. Se dejó reaccionar 2 horas en agitación constante. Posteriormente se adicionaron 0.25 ml de glicina 1M para bloquear al glutaraldehído que no reaccionó, en un tiempo de 30 minutos. Después se dializó el conjugado en 3 litros de amortiguador de Borato pH 8.5 toda la noche a 4ºC. Se alicuotó y liofilizó el conjugado ASB-citrulina [44].
Esquema de inmunización. Se utilizó un lote de conejos a los cuales se les inmunizó con conjugado (ASB-citrulina). En la primera inmunización se inoculó al conejo con 5 mg de conjugado; una segunda, tercera y cuarta inmunizaciones se realizaron con un intervalo de ocho días con la mitad de la concentración inicial; una quinta inmunización se realizó con la concentración inicial para incrementar la producción de anticuerpos. Posteriormente se sangró vía intravenosa para analizar los títulos de anticuerpos contra citrulina por la técnica de ELISA.
Determinación de los títulos de anticuerpos por ELISA. Con una solución 0.5 mM del conjugado en amortiguador de carbonatos, se cubrió con 100 μl/pozo la microplaca y se dejó en incubación toda la noche a 4ºC. Se descartó el conjugado, se lavó 3 veces con PBS-tween. Se cubrieron los sitios inespecíficos con 300 μl/pozo de ovoalbúmina y se incubó 1 hora a 37ºC. Se lavó 3 veces con PBS-tween. Se agregó el suero diluido y se incubó 2 horas a 37ºC. Posteriormente se agregaron 100 μl/pozo de anticuerpo anti-IgG de conejo conjugado con peroxidasa (Sigma Chemical Co, St Louis MO, USA, A-9169), dilución 1:1000, se incubó 3 horas a 37ºC, se lavó 3 veces con PBS-tween, se adicionaron 50 μl del sustrato y Diaminobenzidina y se incubó durante 3 horas a 37ºC. Se leyó a 405 nm (Gráfica 1). [44] Se trabajó con una concentración 0.5 mM del conjugado a una dilución 1:100 para evitar reconocimientos inespecíficos, cuya especificidad fue probada por inmunodifusión doble y Dot-blot.
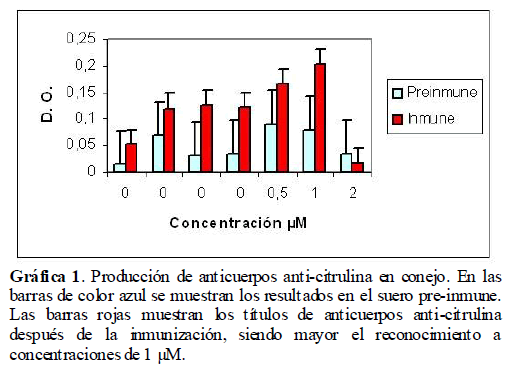
Gráfica 1. Producción de anticuerpos anti-citrulina en conejo. En las barras de color azul se muestran los resultados en el suero pre-inmune. Las barras rojas muestran los títulos de anticuerpos anti-citrulina después de la inmunización, siendo mayor el reconocimiento a concentraciones de 1 μM.
Dot blot. Se colocaron 5 μl de conjugado ASB-Cit, conjugado ovoalbúmina-Citrulina, ASB, PBS, citrulina, arginina, histidina y alanina en una membrana de nitrocelulosa. Se lavaron las tiras con PBS-tween. Se bloquearon las tiras con 2 ml de ovoalbúmina. Se lavaron con PBS-tween, se secaron a 37º C durante 30 minutos. Se agregaron 2 ml de suero de conejo dilución 1:100, por 20 min. Se lavaron con PBS-tween, se secaron a 37º C por 30 minutos. Se agregaron 2 ml del segundo anticuerpo de conejo conjugado con peroxidasa (Sigma Chemical Co, St Louis MO, USA, A-9169), dilución 1:100. Se lavaron con PBS-tween, se secaron a 37º C por 30 minutos. Se realizó el revelado con Diaminobenzidina y se le agregó una gota de H2SO4 para detener la reacción.
Inmunodifusión doble. Se prepararon placas de agarosa al 0.9%, se dejaron gelificar y se les hicieron perforaciones en forma de roseta. Se enfrentó el suero del conejo, el cual se colocó en el pozo del centro y citrulina en la periferia, concentración 1 mg/ml, dilución 1:4; conjugado ASB-CIT, dilución 1:4; conjugado OVO-CIT, dilución 1:4; ASB, dilución 1:4. Se observó a las 24 horas. Adicionalmente se enfrentó el suero, dilución 1:100, 1:1000, el cual se colocó en los pozos de la periferia y citrulina en el pozo del centro concentración 1 mg/ml, dilución 1:4. Se observó hasta el sexto día.
Lisis celular. Las células después de haber sido tratadas con IL-6 y TNF-α, fueron lavadas 3 veces con solución de fosfatos salinos (PBS; pH 7.2) (Gibco BRL, Grand Island NY, USA, 21300-058), después se les añadió 0.5 ml de buffer de lisis que contenía: Tritón X-100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 e inhibidor de proteasas 1 mM, PMSF (Sigma Chemical Co, St Louis MO, USA, P-7626). El lisado se centrifugó durante 10 minutos a 1600 g, el sobrenadante fue recuperado y se le determinó la concentración de proteínas.
Determinación de proteínas. La cuantificación de proteínas se realizó mediante la técnica descrita por Bradford (1976) [45], para su posterior caracterización por electroforesis en geles de poliacrilamida (PAGE-SDS).
Electroforesis. De cada condición experimental, 30 μg de proteína se caracterizaron en geles de poliacrilamida (PAGE-SDS) al 10% de acuerdo a la técnica descrita por Laemmli (1970) [46].
Western blot e Inmunodetección. Las proteínas en los geles de poliacrilamida fueron transferidas a papel de nitrocelulosa (Amersham Laboratories, Buckinghamshire, England, RPN303C), como describió Towbin (1979) [47]. Después, para identificar las proteínas, el blot fue tratado con anticuerpos monoclonales específicos contra las proteínas NOSi, NOSe, caspasa 8 y Fas-L (Santa Cruz Biotechnology, Inc. NOS2: sc-651, NOS3: sc-654, Caspase-8 p20: sc-7890, Fas-L: sc-8009), así como, citrulina de conejo, Hsp60 y 70 (Sigma Chemical Co, St Louis MO, USA, H-4149, H-5147) con una dilución 1:500. Un anticuerpo anti-IgG de ratón conjugado a peroxidasa (Sigma Chemical Co, St Louis MO, USA, A-9044) y un anticuerpo anti-IgG de conejo conjugado a peroxidasa (Sigma Chemical Co, St Louis MO, USA, A-9169) dilución 1:1000, se usaron como segundos anticuerpos, seguido por un sistema de detección quimioluminiscente (ECL, RPN2106, Amersham, Little Chalfont, Buckinghamshire, England), que fue detectado en una película radiográfica BioMax (Eastman Kodak Co, Rochester, NY, USA, 870-1302) en un tiempo de 1 minuto.
Determinación de la cantidad de NOSe, NOSi, citrulina, Hsp60, Hsp70, Fas-L y caspasa 8. Las autorradiografías obtenidas por el método de ECL se analizaron por densitometría (Bio-Rad, Chemy-Doc), con el fin de cuantificar la cantidad de proteína. El valor control fue contrastado con las condiciones tratadas con IL-6 y TNF-α.
Análisis estadístico. Las bandas de proteína NOSe, NOSi, citrulina, Hsp60, Hsp70, Fas-L y caspasa 8 obtenidas bajo las condiciones de sembrado en presencia de IL-6 y TNF-α, fueron analizadas por densitometría (Bio-Rad, Chemy-Doc), y los resultados obtenidos de ésta, fueron expresados como media ? s.e.m., donde n es el número de observaciones.
Resultados
Expresión de NOSe y NOSi en células MDCK tratadas con TNF-α e IL-6
Estudios realizados en biopsias renales de pacientes con LES y diagnóstico de glomerulonefritis, han mostrado la presencia de mediadores de la inflamación como el TNF-α y la IL-6, así como cambios en la expresión de NOSe y NOSi.
Para establecer una correlación entre lo previamente encontrado en pacientes con LES y la acción que pueda tener el TNF-α y la IL-6 en la expresión de NOSe y NOSi in Vitro, se realizaron cultivos de células renales MDCK, las cuales se sometieron a concentraciones diferentes de TNF-α e IL-6. Las células bajo las condiciones de cultivo antes mencionadas se lisaron y caracterizaron las proteínas NOSe y NOSi por PAGE-SDS y Western blot. Se encontró, un incremento de las enzimas NOSe y NOSi en los cultivos celulares cuando son tratados con IL-6 y TNF-α, siendo mayor el incremento a las 48 horas para TNF-α, mientras que para IL-6 es mayor a las 24 horas. A estos resultados se les realizó densitometría para cuantificar la cantidad de proteína NOSe y NOSi expresada para cada condición experimental (Gráfica 2).
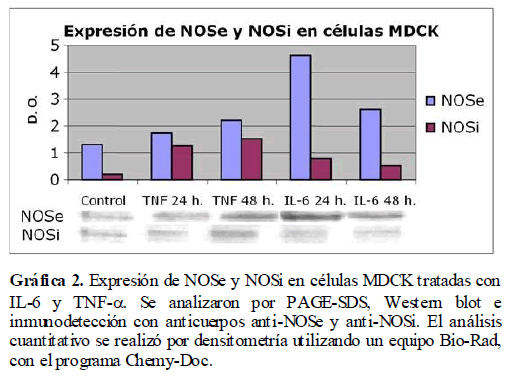
Gráfica 2. Expresión de NOSe y NOSi en células MDCK tratadas con IL-6 y TNF-?. Se analizaron por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-NOSe y anti-NOSi. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
Expresión de citrulina en células MDCK tratadas con TNF-α e IL-6
Al encontrar una evidente sobreexpresión de las enzimas NOSe y NOSi, las cuales participan en la vía de síntesis del óxido nítrico en células MDCK tratadas con TNF-α e IL-6, el siguiente paso fue ver la expresión de citrulina bajo estas condiciones de cultivo. Lo anterior, debido a que citrulina es un aminoácido producto secundario en la actividad de NOS durante la formación del óxido nítrico, por lo que su presencia es un indicativo de la síntesis de óxido nítrico. Para lo anterior, se cultivaron células MDCK, las cuales se sometieron a concentraciones diferentes de TNF-α e IL-6. Posteriormente las células se procesaron para PAGE-SDS y Western blot. Se encontró un incremento de este aminoácido a las 48 horas con TNF-α y a las 24 y 48 horas con IL-6 (Gráfica 3).
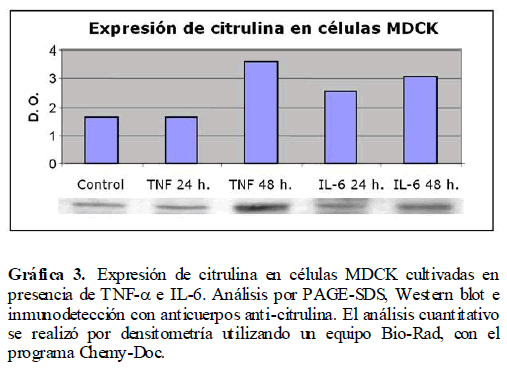
Gráfica 3. Expresión de citrulina en células MDCK cultivadas en presencia de TNF-? e IL-6. Análisis por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-citrulina. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
Determinación de nitritos/nitratos en células MDCK tratadas con TNFα e IL-6
Hasta aquí, hemos demostrado que cuando los cultivos de células MDCK son tratadas con TNF-α e IL-6 se modifica la expresión de las enzimas NOSe y NOSi. Las enzimas NOSe y NOSi catalizan la producción de óxido nítrico a partir de L-Arginina y uno de sus productos es citrulina, que también hemos demostrado que se modifica su expresión cuando las células MDCK son estimuladas con TNF-α e IL-6. El paso a seguir, fue demostrar que bajo estas condiciones, se produce el óxido nítrico, por lo que fue necesario determinar la concentración de nitritos/nitratos en el medio de cultivo de células MDCK estimuladas con TNF-α e IL-6 a través de la prueba de Griess. Se encontró un incremento en la concentración de nitritos/nitratos a las 24 y 48 horas de cultivo, disminuyendo a tiempos mayores. Este incremento fue mayor con TNF-α (Gráfica 4).
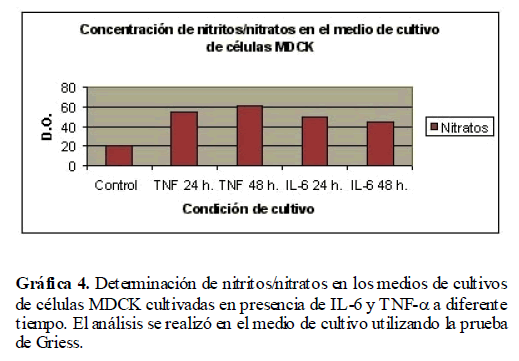
Gráfica 4. Determinación de nitritos/nitratos en los medios de cultivos de células MDCK cultivadas en presencia de IL-6 y TNF-? a diferente tiempo. El análisis se realizó en el medio de cultivo utilizando la prueba de Griess.
Expresión de Hsp60 y Hsp70 en células MDCK tratadas con TNFα e IL-6
Los resultados previos nos indican que los mediadores de la inflamación como son el TNF-α y la IL-6, activan la vía de síntesis del óxido nítrico. Esto nos sugiere cambios drásticos en la homeostasis celular con un consecuente incremento del estrés celular. Para analizar si la presencia de los mediadores de la inflamación como son el TNF-α e IL-6 inducen estrés en las células, se analizó la expresión de las proteínas de estrés calórico (Hsp), tanto la Hsp60 como la Hsp70, en las células MDCK en presencia de TNF-α e IL-6, las cuales fueron analizadas por Western blot. Encontramos un incremento a las 24 y 48 horas en la expresión de las Hsp60 (Gráfica 5) y Hsp70 (Gráfica 6) debido a la presencia de estos mediadores de la inflamación como lo es el TNF-α y la IL-6.
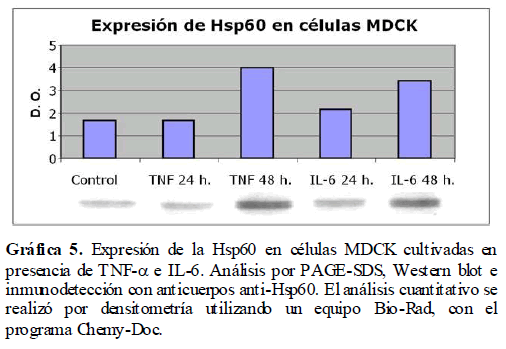
Gráfica 5. Expresión de la Hsp60 en células MDCK cultivadas en presencia de TNF-? e IL-6. Análisis por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-Hsp60. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
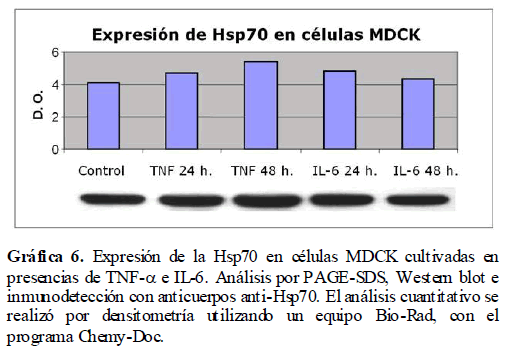
Gráfica 6. Expresión de la Hsp70 en células MDCK cultivadas en presencias de TNF-? e IL-6. Análisis por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-Hsp70. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
Expresión de Fas-L y caspasa 8 en células MDCK tratadas con TNF-α e IL-6
La sobreexpresión de las proteínas de estrés calórico Hsp60 y Hsp70 indicó un incremento en el estrés celular debido a la presencia de mediadores de la inflamación como el TNF-α y la IL-6. Se conoce que estas citosinas
además de inducir estrés celular, pueden inducir y/o activar la vía de la apoptosis a través de Fas-L, por lo que fue importante ver la expresión de Fas-L en células MDCK en presencia de TNF-α e IL-6 a través del análisis por PAGE-SDS y Western blot. Así mismo, bajo estas mismas condiciones, analizamos la expresión de la caspasa 8 involucrada en esta vía apoptótica. Encontramos la expresión tanto de Fas-L (Gráfica 7) como de la caspasa 8 (Gráfica 8) por la presencia de TNF-α e IL-6, con un incremento en su expresión a las 24 y 48 horas.
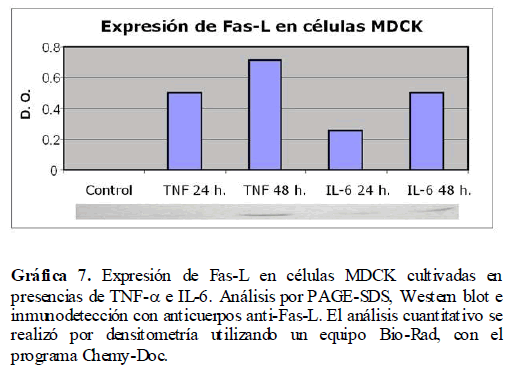
Gráfica 7. Expresión de Fas-L en células MDCK cultivadas en presencias de TNF-? e IL-6. Análisis por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-Fas-L. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
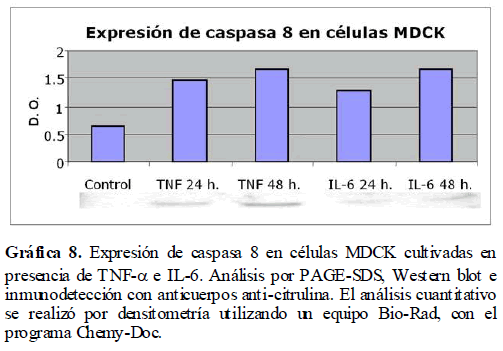
Gráfica 8. Expresión de caspasa 8 en células MDCK cultivadas en presencia de TNF-? e IL-6. Análisis por PAGE-SDS, Western blot e inmunodetección con anticuerpos anti-citrulina. El análisis cuantitativo se realizó por densitometría utilizando un equipo Bio-Rad, con el programa Chemy-Doc.
Discusión
Las alteraciones en la nefritis lúpica se centran en los glomérulos, ya que estas estructuras soportan la mayor parte del ataque inmunológico. En pacientes con LES, la nefropatía es uno de los pronósticos determinantes más importantes y la insuficiencia renal constituye la causa de muerte en más de un tercio de estos pacientes [48,49]. La nefropatía se presenta por depósito de complejos inmunes en el glomérulo, por la citotoxicidad de una serie de auto-anticuerpos en las células renales o bien, por la presencia de mediadores químicos liberados durante los períodos de actividad de la enfermedad, relacionados con procesos inflamatorios como lo son TNF-α e IL-6 [50].
El objetivo del presente trabajo fue medir la expresión de NOSe, NOSi, citrulina, nitritos/nitratos, Hsp60, Hsp70 y la posible activación de apoptosis vía Fas-L y caspasa 8 en células renales MDCK bajo el efecto de IL-6 y TNF-α. Para explicar la participación de las citosinas inflamatorias en la modificación de la expresión de las enzimas NOSe y NOSi, se utilizaron células renales MDCK tratadas con diferentes concentraciones de TNF-α e IL-6. Al analizar la expresión de las proteínas, se observó un aumento en la expresión de NOSe y NOSi cuando los cultivos celulares se expusieron a IL-6 y TNFα, siendo mayor la expresión para NOSe a las 48 horas con TNF-α y para NOSi a las 24 horas con IL-6. Estos resultados concuerdan con los obtenidos por Erdely [51], quien utiliza como modelo experimental ratas Wistar-Furth y concluye que la inhibición de la NOSi de manera crónica evita el daño renal, no así para otros modelos experimentales como las ratas Sprague Dawley, en las que ocurre lo contrario, y donde bajas concentraciones de NOSi causan una progresión a enfermedad crónica de riñón.
Adicionalmente para corroborar la funcionalidad de las enzimas NOS, se inmunodetectó a la citrulina y así detectarla como producto de la reacción de las NOS, donde encontramos un incremento importante de este aminoácido a las 48 horas con TNF-α y a las 24 y 48 horas con IL-6. Se efectuó además la cuantificación de nitritos/nitratos en los medios de cultivos de células sometidas a IL-6 y TNFα, como una medida indirecta de la producción de óxido nítrico, encontrando una mayor producción entre las 24 y 48 horas de cultivo, más intensamente con TNF-α que con IL-6.
Debido a sus funciones, las Hsp se utilizan como marcadores de daño por estrés en enfermedades [52,53], en estudios de eficacia de drogas [54], en estudios ecotoxicológicos [55], y como constituyente de vacunas [56,57]. Al analizar el posible daño celular por las citosinas TNF-α e IL-6, medido a través de las proteínas de choque calórico, encontramos un incremento de estas proteínas en las células, lo que nos indica que las células estuvieron estresadas por la presencia de las citosinas TNF-α e IL-6.
Las proteínas de choque calórico (Hsp), se expresan de manera constitutiva en todas las células tanto procariotas como eucariotas. Estas Hsp se sobreexpresan cuando ocurren cambios en el medio ambiente local de las células de todos los organismos, es decir, se sobreexpresan en respuesta al estrés [58,59].
En el contexto fisiológico, las proteínas Hsp juegan un papel importante en el mantenimiento de la homeostasis celular bajo condiciones normales, como condiciones de estrés [31,60-62]. Bajo condiciones normales, las Hsp tienen influencia en la síntesis, transporte y degradación de proteínas [63,64]; mientras que bajo condiciones de estrés, actúan como moléculas chaperonas [65]. Algunos trabajos han establecido el papel de la Hsp70 en la prevención de la apoptosis, debido a que protege contra los radicales libres de oxígeno [66,67], así como contra la citotoxicidad del factor de necrosis tumoral alfa (TNF-α) [68].
Cuando el estrés celular es mayor y las proteínas de choque calórico no son suficientes para contrarrestar el estrés, la célula activa mecanismos de muerte celular programada conocida como apoptosis. Nosotros analizamos la vía apoptótica a través de Fas-L y caspasa 8, donde encontramos un incremento de ambas proteínas cuando las células estuvieron en presencia de las citosinas TNFα e IL-6. Estos resultados se asemejan con reportes donde el estrés inducido por los mediadores de la inflamación, provoca la expresión de factores que participan en el disparo de la muerte celular, como es el aumento en la expresión de Fas-L y caspasa 8 en presencia de TNF-α [69], coincidiendo sus resultados con los obtenidos por nosotros en este trabajo. Ahora bien, existen reportes donde la expresión de NOSi y la producción constante de óxido nítrico retardan la apoptosis en macrófagos a través del aumento de la concentración de las proteínas que la bloquean [70]. Nuestros resultados indican que los mediadores de la inflamación participan en la inducción de procesos homeostáticos, entre ellos la muerte celular. Como se sabe, la participación del óxido nítrico activa la vía de señalización de JNK y liberación mitocondrial de Citocromo C con activación de la apoptosis [8,69,71]. Con lo anterior se corrobora que el efecto del óxido nítrico sigue siendo controversial, por su papel en el disparo de la apoptosis y protección en algunos tipos celulares, donde podemos suponer que este compuesto más que ser disparador de muerte celular participa en un mecanismo de homeostasis celular.
Conclusiones
Los mediadores de la inflamación como son las citosinas IL-6 y TNF-α modifican la expresión de NOSe y NOSi en células MDCK. La IL-6 y TNF-α aumentan la producción de citrulina y de nitritos/nitratos en células MDCK. Las citosinas IL-6 y el TNF-α inducen estrés celular medido a través de la expresión de las Hsp60 y Hsp70 en células MDCK. Las citosinas IL-6 y el TNF-α activan la vía de la apoptosis a través de la expresión de Fas-L y caspasa 8 en células MDCK.
Agradecimientos
Apoyo del CONACYT. Dr. Sergio Hugo Sánchez Rodríguez. Proyecto: 499100-5-I31456-N.
1094
References
- Bono L, Cameron JS, Hicks JA. The very long-term prognosis and complications of lupus nephritis and its treatment. Q J Med. 1999;92:211-218.
- Gordon C. Long-term complications of systemic lupus erythematosus. Rheumatology. 2002;41:1095-1100.
- Yee CS, Hussein H, Skan J, Bowman S, Situnayake D, Gordon C. Association of damage with autoantibody profile, age, race, sex and disease duration in systemic lupus erythematosus. Rheumatology. 2003;42(2):276-279.
- Sánchez-Rodríguez SH, Barajas VGE, Ramírez AED, Moreno-García A, Barbosa COY. El fenómeno de autoinmunidad: enfermedades y antígenos relacionados. Rev Biomed. 2004;15:49-55.
- Sánchez-Rodríguez SH, Barajas VGE, Ramírez AED, Moreno-García A, Barbosa COY. Lupus eritematoso: enfermedad autoinmune sistémica y órgano específica. Rev. Bioméd. 2004;15:173-180.
- Herrera ER, Barbosa CO, Villalobos HR, Avalos DE. Renal expression of IL-6 y TNFα genes in Lupus Nephritis. Lupus. 1998;7:154-158.
- Miura M, Zhu H, Rotello R, Hartwieg EA, Yuan J. Induction of apoptosis in fibriblasts by IL-1beta-converting enzyme, a mammalian homolog of the C. elegans cell death gene ced-3. Cell. 1993;75:653-660.
- Varfolomeev EE, Ashkenazi A. Tumor necrosis factor: An Apoptosis JuNKie? Cell. 2004;116:491-497.
- Dean GS, Tyrrell-Price J, Crawley E, Isenberg DA. Cytokines and systemic lupus erythematosus. Ann Rheum Dis. 2000;59:243-251.
- Yung S, Tsang RCW, Sun Y, Leung JKH, Chan TM. Effect of human anti-DNA antibodies on proximal renal tubular epithelial cell cytokine expression: implications on tubulointerstitial inflammation in lupus nephritis. J Am Soc Nephrol. 2005;16:3281-3294.
- Ding AH, Nathan CF, Stuehr DJ. Release of reactive nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages. Comparison of activating cytokines and evidence for independent production. J Immunol. 1988;141:2407-12.
- Dennis JS. Structure-function aspects in the nitric oxide synthases. Ann.Rev. Toxicol. 1997;37:339-59.
- López JP. La vía L-arginina-óxido nítrico. 1ª. Edición, Ediciones Científicas, Quito-Ecuador. 1995;336.
- Moncada S, Higgs A. The L-arginine-nitric oxide pathway. N. Engl. J Med. 1993;329:2002-2012.
- Förstermann U, Boissel JP, Kleinert H. Expressional control of the ‘constitutive’ isoforms of nitric oxide synthase (NOS I and NOS III). FASEB J. 1998;12:773-970.
- Bruch-Gerharz D, Ruzicka T, Kolb-Bachofen V. Nitric oxide in human skin: current status and future prospects. J Invest Dematol. 1998;110:1-7.
- Catell V. Nitric oxide glomerulonephrithis. Semin Nephrol. 1999;19:277-287.
- Wanchu A, Khullar M, Bambery P, Sud A. Nitric oxide synthesis is increased in patients with systemic lupus erythematosus. Reumatol Int. 1998;18:41-43.
- Gilkeson G, Cannon C, Oates J, Reilly C, Goldman D, Petri M. Correlation of serum measures of nitric oxide production with lupus disease activity. J. Rheumatol. 1999;26:318-324.
- Shoemaker CW, Holbrook RP, Grenvik RP, Ayres MS. Tratado de Medicina Crítica y Terapia Intensiva; Ed. Médica Panamericana, 3ª Edición. 1998.
- Salvesen GS, Dixit VM. Caspases: intracellular signaling by proteolysis. Cell. 1997;91:443-446.
- Okamura H, Tsutsui H, Komatsu T, Yutsudo M, Hakura A, Tanimoto T, Torigoe K, Okura T, Nukada Y, Hattori K, et al. Cloning of a new cytokine that induces IFN-gamma production by T-cells. Nature. 1995;378:88-91.
- Strasser A, O’Connor L, Dixit VM. Apoptosis signaling. Annu Rev Biochem. 2000;69:217-245.
- Thornberry NA, Lazebnik Y. Caspases: enemies within. Science. 1998;281:1312-1316.
- Albina JE, Cui S, Mateo RB, Reichner JS. Nitric oxide-mediated apoptosis in murine peritoneal macrophages. J Immunol. 1993;150:5080-5085.
- Ashkenazi A, Dixit VM. Death Receptors: signaling and modulation. Science. 1998;281:1305-1308.
- Akbar AN, Savill J, Gombert W, Bofill M, Borthwick NJ, Whitelaw F, Grundy J, Janossy G, Salomon M. The specific recognition by macrophages of CD8+, CD45RO+T cells undergoing apoptosis: a mechanism for T cell clearance during resolution of viral infections. J Exp Med. 1994;180:1943-1947.
- Savill J, Smith J, Sarraf C, Ren Y, Abbott F, Rees A. Glomerular mesangial cells and inflammatory macrophages ingest neutrophils undergoing apoptosis. Kidney Int. 1992;42:924-936.
- Szaboles MJ, Ward L, Buttyan R, D’Agati V. Apoptosis in human renal biopsies. J Am Soc Nephrol. 1994;5:844.
- Yoshimura K, Inui K, Sugenoya Y, Iwasaki S, Ideura T. Apoptosis-preventing Bcl-2 protein and its counter-active Bax mRNA expression in glomeruli with human proliferative glomerulonephritis. J Am Soc Nephrol. 1995;6:932.
- Lindquist S. The heat shock response. Annual Review of Biochemistry. 1986;55:1151-1191.
- Lindquist S, Craig EA. The heat shock proteins. Annu. Rev Genet. 1988;22:631-637.
- Morimoto RI, Milaski KL. Stress Proteins in Biology and Medicine. Cold Spring Harbor Laboratory Press, N.Y. 1990. pp. 1-36.
- Welch WJ. Stress Proteins in Biology and Medicine, Morimoto RI., et al., (eds). Cold Spring Harbor Lab. Cold spring Harbor, N.Y. 1990. pp:223-278.
- Hendrick JP, Harti FU. Molecular chaperone functions of heat-shock proteins. Annual Review of Biochemistry. 1993;62:349-384.
- Harti FU. Molecular chaperones in cellular protein folding. Nature. 1996;381:571-580.
- Arrigo AP. Chaperons moléculaires et repliement des protéines: L'exemple de certaines protéines de choc thermique. Médecine Sciences. 2005:21(6-7):619-625.
- Ortiz A, Marrón B, Ramos A. El destino de los podocitos en las nefropatías proteinúricas. Nefrología. 2002;22:425-431.
- Gil GL, Neira OQ. Anticuerpos Anticélulas Endoteliales en Enfermedades Sistémicas. Reumatología. 2006;22:132-137.
- Negri AL. 15 Deoxiespergualina: una nueva droga inmunosupresora. Trasplantes. 1994;1(1):35-39.
- Cereijido M, Ehrenfeld J, Meza I, Martínez-Palomo A. Structural and functional membrane polarity in cultured monolayers of MDCK cells. J. Memb. Biol. 1980;52:147-159.
- Aihao D, Nathan CF, Dennis SJ. Release of reactive nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages. J Immunology. 1988;141(7):2407-2412.
- Keilhoff G, Reiser M, Stanarius A, Aoki E, Wolf G. Citrulline immunohistochemistry for demostration of NOS activity in vivo and in vitro. Nitric Oxide. 2000;4(4):343-353.
- Coligan JE, Kruisbeek AM, Margulies DH, Ethan MS, Warren S. Current Protocols in Immunology. National Institutes of Health Edit. Board. Vol. I, II,III. 1999.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical. Biochemistry. 1976;72:248-254.
- Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680-685.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrilamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. USA. 1979;76:4350-4354.
- Rubin E, Farber JL. Patología. Editorial Médica Panamericana S. A. de C. V. 1990.
- Moss KE, Isengerg DA. Comparison of renal disease severity and outcome in patients with primary antiphospholipid syndrome, antiphospholipid syndrome secondary to systemic lupus erythematosus (SLE) and SLE alone. Rheumatology. 2001;40:863-867.
- Ravirajan CT, Rowse L, MacGowan JR, Isenberg DA. An analysis of clinical disease activity and nephritis-associated serum autoantibody profiles in patients with systemic lupus erythematosus: a cross-sectional study. Rheumatology. 2001;40:1405-1412.
- Erdely A, Freshour G, Baylis C. Resistance to renbal damage by chronic nitric oxide synthase inhibition in the Wistar-Furth rat. Am J Physiol Regul Integr Comp Physiol. 2006;290:66-72
- Macario AJ. Heat-shock proteins and molecular chaperones: implications for pathogenesis, diagnostics and therapeutics. Int J Clinical Lab Res. 1995;25:59-70.
- Merino S, Martínez J, Barbosa A, Møller AP, de Lope T, Pérez J, Rodríguez CF. Increase in a heat shock protein from blood cells in response of nestling house martins (Delichon urbica) to parasitism: an experimental approach. Oecologia. 1998;116:343-347.
- Tosi P, Visani G, Ottaviani E, Gibellini D, Pellacani A, Tura S. Reduction of heat-shock protein-70 after prolonged treatment with retinoids: biological and clinical implications. Am J Hematol. 1997;56:143-150.
- Eckwert H, Alberti G, Koehler HR. The induction of stress proteins (HSP) in Oniscus asellus (Isopoda) as a molecular marker of multiple heavy metal exposure: I. Principles and toxicological assessment. Ecotoxicology. 1997;6:249-262.
- Newport GR. Heat shock proteins as vaccine candidates. Immunology. 1991;3:17-24.
- Ferraz JC, Stavropoulos E, Yang M, Coade S, Espitia C, Lowrie DB, Colston MJ, Tascon RE. A Heterologous DNA Priming-Mycobacterium Bovis BCG Boosting Immunization Strategy Using Mycobacterial Hsp70, Hsp65, and Apa Antigens Improves Protection against Tuberculosis in Mice. Infection and Immunity. 2004;72:6945-6950.
- Ciocca DR, Oesterreich S, Chammess GC, McGuire WL, Fuqua SAW. Biological and clinical implications of heat shock protein 27000 (Hsp27): a review. Journal of National Cancer Institute. 1993;85:1558-1569.
- Lin H, Li H, Blank M, Head M, Goodman R. Magnetiv field activation of protein-DNA Binding. Journal of Cellular Biochemestry 1998;70:279-303.
- Leppa S, Sistonen L. Heat shock response pathophysiological implications. Annals of Medicine. 1997;29:73-78.
- Schlesinger MJ. Heat shock proteins. J Biol Chem. 1990;265:12111-12114.
- Welch WJ. Mammalian stress response: cell physiology, structure/function of stress proteins and implications for medicine and diseases. Physiol Rev. 1992;4:1063-1081.
- Villalobos-Hurtado R, Sánchez-Rodríguez SH, Avalos-Díaz E, Herrera Esparza R. Possibile ruolo di hsp70 nel trasporto di autoantigeni alla giunzione dermo-epidermica nel lupus eritematoso sistemico. possible role of hsp70 in autoantigen shuttling to the dermo-epidermal junction in systemic lupus erythematosus. Reumatismo. 2003;55(3):155-158.
- Barajas-Vásquez GE, Baldwin-Sevilla C, Barbosa-Cisneros OY, Sánchez-Rodríguez SH. Las proteínas de estrés calórico hsp60, 70 y 90 participan en la adaptación de los caprinos a las zonas áridas. REDVET. 2005;VI(3).
- Brenner BG, Wainberg MA. Heat shock protein-based therapeutic strategies against human immunodeficiency virus type I infection. Infect. Dis. Obstet. Gynecol. 1999;7:80-90.
- Mallouk Y, Vayssier TM, Bonventre JV, Polla BS. Heat shock protein 70 and ATP as partners in cell homeostasis. Int. J. Mol. Med. 1999;4:463-474.
- Garrido C, Gurbuxani S, Ravagnan L, Kroemer G. Heat shock proteins: endogenous modulators of apoptotic cell death. Biochem. Biophys. Res. Commun. 2001;286:433- 442.
- Ip SP, Che CT, Kong YC, Ko KM. Effects of schisandrin B pretreatment on tumor necrosis factor-alpha induced apoptosis and Hsp70 expression in mouse liver. Cell Stress Chaperones. 2001;6:44-48.
- Micheau Oliver, Tschopp Jürg. Induction of TNF Receptor I-Mediated Apoptosis via Two Sequential Signaling Complexes. Cell, 2003;114:181-190.
- Hortelano S, Través PG, Zeini M, Alvarez AM, Boscá L. Sustained nitric oxide delivery delays nitric oxide-dependent apoptosis in macrophages: contribution to the physiological function of activated macrophages. J Immunol. 2003;171:6059-6064.
- Ranjan P, Shrivastava P, Singh SM, Sodhi A, Heintz NH. Baculovirus P53 inhibits NO-induced apoptosis in activated macrophages by inhibiting cytochrome c release. Journal of Cell Science. 2004;117:3031-3039.













