Keywords
Breast cancer; Ductal carcinoma; Hsp70; Hsp90; P53
Introducción
Existen factores exógenos y endógenos que pueden alterar la multiplicación celular, convirtiendo a una célula en cancerosa [1,2]. Si las células cancerosas llegan a filtrarse en el torrente sanguíneo o en el sistema linfático y se alojan en otros tejidos producen metástasis [2]. En el cáncer de mama sus subtipos se deben al crecimiento anormal y desordenado de las células del epitelio en los conductos o lobulillos mamarios, y cuenta con la capacidad de diseminarse a cualquier sitio del organismo e invadirlo [3-5].
De acuerdo a la Organización Mundial de la Salud (OMS), el cáncer de mama es una de las principales causas de muerte en el mundo, y es el tipo de cáncer más frecuente a nivel mundial, es una enfermedad que se incrementa con la edad, cada año se detectan 1.38 millones de casos nuevos y ocurren 458 mil muertes por esta enfermedad [6,7]. Así mismo, la Organización Panamericana de la Salud (OPS) menciona que en el continente Americano, la tendencia es similar, siendo el cáncer de mamá el más común entre las mujeres, y es la segunda causa de muerte por tumores malignos; para el año 2030, la OPS estima más de 596,000 casos nuevos y más de 142,100 muertes en la región, principalmente en la zona de América Latina y el Caribe [8,9]. En México, el cáncer de mama es un problema de salud pública, con mayor presencia en mujeres en edades de 20 a 65 años [10-12],
en el año 2005 el Instituto Nacional de Estadística y Geografía [13], reportó que el cáncer de mama había alcanzado cifras alarmantes, y para el 2006 el cáncer de mama se convirtió en la principal causa de muerte desplazando al cáncer de cérvix en mujeres de 25 años en adelante [14]; Otros datos muestran un incremento de cáncer de mama en mujeres en el Estado de Zacatecas desde 1990 hasta el [11,13]. Los datos epidemiológicos de acuerdo al sexo, indican que el cáncer de mama es la segunda causa de mortalidad en las mujeres de 20 años y más (14.8%), mientras que para los hombres del mismo grupo de edad apenas representa 0.1% de las muertes por neoplasias. Durante 2013, en México el cáncer de mama fue la principal causa de morbilidad hospitalaria entre los tumores malignos para la población de 20 años y más (18.7 por ciento); tres de cada 10 mujeres son hospitalizadas por dicha causa, y aunque en los varones apenas representa 0.7% de los ingresos hospitalarios, desmitifica la creencia de que esta enfermedad sea exclusiva de las mujeres. El cáncer de mama en los varones puede presentarse a cualquier edad, pero generalmente se detecta en aquellos de 60 a 70 años, y se asocia a la exposición a radiaciones, altas concentraciones de estrógeno en la sangre producto de la cirrosis o el síndrome de Klinefelter y por antecedentes heredofamiliares de mutaciones en el gen BRCA2 [15].
Existen muchos factores y genes involucrados en el inicio del cáncer de mama, pero la mortalidad en este tipo de cáncer se debe a los desórdenes por metástasis [10], algunos de los factores de riesgo en cáncer de mama son, la edad (conforme aumenta la edad, incrementa el riesgo), cambios genéticos (mutaciones de los genes BRCA1, BRCA2 y P53), historia familiar, la raza, menarquía temprana, menopausia, entre otros [16].
Si bien, no existe un estudio que mida los factores de riesgo para padecer cáncer de mama, algunos médicos coinciden que el 30% de los casos de cáncer podrían evitarse modificando el estilo de vida de las personas por ejemplo, evitar tener hijos después de los 30 años, uso de anticonceptivos orales, la terapia hormonal, el alcoholismo, el sobrepeso, la mala alimentación, uso de sostenes ajustados, abortos provocados, la contaminación ambiental, el tabaquismo, el estrés, la depresión, el uso de fármacos, no lactar, la nuliparidad, el alto consumo de grasas, la inactividad física [16,17], infecciones por VPH (Virus del Papiloma Humano) y VHB (Virus de la Hepatitis B), entre otros [7,18].
En la progresión del cáncer, están implicadas un grupo de proteínas conocidas como proteínas de estrés térmico (Thermal Shock Proteins, Hsp), éstas fueron descubiertas en 1962 por Feruccio Ritossa en estudios con Drosophila melanogaster [19], como un conjunto de proteínas cuya síntesis se induce rápidamente en respuesta a estrés térmico. Las Hsp participan en el mantenimiento de la homeostasis celular [20], en todas las células eucariotas, representando entre el 1 y 2% de las proteínas totales en células normales, y aumentando hasta un 4.6% bajo condiciones de estrés. Tienen diversas funciones incluyendo el secuestro de múltiples complejos proteínicos, transporte de cadenas polipeptídicas nacientes a través de la membrana celular, regulación del plegamiento proteíco [21], actúan como moléculas chaperonas de otras proteínas inducidas en estados específicos de desarrollo tales como la diferenciación y oncogénesis [19,22]. En condiciones fisiológicas colaboran en la adquisición de la estructura terciaria de las proteínas en formación, interviniendo en su ensamble, translocación y secreción, así como también en la degradación o reparación de proteínas anormales, bloquean vías apoptóticas que implican la activación de cistein-proteasas, y ayudan a determinar el destino de las células siendo dirigidas hacia la apoptosis o la diferenciación. Las Hsp se sobreexpresan en respuesta a agentes físicos y químicos (luz UV, calor, estrés, hipoglucemia, frío, iones de metales pesados, infecciones por virus, radiación electromagnética, anoxia, etanol, etc.) confiriendo protección a las células ante diferentes formas de estrés [19,22]. Las proteínas de choque térmico se encuentran clasificadas en 5 familias de acuerdo a su tamaño molecular en Hsp100, 90, 70, 60 y pequeñas Hsp [21,22].
La transcripción de estas proteínas está regulada por el factor de transcripción HSF1, éste sensa la exposición celular a estrés e induce rápidamente la síntesis de las Hsp, esta inducción es aprovechada por las células cancerosas durante la progresión maligna y contribuyen en el desarrollo del cáncer [21,23]. Algunos autores han demostrado que HSF1 juega un papel clave en el desarrollo de tumores en donde se ha asociado a la activación de Ras o inactivación de p53 en un amplio espectro de tipos de cáncer [24]. Las Hsp se expresan en tejidos neoplásicos de ovario, endometrio, mama, aparato digestivo, entre otros, y su sobreexpresión está asociada a un mal pronóstico de la enfermedad [25] Algunos autores las correlacionan con la proliferación y la diferenciación de los tejidos neoplásicos, y en el desarrollo de la resistencia a drogas quimioterapéuticas [21,23]. Un ejemplo es la Hsp27 que participa en la progresión tumoral [26-29], y es regulada por estrógenos [30], ésta funciona como una proteína antiapoptótica, que es independiente de ATP, y se expresa en órganos sensibles al estrógeno [23]. Si bien la expresión de la Hsp27 en tejido normal se ha encontrado de manera moderada, en lesiones malignas se incrementa su expresión la cual correlaciona con un aumento de receptores de estrógenos, ganglios con metástasis e invasión vascular, siendo ésta un marcador de agresividad tumoral en cáncer de mama. La Hsp27 y Hsp70 promueven la tumorogénesis mamaria inhibiendo la apoptosis y senescencia [31,32].
Varios estudios demostraron que la sobreexpresión de la Hsp27 se correlaciona con el aumento de la resistencia a la apoptosis inducida por fármacos quimioterapéuticos en las células cancerosas [33,34]. Por otro lado, la proteína Hsp60 y Hsp70 han mostrado niveles elevados en un amplio espectro de células malignas que incluyen las células en cáncer de mama [35,36].
La función de la Hsp90 se relaciona con receptores de hormonas esteroideas en la regulación de su actividad biológica, donde su nivel basal se ve aumentada por el estrés. Su actividad parece ser esencial para el crecimiento del cáncer de mama y otros tipos de cáncer [23]. La sobreexpresión de Hsp90 ha sido observada en una gran variedad de tumores malignos humanos, incluyendo el cáncer de mama, ya que estabiliza muchas proteínas oncogénicas [26]. En cáncer de mama, su progresión está dada por HER2 y c-SRC [37]. HER2 es una de las proteínas blanco de Hsp90, y se ha demostrado la degradación de ésta 2 horas después de haber inhibido a la Hsp90 [38,39].
La función de la Hsp90 en células malignas es la inhibición de la apoptosis a través de varias interacciones tales como la unión al factor activador apoptótico (Apaf-1), e inhibir su oligomerización, así como el reclutamiento de procaspasa 9, bloqueando así el montaje del apoptosoma [40].
Otra proteína que participa en la trasformación a células cancerosas es p53, esta es una fosfoproteína supresora de tumores que pertenece a una familia de factores de transcripción. En células normales, el nivel de la proteína p53 es bajo y se encuentra asociada a Mdm2, lo cual induce su ubiquitinización y destrucción por el proteosoma [31,41,42]. El 80% de las mutaciones puntuales de p53 que se detectan en los cánceres humanos, están localizadas en su dominio de unión al ADN. En estudios donde se han evaluado las implicaciones pronósticas y predictivas de p53 en cáncer de mama, se ha encontrado una fuerte relación entre el fenotipo anormal de p53 y un mal pronóstico [31].
El cáncer mamario representa un desafío en materia de salud pública en México, ya que mantiene una tendencia ascendente. En el cáncer de mama existen alteraciones genéticas que afectan o modifican la conformación de proteínas celulares, una de ellas es p53, o bien, proteínas que ayudan a la supervivencia celular y bloquen la apoptosis tales como las proteínas de choque térmico Hsp70 y Hsp90. Por lo anterior, en el presente estudio se evaluó la presencia de estas proteínas y sus niveles de expresión en células malignas. Por lo que el objetivo del presente estudio fue determinar la expresión y asociación de las proteínas Hsp70, Hsp90 y P53 en cáncer de mama.
Materiales y Método
Obtención de muestras de tejido canceroso
El tejido canceroso se obtuvo por cirugía o biopsia de pacientes que asistieron a consulta en el Instituto Mexicano del Seguro Social, el Hospital General de la Secretaria de Salud y El Laboratorio de Citopatología del Hospital de la Mujer, todas del Estado de Zacatecas. Se obtuvieron 15 muestras de tejido mamario, de las cuales, 11 fueron determinadas como cáncer de mama, 1 control negativo se obtuvo a través del SEMEFO de una mujer de 24 años de edad aparentemente sana, y 3 muestras más de alteraciones mamarias no cancerosas. De las 11 muestras determinadas como cáncer de mama, 2 muestras solo eran tejido adiposo, no se pudo valorar proteína. Las muestras fueron lavadas con agua destilada, colocados en tubos eppendorf y posteriormente almacenadas en congelación (-20°C).
Lisis celular
Por separado, cada una de las muestras de tejido mamario se colocaron en un mortero y se les agregó nitrógeno líquido para la ruptura celular, posteriormente se les añadió 1 ml de buffer de lisis que contiene: Tritón X-100 al 1%, NaCl 140 mM, EDTA 1 mM, Tris-HCl 10 mM pH 7.6 e inhibidor de proteasas 1 mM, PMSF (Sigma Chemical Co, St Louis MO, USA, P-7626), el extracto fue colectado y puesto en un tubo eppendorf y se homogenizó con un Homogenizador IKA (Ultra-Turrax® T181351). El lisado celular se centrifugó por 10 min a 14,000 rpm y el sobrenadante se recuperó para determinar la concentración de proteínas [43].
Cuantificación de proteínas
La cuantificación de proteína se realizó a partir de la fracción soluble obtenida en la lisis celular, mediante la técnica descrita por Bradford, (1976) [43]. De cada condición experimental, 15g de proteína fueron separadas en geles de poliacrilamida (PAGESDS al 10%) de acuerdo a la técnica descrita por Laemmli [44].
Western Blot e Inmunodetección
Las proteínas separadas en los geles de poliacrilamida-SDS se transfirieron a membranas de nitrocelulosa (Amersham Biosciences Laboratories, Buckinghamshire, England, RPN303C), tal como lo describió Towbin [45]. La membrana fue bloqueada con solución amortiguadora (PBS-Caseína 3%) durante toda la noche, transcurridas las 12 h. las membranas fueron lavadas con PBS e incubadas con anticuerpos monoclonales contenidos en solución bloqueadora para identificar las proteínas Hsp70 (SC-24 Santa Cruz Biotechnology®) en dilución 1:1000; Hsp90 (SC-101494 Santa Cruz Biotechnology®) en dilución 1:500; P53 (Invitrogen® Novex® PAB240 Lot 697229A) en dilución 1:500; y Actina (SC-8432 Santa Cruz Biotechnology®) en dilución 1:1000 como proteína control. Posteriormente las membranas fueron puestas en contacto con un segundo anticuerpo peroxidado anti-ratón para identificar: Hsp70, Hsp90 y P53 (anti ratón IgGHRP conjugado SC-2005 Lot F0412 Santa Cruz Biotechnology®). La unión antígeno-anticuerpo fue observada de dos formas: la primera, fue revelada mediante colorimetría empleando una solución de Diaminobencidina al 0.1% activada con peróxido de hidrógeno, observando la aparición de bandas de color café sobre las membranas de nitrocelulosa; la segunda se determinó por el método ECL (Amersham™ Prime Wester Blotting Detection Reagment RPN2232 Lot 6762621) que al agregar sobre las membranas el reactivo, este reacciona con la enzima peroxidasa emitiendo luz, la cual se detectó mediante el foto-documentador marca Bio-Rad© (Image Lab Bio-Rad® Laboratorioes) empleando el software Image Lab versión 2.0.1 build 18 (Copyright© 2009 de Bio-Rad® Laboratories), lo anterior permitó observar la expresión y cuantificar la cantidad de proteína presente en cada muestra.
Inmunoprecipitación
Los extractos celulares obtenidos por homogenización, conteniendo el antígeno de interés mezclado con otra gran variedad de antígenos celulares, fueron centrifugados a 13,000 rpm por 10 min, el sobrenadante resultante de cada extracto fue separado y colocado en un nuevo tubo eppendorf para su posterior utilización. Previamente se preparó una solución al 10% de células de Staphylococcus aureus que tiene unida IgG de ratón (células de Pansorbine® sensibilizadas a ratón Calbiochem® Novabiochem Lot B10903 CA92039), la cual fue lavada en 3 ocasiones con PBS y resuspendida en 500 μL de PBS, en seguida esta solución fue separada a partes iguales: la primera de ellas se colocó en un tubo eppendorf y fue puesta en contacto con un anticuerpo monoclonal para precipitar la proteína de interés (10 μL anti-HSP70), por otro lado el segundo tubo con células de Pansorbine® se utilizó para unir todo lo inespecífico del extracto celular. Ambos tubos fueron dejados en incubación en baño de hielo por 24 h. Transcurrido el tiempo de incubación ambos tubos fueron colocados en agitación a 17 rpm por 1 h a temperatura ambiente, el tubo con la solución de células de Pansorbine® y el extracto celular fue centrifugado a 3,000 rpm por 5 min, de éste tubo el sobrenadante fue recuperado y agregado al segundo tubo que contenía las células de Pansorbine® y el anticuerpo monoclonal Hsp70, en seguida fue incubado nuevamente por 2 h (con ello se dio paso a la formación del complejo Antígeno- Anticuerpo-célula de Pansorbine®). Una vez terminado el tiempo de incubación, el tubo fue centrifugado a 3,000 rpm por 5 min. El sobrenadante se retiró y se desechó, y el precipitado se lavó 4 veces con BSL (Buffer de Súper Lavado: NaCl 100 mM, Tris-HCl pH 7.4, 50 mM, EDTA 2 mM TRITON® x-100 2% y SDS 0.5%) y 4 ocasiones más con RIPA (NaCl 150 mM, Tris pH 8, 50 mM, NP- 40 1%, Desoxicolato de Sodio 0.5% y SDS 0.1%), centrifugando entre cada lavado a 3000 rpm por 5 min. Los lavados permitieron eliminar las proteínas y complejos inespecíficos. Una vez eliminado el sobrenadante del último lavado se agregaron 100 μL de BM (Buffer de Muestra Laemmli: SDS 2%, Glicerol 10%, DTT 100 mM, TRIS pH 6.8, 60 mM, Azul de Bromofenol 0.0001%), el precipitado se solubilizó con el BM mediante vórtex y se colocó en baño maría a 85°C por 5 min, finalmente se centrifugó a 10,000 rpm por 5 min., se recuperó el sobrenadante y éste fue analizado por Western Blot e inmunodetección.
Los resultados obtenidos por densitometría de las proteínas: Hsp70, Hsp90 y p53 de las muestras analizadas por Western Blot e inmunoprecipitación, fueron representados gráficamente mediante Excel®, y expresados como media ± sem, donde n=15 es el número de observaciones.
Resultados
Expresión de las proteínas Hsp70, Hsp90 y p53 en tejido canceroso
En las muestras de tejido mamario analizadas mediante Western Blot-ECL utilizando anticuerpos monoclonales, se detectó la presencia de las proteínas Hsp70, Hsp90 y p53. La cantidad de proteínas detectadas presento variaciones en cada una de las muestras, en algunas fue mayor y en otras menor (Figura 1).
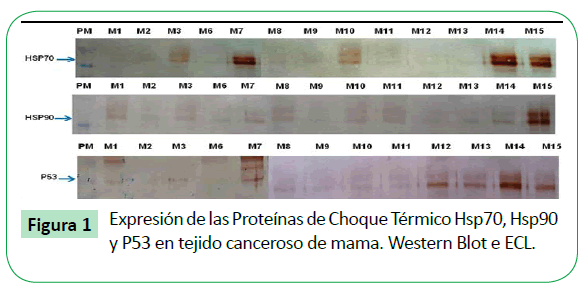
Figure 1: Expresión de las Proteínas de Choque Térmico Hsp70, Hsp90 y P53 en tejido canceroso de mama. Western Blot e ECL.
Cuantificación de la Hsp70, Hsp90 y p53
Las proteínas detectadas en tejido mamario canceroso por Western Blot e ECL, se les determinó la cantidad de Hsp70, Hsp90 y p53, por densitometría observando una mayor expresión respecto al control de la Hsp70, seguido por p53 y en menor proporción la Hsp90 (Figura 2).
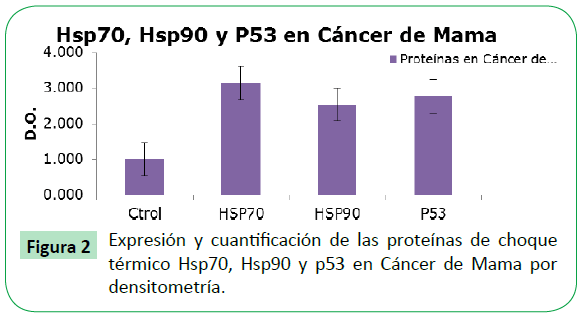
Figure 2: Expresión y cuantificación de las proteínas de choque térmico Hsp70, Hsp90 y p53 en Cáncer de Mama por densitometría.
Asociación de las proteínas Hsp70, Hsp90 y P53
Para determinar si existe asociación entre las proteínas Hsp70, Hsp90 y P53 en las muestras de tejido canceroso analizadas, se realizó la inmunoprecipitación con un anticuerpo monoclonal para la Hsp70, y se analizó si Hsp90 y p53 co-precipitan con ésta. Se observó asociación de la Hsp70 con Hsp90 y p53 en 6 de las 9 muestras de tejido canceroso de mama analizado (M3,M7,M12,M13,M14,M15). Como ejemplo la muestra 3 en la Figura 3, y en la Tabla 1 todas las muestras inmunoprecipitadas. Al analizar la expresión de las proteínas Hsp70, Hsp90 y P53 en las muestras de tejido con alteraciones de la glándula mamaria, se encontró una tendencia en la expresión muy similar al encontrado en cáncer de mama, donde el grado de expresión para la Hsp70 fue discretamente superior al control, mientras que para la Hsp90 y p53 está por debajo del control (Figuras 4 y 5).

Figure 3: Inmunoprecipitación de la Hsp70 y su asociación con Hsp90 y p53. Actina es una proteína control.
| Muestra de Tejido |
Hsp70 |
Hsp90 |
P53 |
| Control Negativo M1 |
+ |
- |
- |
| Alteraciones mamarias M2 |
+ |
- |
- |
| Canceroso M3 |
+ |
+ |
+ |
| Tejido Adiposo M4 |
|
|
|
| Tejido Adiposo M5 |
|
|
|
| Alteraciones mamarias M6 |
+ |
- |
- |
| Canceroso M7 |
+ |
- |
+ |
| Canceroso M8 |
+ |
- |
- |
| Alteraciones mamarias M9 |
+ |
- |
- |
| Canceroso M10 |
+ |
- |
- |
| Canceroso M11 |
+ |
- |
- |
| Canceroso M12 |
+ |
+ |
+ |
| Canceroso M13 |
+ |
+ |
+ |
| Canceroso M14 |
+ |
+ |
+ |
| Canceroso M15 |
+ |
+ |
- |
Tabla 1: Inmunoprecipitación de la Hsp70 y su asociación con Hsp90 y p53. Las muestras con (+) indican presencia de las proteínas y el (-) indica la ausencia de proteínas en las muestras inmunoprecipitadas.
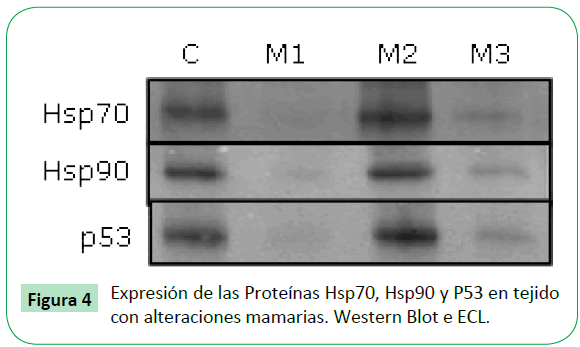
Figure 4: Expresión de las Proteínas Hsp70, Hsp90 y P53 en tejido con alteraciones mamarias. Western Blot e ECL.
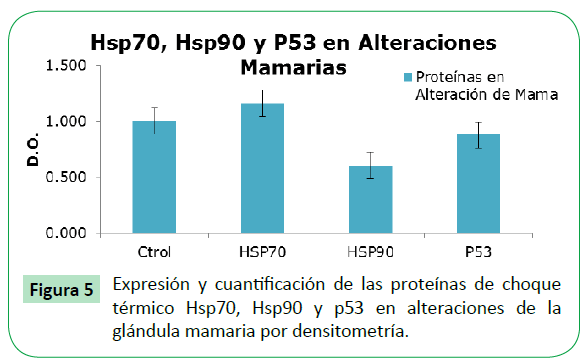
Figure 5: Expresión y cuantificación de las proteínas de choque térmico Hsp70, Hsp90 y p53 en alteraciones de la glándula mamaria por densitometría.
La disminución del calibre del chorro fue el síntoma más frecuente 48.2%, con 1-12 meses de evolución de sintomatología en 64.4% de los casos. Otros síntomas fueron nicturia 14.7%, hematuria 11.8% y micción por goteo 11.6%. Solamente 10.8% de los pacientes, tenían antecedente familiar de cáncer de próstata. El 52.5% presentaban un nivel de PSA menor o igual a 4 ng/dl, el 30% entre 4 a 20 ng/dl, y 8.4%>20 ng/dl. En 26.8% de los pacientes no estaban consignados los niveles de PSA.
Con respecto a los resultados histopatológicos, la hiperplasia prostática benigna fue reportada en 52% de las biopsias y un 32% fueron positivas por cáncer, de los cuales el 42% corresponde a tumores de alto grado (Gleason de 7 a10), 35.5% tumores de bajo grado (Gleason 2 a 6) y 22.5% adenocarcinomas de próstata (Gleason no especificado). Entre otros resultados histopatológicos se reportaron como negativos por malignidad, neoplasia prostática intraepitelial, prostatitis crónica y prostatitis aguda. (Figura 6).
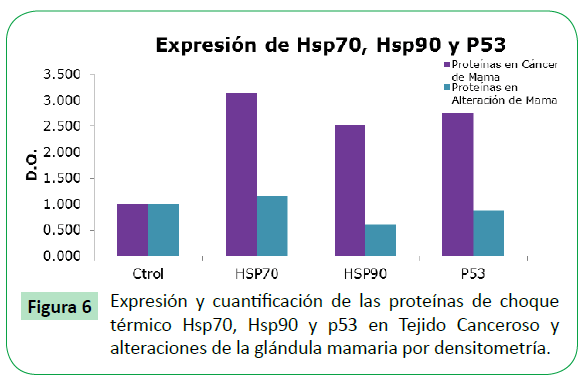
Figure 6: Expresión y cuantificación de las proteínas de choque térmico Hsp70, Hsp90 y p53 en Tejido Canceroso y alteraciones de la glándula mamaria por densitometría.
Discusión
El objetivo del presente estudio fue determinar la expresión y asociación de las proteínas de choque térmico Hsp70, Hsp90 y p53 en cáncer de mama y en alteraciones mamarias. Los resultados de la presente investigación muestran la presencia de las proteínas Hsp70, Hsp90 y p53 en todas las muestras analizadas, ya sea de tejido canceroso o de alteración de la glándula mamaria. Lo anterior correlaciona con otros autores que han demostrado que las Hsp se expresan de manera constitutiva y ubicua en las células eucariotas, donde participan en el mantenimiento de la homeostasis celular [21,37].
Al analizar el nivel de expresión de las Hsp en tejido canceroso, se encontró una mayor cantidad de Hsp70. Trabajos previos han demostrado que las Hsp juegan un papel importante en el desarrollo y evolución del cáncer [22]. Los estudios de Joly et al. [46]. Indican que la Hsp70 participa en la proliferación de células tumorales, invasión, diferenciación, metástasis y muerte. También se ha visto que la Hsp70 tiene un papel fundamental en varios puntos de control de inhibición de la apoptosis [47], por lo que se ha considerado un blanco ideal para el tratamiento del cáncer utilizando inhibidores de la Hsp70. Otros estudios han mostrado que la Hsp70 en suero puede ser un biomarcador para la detección temprana de cáncer de páncreas [48] y puede ser utilizado como un indicador para alta mortalidad en pacientes con cáncer colorectal sin metástasis [49]. Además, sus niveles séricos elevados se asocian con aumento del riesgo de cáncer de pulmón [50].
El segundo grado de expresión en tejido canceroso es la proteína p53. La p53 interviene en la regulación del ciclo celular y en la apoptosis como respuesta al daño del ADN, poco más del 50% de los tumores humanos contienen mutaciones de este gen, muchas de estas son puntuales en exones, dando como resultado una proteína no funcional, inactiva o sin regulación de la apoptosis, pero que es estable y se acumula en altos niveles dentro del núcleo. Con algunas formas mutantes de p53, se ha observado la formación de complejos con las proteínas Hsp70 y Hsp90 [41,42].
En tercer grado de expresión en tejido canceroso se encontró la Hsp90. En células normales, la Hsp90 participa en la transformación a células cancerosas mediante la unión y activación de las proteínas Her2 y AKT, y cuando se inhibe a la Hsp90 disminuye la actividad de las proteínas Her2 y AKT deteniendo la proliferación de las células cancerosas e insensibilizando las señales de crecimiento. En células cancerosas la Hsp90 participa en evadir la apoptosis, potencializa la replicación ilimitadamente, sustentan la angiogénesis, la invasión de tejidos y metástasis. Existen indicadores que demuestran que la expresión de la Hsp90 y el aumento de su actividad en mucho dependen del potencial maligno de una célula. La Hsp90 juega un papel clave en la progresión tumoral ya que acompaña oncogenes mutados y se sobreexpresa en la transformación completa y progresión tumoral. La Hsp90 puede contribuir a la evolución de la resistencia de poblaciones celulares tumorales al tratamiento permitiendo que emerjan diversas proteínas que pueden estar siendo afectadas por el estrés de la terapia de cáncer [31]. Inhibidores de las Hsp90 conocidos como ansamicinas y benzoquinonas, inhiben la vía funcional de las Hsp90 por unión competitiva del ATP, disminuyendo la actividad de la ATPasa y degradación de la Hsp90 [31].
La relación que existe entre la Hsp70 y Hsp90 con p53 y su participación en cáncer de mama, permite que sea de interés valorar la asociación entre ellas analizado a través de la técnica de inmunoprecipitación. De las 9 muestras inmunoprecipitadas, solo en 6 se encontró asociación, donde se identificaron al menos 2 de las 3 proteínas de interés (Hsp70, Hsp90, P53). En las 6 muestras se observó que al precipitarse la proteína Hsp70 también se encuentra presente la Hsp90 y/o la p53, observando la asociación entre las proteínas: Hsp70, Hsp90 y p53. La asociación de estas proteínas o formación de complejos proteínicos han sido también reportadas por Davidoff y colaboradores [41], donde determinaron que algunas formaciones de complejos proteínicos están relacionadas en cáncer de mama, debido a las mutaciones que p53 presenta en algunos de sus exones. Las formas mutantes de p53 forman complejos con proteínas celulares como Hsp70 y Hsp90, en donde una variante de p53 con mutaciones en el exón 5 se une a Hsp70, aquellas variantes de P53 con mutaciones en el exón 8 simplemente no se unen al complejo [41]. Muy probablemente esté presente alguna de estas mutaciones para las 6 muestras positivas, donde encontramos asociación de estas proteínas.
Por otro lado, respecto a la cantidad de proteínas Hsp70, Hsp90 y P53 en tejido mamario identificadas como alteraciones de la glándula mamaria (no cancerosas), se observó una mayor expresión de la proteína Hsp70. Estos resultados se pueden considerar como una “alerta” en pacientes con anomalías benignas, ya que si bien solo son alteraciones de tejido mamario, en cualquier momento esta proteína podría ayudar a la célula a evadir y ser independiente de los mecanismos de regulación celular, y permitir la transformación a células cancerosas [19].
Conclusión
Las Hsp son sobreexpresadas en muchos tumores humanos malignos incluyendo el cáncer de mama, y la función citoprotectora de las Hsp es esencial para la supervivencia de las células del cáncer.
En el presente estudio se observó una mayor expresión de las proteínas Hsp70, Hsp90 y p53 en tejido canceroso, y la asociación entre ellas en 6 muestras, en comparación con el encontrado en alteraciones de la glándula mamaria.
Recomendación
En vista de la importancia de esta patología en la población masculina, un sistema de registro y control es esencial en nuestros centros asistenciales, para establecer mediante forma estadística los factores asociados en nuestra población, y así mismo observar el comportamiento de esta neoplasia en nuestro país.
Conflicto de Interés
Los autores declaran no tener conflictos de interés con la publicación de este artículo.
19175
References
- Brandan ME, Villaseñor NY (2006) Detección del cáncer de mama: Estado de la mamografía en México. Cancerología2006: 147-162.
- ECO (2013) Generalidades en oncología. Fundación para la excelencia y la calidad de la oncología.
- Sanfilippo BJ, Moreno Hernández MI (2008) Cáncer de mama. Seminario: El ejercicio actual de la medicina. Facultad de Medicina de la Universidad Nacional Autónoma de México.
- Arce C, Bargalló E, Villaseñor Y, Gamboa C, Lara F, et al. (2011)Oncoguía: cáncer de mama. Cancerología 6:77-86.
- Instituto Nacional del Cáncer. Estadios del cáncer de seno. 2015b. También disponible en: https://www.cancer.gov
- Kesson EM, Allardice GM, George WD, Burns HJ, Morrison DS (2012)Effects of multidisciplinaryteamworkingonbreast cáncer survival: Retrospective, comparative, interventionalcohortstudy of 13 722 women. BMJ 344:e2718.
- Organización Mundial de la Salud [OMS] (2015) Cáncer de mama: prevención y control.
- Organización Panamericana de la Salud [OPS]. (2014) Cáncer de mama en las Américas.
- Organización Panamericana de la Salud [OPS]. (2014) La OPS observa el mes de concientización sobre el cáncer de mama.
- Martín B, Sanz R, Aragüés R, Oliva B, Sierra A (2008)Functionalclustering of metastasisproteins describes plasticadaptationresources of breast-cancercellsto new microenvironments. J Proteo Res7: 3242-3253.
- Guzmán-Santos K, Morales-Cordero K, Hernández-Rodríguez A, Gómez-Torres E, García-Cabral F, et al. (2012) Carcinoma ductal infiltrante, el tipo de cáncer de mama más común. Archde Med 8:1-8.
- Valadez B (2012) Aumenta de nuevo la mortalidad por cáncer de mama en México.
- Instituto Nacional del Cáncer (2015) Cáncer de seno (mama) masculino: Tratamiento (PDQ).
- Romero F, Santillán AL, Olvera HP, Morales SM, Ramírez MV (2008) Frecuencia de factores de riesgo de cáncer de mama. GinecolObstetMex 76:667-672.
- Olaya-Contreras P, Buekens P, Lazcano-Ponce E, Villamil-Rodriguez J (1999) Factores de riesgo reproductivo asociados al cáncer mamario, en mujeres colombianas. RevSaudePublica 33.
- Instituto Mexicano del Seguro Social [IMSS]. (2015) Octubre “Mes de sensibilización del cáncer de mama”.
- Csermely P, Yahara I (2002)Heat shock proteins. In Kéri Gy, Tóth I, eds., Molecular pathomechanismsand new trendsin drugresearch. Taylor and Francis, London and New York, pp: 67-75.
- Vidyasagar A, Wilson NA, Djamali A (2012)Heat shock protein 27 (HSP27): Biomarkerof disease and therapeutic target.FibrogenTisRep 5:7.
- Lanneau D, de Thonel A, Maurel S, Didelot C, Garrido C (2007) Apoptosis versus celldifferentiation, Role of heat shock proteinsHSP90, HSP70 and HSP27. Prion 1:53-60.
- Sánchez-Rodríguez SH, Ramírez-Alvarado ED, Barbosa-Cisneros OY (2007) El estrés impuesto por los rayos gamma, peróxido de hidrógenoy calor es amortiguado por cambios en la presión y localización de la Hsp70 en células HeLa. Archde med3.
- Calderwood SK (2010)Heatshock proteins in breastcancerprogressiona suitable case fortreatment?.Int J Hyperthermia 26:681-685.
- Dai C, Whitesell L, Rogers AB, Lindquist S (2007)Heat shock factor 1 is a powerfulmultifacetedmodifier of carcinogénesis. Cell130:1005-1018.
- Ciocca DR and Calderwood SK (2005)Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatmentimplications. Cell Stress Chaperones10: 86-103.
- Ciocca DR, Oesterreich S, Chamness GC, McGuire WL, FuquaSA (1993)Biological and clinicalimplications of heat shock protein 27,000 (Hsp27): a review. J NatlCancerInst 85:1558-1570.
- Jakob U, Gaestel M, Engel K, Buchner J (1993) Small heat shock proteins are molecular chaperones. J BiolChem 268: 1517-1520.
- Doshi BM, Hightower LE, Lee J (2009)The role of Hsp27 and actin in theregulation of movement in human cáncer cellsrespondingtoheat shock. CellStresChaper14:445-457.
- Arrigo AP, Paul C, Ducasse C, Manero F, Kretz-Remy C, et al. (2002) Small stress proteins: novel negativemodulators of apoptosis inducedindependently of reactive oxygenspecies. Prog Mol SubcellBiol 28:185-204.
- Calaf GM, Roy D (2008)Cancer genes inducedbymalathion and parathion in thepresence of estrogen in breastcells. International J Mol Med21:261-268.
- Coronato S, Laguens GE, Spinelli OM, Girolamo WD (2002) Marcadores tumorales en cancerde mama. Medi 62:73-82.
- Garrido C, Brunet M, Didelot C, Zermati Y, Schmitt E, et al. (2006) Heat shock proteins 27 and 70: anti-apoptoticproteinswithtumorigenicproperties. CellCyc 5:2592-2601.
- Mori-Iwamoto S, Kuramitsu Y, Ryozawa S, Mikuria K, Fujimoto M, et al. (2007)Proteomicsfindingheat shock protein 27 as a biomarkerforresistance of pancreatic cáncer cellstogemcitabine. Int J Oncol 31:1345-1350.
- Choi DH, Ha JS, Lee WH, Song JK, Kim GY, et al. (2007)Heat shock protein 27 isassociatedwithirinotecanresistance in human colorectal cáncer cells. FEBS Lett 581:1649-1656.
- Naylor DJ, Hartl FU (2001)Contribution of molecular chaperones Toproteinfolding in thecytoplasm of prokaryotic and eukaryoticcells. BiochemSocSymp 68: 45-68.
- Pick E, Kluger Y, Giltnane JM, Moeder C, Camp RL, et al. (2007) High HSP90 expressionisassociatedwithdecreasedsurvival in breastcancer. Cancer Res 67:2932-2937.
- Basso AD, Solit DB, Munster PN, Rosen N (2002)AnsamycinantibioticsinhibitAktactivation and cyclin D expression in breast cáncer cellsthatoverexpress HER2. Oncogene 21:1159-1166.
- Münster PN, Basso A, Solit D, Norton L, Rosen N (2001)Modulation of Hsp90 functionbyansamycinssensitizesbreast cáncer cellstochemotherapyinduced apoptosis in an RB- and schedule-dependentmanner. ClinCancer Res 7:2228-2236.
- Pandey P, Saleh A, Nakazawa A, Kumar S, Srinivasula SM, et al. (2000)Negativeregulation of cytochrome c-mediatedoligomerization of Apaf-1 and activation of procaspase-9 byheat shock protein 90. EMBO J 19:4310-4322.
- Davidoff A, Iglehart J, Marks J (1992)Immune response to p53 isdependentupon p53/HSP70 complexes. MedSci 89:3439-3442.
- Lera J, Napal C, García D, López G, Abascal L, et al. (1997) Detección de mutaciones en el gen p53 en el cáncer de mama familiar y esporádico en la población Navarra. ANALES Sin San Navarra 20:39-43.
- Bradford MA (1976) Rapid and sensitivemethodforthequantitationof microgramquantitiesof proteinutilizingtheprincipleof protein-dyebinding. Anal Biochem72:248-254.
- Laemmli UK (1970)Cleavage of structuralproteinsduringtheassembly of the head of bacteriphage T4. Nature 227:680-685.
- Towbin H, Staehelin T, Gordon J (1979)Electrophoretic transfer of proteinfrompolyacrilamidegelstonitrocellulosesheets: procedure and someapplications. ProcNatl Acad76:4350-4354.
- Joly AL, Wettstein G, Mignot G, Ghiringhelli F, Garrido C (2010) Dual role of heat shock proteins as regulators of apoptosis and innateImmunity.J. InnateImmun 2:238-247.
- Lianos GD, Alexiou GA, Mangano A, Mangano A, Rausei S, et al. (2015)The role of heat shock proteins in Cancer.CancerLett 360: 114-118.
- Dutta SK, Girotra M, Singla M, Dutta A, Otis Stephen F, et al. (2012) Serum HSP70: a novel biomarkerforearlyDetection of pancreaticcancer.Pancreas 41:530-534.
- Kocsis J, Meszaros T, Madaras B, Toth EK, Kamondi S, et al. (2011) High levels of acutephaseProteins and soluble 70 kDaheat shock proteins are independent and Additiveriskfactorsformortality in colorectalcancer.CellStrChaper16:49-55.
- Suzuki K, Ito Y, Wakai K, Kawado M, Hashimoto S, et al. (2006)Serumheat shock protein 70 levels and lungcancerrisk: a case- Control studynested in a largecohortstudy.CancerEpidemiol. BiomarkersPrev 15:1733-1737.











