Keywords
Cutaneous leishmaniasis; Case-control studies; Literature review as subject
Introduction
La leishmaniasis es una enfermedad infecciosa causada por un parásito protozoario del género Leishmania, transmitida por la picadura de flebótomos hembra, se encuentra dentro del grupo de enfermedades tropicales olvidadas y presenta tres formas clínicas, cutánea, mucocutánea y visceral [1-4]. En la actualidad existen más de 20 diferentes especies de Leishmania con cerca 90 especies de vectores involucrados en la transmisión del parásito [5].
La forma más común es la leishmaniasis cutánea , caracterizada por la presencia de úlceras principalmente en áreas expuestas como cara, brazos y piernas, que derivan en diferentes grados de discapacidad; puede curarse espontáneamente, produce cicatrices graves y permanentes, y puede generar estigmatización social [1,2].
Esta enfermedad es endémica en 98 países, Colombia junto con Afganistán, Argelia, Brasil, Irán, Siria, Etiopía, Sudán del Norte, Costa Rica y Perú registran el mayor número de casos, representando entre el 70% y el 75% de la incidencia mundial estimada. Anualmente se reportan más de 220.000 casos de leishmaniasis cutánea, aunque esta cifra es mucho menor de la real, entre otras razones, por la búsqueda pasiva de casos, problemas de acceso al diagnóstico, falta de personal de salud en zonas rurales y el hecho que muchos países endémicos no reportan casos al no disponer de programas de notificación, vigilancia e investigación [1,6].
Pese a que en los últimos años se han evidenciado grandes avances en la investigación de esta enfermedad, en América aún no existen suficientes grupos dedicados a esta área y la mayoría de esfuerzos se concentran en la investigación experimental de diferentes opciones terapéuticas. En este sentido, se ha obstado la investigación observacional, a pesar de su relevancia para determinar la magnitud del evento, su distribución según diferentes subgrupos poblacionales y la identificación de los factores de riesgo. Particularmente la investigación etiológica de casos y controles resulta de gran relevancia para el estudio de enfermedades raras o problemas de salud poco frecuentes, y/o con largos periodos de incubación, además se puede realizar en un menor tiempo, son de menor costo comparado con los estudios de cohortes, permiten evaluar e identificar relaciones causales que puedan verificarse posteriormente con estudios de mayor poder en la escala de causalidad [7,8].
Específicamente para leishmaniasis cutánea existen estudios que han identificado algunos factores de riesgo, por ejemplo en Argentina en el 2001 se reportó que dormir fuera de la habitación se asociaba con un mayor riesgo de infectarse [9], en otro estudio realizado en ese mismo país uno de los factores más influyentes fue tener menos de tres habitaciones en el hogar [10]; un estudio realizado en Palestina en el 2003 evidenció que la elevada educación del jefe de hogar y dormir con mosquitero reducen significativamente la probabilidad de adquirir la infección [11]. También se han investigado factores inmunológicos relacionándolos con leishmaniasis cutánea, como es el caso un estudio de Brasil en el que se establece una mayor expresión del alelo C común CXCR1 rs2854386 en los casos [12].
Pese a estos antecedentes, no se dispone de una revisión sistemática que permita identificar y agrupar los potenciales factores de riesgo para la leishmaniasis cutánea reportados en la literatura científica. La relevancia de este tipo de revisiones radica en que sus resultados constituyen una base para la orientación de estudios posteriores, la descripción de la heterogeneidad de factores reportados, la identificación de los lugares con mayores desarrollos en investigación observacional en esta enfermedad, así como el análisis de los factores que serían prioritarios para la gestión de programas de promoción, prevención y atención de la leishmaniasis cutánea.
El objetivo de este estudio fue describir las publicaciones sobre estudios de casos y controles en leishmaniasis cutánea e identificar sus factores de riesgo.
Métodos
Tipo de estudio: Revisión sistemática de la literatura.
Protocolo de búsqueda y selección de los estudios según las fases de la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta- Analyses) [13]
Identificación: Con base en la combinación de los términos “leishmaniasis cutánea” y “estudios de casos y controles”, se definieron las siguientes estrategias de búsqueda “leishmaniasis cutánea AND caso control”, “cutaneous leishmaniasis AND cases and controls” y “leishmaniasis cutánea AND casos e controles”; éstas se aplicaron en las bases de datos PubMed, Science Direct, Scielo, Lilacs, Embase, Ebsco, Scopus, Web of Science y Wiley Interscience.
Tamización: Se aplicaron los criterios de inclusión de tener los términos de búsqueda en título, resumen o palabras clave; publicaciones en inglés, español o portugués; investigaciones originales y cuyo objetivo central o población de estudio fuesen pacientes con leishmaniasis cutánea. Los estudios identificados se exportaron a una fuente común para la eliminación de las publicaciones duplicadas. Algunas sintaxis empleadas en las búsquedas fueron: en scielo (ti:((ab:(leishmaniasis cutánea AND casos y controles)))); en Medline-Pubmed (cutaneous leishmaniasis [Title/Abstract]) AND case control [Title/Abstract]; en ScienceDirect TITLE-ABSTR-KEY (cutaneous leishmaniasis) and TITLE-ABSTR-KEY (case control); en Lilacs tw:(leishmaniasis cutanea) AND (casos y controles:"regional") AND (db:("LILACS")).
Elección: En esta fase se aplicaron los criterios de exclusión como los estudios preclínicos, de casos, descriptivos, de pruebas diagnósticas, ensayos clínicos e intervenciones de control vectorial; además, se excluyeron estudios no disponibles o retirados de las bases de datos consultadas.
Inclusión: Con los estudios que cumplían el protocolo se realizó una síntesis cualitativa de las variables título, autores, año de publicación, país, definición de casos, número de casos, definición y número de controles, factores de riesgo asociados, medida estadística o tipo de análisis aplicado, tiempo de duración del estudio y resultado central. Estas variables se consignaron en una base de datos diseñada en SPSS 24.0®.
Reproducibilidad y evaluación de la calidad metodológica: Se garantizó la reproducibilidad de la selección de los estudios y la extracción de la información, aplicando el protocolo por parte de dos investigadores de forma independiente. Para la evaluación de la calidad metodológica se aplicaron los 22 criterios de la guía STROBE (Strengthening the reporting of observational studies in epidemiology).
Resultados
En la búsqueda inicial se identificaron 11.373 estudios, de las cuales sólo 744 incluían los términos de búsqueda en título, resumen o palabras clave, al finalizar la aplicación del protocolo se incluyeron 34 que compararon diferentes factores asociados con la leishmaniasis cutánea entre casos y controles (Figura 1).
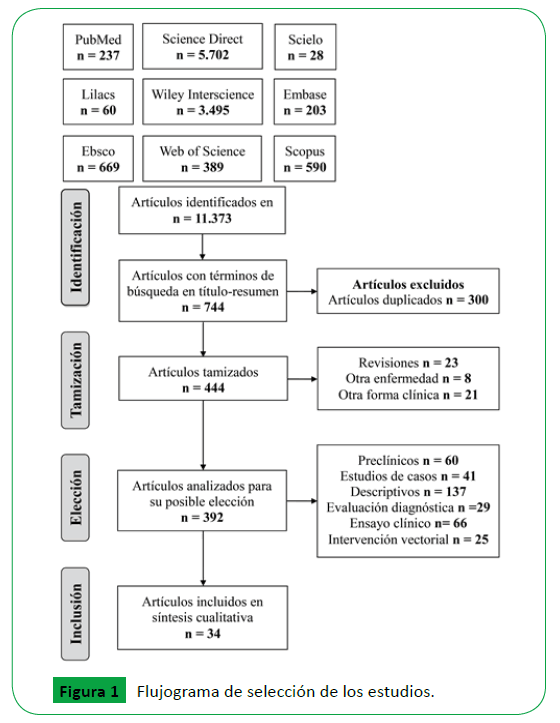
Figura 1: Flujograma de selección de los estudios.
Los estudios incluidos se publicaron entre 1987 y 2016; el 52,9% de fueron de América y el 32,4% de Asia, los países con la mayor frecuencia de publicaciones fueron Brasil con el 29,4% (n=10) e Irán con el 20,6% (n=7). Se analizaron 2.706 casos definidos como personas con diagnóstico clínico de leishmaniasis cutánea, que en algunas publicaciones se complementó con el diagnóstico parasitológico o epidemiológico y serológico (o demostración de la exposición), y 7.511 controles que incluyeron personas sanas o sin la infección, equiparando por lugar de residencia, vivir en zona endémica, sexo o edad (Tabla 1).
| |
País |
n Casos |
n Controles |
| Barbier et al. [14] |
Guyana Francesa |
31a |
52c |
| Lara et al. [15] |
Venezuela |
24a |
26 |
| Sosa et al. [9] |
Argentina |
30ab |
60cd |
| Al et al. [11] |
Palestina |
139a |
108c |
| Yadon et al. [10] |
Argentina |
171a |
308c |
| Cabrera et al. [16] |
Venezuela |
48ab |
22c |
| Ozbilge et al. [17] |
Turquía |
40a |
40 |
| Ampuero et al. [18] |
Brasil |
40 |
71 |
| Kamali et al. [19] |
Irán |
58ab |
780 |
| Fishman et al. [20] |
Israel |
34a |
32c |
| Rodríguez et al. [21] |
Nicaragua |
25 |
10 |
| Matos et al. [22] |
Brasil |
78a |
609 |
| Jafari et al. [23] |
Irán |
35a |
15 |
| Pedrosa y Ximenes [24] |
Brasil |
98a |
196c |
| Mendes et al. [25] |
Brasil |
31a |
8 |
| Samaranayake et al. [26] |
Sri Lanka |
200a |
200cd |
| Castellucci et al. [12] |
Brasil |
60a |
120cd |
| Ajdary et al. [27] |
Irán |
84b |
120 |
| Ramasawmy et al. [28] |
Brasil |
60a |
120cd |
| Limoncu et al. [29] |
Turquía |
13a |
50 |
| Ajdary et al. [30] |
Irán |
22a |
120c |
| Fernández et al. [31] |
México |
64b |
123c |
| Votýpka et al. [32] |
Turquía |
83 |
199cd |
| Ribas et al. [33] |
Brasil |
169a |
260cd |
| Fernandes et al. [34] |
Brasil |
110a |
682c |
| Ahmed y Abou [35] |
Libia |
135 |
270cd |
| Ribas A [36] |
Brasil |
111a |
218c |
| Farzin y Moassesi [37] |
Irán |
95 |
100c |
| Nilforoushzadeh et al. [38] |
Irán |
200a |
200c |
| Ortiz et al. [39] |
México |
79b |
126cd |
| Kariyawasam et al. [40] |
Sri Lanka |
38a |
1881cd |
| Nilakshi et al. [41] |
Sri Lanka |
200a |
200d |
| Mortazavi et al. [42] |
Irán |
43a |
11 |
| Araujo et al. [43] |
Brasil |
58b |
174c |
| aDiagnóstico parasitológico; bDiagnóstico epidemiológico-serológico; cEquiparado por zona de residencia o zona endemic; dEquiparado sexo y/o edad. |
Tabla 1 Descripción de los estudios incluidos en la revisión.
En la definición de los casos y los controles, si bien la mayoría precisó el criterio clínico y parasitológico, se halló una elevada heterogeneidad de características; así, para el criterio clínico algunos estudios delimitaron los casos como pacientes que presentaba en el examen físico una o más lesiones clínicas activas, cicatrices compatibles con leishmaniasis [18], personas con lesión activa de menos de 6 meses [19], casos activos con lesiones cutáneas nodulares [21], presencia de una lesión ulcerosa crónica en un sitio de piel sin evidencia de compromiso mucoso, y sin evidencia de diseminación a 10 o más sitios (leishmaniasis diseminada) [12]. De igual forma, en el criterio epidemiológico se incluían personas con menos de 3 meses de residencia en una zona endémica o que se mudaron al área endémica [20], o controles definidos como personas sin infección con menos de 3 meses de residir en una zona endémica [20], sanos que hayan habitado la misma zona de un caso por más de un año [43], personas sin la infección equiparados con los casos según la etnia [26], la ocupación [33] o una variación de la edad de cinco o menos años.
En el 65,7% (n=23) de los estudios se evaluaron factores inmunológicos, entre estos los más frecuentes fueron moléculas del complejo mayor de histocompatibilidad HLA (n=4), TNF (n=4), IFN (n=3) y varias interleucinas, las cuales no se pudieron agrupar en medidas únicas (metanalizar) dada su eleva heterogeneidad; sin embargo, en la Tabla 2 se indican los factores analizados en los diferentes estudios, así como aquellos que presentaron una asociación significativa.
| Estudio |
Resultado en los casos (Vs controles) |
| Barbier et al. [14] |
Menor frecuencia de HLA-Cw7 |
| Lara et al. [15] |
Mayor frecuencia de HLA-Bw22 (RR=12,5) y HLA-DQw3 (RR=4,2) |
| Cabrera et al. [16] |
Mayor IgE y anti-Leishmania IgE |
| Ozbilge et al. [17] |
Mayor peroxidación lipídica |
| Kamali et al. [19] |
Mayor IFN-γ genotipo TT (OR=5,7). |
| Fishman et al. [20] |
Menor Inmunidad celular BT positivo |
| Menor Inmunidad humoral IgG seropositivo |
| Rodriguez et al. [21] |
Mayor IL-10 |
| Matos et al. [22] |
No se halló asociación con IFN-γ |
| Jafari et al. [23] |
Mayor IFN-γ, IL-5, IL-10 y CD26 |
| Mendes et al. [25] |
Menor porcentaje de fenotipo CLA+ en LT CD4+ que en LT CD8+ |
| Mayor porcentaje de fenotipo CD11a (LFA-1) |
| Samaranayake et al. [26] |
No se halló asociación con TNF, LTA y SLC11A1 |
| Castellucci et al. [12] |
Mayor alelo C común CXCR1 rs2854386 (OR=2,4) |
| Ajdary et al. [27] |
No se halló asociación con polimorfismos Arg753Gln y Arg677Trp de TLR2 |
| Ramasawmy et al. [28] |
No se halló asociación con MCP-1 codificada por CCL2 |
| Ajdary et al. [30] |
Mayor frecuencia de genotipos Asp/Gly (OR=25,3) y genotipo Thr399Ileu (OR=3,3) |
| Fernández et al. [31] |
Mayor frecuencia del polimorfismo IL-1β heterocigoto C/T vs homocigoto C/C (OR:3,7) y Heterocigoto C/T vs homocigoto T/T (OR:2,4) |
| Ribas et al. [33] |
Mayor frecuencia de HLA-DRB1*13 (OR=1,7) y HLA-B*44 (OR=1,7) |
| Fernandes et al. [34] |
Mayor MIF-173C (CG+CC) (OR=1,8) y Mayor TNF-308 G/A (OR=0.75 |
| Ribas et al. [36] |
No se halló asociación con receptor quimioquina CCR5 |
| Ortiz et al. [39] |
Mayor frecuencia del genotipo SLC11A1 alelo rs2276631 C/C (OR=2,7) y del haplotipo CGCCADins (OR=3,4) |
| Nilakshi et al. [41] |
Menor frecuencia de alelo B*07 (OR=0.4) y Halotipo del locus DRB1*15-DQB1*06 (OR=0.3) |
| Mortazavi et al. [42] |
Mayor actividad de la arginasa |
Tabla 2 Potenciales factores de riesgo inmunológicos incluidos en los estudios.
Menos del 30% de los estudios evaluaron factores de riesgo sociodemográficos, conductuales, del domicilio, el peridomicilio o el ambiente laboral; entre estos, lo que presentaron una mayor fuerza de asociación fueron: bajos ingresos (OR 28,7), tiempo excesivo al aire libre (OR 24,1 y 9,2), antecedente familiar de leishmaniasis el último año (OR=17,8), estanque a menos de 150m de la casa (OR= 15,1), recoger agua (OR 13,2), casas con pared de yeso (OR 18,3) y piso de tierra (OR 6,1); dormir sin mosquitero (OR 11,1) o fuera de la habitación (OR 6,3), no protegerse de insectos (OR 6,1 y 8,3) y baja escolaridad (OR 5,0) (Tabla 3).
| Estudio |
Factor asociado |
| |
Domiciliares |
| Sosa et al. [9] |
3 o más cerdos OR=2,4 (IC95%: 1,1;4,9) |
| 3 o más caballos OR=3,8 (IC95%: 0,9;15,7) |
| Suministro externo de agua OR=2,7 (IC95%: 0,8;8,7) |
| No combatir insectos OR=2,5 (IC95%: 0,7;9,1) |
| Dormir fuera de la habitación OR=6,3 (IC95%: 1,7;22,5) |
| Al et al. [11] |
Sin asociación con la presencia de animales ni el tipo de techo del hogar |
| Elevada educación del jefe de hogar OR=0,2 (IC95%: 0,03;0,97) |
| Dormir con mosquitero OR=0,1 (IC95%: 0,00-0,96) |
| Yadon et al. [10] |
< 3 habitaciones en el hogar OR=7,6 (IC95%: 4,2;13,9). |
| Piso de tierra OR=6,1 (IC95%: 1,1;34,3). |
| Ampuero et al. [18] |
Sin asociación con presencia de reservorios y animales domésticos con lesiones |
| Pedrosa et al. [24] |
Material de la pared no duradero OR=2,4 (IC95%: 1.02;5,4). |
| Aves en la casa OR=2,9 (IC95%: 1,3;6,7) |
| No tener estufa de gas OR=2,4 (IC95%: 1,1;5,3) |
| Votýpka et al. [32] |
Almacenamiento de estiércol OR=2,0 (IC95%: 1,1;4,0) |
| Ahmed et al. [35] |
Tamaño de la familia, número de habitaciones, animales domésticos, roedores y moscas |
| Nilforoushzadeh et al. [38] |
Almacenamiento de alimentos OR=4,0 (IC95%: 1,1;15,1) |
| Kariyawasam et al. [40] |
Ladrillos con yeso OR=18,3 (IC95%: 4,4;76,8) |
| Araujo et al. [43] |
Animales dentro de la casa OR=2,3 (IC95%: 1,1;4,9) |
| |
Conductuales |
| Sosa et al. [9] |
Dormir fuera de la habitación OR=6,3 (IC95%: 1,7;22,5) |
| Al et al. [11] |
Dormir sin mosquitero OR: 11,1 (IC95%: 1,0;100) |
| Yadon et al. [10] |
No se halló asociación con actividades al aire libre (bañarse, nadar, lavar ropa) |
| Ampuero et al. [18] |
No se halló asociación con uso de mosquiteros, tipo de ropa utilizada y lugar de baño |
| Votýpka et al. [32] |
No se halló asociación con dormir sin mosquiteros o al aire libre |
| Nilforoushzadeh et al. [38] |
No hacer control de insectos OR=8,3 (IC95%: 3,9;17,8). |
| Trabajo con suelo OR=2,1 (IC95%: 1,3;3,4) |
| Kariyawasam et al. [40] |
No usar protección contra picaduras OR=6,1 (IC95%: 1,3;30,3). |
| Tiempo excesivo al aire libre OR=24,1 (IC95%: 5,4;106,3) |
| Araujo et al. [43] |
No se halló asociación con actividades de ocio realizadas en el área de bosque, dormir en el lugar de trabajo |
| |
Laborales |
| Sosa et al. [9] |
Actividades ganaderas OR=4,6 (IC95%: 1,2;17,6) |
| Dormir en el lugar de trabajo OR=4,1 (IC95%: 1,3;13,4) |
| Trabajo en bosque OR=3,7 (IC95%: 0,7;19,0) |
| Yadon et al. [10] |
Recoger agua OR=13,2 (IC95%: 2,7;62,8) |
| Trabajar en agricultura OR=5,7 (IC95%: 1,5;20,7) |
| Pedrosa y Ximenes [24] |
Trabajo rural OR=2,6 (IC95%: 1,7;46,1) |
| Actividades en el bosque OR=9,2 (IC95%: 1,8;46,7) |
| Araujo et al. [43] |
>4 horas fuera del hogar OR=3,9 (IC95%: 1,8;8,4) |
| |
Trabajo rural OR=2,6 (IC95%: 1,3;4,9) |
| |
Peri-domiciliares |
| Sosa et al. [9] |
Sin asociación con cultivos o hierba alta a menos de 200m |
| Yadon et al. [10] |
Estanque a <150m de la casa OR=15,1 (IC95%: 4,5;50,1) |
| Área cultivada <200m de la casa OR=5,2 (IC95%: 1,5;18,4) |
| Ampuero et al. [18] |
Antecedentes familiar de leishmaniasisi el último año OR=17,8 (IC95%: 4,1;77,2) |
| Pedrosa y Ximenes [24] |
Bosque <200m OR=4,3 (IC95%: 1,4;13,8) |
| Animales dentro de la casa OR=2,93 (IC95%: 1,3;6,8) |
| Votýpka et al. [32] |
Vivir cerca de un granero OR=2,1 (IC95: 1,02;4,6) |
| Nilforoushzadeh et al. [38] |
Cobertizos de animales o perreras OR=2,5 (IC95%: 1,5;4,1) |
| Sin fuente de agua OR=1,7 (IC95%: 1,1;2,7) |
| Araujo et al. [43] |
Animales fuera de la casa OR=2,6 (IC95%: 1,3;5,5) |
| |
Socio-demográficos |
| Al et al. [11] |
Escolaridad del jefe del hogar >10 años OR=0,2 (IC95%: 0,03;0,97) |
| Pedrosa y Ximenes [24] |
>4 años de escolaridad OR=0,22 (IC95%: 0,7–0,72) |
| Ingreso > salario mínimo OR=4,1 (IC95%: 1,6;10,2) |
| Votýpka et al. [32] |
No se halló asociación con la edad |
| Nilforoushzadeh et al. [38] |
Nivel económico: medio OR=2,3 (IC95%:1,2;4,3), bajo OR=2,0 (IC95%:1,0;4,0) |
| Kariyawasam et al. [40] |
Ingreso mensual <131.4 USD OR=28,7 (IC95%: 2,7;307,7) |
| Araujo et al. [43] |
Hombre OR=6,0 (IC95%: 3,1;11,5) |
Tabla 3 Potenciales factores de riesgo domiciliares, conductuales, laborales, peri-domiciliares y socio-demográficos.
En la Figura 2 se presentan los factores de riesgo más reportados en los estudios de esta revisión, siendo más alta la frecuencia de la realización de actividades al aire libre, la presencia de animales en la casa y tener cultivo o bosque cerca al domicilio.
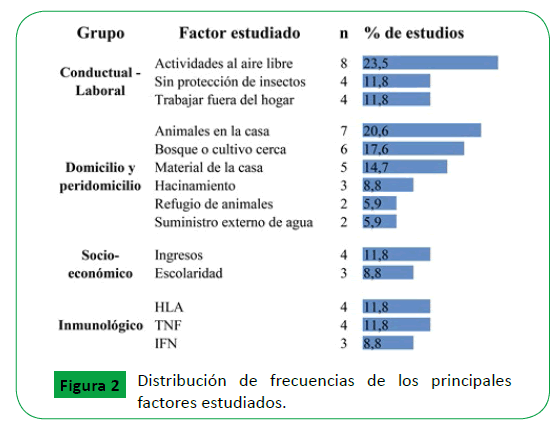
Figura 2: Distribución de frecuencias de los principales factores estudiados.
En relación con la medición de los factores de riesgo, se aplicaron encuestas transversales para las características del domicilio, el peri-domicilio, el ambiente laboral y las variables comportamentales; esto implica la presencia de sesgo temporal y bajo poder causal en las asociaciones descritas, en la medida que dichas encuestas no se indagó la duración de la exposición, ni se garantizó la longitudinalidad (de tipo restrospectivo) de las asociaciones exploradas. En relación con el estudio de los datos factores inmunológicos se aplicaron técnicas de microtoxicidad, hipersensibilidad, ELISA, citometría de flujo y PCR.
Discusión
En esta revisión sistemática se incluyeron estudios con una población de 2.706 casos y 7.511 controles en los que se determinaron diversos factores asociados con el riesgo de adquirir leishmaniasis cutánea, muchos evaluaron factores inmunológicos y en menor proporción se indagó la relación de la enfermedad con aspectos sociodemográficos, del domicilio, conductuales o del ambiente laboral; entre éstos se logró la identificación de factores de riesgo claves como el tiempo excesivo al aire libre, antecedente familiar de leishmaniasis, estanques a menos de 150 m de la casa, el tipo de material de construcción de las casas, baja protección contra insectos, baja escolaridad, presencia de animales y bajo nivel de ingresos.
Los hallazgos descritos evidencian una gran diversidad en los factores de riesgo, así como en los tamaños de la población estudiada, los países, los años de estudio y las definiciones de casos y controles; lo que a su vez corrobora el bajo nivel de desarrollo de investigación observacional y etiológica en esta enfermedad, y en general, el insuficiente nivel de conocimiento de los ejes para las intervenciones poblacionales contra la leishmaniasis cutánea. Todo ello redunda en la necesidad de aumentar las evidencias disponibles en cada país, así como el reto de lograr un mínimo nivel de homogeneidad sobre asuntos teóricos y metodológicos de la investigación epidemiológica en este campo.
En esta revisión sistemática la mayor proporción de estudios se identificó en América y Asia, los países con la mayor frecuencia de publicaciones fueron Brasil e Irán; esto coincide con los perfiles epidemiológicos de la enfermedad en el ámbito mundial dado que según la OMS, aproximadamente un 95% de los casos de leishmaniasis cutánea se producen en las Américas, la cuenca del Mediterráneo, Oriente Medio y Asia Central; más de dos terceras partes de los casos nuevos aparecen en Afganistán, Argelia, Brasil, Colombia, República Islámica de Irán y República Árabe Siria [44]. Además, se estiman entre 0,6 millones y 1,0 millón de casos nuevos por año, con una alta heterogeneidad en la distribución de la enfermedad, dados los múltiples factores que afectan su epidemiología; entre ellos vale destacar las características de la especie del parásito, aspectos ecológicos de los lugares donde se transmite, el grado de exposición pasada y actual de la población, características clínicas de los afectados, entre otras condiciones socioeconómicas, laborales y conductuales, como las descritas en esta revisión [44,45].
Es oportuno precisar que el ciclo selvático de leishmaniasis cutánea se presenta en la interacción humano-vector infectado, principalmente cuando el hombre invade territorios donde cohabitan el vector y reservorios selváticos que mantienen los focos de transmisión. Esto podría explicar algunos de los factores y grupos de riesgo identificados en el estudio, como la presencia de casos principalmente en varones de edad adulta, con actividades laborales en las cuales deben adentrarse en áreas selváticas húmedas [46], trabajar en ganadería [9], agricultura [10], pesca [24] y permanecer mucho tiempo en el área laboral [9].
Por su parte, los ciclos domiciliarios y peridomiciliarios de la enfermedad comúnmente se presenta a nivel rural (y excepcionalmente en el área urbana), donde el vector habita y se reproduce en cultivos y criaderos de animales cercanos a las casas; esto facilita la interacción con todos los miembros de la familia, incrementando así los casos de leishmaniasis cutánea en todos los grupos etarios [46].
En esta revisión se identificaron algunos factores referidos a este ciclo de transmisión como tener animales dentro y fuera de la casa [9,24,35,43], pocas habitaciones o elevado tamaño familiar [10,35], analfabetismo o baja escolaridad [11,24,35], bajo nivel de ingresos, [11,24,38,40,43] y no usar protección contra los insectos [11,40]. Estos factores permitirían priorizar algunos subgrupos de mayor riesgo y establecer medidas de prevención adecuadas para cada localidad [47], dado que los resultados de esta revisión evidencian una alta heterogeneidad de posibles factores de riesgo, al tiempo que también permitió evidenciar el hecho que un factor puede constituir un riego en algunos estudios y en otros no, recabando la necesidad de incrementar los estudios etiológicos de cada localidad.
La presencia de animales fue identificado como un factor de riesgo en varios estudios; sin embargo, una limitación en este hallazgo está dado por el hecho que muchos estudios no especifican los tipos de animales existentes en las viviendas o en el peri-domicilio, como base para su extrapolación a otras poblaciones; por ejemplo, en Colombia se atribuyen como reservorios de importancia para Leishmania spp. en el ámbito selvático Choloepus hoffmani (perezoso de dos dedos), Bradypus griseus (perezoso de tres dedos), posiblemente roedores del género Proechimys spp. (rata espinosa) y cánidos del género Procyon spp. (el mapache o zorra manglera); y en el ciclo de transmisión peri-domiciliaria y actuando como responsables de los focos domésticos y peridomésticos Melanomys caliginosus (ratón silvestre), Microryzomys minutus (ratón enano), Ratus rattus (rata), Sylvilagus braziliensis (conejo de páramo), Didelphis marsupialis (chucho, fara, runcho), Micoureus demerarae (comadrejita cenicienta, marmosa), Cannis familiaris (perro) y el hombre [46].
Por otro lado, un hallazgo llamativo en esta revisión fue la elevada frecuencia de publicaciones que analizaron factores inmunológicos como las variantes polimórficas CXCR1_rs2854386 [12] y Asp299Gly [30], la actividad de la arginasa [42], el antígeno HLA-Cw7 [14], HLA-Bw22 y HLA-DQw3 [15], los cuales son muy relevantes para la orientación de estudios posteriores, dado que los factores identificados en esta revisión permiten el estudio de la patogénesis de la enfermedad, su progresión e incluso la orientación de nuevas opciones terapéuticas; por ejemplo, individuos con diferente expresión del HLA presentan diferencias en su riesgo de desarrollar la enfermedad, lo que constituye un hallazgo valioso para ampliar la información relacionada con diferentes mecanismos inmunológicos de esta enfermedad, como base para su control [48,49].
Entre las limitaciones de este estudio se destaca la elevada heterogeneidad en las publicaciones, las cuales impidieron metanalizar los principales factores de riesgo reportados para leishmaniasis cutánea y evaluar posibles sesgos de publicación. A esto se suma el hecho que muchos estudios de casos y controles no cumplieron criterios básicos de este tipo de investigación etiológica como el no explicitar en la selección de los casos y los controles aspectos como los parámetro del cálculo de muestra (principalmente la potencia estadística), la delimitación de un marco temporal relevante en relación a la enfermedad/ exposición, la selección aleatoria basados en una población, control o ajuste de potenciales factores de confusión y considerar los criterios de Bradford Hills (por ejemplo, secuencia temporal, gradiente dosis-respuesta, fortaleza de asociación, verosimilitud biológica) [50].
Conclusión
Existe una elevada heterogeneidad en los diseños metodológicos y factores analizados en los estudios de casos y controles para leishmaniasis cutánea, lo cual evidencia la necesidad de mejorar la investigación observacional en esta enfermedad. Los factores con una mayor fuerza de asociación se relacionaron con vivir en condiciones de pobreza, tiempo excesivo al aire libre, antecedente familiar de leishmaniasis, algunas características de la vivienda, no protegerse de insectos y baja escolaridad; cuya corroboración como factores de riesgo demanda la ejecución de estudios posteriores de mejorar calidad y grado de evidencia, para implementarlos como ejes de la prevención, control y atención de la enfermedad.
Conflicto de Intereses
Ninguno de los autores declara conflicto de intereses para la publicación de este manuscrito.
References
- Savioli L, Daumerie D (2010) First WHO report on neglected tropical diseases: Working to overcome the global impact of neglected tropical diseases. WHO, Ginebra pp: 91-96.
- World Health Organization (2014) Manual for case management of cutaneous leishmaniasis in the WHO eastern mediterranean region. pp: 7-10.
- World Health Organization (2016) Neglected tropical diseases.
- Manamperi N, Oghumu S, Pathirana N, de Silva M, Abeyewickreme W, et al. (2017) In situ immunopathological changes in cutaneous leishmaniasis due to Leishmania donovani. Parasite Immunol 39: e12413.
- Sophie M, Hameed A, Muneer A, Samdani A, Saleem S, et al. (2017) SLC11A1 polymorphisms and host susceptibility to cutaneous leishmaniasis in Pakistan. Parasit Vectors 10: 1-9.
- Alvar J, Velez I, Bern C, Herrero M, Desjeux P, et al. (2012) Leishmaniasis worldwide and global estimates of its incidence. PLoS One 7: e35671.
- Altagracia M, Kravzov J, Moreno C, López F, Martínez J (2012) Las enfermedades "olvidadas" de América Latina y el Caribe: Un problema de salud pública global. Rev Mex Cienc Farm 43: 33-41.
- Lazcano E, Salazar E, Hernández M (2001) Estudios epidemiológicos de casos y controles. Fundamento teórico, variantes y aplicaciones. Salud Pública Mex 43: 135-150.
- Sosa S, Segura E, Gómez A, Salomón O, Peralta M, et al. (2001) Cutaneous leishmaniasis in northern Argentina: Identification of risk factors in a case-cohort study of three municipalities in Salta. Rev Soc Bras Med Trop 34: 511-517.
- Yadon Z, Rodrigues L, Davies C, Quigley M (2003) Indoor and peridomestic transmission of American cutaneous leishmaniasis in northwestern Argentina: A retrospective case-control study. Am J Trop Med Hyg 68: 519-526.
- Al A, Barghuthy F, Schnur L, Jacobson R, Schönian G, et al. (2003) Epidemiology of cutaneous leishmaniasis in the endemic area of Jericho, Palestine. East Mediterr Health J 9: 805-815.
- Castellucci L, Jamieson SE, Miller ES, Menezes E, Oliveira J, et al. (2010) CXCR1 and SLC11A1 polymorphisms affect susceptibility to cutaneous leishmaniasis in Brazil: A case-control and family-based study. BMC Med Gene 11.
- Moher D, Liberati A, Tetzlaff J, Altman DG (2009) Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement. Ann Intern Med 151: 264-269.
- Barbier D, Demenais F, Lefait J, David B, Blanc M, et al. (1987) usceptibility to human cutaneous leishmaniasis and HLA, Gm, Km markers. Tissue Antigens 30: 63-67.
- Lara M, Layrisse Z, Scorza J, Garcia E, Stoikow Z, et al. (1991) Immunogenetics of human American cutaneous leishmaniasis. Study of HLA haplotypes in 24 families from Venezuela. Hum Immunol 30:129-135.
- Cabrera M, Rodriguez O, Monsalve I, Tovar R, Hagel I (2003) Variations in the serum levels of soluble CD23, nitric oxide and IgE across the spectrum of American cutaneous leishmaniasis. Acta Trop 88: 145-151.
- Ozbilge H, Aksoy N, Kilic A, Saraymen R, Yazar S, et al. (2005) Evaluation of oxidative stress in cutaneous leishmaniasis. J Dermatol 32: 7-11.
- Ampuero J, Urdaneta M, Macêdo, V (2005) Factores de riesgo para la transmisión de leishmaniasis cutánea en niños de 0 a 5 años en un área endémica de leishmania (Viannia) braziliensis. Cad Saúde Pública 21: 161-170.
- Kamali E, Rasoulia M, Mortazavic H, Gharesi B (2006) Cytokine gene polymorphisms and susceptibility to cutaneous leishmaniasis in Iranian patients. Cytokine 35: 159-165.
- Fishman D, Bazarsky E, Sneir R, Klement E, Orr N, et al. (2006) The flow-cytometry-based evaluation of cellular immunity in cases of cutaneous leishmaniasis and healthy controls from the endemic area in southern Israel. Ann Trop Med Parasitol 100: 23-31.
- Rodríguez B, Beatty R, Belli A, Barreto A, Palacios X, et al. (2007) Atypical cutaneous leishmaniasis cases display elevated antigen-induced interleukin-10. Parasite Immunol 29: 277-282.
- Matos G, Covas C, Bittar R, Gomes A, Marques F, et al. (2007) IFNG+874T/A polymorphism is not associated with American tegumentary leishmaniasis susceptibility but can influence Leishmania induced IFN-γ production. BMC Infect Dis 7: 33.
- Jafari R, Ajdary S, Amiri Z, Mohammadi A, Nourijelyani K, et al. (2008) CD26 expression on CD4+T cells in patients with cutaneous leishmaniasis. Clin Exp Immunol 153: 31-36.
- Pedrosa F, Ximenes R (2009) Sociodemographic and environmental risk factors for American cutaneous leishmaniasis (ACL) in the state of Alagoas, Brazil. Am J Trop Med Hyg 81: 195-201.
- Mendes C, Gomes A, Nunes E, Pereira R, Nogueira R, et al. (2009) The skin homing receptor cutaneous leucocyte-associated antigen (CLA) is up-regulated by leishmania antigens in T-lymphocytes during active cutaneous leishmaniasis. Clin Exp Immunol 157: 377-384.
- Samaranayake T, Fernando S, Dissanayake V (2010) Candidate gene study of susceptibility to cutaneous leishmaniasis in Sri Lanka. Trop Med Int Health 15: 632-638.
- Ajdary S, Ghamilouie M, Alimohammadiana M, Hosseini M, Pakzad S (2010) Lack of association of toll-like receptor 2 Arg753Gln with cutaneous leishmaniasis. Parasitol Int 59: 466-468.
- Ramasawmy R, Menezesa E, Magalhãesa A, Oliveira J, Castelluccia L, et al. (2010) The -2518 bp promoter polymorphism at CCL2/MCP1 influences susceptibility to mucosal but not localized cutaneous leishmaniasis in Brazil. Infect Genet Evol 10: 607-613.
- Limoncu M. ?anlida? T, Balcio?lu I, Akçali S, Özensoy S, et al. (2011) Complement C1, C3 and C4 levels in sera of leishmaniasis cases in Turkey. Afr J Microbiol Res 5: 720-724.
- Ajdary S, Ghamilouie M, Alimohammadiana M, Riazi F, Pakzadc S (2011) Toll-like receptor 4 polymorphisms predispose to cutaneous leishmaniasis. Microb Infect 13: 226-231.
- Fernández E, Rangel C, Espinosa V, Carrillo K, Salaiza N, et al. (2012). Disease Severity in Patients Infected with Leishmania mexicana Relates to IL-1β. PLoS Negl Trop Dis 6: e1533.
- Votýpka J, Kasap O, Volf P, Kodym P, Alten B (2012) Risk factors for cutaneous leishmaniasis in Cukurova region, Turkey. Trans R Soc Trop Med Hyg 106: 186-190.
- Ribas R, Ribas A, Dos Santos M, da Silva W, Lonardoni M, et al. (2013) Association between HLA genes and American cutaneous leishmaniasis in endemic regions of southern Brazil. BMC Infect Dis 13: 198.
- Fernandes C, Cardoso C, Gomes A, Santos J, Da-Cruz A, et al. (2013) Candidate gene case-control and functional study shows macrophage inhibitory factor (MIF) polymorphism is associated with cutaneous leishmaniasis. Cytokine 61: 168-172.
- Ahmed S, Abou H (2013) Cutaneous leishmaniasis in Gharyan- Libya a case-control study. Life Sci J 10: 826-834.
- Ribas A, Ribas R, Da Silva J, Aristides S, Lonardoni M, et al. (2013) Effect of the chemokine receptor CCR5 in the development of American cutaneous leishmaniasis in a southern Brazilian population. Mol Med Rep 8: 189-194.
- Farzin L, Moassesi, M (2014) A comparison of serum selenium, zinc and copper level in visceral and cutaneous leishmaniasis. J Res Med Sci 19: 355-357.
- Nilforoushzadeh M, Hosseini S, Heidari A, Bidabadi L, Siadat A (2014) Domestic and peridomestic risk factors associated with transmission of cutaneous leishmaniasis in three hypo endemic, endemic, and hyper endemic areas: A randomized epidemiological study. J Res Med Sci 19: 928-932.
- Ortiz A, De la Rosa G, Zavaleta B, Chávez S, Pastor J, et al. (2015) Association of leishmaniasis with TNF alpha promoter and SLC11A1 gene polymorphisms in patients of two endemic areas in Mexico. Microbes Infect 17: 387-394
- Kariyawasam K, Edirisuriya C, Senerath U, Hensmen D, Siriwardana H, et al. (2015) Characterisation of cutaneous leishmaniasis in Matara district, southern Sri Lanka: Evidence for case clustering. Pathog Glob Health 109: 336-343.
- Nilakshi S, Sumadhya F, Nilaksha N, Chaturaka R, Nadira K, et al. (2016) Association of HLA class I and II genes with cutaneous leishmaniasis: A case control study from Sri Lanka and a systematic review. BMC Infect Dis 16: 292.
- Mortazavi H, Sadeghipour P, Taslimi Y, Habibzadeh S, Zali F, et al. (2016) Comparing acute and chronic human cutaneous leishmaniasis caused by leishmania major and leishmania tropica focusing on arginase activity. J Eur Acad Dermatol Venereol 30: 2118-2121.
- Araujo A, Portela NC, Feitosa AP, Silva O, Ximenes R, et al. (2016) Risk factors associated with American cutaneous leishmaniasis in an endemic area of Brazil. Rev Inst Med Trop São Paulo 58: 86.
- Organización Mundial de la Salud (2017) Leishmaniasis.
- Ferreras A, García I, Gato A, Ferreras P (2014) Infecciones por protozoos hemoflagelados: Leishmaniasis, enfermedad de Chagas y tripanosomiasis africana. Medicine - Programa de Formación Médica Continuada Acreditado 11: 3194–3207.
- Guía de Atención de la Leishmaniasis. Epidemiología en Guía de Atención de la Leishmaniasis.
- Vásquez L, Sierra D, Rojas E (2002) Mecanismos de transmisión de la leishmaniasis. Revista de la Sociedad Venezolana de Microbiología 22: 182-187.
- Gupta G, Oghumu S, Satoskar RA (2013) Mechanisms of immune evasion in leishmaniasis. Adv Appl Microbiol 82: 155-184.
- Scott P, Novais FO (2016) Cutaneous leishmaniasis: Immune responses in protection and pathogenesis. Nat Rev Immunol 16: 581-592.
- Critical Appraisal Skills Programme Español (2016) Herramienta de análisis de estudios de Casos y Controles.
21537
References
- Savioli L, Daumerie D (2010) First WHO report on neglected tropical diseases: Working to overcome the global impact of neglected tropical diseases. WHO, Ginebra pp: 91-96.
- World Health Organization (2014) Manual for case management of cutaneous leishmaniasis in the WHO eastern mediterranean region. pp: 7-10.
- Manamperi N, Oghumu S, Pathirana N, de Silva M, Abeyewickreme W, et al. (2017) In situ immunopathological changes in cutaneous leishmaniasis due to Leishmania donovani. Parasite Immunol 39: e12413.
- Sophie M, Hameed A, Muneer A, Samdani A, Saleem S, et al. (2017) SLC11A1 polymorphisms and host susceptibility to cutaneous leishmaniasis in Pakistan. Parasit Vectors 10: 1-9.
- Alvar J, Velez I, Bern C, Herrero M, Desjeux P, et al. (2012) Leishmaniasis worldwide and global estimates of its incidence. PLoS One 7: e35671.
- Altagracia M, Kravzov J, Moreno C, López F, Martínez J (2012) Las enfermedades "olvidadas" de América Latina y el Caribe: Un problema de salud pública global. Rev Mex Cienc Farm 43: 33-41.
- Lazcano E, Salazar E, Hernández M (2001) Estudios epidemiológicos de casos y controles. Fundamento teórico, variantes y aplicaciones. Salud Pública Mex 43: 135-150.
- Sosa S, Segura E, Gómez A, Salomón O, Peralta M, et al. (2001) Cutaneous leishmaniasis in northern Argentina: Identification of risk factors in a case-cohort study of three municipalities in Salta. Rev Soc Bras Med Trop 34: 511-517.
- Yadon Z, Rodrigues L, Davies C, Quigley M (2003) Indoor and peridomestic transmission of American cutaneous leishmaniasis in northwestern Argentina: A retrospective case-control study. Am J Trop Med Hyg 68: 519-526.
- Al A, Barghuthy F, Schnur L, Jacobson R, Schönian G, et al. (2003) Epidemiology of cutaneous leishmaniasis in the endemic area of Jericho, Palestine. East Mediterr Health J 9: 805-815.
- Castellucci L, Jamieson SE, Miller ES, Menezes E, Oliveira J, et al. (2010) CXCR1 and SLC11A1 polymorphisms affect susceptibility to cutaneous leishmaniasis in Brazil: A case-control and family-based study. BMC Med Gene 11.
- Moher D, Liberati A, Tetzlaff J, Altman DG (2009) Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement. Ann Intern Med 151: 264-269.
- Barbier D, Demenais F, Lefait J, David B, Blanc M, et al. (1987) usceptibility to human cutaneous leishmaniasis and HLA, Gm, Km markers. Tissue Antigens 30: 63-67.
- Lara M, Layrisse Z, Scorza J, Garcia E, Stoikow Z, et al. (1991) Immunogenetics of human American cutaneous leishmaniasis. Study of HLA haplotypes in 24 families from Venezuela. Hum Immunol 30:129-135.
- Cabrera M, Rodriguez O, Monsalve I, Tovar R, Hagel I (2003) Variations in the serum levels of soluble CD23, nitric oxide and IgE across the spectrum of American cutaneous leishmaniasis. Acta Trop 88: 145-151.
- Ozbilge H, Aksoy N, Kilic A, Saraymen R, Yazar S, et al. (2005) Evaluation of oxidative stress in cutaneous leishmaniasis. J Dermatol 32: 7-11.
- Ampuero J, Urdaneta M, Macêdo, V (2005) Factores de riesgo para la transmisión de leishmaniasis cutánea en niños de 0 a 5 años en un área endémica de leishmania (Viannia) braziliensis. Cad Saúde Pública 21: 161-170.
- Kamali E, Rasoulia M, Mortazavic H, Gharesi B (2006) Cytokine gene polymorphisms and susceptibility to cutaneous leishmaniasis in Iranian patients. Cytokine 35: 159-165.
- Fishman D, Bazarsky E, Sneir R, Klement E, Orr N, et al. (2006) The flow-cytometry-based evaluation of cellular immunity in cases of cutaneous leishmaniasis and healthy controls from the endemic area in southern Israel. Ann Trop Med Parasitol 100: 23-31.
- Rodríguez B, Beatty R, Belli A, Barreto A, Palacios X, et al. (2007) Atypical cutaneous leishmaniasis cases display elevated antigen-induced interleukin-10. Parasite Immunol 29: 277-282.
- Matos G, Covas C, Bittar R, Gomes A, Marques F, et al. (2007) IFNG+874T/A polymorphism is not associated with American tegumentary leishmaniasis susceptibility but can influence Leishmania induced IFN-γ production. BMC Infect Dis 7: 33.
- Jafari R, Ajdary S, Amiri Z, Mohammadi A, Nourijelyani K, et al. (2008) CD26 expression on CD4+T cells in patients with cutaneous leishmaniasis. Clin Exp Immunol 153: 31-36.
- Pedrosa F, Ximenes R (2009) Sociodemographic and environmental risk factors for American cutaneous leishmaniasis (ACL) in the state of Alagoas, Brazil. Am J Trop Med Hyg 81: 195-201.
- Mendes C, Gomes A, Nunes E, Pereira R, Nogueira R, et al. (2009) The skin homing receptor cutaneous leucocyte-associated antigen (CLA) is up-regulated by leishmania antigens in T-lymphocytes during active cutaneous leishmaniasis. Clin Exp Immunol 157: 377-384.
- Samaranayake T, Fernando S, Dissanayake V (2010) Candidate gene study of susceptibility to cutaneous leishmaniasis in Sri Lanka. Trop Med Int Health 15: 632-638.
- Ajdary S, Ghamilouie M, Alimohammadiana M, Hosseini M, Pakzad S (2010) Lack of association of toll-like receptor 2 Arg753Gln with cutaneous leishmaniasis. Parasitol Int 59: 466-468.
- Ramasawmy R, Menezesa E, Magalhãesa A, Oliveira J, Castelluccia L, et al. (2010) The -2518 bp promoter polymorphism at CCL2/MCP1 influences susceptibility to mucosal but not localized cutaneous leishmaniasis in Brazil. Infect Genet Evol 10: 607-613.
- Limoncu M. Şanlidağ T, Balcioğlu I, Akçali S, Özensoy S, et al. (2011) Complement C1, C3 and C4 levels in sera of leishmaniasis cases in Turkey. Afr J Microbiol Res 5: 720-724.
- Ajdary S, Ghamilouie M, Alimohammadiana M, Riazi F, Pakzadc S (2011) Toll-like receptor 4 polymorphisms predispose to cutaneous leishmaniasis. Microb Infect 13: 226-231.
- Fernández E, Rangel C, Espinosa V, Carrillo K, Salaiza N, et al. (2012). Disease Severity in Patients Infected with Leishmania mexicana Relates to IL-1β. PLoS Negl Trop Dis 6: e1533.
- Votýpka J, Kasap O, Volf P, Kodym P, Alten B (2012) Risk factors for cutaneous leishmaniasis in Cukurova region, Turkey. Trans R Soc Trop Med Hyg 106: 186-190.
- Ribas R, Ribas A, Dos Santos M, da Silva W, Lonardoni M, et al. (2013) Association between HLA genes and American cutaneous leishmaniasis in endemic regions of southern Brazil. BMC Infect Dis 13: 198.
- Fernandes C, Cardoso C, Gomes A, Santos J, Da-Cruz A, et al. (2013) Candidate gene case-control and functional study shows macrophage inhibitory factor (MIF) polymorphism is associated with cutaneous leishmaniasis. Cytokine 61: 168-172.
- Ahmed S, Abou H (2013) Cutaneous leishmaniasis in Gharyan- Libya a case-control study. Life Sci J 10: 826-834.
- Ribas A, Ribas R, Da Silva J, Aristides S, Lonardoni M, et al. (2013) Effect of the chemokine receptor CCR5 in the development of American cutaneous leishmaniasis in a southern Brazilian population. Mol Med Rep 8: 189-194.
- Farzin L, Moassesi, M (2014) A comparison of serum selenium, zinc and copper level in visceral and cutaneous leishmaniasis. J Res Med Sci 19: 355-357.
- Nilforoushzadeh M, Hosseini S, Heidari A, Bidabadi L, Siadat A (2014) Domestic and peridomestic risk factors associated with transmission of cutaneous leishmaniasis in three hypo endemic, endemic, and hyper endemic areas: A randomized epidemiological study. J Res Med Sci 19: 928-932.
- Ortiz A, De la Rosa G, Zavaleta B, Chávez S, Pastor J, et al. (2015) Association of leishmaniasis with TNF alpha promoter and SLC11A1 gene polymorphisms in patients of two endemic areas in Mexico. Microbes Infect 17: 387-394
- Kariyawasam K, Edirisuriya C, Senerath U, Hensmen D, Siriwardana H, et al. (2015) Characterisation of cutaneous leishmaniasis in Matara district, southern Sri Lanka: Evidence for case clustering. Pathog Glob Health 109: 336-343.
- Nilakshi S, Sumadhya F, Nilaksha N, Chaturaka R, Nadira K, et al. (2016) Association of HLA class I and II genes with cutaneous leishmaniasis: A case control study from Sri Lanka and a systematic review. BMC Infect Dis 16: 292.
- Mortazavi H, Sadeghipour P, Taslimi Y, Habibzadeh S, Zali F, et al. (2016) Comparing acute and chronic human cutaneous leishmaniasis caused by leishmania major and leishmania tropica focusing on arginase activity. J Eur Acad Dermatol Venereol 30: 2118-2121.
- Araujo A, Portela NC, Feitosa AP, Silva O, Ximenes R, et al. (2016) Risk factors associated with American cutaneous leishmaniasis in an endemic area of Brazil. Rev Inst Med Trop São Paulo 58: 86.
- Ferreras A, García I, Gato A, Ferreras P (2014) Infecciones por protozoos hemoflagelados: Leishmaniasis, enfermedad de Chagas y tripanosomiasis africana. Medicine - Programa de Formación Médica Continuada Acreditado 11: 3194–3207.
- Guía de Atención de la Leishmaniasis. Epidemiología en Guía de Atención de la Leishmaniasis.
- Vásquez L, Sierra D, Rojas E (2002) Mecanismos de transmisión de la leishmaniasis. Revista de la Sociedad Venezolana de Microbiología 22: 182-187.
- Gupta G, Oghumu S, Satoskar RA (2013) Mechanisms of immune evasion in leishmaniasis. Adv Appl Microbiol 82: 155-184.
- Scott P, Novais FO (2016) Cutaneous leishmaniasis: Immune responses in protection and pathogenesis. Nat Rev Immunol 16: 581-592.
- Critical Appraisal Skills Programme Español (2016) Herramienta de análisis de estudios de Casos y Controles.







