Keywords
immunotherapy, vaccine, Alzheimer’s disease, beta amyloid
Introducción
A pesar de los esfuerzos para alcanzar un tratamiento curativo para la Enfermedad de Alzheimer (EA) el manejo de estos pacientes aún se sigue basando en tratamiento sintomático. Entre las nuevas líneas de investigación que persiguen un alcanzar un tratamiento curativo, una de las más prometedoras es la denominada inmunoterapia, que consiste en provocar una respuesta inmune frente a los depósitos de péptidos patógenos causantes de la enfermedad. La inmunoterapia anti-amiloide beta (Aβ) ha sido sujeto de intensa investigación desde que la inmunización activa con Aβ en ratones transgénicos demostró reducir los depósitos de Aβ [1,2] e incluso las neuritas distróficas [3]. Trabajos ulteriores encontraron que la inmunización anti-Aβ se asocia con mejoría en funciones cognitivas en ratones transgénicos tanto si se acompañaba de reducción en los depósitos cerebrales de amiloide [4,5] como si no lo hace [6]. Actualmente son numerosos los grupos de investigación que trabajan en este campo de forma que el número de artículos publicados y patentes registradas vinculados con este área están creciendo exponencialmente. Básicamente pueden distinguirse 3 modalidades de inmunización para la EA: la inmunización activa (mediante administración del antígeno) la inmunización pasiva (mediante administración de anticuerpos específicos) y la vacuna génica (mediante transfección de genes que producen el antígeno en el propio organismo).
En los párrafos siguientes se ofrece un análisis de los mecanismos y agentes que intervienen en la respuesta inmune frente al Aβ y se revisa la experiencia acumulada hasta el momento con las diferentes modalidades de inmunización.
Las bases de la inmunoterapia Aβ
La importancia de la barrera hemato-encefálica (BHE)
Recordemos que el Sistema Nervioso Central (SNC) se encuentra parcialmente aislado del resto del organismo mediante la BHE, que es una monocapa de células del lecho capilar de los vasos sanguíneos cerebrales que previene la formación de ultrafiltrados plasmáticos manteniendo la homeostasis cerebral, aunque existen sistemas de transportadores que permiten el paso de ciertas moléculas. Por tanto la primera cuestión es si el antígeno y los anticuerpos son capaces de atravesar la BHE. Mediante inyección en el cerebro de Aβ marcado radioactivamente se ha visto que el Aβ soluble puede ser recuperado en sangre [7]. Posteriormente se ha visto que este transporte puede ser bidireccional [8,9]. La existencia de un equilibrio dinámico entre el Aβ soluble del SNC y los fluidos periféricos se cree que se debe a que el mecanismo por el que Aβ se mueve hacia dentro y hacia fuera del cerebro y atraviesa la BHE que se basa en un mecanismo de transporte mediado por receptor. De este modo, la alteración de los niveles de Aβ en un compartimento altera el equilibrio causando el transporte de Aβ desde un compartimento a otro hasta que se alcanza un nuevo equilibrio. Así, los hallazgos de DeMattos et al. son consistentes con esta conclusión ya que la administración periférica de un anticuerpo monoclonal anti-Aβ en ratones transgénicos provocó un rápido incremento de los niveles plasmáticos de Aβ alterando el equilibrio sangre-cerebro de Aβ a pesar de que el anticuerpo no se unía a los acúmulos cerebrales [10]. Sin embargo Bard et al. demostraron que los anticuerpos anti-Aβ sí atravesaban la BHE accediendo al SNC donde se unían a las placas amiloides [11]; la única diferencia entre los estudios de DeMattos y Bard fue la vía de administración periférica. Mientras DeMattos et al. inyectaron los anticuerpos intravenosos, Bard et al. los administraron vía inyección intraperitoneal, lo que hace pensar que las diferentes vías de administración influyen en la capacidad de los anticuerpos para atravesar la BHE. Por otro lado en las autopsias de pacientes que habían recibido inmunización activa Aβ los infiltrados de células T eran más densos en la proximidad de los vasos con angiopatía amiloide, lo que sugiere que la BHE había sido rota [12].
De todas formas, y a pesar de lo dicho, ni el Aβ [13] ni los autoanticuerpos anti-Aβ [14,15] plasmáticos son buenos biomarcadores de la enfermedad.
El estado inmune de los pacientes con EA
En general, el envejecimiento causa disminución en la intensidad de las respuestas inmunes [16]; por ejemplo la inmunización activa con las vacunas de la gripe o del tétanos induce una inmunidad menos protectora en ancianos que en jóvenes. Hyman et al. demostraron la presencia de autoanticuerpos frente a Aβ en individuos con o sin depósitos Aβ y probaron que para una misma edad los niveles de tales anticuerpos se correlacionaban con la probabilidad de desarrollar demencia [15], por lo que niveles bajos de autoanticuerpos Aβ, aunque frecuentes en la población anciana (debido al deterioro específico de la actividad de los linfocitos T helper sobre los linfocitos B que producen anticuerpos anti-amiloide-β42) no confieren protección frente al desarrollo de demencia, de hecho se ha visto que los pacientes con EA tienen niveles más bajos de anticuerpos anti-Aβ que los individuos ancianos sanos [17]. Por contra, respecto a la inmunoterapia Aβ se ha comunicado que la inmunización activa en ratones y humanos de edad avanzada causa un incremento en las respuestas autoinmunes [18, 19]. Esto no es así en aquellos pacientes con elevación de Aβ cerebral y periférica durante un periodo muy largo de la vida, como puede ser el caso de aquellos pacientes con mutaciones en las presenilinas o con síndrome de Down que tienen respuestas reducidas a la vacuna Aβ, lo cual también ha sido demostrado en ratones transgénicos APP [20], sugiriendo que la producción de Aβ desde edades tempranas podría inducir tolerancia de los linfocitos T. Esta reactividad intrínseca ante el propio antígeno Aβ en seres humanos demuestra que mientras la tendencia general es a reducir la respuesta inmune conforme avanza la edad existe un aumento selectivo de la reactividad de los linfocitos T frente a Aβ en ancianos cuya causa se desconoce, aunque podría estar relacionada con la susceptibilidad y curso de la EA.
El mecanismo de acción: aclaramiento periférico versus aclaramiento central
Aunque tanto las estrategias de inmunización pasiva como las de inmunización activa resultan eficaces en modelos animales de EA, aún se desconoce el mecanismo exacto por el que los anticuerpos consiguen este efecto, si bien se postulan 2 hipótesis: la del aclaramiento periférico (plasmático) y la del aclaramiento central (tisular) de amiloide. Como veremos, existen evidencias a favor y en contra de ambas hipótesis, pero es importante señalar que estos mecanismos no son mutuamente excluyentes.
La administración periférica del anticuerpo monoclonal m266 (dirigido contra el dominio central de Aβ) en ratones transgénicos provoca un rápido incremento (x1000) de los niveles plasmáticos de Aβ alterando el equilibrio sangre-cerebro de Aβ. A pesar de que la administración periférica de m266 a ratones transgénicos PDAPP reduce el depósito de Aβ m266 no se une a los acúmulos cerebrales por lo que parece que reduce los depósitos mediante el aumento del aclaramiento plasmático, y por lo tanto m266 actúa mediante un efecto de “sumidero plasmático” que facilita el flujo de Aβ del cerebro a la sangre [10].
Sin embargo otros estudios proponen otros mecanismos para explicar las bases de la inmunoterapia. Por ejemplo Bard et al. administraron periféricamente anticuerpos anti-Aβ en ratones transgénicos PDAPP demostrando que dichos anticuerpos atravesaban la BHE accediendo al SNC donde se unían a las placas amiloides y activaban las células microgliales induciendo así el aclaramiento del amiloide [11]. Otro estudio también demostró que la aplicación directa de anticuerpos anti-Aβ sobre la superficie del cortex de ratones PDAPP vivos también producía descenso de los depósitos en la zona donde habían sido aplicados [21,22] y que estos anticuerpos que se unen directamente a las placas seniles pueden ser un primer paso esencial para su aclaramiento.
La inmunoterapia parece ser mucho más eficaz en ratones transgénicos jóvenes sin depósito de amiloide que en ratones más viejos que contienen extensas placas de amiloide [23]. Esta observación es más consistente con la hipótesis del sumidero periférico de Aβ porque en ausencia de depósitos Aβ el secuestro de Aβ soluble por anticuerpos anti-Aβ en el plasma de ratones transgénicos PDAPP jóvenes reduce de forma eficaz los niveles solubles de Aβ cerebral de forma que quedaría insuficiente Aβ en el cerebro de estos ratones como para agregarse en depósitos insolubles, al contrario de lo que sucedería en ratones viejos del amiloide agregado e insoluble; mientras que si la inmunoterapia Aβ funcionase por anticuerpos que cruzan la BHE accediendo al cerebro y uniéndose a las placas amiloides existentes para que estas sean eliminadas por las células microgliales, el proceso debería ser tan eficaz en ratones viejos con placas como en los jóvenes sin placas, lo cual no se ha observado en varios estudios realizados [11,4,5].
El antígeno y sus epítopos
Principalmente existen 3 epítopos en el Aβ frente a los que se dirigen los anticuerpos: a) epítopo amino-terminal (aminoácidos 1–6) que provoca la unión de los anticuerpos a los péptidos Aβ agregados in vitro así como a los depósitos cerebrales y vasculares in vivo y a la Proteína Precursora del Amiloide (PPA); b) epítopo de la región central (aminoácidos 15–25) que provoca la unión de los anticuerpos a la PPA pero no al Aβ agregado in vitro, placas amiloides o depósitos vasculares; c) región carboxi-terminal cuyos anticuerpos específicos han sido menos estudiados, pero parecen estimular a los linfocitos T. Las placas Aβ y algunos de sus agregados, precursores oligoméricos y protofibrilares, contienen un neoepítopo que no se encuentra en la PPA ni en sus derivados solubles. Estas formas agregadas de amiloide se desarrollan tardíamente en la vida adulta y probablemente han escapado al proceso de tolerancia inmune siendo la secuencia temporal de la formación de neoepítopos paralela al incremento de toxicidad. La estructura de los agregados Aβ es en forma de plegamientos β mientras que el Aβ soluble presente en la sangre y en el líquido cefalorraquídeo no tiene esta estructura, por lo que quizás este cambio conformacional del Aβ podría ser el responsable de estimular la respuesta de los linfocitos T, si bien la inducción de tal respuesta se ha localizado en epítopos de los residuos 15–42. Por su parte los anticuerpos reconocen una conformación específica del residuo amino-terminal de 8 aminoácidos del Aβ que se favorece al menos 1000 veces más en las fibrillas que en los péptidos monoméricos, o bien que la maduración de la afinidad de los anticuerpos producen un lugar adicional de unión para el residuo amino-terminal de un monómero Aβ adyacente. Las respuestas inmunes contra neoepítopos relacionados con la enfermedad de Aβ son fuertes incluso en la población anciana con EA. In vivo, esta especificidad dirigiría los anticuerpos primariamente hacia los depósitos de amiloide vascular fibrilar incluso en presencia de exceso de Aβ monomérico o su precursor. Esta observación podría explicar la inflamación meníngea que se desarrolla en pacientes con EA inmunizados con Aβ [24] pero dado que las placas de Aβ están confinadas al tejido cerebral la inmunoterapia Aβ diseñada hacia dianas selectivas de neoepítopos presentes en los oligómeros Aβ, protofibrillas y fibrillas y hacia la PPA y sus derivados fisiológicos no causaría enfermedad autoinmune en los tejidos no afectados del organismo. Además, los anticuerpos dirigidos hacia la región amino-terminal (residuos 4-10) son suficientes para evitar la citotoxicidad y fibrilogénesis sin provocar una respuesta inflamatoria [25]. Los epítopos para linfocitos T reactivos frente a Aβ son primariamente los aminoácidos 16–42 [26] mientras que el epítopo primario para que se generen los anticuerpos son los aminoácidos 1–12 [27,28,29,30]. Se diseñó una vacuna que contiene el epítopo que estimula a los linfocitos B (residuo 1-15) junto al péptido sintético universal para los linfocitos Th pan HLA-DR (PADRE); inmunizando ratones transgénicos con esta vacuna se alcanzaron títulos altos de anticuerpos anti-Aβ pudiendo obtenerse en los esplenocitos de dichos ratones inmunizados una robusta estimulación de linfocitos T en respuesta al péptido PADRE, pero no cuando se trataban de reactivar mediante Aβ [31].
Los agentes implicados en la respuesta inmune
Los efectos positivos de la inmunización Aβ en el modelo animal (tales como el descenso de las placas o la mejoría en el comportamiento) parecen estar mediados por anticuerpos, no por respuesta celular [4,5,6,32]. En concreto la medición de inmunoglobulinas en ratones vacunados con Aβ demostraron un predominio de los isotipos IgG2b, IgG1, IgG2a y bajos niveles de IgA sugiriendo una respuesta tipo 2 (Th2) mediada por linfocitos T-helper, lo que indica una respuesta humoral [27,33]. Como se ha dicho, los anticuerpos administrados periféricamente pueden llegar al cerebro y unirse al amiloide para que posteriormente la microglía elimine los depósitos mediante fagocitosis mediada por receptor-Fc. De hecho los anticuerpos más eficaces fueron los de isotipo IgG2a, que muestran gran afinidad por los receptores Fc de la microglía [34]. De todos modos éste no ha de ser el único mecanismo de aclaramiento central ya que se ha visto que la inmunización de ratones “knockout” sin receptor gamma era casi tan eficaz como la de ratones con dicho receptor [35]. La administración intracraneal de anticuerpos anti-Aβ en la corteza frontal y en el hipocampo de ratones transgénicos APP sugieren un mecanismo bifásico en la acción de los anticuerpos. La primera fase ocurre entre 4 y 24 horas, aclara primariamente los depósitos difusos Aβ y no está asociada con activación microglial. La segunda fase sucede entre 1 y 3 días y es responsable del aclaramiento de los depósitos de amiloide compactos y está asociada con activación microglial [36] si bien esta respuesta tiende a desvanecerse tras 9 meses de tratamiento [37].
Inmunoterapia activa: experiencia en humanos
Descripción de los ensayos
· Fase I: Basados en los hallazgos preclínicos y tras extensos estudios preclínicos de seguridad en varias especies animales (ratones, conejos, hamsters y primates) se procedió a la inmunización con Aβ42 (AN1792) sintético preagregrado junto al adyuvante inmunogénico QS-21 en estudios de fase I que demostraron buena seguridad y tolerabilidad en 104 pacientes tratados con dosis únicas o múltiples de AN1792 o con sólo QS-21 provocándose un aumento detectable de los anticuerpos anti-Aβ42 en aproximadamente el 25% de los que recibieron AN1792 [1].
· Fase II: Un ensayo internacional, multicéntrico, randomizado, paralelo, doble ciego y controlado con placebo de inmunoterapia activa se inició en el año 2001 para evaluar la seguridad, tolerabilidad y eficacia clínica. Se programó para desarrollarse en 2 años y el calendario previsto de inmunizaciones incluía inyecciones en el músculo deltoides de 225 μg (0.5 ml) de AN1792 mas 50 μg de QS-21 o suero salino (placebo) en la visita basal y a los 1, 3, 6, 9 y 12 meses. Un total de 372 pacientes con EA leve o moderada se randomizaron para recibir tratamiento o placebo en una relación de 4 a 1, con la intención de alcanzar una relación final 1 a 1 de pacientes respondedores (que generarían anticuerpos, según los resultados de la Fase I) vs placebo. La dosificación se detuvo en Enero del año 2002 tras síntomas, signos y hallazgos de laboratorio sugestivos de meningoencefalitis aséptica en 4 de los pacientes tratados con AN1792 [38]. No obstante se continuó con el seguimiento clínico y monitorización de los pacientes no afectos bajo las condiciones iniciales descritas en el ensayo.
Meningoencefalitis post inmunización
Ee los 298 pacientes inmunizados, 18 desarrollaron meningoencefalitis aséptica subaguda tras la inmunización (6%). Esta proporción es significativamente superior a la encontrada en el grupo placebo (0/74). Los casos varían en severidad: 12 pacientes recuperaron su situación basal, mientras que 6 mantuvieron el empeoramiento cognitivo, 2 de los cuales también tuvieron secuelas de focalidad neurológica (severas en uno de los casos). En 16 de los 18 casos, la reacción ocurrió tras administrarse 2 inyecciones, en 1 caso tras 1 inyección (el paciente con afectación más severa), y otro tras 3 inyecciones (con pronóstico favorable). Por lo tanto no existe relación entre el número de inyecciones y la severidad del cuadro clínico. La vacuna Aβ puede producir, bajo ciertas circunstancias, una reacción aberrante de tipo autoinmune. Una de estas circunstancias puede ser la utilización de adyuvantes ya que en ratones inmunizados con el péptido Aβ42 se demostró que desarrollaban una meningoencefalitis (caracterizada por la presencia de un infiltrado inflamatorio perivenular de macrófagos, linfocitos T, B e inmunoglobulinas, tanto en el cerebro como en la médula espinal) sólo cuando se coadministró “toxina pertusis”, un agente conocido por favorecer las respuestas autoinmunes [39], a lo que se puede añadir el hecho de que cuando se administran a ratones dosis bajas de la enterotoxina termosensible de Escherichia coli junto a Aβ intranasal se produce un dramático incremento (12 veces) en los títulos de anticuerpos en comparación con aquellos ratones que reciben el Aβ sin el adyuvante [33]. Otra circunstancia es el epítopo administrado, ya que la respuesta inflamatoria de la meningoencefalitis se ha atribuído a respuesta mediada por linfocitos T que es activada por epítopos localizados en la región media y carboxiterminal (residuos 15–42) del Aβ.
Efectos clínicos de la inmunización
No se hallaron diferencias significativas entre el grupo de pacientes que generaron anticuerpos y el grupo placebo respecto al rendimiento global en los test y escalas “ADAS-Cog”, “Disability Assessment for Dementia”, “Clinical Dementia Rating”, “MMSE” y “Clinical Global Impression of Change”. Sin embargo el análisis fino del rendimiento en las baterías de exploración neuropsicológica sí reveló diferencias a favor del grupo de pacientes que generaron anticuerpos (0.03 +/- 0.37 vs -0.20 +/- 0.45; p = 0.020). Por otro lado los niveles de proteína tau en LCR (que se ha comprobado que es un buen biomarcador de la EA) se encontraban disminuídos en los respondedores respecto a los controles [40].
Estudios de imagen de los pacientes inmunizados
Los hallazgos de Resonancia Magnética cerebral con y sin contraste fueron variados: ninguno de estos casos mostró hemorragias, que sí han sido comunicadas en los estudios neuropatológicos como efecto adverso de la inmunización pasiva en el modelo murino [41] y en humanos [42]. Unos pocos pacientes simplemente mostraron realce meníngeo, mientras que otros, además, tenían adelgazamiento de las meninges, lesiones de sustancia blanca con o sin edema y la mayoría de pacientes con EA más avanzado tenía lesiones en la corteza cerebral posterior [43] y cerebelosa [44]. De todos modos no está claro por qué las áreas cerebrales más afectadas por el depósito de amiloide (corteza temporal y asociativa) [45] no fueron las más afectadas. También se han realizado estudios volumétricos apreciándose una relación inversa entre la pérdida de volumen cerebral y el rendimiento cognitivo de los pacientes que generaron anticuerpos a títulos altos [46] que pudiera ser debida al aclaramiento de amiloide y eliminación de fluídos.
Descripción neuropatológica de los efectos de la inmunización
El examen postmorten de dos pacientes que habían participado en el ensayo con AN-1792 reveló escasez de placas en el neocórtex y ausencia de neuritas distróficas y astrocitos reactivos (en comparación con los controles no inmunizados); microglía activada y unión a las placas restantes.
Los hallazgos característicos fueron depleción focal de placas difusas y neuríticas y la presencia de un pequeño número de placas extremadamente densas (colapsadas) rodeadas de microglía activa, IgG, factor 3 del Complemento y células gigantes multinucleadas rellenas de Aβ42 y Aβ40. Además se apreció afectación severa de los vasos de pequeño calibre y múltiples hemorragias corticales [47]. El Aβ vascular persistió abundante, al igual de lo que se había visto en ratones inmunizados [41]. La reducción de los depósitos de amiloide se acompañó de bajas respuestas al estrés oxidativo. Los ovillos neurofibrilares fueron abundantes a pesar de la aparente reducción de los depósitos de amiloide. En conjunto estos resultados sugieren que se había generado una respuesta inmune eficaz sobre el aclaramiento Aβ de las placas pero no sobre el vascular. El estudio neuropatológico de un caso de meningoencefalitis tras la inmunización con péptido Aβ demostró infiltrados inflamatorios que se componen de linfocitos CD8+, CD4+, CD3+, CD5+ y más raramente CD7+, mientras que no se encontraron linfocitos B ni linfocitos T citotóxicos CD16, CD57 [42]. En otro estudio de la neuropatología postmortem sobre un caso previo de la fase I del estudio [47] se describe una extensa meningoencefalitis con amplia presencia de linfocitos T así como extensa infiltración de macrófagos en sustancia blanca y aclaramiento de las placas Aβ.
Análisis de la respuesta humoral a la inmunización
Midiendo los anticuerpos frente al amiloide sintético
De los casi 300 pacientes a los que se les administró AN1792 aproximadamente el 20% desarrollaron una respuesta inmune mediada por anticuerpos. Estos anticuerpos séricos mostraron una especificidad alta por el Aβ de las placas amiloides y vasos cerebrales sin haber reacciones cruzadas con la proteína precursora del amiloide o sus derivados ni con células cerebrales normales [29]. Se ha visto que los pacientes que generan anticuerpos tras la administración de la vacuna Aβ muestran un declinar cognitivo más lento, efecto que ha sido apreciado incluso en los pacientes que desarrollaron meningoencefalitis transitoria [48]. En un subgrupo de estos últimos pacientes se detectaron anticuerpos anti-Aβ suero en 15 de 18 pacientes y en LCR en 6 de 8, así que hay una relación obvia entre la presencia de anticuerpos y el riesgo de meningoencefalitis. La IgG sérica no fue detectable en 3 pacientes aunque uno de ellos tenía un título medible de IgM en la visita de discontinuación anticipada. La IgM fue positiva en todos los pacientes con meningoencefalitis, aunque en algunos lo fue a niveles bajos. Sin embargo no hubo relación ni con el título de anticuerpos, ni con parámetros tales como el retardo, severidad o presencia de recurrencias, por lo que se debate si el mecanismo pudiera estar mediado por linfocitos T ya que la molécula Aβ42 contiene un dominio capaz de activar linfocitos T [49,26].
· Midiendo los anticuerpos frente al amiloide de las placas
Para analizar tanto la calidad como los títulos de anticuerpos contra el Aβ de las placas generados en respuesta a la inmunización activa se desarrolló el inmunoensayo “Inmunoreactividad sobre el Amiloide de Placas Tisulares” (TAPIR, Tissue Amyloid Plaque ImmunoReactivity) que es útil para predecir el pronóstico de los pacientes vacunados. Contrariamente a los ensayos ELISA convencionales con péptidos sintéticos fijados que suelen usarse para medir la respuesta humoral en los ensayos de vacunas, TAPIR usa placas bona fide de Aβ tisular que incubadas durante un largo periodo de tiempo en cerebro vivo afectan tanto a la maduración de neoepítopos como a la composición proteinácea de las placas. Se detectaron elevaciones significativas en los títulos de anticuerpos TAPIR en 20 de 30 pacientes que participaron en el ensayo, lo cual significa una mayor sensibilidad que la aportada por el inmunoensayo tipo ELISA [48].
Immunoterapia pasiva
Anticuerpos anti-Aβ
La idea del beneficio potencial de un tratamiento con anticuerpos anti-Aβ en pacientes con EA esporádica proviene de la apreciación de que el declinar cognitivo de los pacientes sometidos a inmunoterapia activa se correlacionaba de forma directa con los niveles de anticuerpos anti-Aβ séricos [48]. La inmunoterapia pasiva requiere la administración repetida de anticuerpos anti-Aβ humanizados. Existen varios métodos para obtener anticuerpos anti-Aβ humanos o humanizados: a) purificación de los anticuerpos específicos de las inmunoglobulinas humanas; b) humanización de los anticuerpos anti-Aβ murinos replazando ciertas porciones mediante tecnología de DNA recombinante; c) generación in vitro de anticuerpos anti-Aβ mediante técnicas de exhibición de baterías de fagos de inmunoglobulinas humanas; d) generación in vivo mediante la inmunización de ratones cuyos loci para las inmunoglobulinas han sido reemplazados por los genes de las inmunoglubulinas humanas [50].
Los anticuerpos anti-Aβ específicos para la región N-terminal del Aβ son capaces de acceder al tejido cerebral, unirse a las placas de amiloide y eliminarlas mediante fagocitosis mediada por Fc [11], lo que explicaría la vía de aclaramiento central del amiloide. Por su parte el tratamiento de ratones transgénicos con anticuerpos anti- Aβ específicos para la región central del amiloide que no tiñen las placas de amiloide cerebrales y que no se detectan en el cerebro también provocan el aclaramiento de las placas cerebrales [10], lo que se explicaría por la vía de aclaramiento periférico.
Experiencia en animales
La administración de anticuerpos anti-Aβ en ratones transgénicos APP previene o elimina el depósito amiloide (Figura 1), dependiendo de si el tratamiento se inicia antes o tras el comienzo del depósito [11], pudiendo incluso prevenir el declinar cognitivo de los ratones transgénicos APP [10].
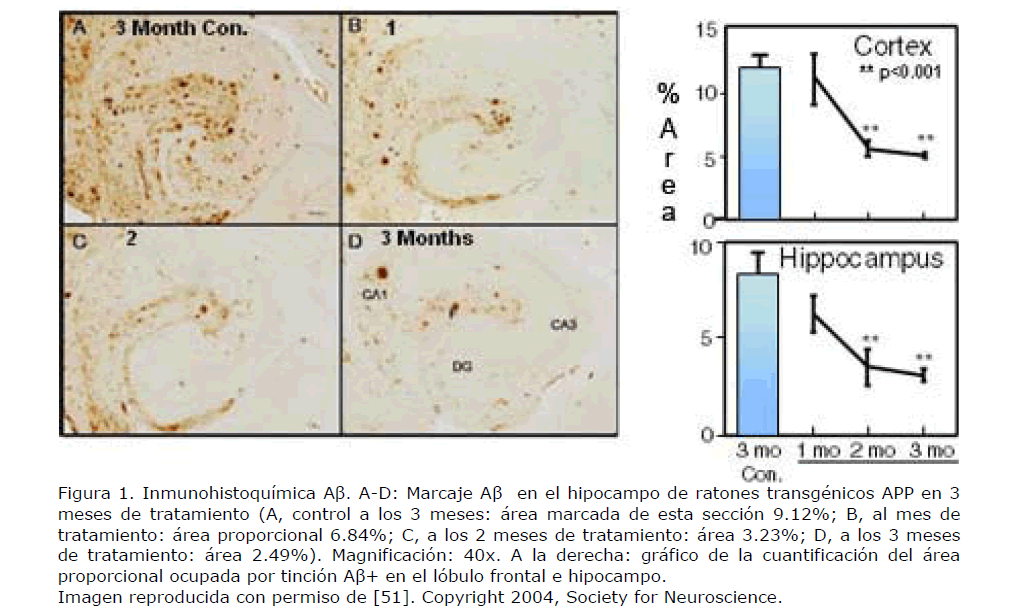
Figura 1. Inmunohistoquímica Aβ. A-D: Marcaje Aβ en el hipocampo de ratones transgénicos APP en 3 meses de tratamiento (A, control a los 3 meses: área marcada de esta sección 9.12%; B, al mes de tratamiento: área proporcional 6.84%; C, a los 2 meses de tratamiento: área 3.23%; D, a los 3 meses de tratamiento: área 2.49%). Magnificación: 40x. A la derecha: gráfico de la cuantificación del área proporcional ocupada por tinción Aβ+ en el lóbulo frontal e hipocampo. Imagen reproducida con permiso de [51]. Copyright 2004, Society for Neuroscience.
Se ha visto que estos anticuerpos son capaces de unirse a las placas de amiloide (Figura 2) y activar la microglía [51].
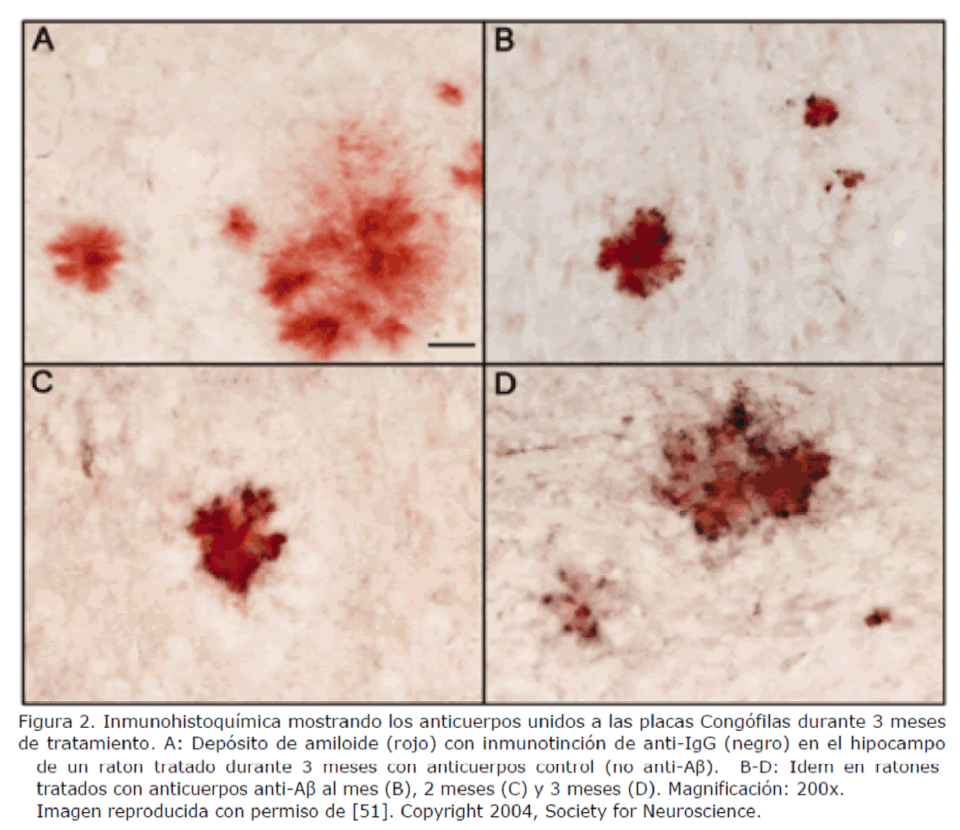
Figura 2. Inmunohistoquímica mostrando los anticuerpos unidos a las placas Congófilas durante 3 meses de tratamiento. A: Depósito de amiloide (rojo) con inmunotinción de anti-IgG (negro) en el hipocampo de un raton tratado durante 3 meses con anticuerpos control (no anti-Aβ). B-D: Idem en ratones tratados con anticuerpos anti-Aβ al mes (B), 2 meses (C) y 3 meses (D). Magnificación: 200x. Imagen reproducida con permiso de [51]. Copyright 2004, Society for Neuroscience.
No obstante con este modelo de inmunización también han aparecido efectos secundarios. Se ha comunicado que la infusión de anticuerpos monoclonales murinos específicos para el epítopo N-terminal del Aβ en ratones transgénicos APP de una cepa que desarrolla angiopatía congófila causó focos de hemorragia cerebral [41]; este efecto adverso parece depender de la especificidad del epítopo para el que se generan los anticuerpos. También se han comunicado casos de meningoencefalitis tras inmunoterapia pasiva [52].
Experiencia en humanos
Hasta la fecha casi todos los estudios realizados con inmunoterapia pasiva se han realizado en animales transgénicos y por tanto deben ser interpretados con precaución a pesar de sus excelentes resultados, ya que hay que recordar que por ejemplo la mayor parte de las cepas de ratones transgénicos APP no desarrollan depósitos vasculares de amiloide que sí existen invariablemente en los pacientes con EA y que pueden modificar la respuesta a la inmunoterapia. De la experiencia en humanos tan sólo existen datos de estudios con inmunoglobulinas humanas policlonales (que incluyen anticuerpos anti-Aβ), éstos nos muestran que la infusión intravenosa de estas inmunoglobulinas en 6 pacientes ancianos con EA esporádica causó una mejoría significativa en el rendimiento cognitivo tras 6 meses de tratamiento [53]. Sin embargo ya existen varios estudios en desarrollo en humanos con inmunoterapia pasiva con anticuerpos monoclonales Aβ (de los cuales existen varios con diferentes especificidades), entre los que se pueden destacar los emprendidos por Laboratorios Elan and Wyeth con el anticuerpo monoclonal humanizado AAB-001 o por el Dementia Research Centre en colaboración con el Hammersmith Hospital de Londres para monitorizar los resultados mediante estudios de imagen con ligandos de amiloide.
Vacuna génica
El uso de vectores virales ha permitido desarrollar vacunas génicas para la EA en las que el antígeno no se administra directamente si no que su gen es transfectado mediante el vector a células del propio paciente para ser expresado a nivel periférico [54]. Así, una vacuna consistente en un adenovirus recombinante Aß1-42 junto a la subunidad ß de la toxina colérica (que actúa como adyuvante inmunológico no inductor de linfocitos Th1) consiguió aclarar las placas y mejorar el comportamiento en ratones transgénicos APP [55]. Otra vacuna con adenovirus recombinante cDNA Aß (AAV/Aß) administrada vía oral sin adyuvante indujo la expresión y secreción de Aß1-43 y Aß1-21 en la capa celular intestinal del intestino en ratones transgénicos APP; los niveles séricos de anticuerpos se elevaron durante más de 6 meses sin respuestas proliferativas de linfocitos T y el depósito cerebral se redujo significativamente en comparación con los controles sin cambios inflamatorios [56]. Además del gen del antígeno se puede incluir el gen de un adyuvante o inmunomodulador, como la Interleuquina 4 (IL-4), con lo que se consigue una respuesta inmune humoral (Tipo Th2) muy intensa [57] o como el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) que favorece una respuesta inmune mediada por IgG1 y IgG2b [58].
Conclusiones
Para comprender las bases de la inmunoterapia Aβ es preciso conocer una serie de observaciones que se han comunicado en los últimos años. Así, hay que tener en cuenta hechos tales como que: parece que tanto el Aß como los anticuerpos anti-Aß son capaces de atravesar la BHE; existe una reactividad intrínseca frente al antígeno Aβ propio; el mecanismo por el que actúan los anticuerpos anti-Aβ puede explicarse por un aclaramiento periférico (efecto sumidero) y por un aclaramiento central (efecto directo) de los depósitos Aβ; el Aβ tiene varios epítopos distintos cuyos anticuerpos específicos tienen distintas propiedades inmunológicas, la maduración del Aβ en placas favorece la aparición de neoepítopos no presentes en el amiloide sintético; los efectos positivos de la inmunización Aβ tales como el descenso de las placas o la mejoría en el comportamiento parecen estar mediados por anticuerpos mientras que la respuesta inflamatoria causante de la meningoencefalitis aséptica está mediada por linfocitos T.
El mayor ensayo de inmunoterapia activa realizado hasta el momento tuvo que ser detenido por la aparición de varios casos de meningoencefalitis aséptica, sin embargo los resultados obtenidos han permitido identificar varios aspectos relevantes que pueden ser clave para la eficacia y aparición de efectos secundarios gracias a lo cual se ha podido reorientar la estrategia hacia un método que permita ser eficaz sin causar efectos adversos graves; entre dichas estrategias se encuentra una mejor selección del antígeno (epítopo) utilizado así como de las vías de administración y adyuvantes empleados. También se ha experimentado con otras modalidades de inmunoterapia como la inmunización pasiva y la vacuna génica, con resultados prometedores en animales transgénicos pero con escasa experiencia aún en humanos.
1379
References
- Schenk D, Barbour R, Dunn W, et al. Immunization with amyloid-β attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature 1999; 400: 173– 177.
- Sigurdsson EM, Scholtzova H, Mehta PD, Frangione B, Wisniewski T. Immunization with a nontoxic/nonfibrillar amyloid-β homologous peptide reduces Alzheimer’s disease-associated pathology in transgenic mice. Am J Pathol 2001; 159: 439–447.
- Lombardo JA, Stern EA, McLellan ME, Kajdasz ST, Hickey GA, Bacskai BJ, Hyman BT. Amyloid-β antibody treatment leads to rapid normalization of plaque-induced neuritic alterations. J Neurosci. 2003;23(34):10879-83.
- Janus C, Pearson J, McLaurin J, et al. Aβ peptide immunization reduces behavioural impairment and plaques in a model of Alzheimer’s disease. Nature 2000; 408: 979–982. Kawarabayashi, T., Younkin, L. H., Saido, T. C., Shoji, M., Ashe, K. H., & Younkin, S. G. J. Neurosci. 2001; 21, 372-381.
- Morgan D, Diamond DM, Gottschall PE, et al. Aβ peptide vaccination prevents memory loss in an animal model of Alzheimer’s disease. Nature 2000; 408: 982– 985.
- Dodart JC, Bales KR, Gannon KS, Greene SJ, DeMattos RB, Mathis C, DeLong CA, Wu S, Wu X, Holtzman DM, Paul SM. Immunization reverses memory deficits without reducing brain Abeta burden in Alzheimer's disease model. Nat Neurosci. 2002;5(5):452-7.
- Shibata M, Yamada S, Kumar SR, Calero M, Bading J, Frangione B, Holtzman D M, Miller CA, Strickland DK, Ghiso J, Zlokovic BV. Clearance of Alzheimer’s amyloidß1- 40 peptide from brain by LDL receptor–related protein-1 at the blood-brain barrier. J. Clin. Invest. 2000; 106, 1489 1499
- Ghersi-Egea, J.-F., Gorevic, P. D., Ghiso, J., Frangione, B., Patlak, C. S., & Fensternacher, J. D. Fate of Cerebrospinal Fluid-Borne Amyloid β-Peptide: Rapid Clearance into Blood and Appreciable Accumulation by Cerebral ArteriesJ. Neurochem. 1996;67, 880-883
- Zlokovic BV, Martel CL, Matsubara E, McComb JG, Zheng G, McCluskey RT, Frangione B, Ghiso J. Glycoprotein 330/Megalin: Probable Role in Receptor- Mediated Transport of Apolipoprotein J Alone and in a Complex with Alzheimer Disease Amyloid β at the Blood-Brain and Blood-Cerebrospinal Fluid Barriers. Proc Natl Acad Sci U S A. 1996; 93 (9): 4229–4234
- DeMattos RB, Bales KR, Cummins DJ, Dodart JC, Paul SM, Holtzman DM. Peripheral anti-Aβ antibody alters CNS and plasma Aβ clearance and decreases brain Aβ burden in a mouse model of Alzheimer’s disease. Proc Natl Acad Sci USA 2001; 98: 8850–8855.
- Bard F, Cannon C, Barbour R, et al. Peripherally administered antibodies against amyloid β-peptide enter the central nervous system and reduce pathology in a mouse model of Alzheimer disease. Nat Med 2000; 6: 916–919.
- Orgogozo J-M, Gilman S, Dartigues J-F, et al. Subacute meningoencephalitis in a subset of patients with AD after Aβ immunization. Neurology 2003; 61: 46–54.
- Mehta PD, Pirttila T, Mehta SP, Sersen EA, Aisen PS, Wisniewski HM. Plasma and cerebrospinal fluid levels of amyloid β proteins 1–40 and 1–42 in Alzheimer disease. Arch Neurol 57: 100–105, 2000
- Du Y, Dodel R, Hampel H, Buerger K, Lin S, Eastwood B et al. Reduced levels of amyloid β-peptide antibody in Alzheimer disease. Neurology 57: 801–805, 2001
- Hyman BT, Smith C, Buldyrev I, Whelan C, Brown H, Tang MX et al. Autoantibodies to amyloid-β and Alzheimer’s disease. Ann Neurol 49: 808–810, 2001.
- Weksler ME, Goodhardt M, Szabo P: The effect of age on B cell development and humoral immunity. Springer Semin Immunopathol 2002, 24:35-52.
- Weksler ME, Relkin N, Turkenich R, LaRusse S, Zhou L, Szabo P. Patients with Alzheimer disease have lower levels of serum anti-amyloid peptide antibodies than healthy elderly individuals. Exp Gerontol. 2002;37(7):943-8.
- Lee J-W, Jin F, Weksler ME: The Nature and Significance of Age-associated Autoimmunity. In in The Molecular Pathology of Autoimmune Diseases 2nd edition. Edited by: Theofilopoulos AN, Bona CA. 2002, 1089.
- Morris, J.C. & Price, A.L.. Pathologic correlates of nondemented aging, mild cognitive impairment, and early-stage Alzheimer's disease. J. Mol. Neurosci. 2001;17, 101-118
- Monsonego, A., Maron, R., Zota, V., Selkoe, D. J. & Weiner, H. L. Proc. Natl. Acad. Sci. USA 2001, 98:10273-1027
- Backsai, B. J., Kajdasz, S. T., Christie, R. H., Carter, C., Games, D., Seubert, P., Schenk, D., Hyman, B. T. Imaging of amyloid-beta deposits in brains of living mice permits direct observation of clearance of plaques with immunotherapy.; Nat. Med. 2001;7, 369-372.
- Chauhan NB, Siegel GJ. Intracerebroventricular passive immunization with anti- Aβ antibody in Tg2576. J Neurosci Res. 2003;74(1):142-7.
- Schenk D. Opinion. Amyloid-β immunotherapy for Alzheimer’s disease: the end of the beginning. Nat Rev Neurosci 2002; 3: 824–828.
- Miller DL, Currie JR, Mehta PD, Potempska A, Hwang YW, Wegiel J. Humoral immune response to fibrillar β-amyloid peptide. Biochemistry. 2003;42(40):11682- 92.
- McLaurin J, Cecal R, Kierstead ME, et al. Therapeutically effective antibodies against amyloid-β peptide target amyloid-β residues 4–10 and inhibit cytotoxicity and fibrillogenesis. Nat Med 2002; 8: 1263–1269.
- Monsonego A, Zota V, Selkoe DJ. Immunogenic aspects of amyloid β-peptide: implications for the pathogenesis and treatment of Alzheimer’s disease. Neurobiol Aging 2002; 23: S112.
- Spooner ET, Desai RV, Mori C, Leverone JF, Lemere CA. The generation and characterization of potentially therapeutic Aβ antibodies in mice: differences according to strain and immunization protocol. Vaccine. 2002;21(3-4):290-7.
- Town T, Tan J, Sansone N, Obregon D, Klein T, Mullan M. Characterization of murine immunoglobulin G antibodies against human amyloid-β1-42. Neurosci. Lett. 2001;307(2), 101-104
- Hock, C. Generation of antibodies specific for β-amyloid by vaccination of patients with Alzheimer disease. Nat. Med. 2002; 8: 1270-1275
- Leverone JF, Spooner ET, Lehman HK, Clements JD, Lemere CA. Abeta1-15 is less immunogenic than Abeta1-40/42 for intranasal immunization of wild-type mice but may be effective for "boosting". Vaccine. 2003;21(17-18):2197-206.
- Agadjanyan MG, Ghochikyan A, Petrushina I, Vasilevko V, Movsesyan N, Mkrtichyan M, Saing T, Cribbs DH. Prototype Alzheimer's disease vaccine using the immunodominant B cell epitope from beta-amyloid and promiscuous T cell epitope pan HLA DR-binding peptide. J Immunol. 2005 Feb 1;174(3):1580-6.
- Kotilinek LA, Bacskai B, Westerman M, Kawarabayashi T, Younkin L, Hyman BT, Younkin S, Ashe KH. Reversible memory loss in a mouse transgenic model of Alzheimer's disease. J Neurosci. 2002;22(15):6331-5
- Lemere CA, Spooner ET, Leverone JF, Mori C, Clements JD. Intranasal immunotherapy for the treatment of Alzheimer's disease: Escherichia coli LT and LT(R192G) as mucosal adjuvants. Neurobiol Aging. 2002;23(6):991-1000.
- Bard F, Barbour R, Cannon C, Carretto R, Fox M, Games D, Guido T, Hoenow K, Hu K, Johnson-Wood K, Khan K, Kholodenko D, Lee C, Lee M, Motter R, Nguyen M, Reed A, Schenk D, Tang P, Vasquez N, Seubert P, Yednock T. Epitope and isotype specificities of antibodies to β -amyloid peptide for protection against Alzheimer's disease-like neuropathology. Proc Natl Acad Sci U S A. 2003;100(4):2023-8.
- Das P, Howard V, Loosbrock N, Dickson D, Murphy MP, Golde TE. Amyloid-β immunization effectively reduces amyloid deposition in FcRgamma-/- knock-out mice. J Neurosci. 2003;23(24):8532-8.
- Wilcock DM, DiCarlo G, Henderson D, Jackson J, Clarke K, Ugen KE, Gordon MN, Morgan D. Intracranially administered anti-Aβ antibodies reduce β-amyloid deposition by mechanisms both independent of and associated with microglial activation. J Neurosci. 2003;23(9):3745-51
- Arendash GW, Gordon MN, Diamond DM, Austin LA, Hatcher JM, Jantzen P. Behavioral assessment of Alzheimer’s transgenic mice following long-term Aβ vaccination: task specificity and correlations between Aβ deposition and spatial memory. DNA Cell Biol 2001; 20: 737–744.
- Senior K. Dosing in phase II trial of Alzheimer’s vaccine suspended. Lancet Neurol 2002; 1: 3.
- Furlan R, Brambilla E, Sanvito F, Roccatagliata L, Olivieri S, Bergami A, Pluchino S, Uccelli A, Comi G, Martino G. Vaccination with amyloid-β peptide induces autoimmune encephalomyelitis in C57/BL6 mice. Brain. 2003;126(Pt 2):285-91.
- Gilman S, Koller M, Black RS, Jenkins L, Griffith SG, Fox NC, Eisner L, Kirby L, Rovira MB, Forette F, Orgogozo JM; AN1792(QS-21)-201 Study Team. Clinical effects of Abeta immunization (AN1792) in patients with AD in an interrupted trial. Neurology. 2005 May 10;64(9):1553-62.
- Pfeifer M, Boncristiano S, Bondolfi L, et al. Cerebral hemorrhage after passive anti-Aβ immunotherapy. Science 2002; 298: 1379.
- Ferrer I, Boada Rovira M, Sanchez Guerra ML, Rey MJ, Costa-Jussa F. Neuropathology and pathogenesis of encephalitis following amyloid-β immunization in Alzheimer's disease. Brain Pathol. 2004;14(1):11-20.
- Delacourte A, Sergeant N, Champain D, Wattez A, Maurage CA, Lebert F. Nonoverlapping but synergetic tau and APP pathologies in sporadic Alzheimer’s disease. Neurology 2002; 59: 398–407.
- Mann DM, Iwatsubo T, Snowden JS. Atypical amyloid (Aβ) deposition in the cerebellum in Alzheimer’s disease: an immunohistochemical study using endspecific A β monoclonal antibodies. Acta Neuropathol (Berl) 1996; 91: 647–653.
- Braak H, Braak E. Pathology of Alzheimer’s disease. In: Calne DB, ed. Neurodegenerative diseases. Philadelphia: Saunders, 1994: 585–613.
- Fox NC, Black RS, Gilman S, Rossor MN, Griffith SG, Jenkins L, Koller M; AN1792(QS-21)-201 Study. Effects of Abeta immunization (AN1792) on MRI measures of cerebral volume in Alzheimer disease. Neurology. 2005 May 10;64(9):1563-72.
- Nicoll JA, Wilkinson D, Holmes C, Steart P, Markham H, Weller RO. Neuropathology of human Alzheimer disease after immunization with amyloid-β peptide: a case report. Nat Med 2003; 9: 448–452.
- Hock C, Konietzko U, Streffer JR, Tracy J, Signorell A, Muller-Tillmanns B, Lemke U, Henke K, Moritz E, Garcia E, Wollmer MA, Umbricht D, de Quervain DJ, Hofmann M, Maddalena A, Papassotiropoulos A, Nitsch RM: Antibodies against betaamyloid slow cognitive decline in Alzheimer's disease. Neuron 2003, 38:547-554
- Grubeck–Loebenstein B, Blasko I, Marx FK, Trieb I. Immunization with β- amyloid: could T-cell activation have a harmful effect? Trends Neurosci 2000; 23: 114.
- Brekke OH, Loset GA: New technologies in therapeutic antibody development. Curr Opin Pharm 2003, 3:544-550
- Wilcock DM, Rojiani A, Rosenthal A, Levkowitz G, Subbarao S, Alamed J, Wilson D, Wilson N, Freeman MJ, Gordon MN, Morgan D. Passive Amyloid Immunotherapy Clears Amyloid and Transiently Activates Microglia in a Transgenic Mouse Model of Amyloid Deposition. The Journal of Neuroscience, July 7, 2004, 24(27):6144-6151
- Lee EB, Leng LZ, Lee VM, Trojanowski JQ. Meningoencephalitis associated with passive immunization of a transgenic murine model of Alzheimer's amyloidosis. FEBS Lett. 2005 May 9;579(12):2564-8. Epub 2005 Apr 7.
- Dodel RC, Du Y, Depboylu C, Hampel H, Frölich L, Haag A, Hemmeter U, Paulsen S, Teipel SJ, Brettschneider S, Möller HJ, Wei X, Farlow M, Sommer N, Oertel WH: Intravenous Immunoglobulins containing Antibodies against b-amyloid for the Treatment of Alzheimer's Disease. Journal Neurol Neurosurg Psychiatry 2004, 75:1472-4
- Qu B, Rosenberg RN, Li L, Boyer PJ, Johnston SA. Gene vaccination to bias the immune response to amyloid-beta peptide as therapy for Alzheimer disease. Arch Neurol. 2004 Dec;61(12):1859-64.
- Zhang J, Xu S, Qin J, Ma S, Zhang H, Kong Q, Chen D, Ba D, He W. A novel recombinant adeno-associated virus vaccine reduces behavioral impairment and betaamyloid plaques in a mouse model of Alzheimer's disease. Neurobiol Dis. 2003 Dec;14(3):365-79
- Hara H, Monsonego A, Yuasa K, Adachi K, Xiao X, Takeda S, Takahashi K, Weiner HL, Tabira T. Development of a safe oral Abeta vaccine using recombinant adenoassociated virus vector for Alzheimer's disease. J Alzheimers Dis. 2004 Oct;6(5):483-8.
- Ghochikyan A, Vasilevko V, Petrushina I, Movsesyan N, Babikyan D, Tian W, Sadzikava N, Ross TM, Head E, Cribbs DH, Agadjanyan MG. Generation and characterization of the humoral immune response to DNA immunization with a chimeric betaamyloid- interleukin-4 minigene. Eur J Immunol. 2003 Dec; 33(12):3232-41.
- Kim HD, Cao Y, Kong FK, Van Kampen KR, Lewis TL, Ma Z, Tang DC, Fukuchi K. Induction of a Th2 immune response by co-administration of recombinant adenovirus vectors encoding amyloid beta-protein and GM-CSF. Vaccine. 2005 Apr 27;23(23):2977-86.







