Keywords
Pulmonary Disease, Chronic Obstructive (C.O.P.D.). Heart Failure, Congestive (C.H.F.)
Introducción
La enfermedad pulmonar obstructiva crónica (E.P.O.C.) afecta a más de 52 millones de personas en todo el mundo y causó más de 2,74 millones de muertes en el año 2000. La E.P.O.C. es la cuarta causa de muerte en el mundo, y en las próximas décadas se prevee que aumentará la prevalencia y mortalidad de la misma [1]. Sin embargo, se estima que la prevalencia real de la enfermedad es mucho mayor. El estudio IBERPOC, estudio epidemiológico español, estableció que la prevalencia de E.P.O.C. en España es del 9% en individuos de entre 40 a 69 años [2]. La prevalencia de E.P.O.C. en pacientes con insuficiencia cardíaca crónica (I.C.C.) oscila entre un 9 y un 33% [3-5]. De hecho, ambas entidades se observan con más frecuencia en edades más avanzadas4. Desde la aparición de dos estudios clásicos en la década de los ochenta sobre el aumento de la supervivencia gracias a la oxigenoterapia domiciliaria en pacientes con E.P.O.C. (y, en los últimos años, también por otros avances terapéuticos (broncodilatadores, antibióticos..)), nos encontramos cada vez más con un mayor número de enfermos que padecen ambas patologías [6]. Por tanto, en los próximos años, asistiremos a un aumento del número de pacientes que presenten E.P.O.C. e I.C.C. Llama la atención el poco interés que ha merecido hasta ahora esta asociación en la literatura. Sin embargo, es esencial el manejo óptimo de ambas patologías con vistas a maximizar la capacidad funcional de los pacientes que las sufren [4].
Breve repaso de la E.P.O.C.:
La E.P.O.C. es un proceso patológico que se caracteriza por una limitación del flujo respiratorio que no es completamente reversible. La limitación del flujo respiratorio es, por lo general, progresiva, y se asocia con una respuesta inflamatoria pulmonar anómala a gases nocivos. Los síntomas de la E.P.O.C. son tos, emisión de esputo y disnea de esfuerzo. El diagnóstico de E.P.O.C. debe ser considerado en cualquier individuo con síntomas y antecedentes de exposición a factores de riesgo, principalmente el humo del tabaco. El diagnóstico debe ser confirmado por medio de la espirometría [1] (Tabla 1).
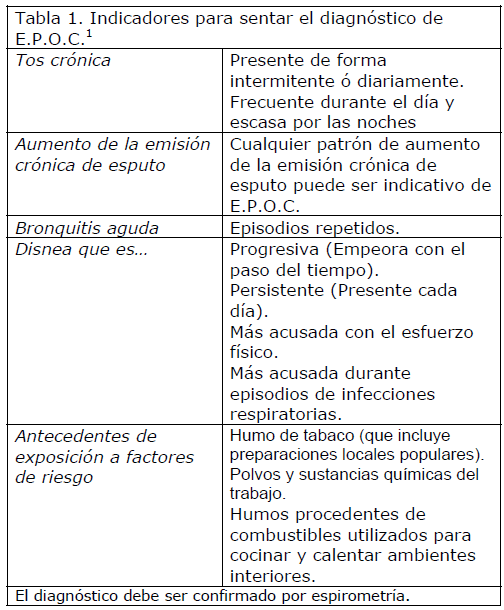
Tabla 1. Indicadores para sentar el diagnóstico de E.P.O.C. [1]
Cuando se realiza una espirometría, debe medirse: la capacidad vital máxima (CVM) y el volumen espiratorio máximo en el primer segundo (VEMS1) y debe calcularse el cociente entre estas dos variables (VEMS1/CVM).
Los pacientes con E.P.O.C. presentan de forma característica una disminución tanto del VEMS1 como del cociente VEMS1/CVM.
El grado de alteración espirométrica refleja, generalmente, la gravedad de la E.P.O.C. Clasificación de la gravedad1
• Estadío 0: En riesgo: Tos crónica y aumento de la emisión de esputo. La función pulmonar es todavía normal.
• Estadío 1: E.P.O.C. leve: Limitación leve del flujo respiratorio (VEMS1/CVM <70%, pero VEMS1 >80% del valor referencia), y generalmente, pero no siempre, con tos crónica y aumento de la emisión de esputo.
• Estadio 2: E.P.O.C moderado: Mayor deterioro de la limitación del flujo respiratorio (50% o VEMS1< 80% del valor de referencia) y, en general, progresión de los síntomas con dificultad respiratoria que se manifiesta característicamente durante el esfuerzo físico.
• Estadio 3: E.P.O.C grave: Deterioro superior de la limitación del flujo respiratorio (30% o VEMS1< 50% del valor de referencia),progresión de la dificultad respiratoria y episodios de exacerbaciones que afectan la calidad de vida de los pacientes.
Las exacerbaciones de los síntomas que tienen un impacto negativo en la calidad de vida y el pronóstico de los pacientes se observan especialmente en pacientes con VEMS1< 50% del valor de referencia.
Estadio 4: E.P.O.C muy grave: Limitación grave del flujo respiratorio (VEMS1< 30% del valor de referencia) ó presencia de insuficiencia respiratoria crónica; Los pacientes pueden padecer EPOC muy grave (estadio 4) incluso cuando el VEMS1>50% del valor de referencia si está presente esta complicación.
En este estadio, la calidad de vida, se encuentra sustancialmente afectada y las exacerbaciones pueden poner en peligro la vida de los pacientes. Diagnóstico diferencial (Tabla 2).
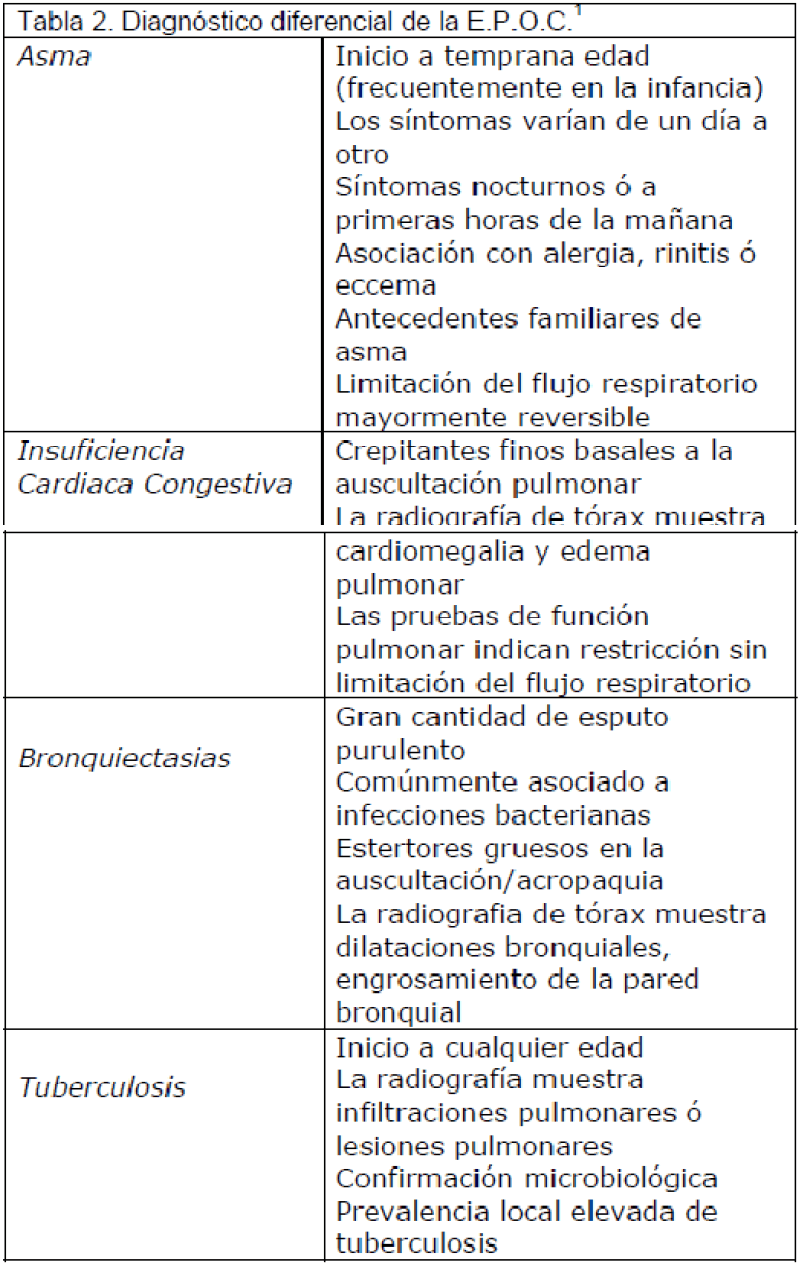
Tabla 2. Diagnóstico diferencial de la E.P.O.C. [1]
Como ya señalábamos en la introducción, la E.P.O.C. y la I.C.C. son dos enfermedades muy prevalentes y, en ocasiones, difíciles de diferenciar. Como ejemplo, hay pacientes mayores con fallo cardíaco que a la auscultación presentan sibilancias (“asma cardíaca”) [11]. Así, la distinción entre una y otra es de suma importancia de cara a determinar una actitud terapéutica específica. El síntoma cardinal de ambas entidades es la disnea. Es fundamental la realización de una buena anamnesis y exploración física en todo paciente que se presente con disnea de causa no filiada [6]. Además de las pruebas complementarias básicas (ECG, Rx de tórax, espirometría...), la cuantificación del péptido natriurético cerebral (BNPó NT-proBNP) permite en determinados casos, apoyar o descartar el diagnóstico de I.C.C [8].
Anamnesis
• Antecedentes de tabaquismo.
• Tos con expectoración.
• Disnea progresiva (tolerancia al ejercicio disminuida con reducción de los niveles de actividad diarios)
• Estado nutricional y capacidad de ejercicio: la masa libre de grasa calculada por impedancia bioeléctrica es un predictor de la capacidad de ejercicio mejor que el VEMS1 en E.P.O.C. ó la fracción de eyección del ventrículo izquierdo en I.C.C. [13]
• Historia de ingresos hospitalarios por infección respiratoria.
• Criterios de agudización:
• Aumento de la producción de esputo.
• Aumento de la purulencia de esputo.
• Empeoramiento de la disnea.
Exploración Física:
• Distensión del tórax por obstrucción del flujo aéreo.
• Manifestaciones de insuficiencia cardiaca derecha:
• Ingurgitación venosa yugular (excluir estados de hipervolemia u obstrucción de la vena cava)
• Congestión hepática (hepatomegalia dolorosa)
• Edema periférico: Edema maleolar o sacro, derrame pleural, ascitis o anasarca.
• Auscultación:
• Respiratoria: Disminución del murmullo vesicular, roncus y sibilancias dispersas y alargamiento del tiempo de espiración.
• Cardiaca: Refuerzo del segundo ruido pulmonar, ruido de galope protodiastólico derecho (S3), soplo sistólico de insuficiencia tricúspide.
Pruebas complementarias:
• Analítica básica. En los últimos años, disponemos de un nuevo test diagnóstico: péptido natriurético cerebral (BNP) ó también el NT-proBNP; la determinación de los mismos nos permite, en casos de dudas diagnósticas, descartar la insuficiencia cardíaca como causa de disnea. Sin embargo, no debe ser considerado como una prueba de diagnóstico único. Debe ser usada e interpretada dentro del contexto clínico del paciente, especialmente en personas de edad avanzada [8-11].
• Gasometría: PaCO2 frecuentemente disminuída en pacientes con I.C.C, y puede estar aumentada en pacientes con E.P.O.C. [4] (Figura 1)
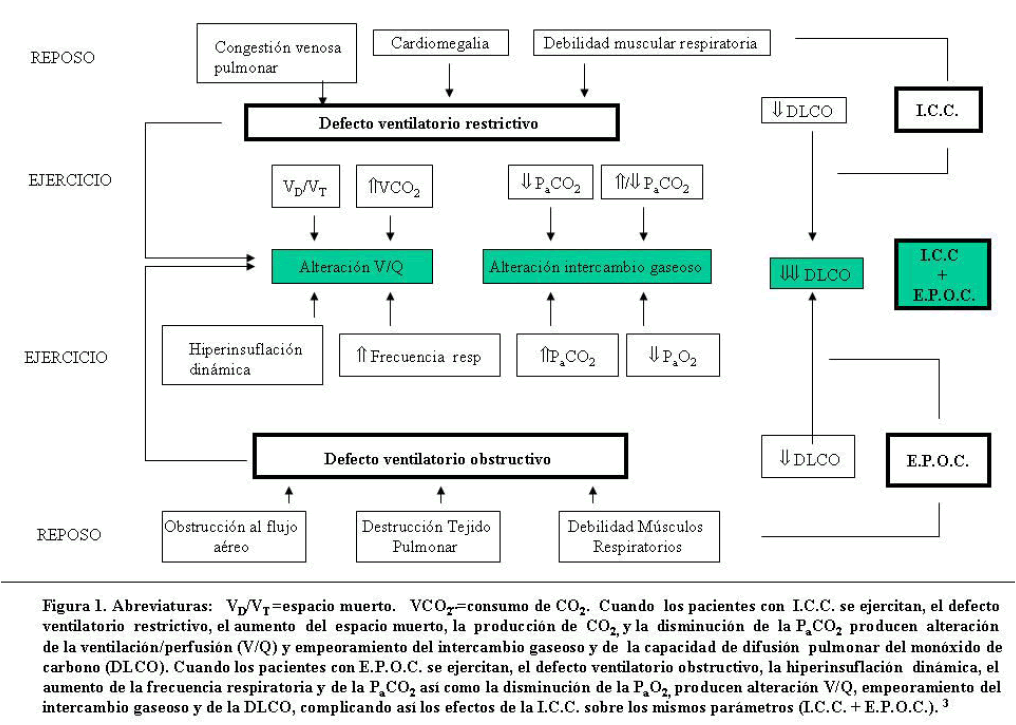
Figura 1. Abreviaturas VD/VT=espacio muerto. VCO2=consumo de CO2. Cuanda loas pacientes con I.C.C.se ejercitan, el dececto ventilatorio, el aumento del espacio muerto, la producción de CO2, y la disminución de la PaCO2 producen alteración de la ventilación/perfusión (V/Q) y empeoramiento del intercambio gaseoso y de la capacidad de difusión pulmonar del monóxido de carbono (DLCO). Cuando los pacientes con E.P.O.C. se ejercitan, el defecto ventilatorio obstructivo, la hiperinsuflación dinamica, el aumento de la frecuencia respiratoriay de la PaCO2 asi como la dismincución de la PaCO2, producen alteración V/Q, empeoramiento del intercambio gaseoso y de la DLCO, complicando asi los efectos de la I.C.C. sobre los mismos parametros (I.C.C. + E.P.O.C.). [3]
• Electrocardiograma: Sobrecarga de cavidades derechas: onda p pulmonale, desviación eje a la derecha y signos de hipertrofia de ventrículo derecho (H.V.D.)
• Radiografía de tórax postero-anterior y lateral: Cardiomegalia (sin crecimiento de la aurícula izquierda). Hipertensión pulmonar precapilar: agrandamiento arteria pulmonar (signo de la convergencia del hilio) [12].
• Ecocardio: Localiza la disfunción ventricular y sus causas (cardiopatía subyacente). Estimación de las presiones pulmonares (en pacientes con obstrucción crónica al flujo aéreo es frecuente encontrar una pobre ecogenicidad que dificulta el cálculo de las mismas) [11].
• Pruebas de la función respiratoria: (Figura 1) Diagnóstico de confirmación de E.P.O.C (en fase de compensación).
• Otras exploraciones: En casos muy individualizados, si la radiografía de tórax y el electrocardiograma son normales, hay que valorar el origen respiratorio de la disnea mediante:
· Estudio hemodinámico (presiones y arteriografía)
· Estudio gammagráfico (ventilación/perfusión).
· BNP ó NT-proBNP (ya comentado).
Tratamiento general de la E.P.O.C. estable: [1]
• El tratamiento debe basarse en tres principios generales:
• Identificar la gravedad de la enfermedad de forma individualizada.
• Desarrollar un plan de tratamiento por etapas.
• Elegir el tratamiento de acuerdo con las características sociales y personales de cada paciente, y según la disponibilidad local de los distintos medicamentos.
• La educación del paciente es necesaria para mejorar sus habilidades con respecto a la enfermedad, abandonar el hábito de fumar, afrontar aspectos relacionadas con los derechos y decisiones sobre la atención médica al final de la vida, y la mejora de la respuesta a las exacerbaciones.
Tratamiento farmacológico (tabla 3):
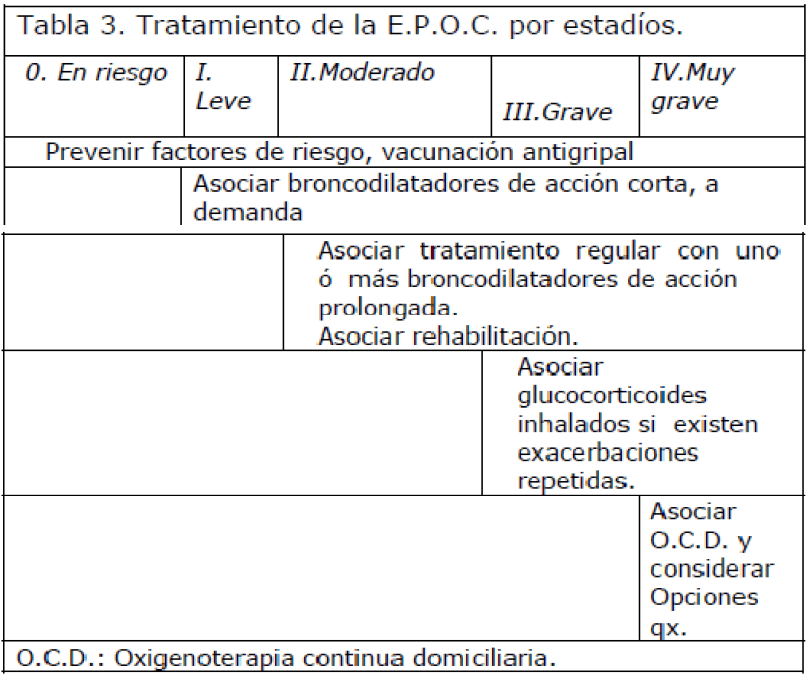
Tabla 3. Tratamiento de la E.P.O.C. por estadíos.
• Broncodilatadores. A demanda ó en régimen regular según síntomas y espirometría. El uso de broncodilatadores de acción larga es más efectivo y conveniente, pero tiene un coste superior.
• Teofilina. Fármaco eficaz pero, por su toxicidad potencial, es preferible el empleo de broncodilatadores inhalados.
• Glucocorticoides. Criterios para indicación de glucocorticoides inhalados:
1. Mejoría sintomática y respuesta espirométrica documentada al glucocorticoide inhalado.
2. VEMS1<50% del valor de referencia.
3. Antecedentes de exacerbaciones repetidas.
Otros tratamientos farmacológicos:
• Vacunas. Antigripal anual. Con respecto a la antineumocócica, no hay evidencia suficiente para recomendarla sistemáticamente a pacientes con E.P.O.C.
• Mucolíticos. Pueden beneficiarse de ellos pacientes con esputo viscoso.
• Antitusígenos. Su empleo habitual está contraindicado.
Tratamiento no farmacológico:
Comprende rehabilitación, oxigenoterapia y opciones quirúrgicas.
• Rehabilitación. Los principales objetivos son reducir los síntomas, mejorar la calidad de vida, y aumentar la participación en las actividades físicas diarias.
• Oxigenoterapia. La administración de 02 regular a largo plazo (>15 horas/día) ha demostrado disminuir la presión arterial pulmonar y la policitemia, mejorar la capacidad de ejercicio, el funcionamiento pulmonar y la actividad intelectual, además de aumentar la supervivencia.
• Opciones quirúrgicas. Bullectomía y trasplante pulmonar en casos seleccionados de pacientes con E.P.O.C. grave.
Tratamiento de las exacerbaciones [1]:
La E.P.O.C. se asocia frecuentemente con exacerbaciones de los síntomas. Entre las causas de las exacerbaciones destacan la infección del árbol traqueobronquial y la contaminación ambiental. En un tercio de los casos no puede identificarse ninguna causa.
La infección respiratoria es la primera causa implicada como agravante de insuficiencia cardíaca establecida, motivando el ingreso hospitalario, sobre todo en el período invernal [7]. En la población mayor de 65 años en una serie de nuestro país, en un 22% de los casos, éste fue el motivo de la descompensación [14]. En otro estudio se observó que en hasta un 63% de los casos, el motivo de reingreso por I.C.C. eran las infecciones [15].
Evaluación de la gravedad de una exacerbación de E.P.O.C.:
• Medición del VEMS [1]: Si <1 litro, sugestivo de exacerbación grave. Difícil de practicar durante una exacerbación.
• Gasometría arterial: Sirve para confirmar el tipo de insuficiencia respiratoria (parcial ó global), determinar la gravedad del cuadro y ayudar en la toma de decisiones sobre la actitud terapéutica.
• Radiografía de tórax: Sirve para excluir diagnósticos alternativos que puedan simular los síntomas de una exacerbación.
• Electrocardiograma: Útil en el reconocimiento de hipertrofia ventricular derecha, arritmias e isquemia miocárdica.
• Otras pruebas: Cultivo de esputo y bioquímica básica, entre otras.
Tratamiento farmacológico:
• Broncodilatadores: Si no se ha utilizado previamente, agregar anticolinérgico hasta que los síntomas mejoren.
• Glucocorticoides: Si en condiciones estables el paciente presenta un VEMS1<50% del valor de referencia, se recomienda añadir una dosis de 40 mg de prednisona oral durante 10 días. La budesonida nebulizada puede ser una alternativa a los glucocorticoides orales para el tratamiento de exacerbaciones no acidóticas.
• Antibióticos: Según criterios comentados previamente (Criterios de agudización).
Tratamiento no farmacológico:
Ventilación mecánica no invasiva (V.M.N.I.). Indicada en exacerbaciones graves de E.P.O.C. (pH<7,30) donde no esté contraindicada la V.M.N.I. [16,17] Contraindicaciones para V.M.N.I.: Apnea, inestabilidad hemodinámica, incapacidad de proteger la vía aérea, anatomía facial anómala, vómitos incontrolados, falta de colaboración o alteración del estado mental, e incapacidad para tolerar la mascarilla. [18] La adición de una mezcla de helio y oxígeno a la V.M.N.I. disminuye el trabajo respiratorio en pacientes con exacerbación grave de E.P.O.C. [19] En espera de estudios definitivos, la C.P.A.P. (Continuous Positive Airway Pressure) es la modalidad de V.M.N.I. preferida en pacientes con Edema Agudo de Pulmón (E.A.P.), excepto quizás en pacientes con hipercapnia y E.A.P., quienes se beneficiarían más del modo Bi.P.A.P. (Bilevel Positive Airway Pressure). [18]
En pacientes con I.C.C. avanzada y respiración de Cheyne-Stokes-Apnea Central del Sueño (RCS-ACS), es muy probable que el tratamiento con C.P.A.P. mejore la evolución general de estos pacientes al favorecer la función cardíaca [20].
Aspectos a tener en cuenta en el tratamiento de pacientes con E.P.O.C. e I.C.C. concomitante:
• Beta-bloqueantes: Los beta-bloqueantes se han convertido en fármacos de primera línea en el tratamiento de la I.C.C., y, dejando a un lado el trasplante cardíaco, suponen la única intervención que revierte la dilatación cardíaca y aumenta la contractilidad miocárdica [3]. Hasta hace poco, el uso de beta-bloqueantes en pacientes con E.P.O.C. e I.C.C. concomitante se consideraba una contraindicación relativa. Sin embargo, a día de hoy, existen varios trabajos que apoyan el uso de los mismos [3,5]. Un metaanálisis de 19 ensayos aleatorizados y controlados de beta-bloqueantes selectivos (atenolol, metoprolol, bisoprolol...) confirma la ausencia de efectos sobre el VEMS1 y sobre la respuesta broncodilatadora a agonistas beta-2 [21]. Los beta-bloqueantes administrados a largo plazo después de un infarto de miocardio aumentan la supervivencia de la misma manera en pacientes con E.P.O.C. que en pacientes sin E.P.O.C [3]. Sin embargo, se desconocen sus efectos en las exacerbaciones de E.P.O.C.
En cuanto a los bloqueantes alfa y beta no selectivos (labetalol, carvedilol), existen varios estudios que demuestran la ausencia de efectos sobre el VEMS1 [3,5]. La actividad bloqueante alfa- 1 del carvedilol y del labetalol puede ser suficiente para anular la broncoconstricción inducida por el bloqueo beta-2 adrenérgico producido en pacientes con E.P.O.C., pero no en pacientes con asma [3,5].
• Amiodarona: El efecto adverso más grave de la amiodarona es la toxicidad pulmonar que se correlaciona más con una dosis acumulativa total [22]. Se ha objetivado una incidencia del 5- 15% de toxicidad pulmonar en pacientes tratados con amiodarona a largo plazo. La enfermedad pulmonar preexistente puede incrementar este riesgo, aunque hay estudios en los que este hecho no se ha comprobado [23]. En uno de estos estudios, realizado en pacientes con E.P.O.C. e I.C.C., no se encontraron diferencias significativas a largo plazo en las mediciones de la DLCO entre los que recibieron amiodarona y los que recibieron placebo, ni se objetivó un aumento de las complicaciones pulmonares [22,23].
• Inhibidores de la enzima convertidora de angiotensina (IECAs): La revisión de la literatura demuestra que, en pacientes con enfermedad pulmonar primaria como el asma ó la E.P.O.C., no está aumentado el riesgo de desarrollar tos o broncoconstricción como resultado del tratamiento con IECAs [24]. Por otro lado, no se ha demostrado su eficacia en el tratamiento de la disfunción ventricular derecha. Se sabe que los IECAs carecen de selectividad sobre la circulación pulmonar, y al revertir la vasoconstricción hipóxica en alveolos no ventilados pueden empeorar la alteración V/Q [25].
• Diuréticos: Provocan una disminución de los edemas periféricos (precaución con diuréticos de asa, ya que pueden producir alcalosis metabólica que inhibe la respiración) [7].
• Digoxina: Beneficiosa si coexiste fallo ventricular sistólico izquierdo, ó taquicardia supraventricular asociadas a fallo ventricular derecho. Sin embargo, los pacientes con E.P.O.C. muestran mayor sensibilidad a la intoxicación por digital, y, en ausencia de fallo ventricular izquierdo, se prefiere el uso de verapamilo [25].
• Anticoagulación: El papel de la anticoagulación no ha sido establecido en pacientes con hipertensión pulmonar secundaria. Debe ser considerada en pacientes con hipertensión pulmonar secundaria que presenten elevado riesgo de tromboembolismo, incluyendo fibrilación auricular y enfermedad estructural cardíaca, embolismo pulmonar previo, disnea grave que impida la movilidad, y defectos septales auriculares que no puedan ser corregidos o que produzcan shunt derechoizquierdo [25].
• Flebotomía: Se debe considerar si el hematocrito>60%. En estos casos ha demostrado disminuir la fatiga, las cefaleas, y las presiones de la arteria pulmonar en pacientes con E.P.O.C. Se recomiendan pequeños volúmenes (250 ml) para minimizar el riesgo de inestabilidad hemodinámica. Debe apreciarse, sin embargo, que el método más efectivo para tratar la policitemia secundaria es la corrección de la hipoxemia [25].
1426
References
- Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Updated 2003. Executive summary.
- J.F.Masa et al. Costes de la EPOC en España. Estimación a partir de un estudio epidemiológico poblacional. Archivos de Bronconeumología, 2004; 40(2): 72-9.
- Kjoller E, Kober L, Iversen K, Torp-Pedersen C. Importance of chronic obstructive pulmonary disease for prognosis and diagnosis of congestive heart failure in patients with acute myocardial infarction. Eur J Heart Fail 6 (2004) 71-77.
- Sirak T, Jelic S, Le Jemtel T. State-of-the-Art- Papers. Therapeutic Update: Non-selective Betaand Alpha-Adrenergic Blockade in Patients With Coexistent Chronic Obstructive Pulmonary Disease and Chronic Heart Failure. J Am Coll Cardiol 2004; 44:497-502.
- Kotlyar E et al. Tolerability of carvedilol in patients with heart failure and concomitant chronic obstructive pulmonary disease or asthma. J Heart Lung Transplant 2002;21;1290-95.
- Carrera M et al. The results of the operation of a monitoring unit for home oxygen therapy. Arch Bronchoneumol 1999;35(1):33-38.
- J Forteza-Rey, J Rodríguez, M del Río. Manejo de la insuficiencia cardíaca en situaciones especiales. Insuficiencia cardíaca: Recomendaciones diagnósticas y terapéuticas. Edición 2002. S.E.M.I. (Sociedad Española de Medicina Interna).
- Cowie MR, et al. Clinical applications of B-type natriuretic peptide (BNP)testing. Review article. Eur Heart J 2003:24;1710-18.
- Filippatos GS, Anker SD, Kardaras F. B-type natriuretic peptide serum levels in acute heart failure. Letter to the editor. Eur Heart J 2004:25, 1085.
- Pruszczyk P, Szulc, Kostrubiec M. Potential clinical application of brain natriuretic peptides in acute pulmonary embolism. Eur Heart J 2004 Apr:25(7):621.
- Cabanes L et al. Brain natriuretic peptide blood levels in the differential diagnosis of dyspnea. Preliminary report. Chest 2001;120:2047-50.
- Frija J. Radiología del Tórax. Manual.1996.Ed. Masson. Páginas 111-13 Gosker H et al. Striking similarities in systemic factors contributing to decreased exercise capacity in patients with severe chronic heart failure or COPD. Chest 2003;123:1416-1424.
- Saenz de la Calzada C. Valoración clínica del paciente con insuficiencia cardíaca. En: Insuficiencia cardíaca. IDEPSA, Editores. Madrid, 1992:90-108.
- Sasaki T, Yanagitani Y, Kubo T, Matsuo H, Miyatake K. Precipitating factors in patients with repetitive exacerbation of chronic left heart failure. J Cardiol. 1998 Apr;31(4):215-22.
- Keenan et al. Which patients with acute exacerbation of chronic obstructive pulmonary disease benefit from noninvasive positive pressure ventilation? A systematic review of the literature. Annals of Internal Medicine 2003:138;861-870.
- Deng JC, Hyzy RC. Noninvasive positive pressure ventilation in acute respiratory failure. UpToDate online 11.3 www.uptodate.com.
- Panacek EA, Kirk D. Role of noninvasive ventilation in the management of decompensated heart failure. Reviews in cardiovascular medicine 2002 Vol 3 Sup 4 Pág 35-40.
- Feller-Kopman DJ. Physiology and clinical use of heliox. UpToDate online 12.2. www.uptodate.com
- Gehlbach BK, Geppert E. The pulmonary manifestations of left heart failure. Chest 2004 ;febr125(2):669-82. Review article.
- Salpeter SS, Ormiston T, Salpeter E, Poole P, Cates C. Cardioselective beta-blockers for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002;2:CD003566.
- Chan ED, Talmadge EK. Amiodarone pulmonary toxicity. UpToDate 11.3. www.uptodate.com
- Singh SN et al. Pulmonary effect of amiodarone in patients with heart failure. J Am Coll Cardiol 1997;30:514-17)
- Packard KA, Wurdeman RL, Arouni AJ. ACE inhibitor-induced bronchial reactivity in patients with respiratory dysfunction. Ann Pharmacother 2002;36:1058-67.
- Dauerman HL, Morgan JP. Treatment of secondary pulmonary hypertension. UpToDate. 11.3. www.uptodate.com









