Keywords
Insuficiencia hepática aguda; Hepatitis fulminante; Encefalopatía; Trasplante hepático; Soporte hepático artificial
Introduction
La insuficiencia hepática aguda (IHA) tambie?n conocida como fallo hepático agudo, falla hepática fulminante, hepatitis fulminante y necrosis hepática aguda, es un sindrome clínico infrecuente que se caracteriza por un episodio agudo de disfunción hepática sin daño subyacente crónico.
La definición es muy variable, pero en general se acepta, como un estado de coagulopatía manifestado por un INR>1,5 asociado a encefalopatía hepática en las primeras 26 semanas, en un paciente sin hepatopatía previa [1]. Se incluye en la definición la enfermedad de Wilson y hepatitis autoinmune a pesar de la existencia de cirrosis, siempre que la enfermedad haya sido reconocida por debajo de las 26 semanas. Por otra parte, se define hepatitis aguda grave cuando encontramos INR>1,5 o prolongación de los tiempos de protrombina (TP) durante las primeras 26 semanas, sin encefalopatía. Cuando esta descompensación ocurre en un paciente con hepatopatía conocida se conoce como hepatopatía aguda sobre crónica ya que usualmente es inducida por un factor desencadenante.
La IHA se puede categorizar en función del momento de aparición de los síntomas, clasificándose como hiperaguda (<7 días), aguda (7 a 21 días) o subaguda (> 21 días y <26 semanas). Esta clasificación toma importancia dado que se asocia con el pronóstico y orientación sobre su etiología, determinante en las estrategias terapéuticas. Hasta en un 40% de los pacientes se desconoce su etiologi?a. El pronóstico de la enfermedad está ligado a la etiología y a la cronología de las manifestaciones. Siendo así la hiperaguda presenta una mejor pronóstico de resolución espontánea que la subaguda.
Es típico que pacientes previamente sanos comiencen a desarrollar síntomas inespecíficos como náuseas, vómitos, malestar general, ictericia y encefalopatía hepática; por lo que el diagnóstico exige descartar lesión hepática previa y valorar signos de insuficiencia hepatocelular grave. La IHA debe ser considerada como una emergencia médica por su deterioro rápidamente progresivo, compromiso orgánico múltiple, complicaciones impredecibles y alto riesgo de mortalidad [1].
Se requiere un diagnóstico rápido y oportuno para dar manejo etiológico, terapia de soporte y el tratamiento multidisciplinario más agresivo posible en la unidad de cuidado crítico (UCI) incluyendo el trasplante hepático (TH) como tratamiento de elección en pacientes seleccionados [2].
Método
Se realizó una búsqueda avanzada con los términos DeCS: Acute liver failure, fulminant hepatitis, encephalopathy, liver transplantation, extracorporeal liver support devices, utilizando los motores de búsqueda Embase, PubMed y Scopus, seleccionando entre artículos originales, reportes-series de casos y revisiones de la literatura; distinguiendo los más relevantes para la elaboración del manuscrito.
Epidemiología
Dada la rareza de esta afección, hay pocas encuestas poblacionales de su incidencia, pero los datos sugieren una variación geográfica significativa en la causa predominante [2]. La IHA es más común en países en desarrollo, con una incidencia estimada de 60 casos por millón de habitantes por año, donde las infecciones virales (Hepatitis A, B, E) son las causas predominantes [2]. Dentro de los factores que disminuyen la incidencia se encuentran las normas de saneamiento y vacunación [2]. En Latinoame?rica y Colombia, los datos son escasos; sin embargo, los datos encontrados no distan de la literatura siendo las causas más frecuentes criptogénica, virus hepatotrópos y hepatitis autoinmune.
En los países desarrollados la forma más común es la lesión hepática inducida por fármacos (LHIF) como el paracetamol. Las mujeres tienen mayor riesgo de desarrollar LHIF debido al mayor uso de medicamentos hepatotóxicos, así como diferencias en el metabolismo de los fármacos [2].
Virus
Las infecciones causadas por virus de la hepatitis A y E son probablemente responsables de la mayoría de casos de IHA, con tasas de muerte de más del 50% [3,4], también puede ocurrir después de una infección por hepatitis B [5]. La supervivencia es pobre en pacientes con reactivación de infección subclínica por virus de la hepatitis B sin enfermedad hepática crónica establecida condición que es más común en pacientes inmunosuprimidos. Recomienda en este grupo de pacientes profilaxis antiviral antes del inicio de quimioterapia, inmunoterapia o terapia con glucocorticoids [6]. Otras causas virales raras de insuficiencia hepática incluyen virus del herpes simple, citomegalovirus, virus de Epstein-Barr y parvovirus [7].
Daño hepático inducido por drogas (DILI)
En los Estados Unidos causa el 50% de las IHA [8,9], el fármaco que más daño incidencia presenta es el paracetamol y tal lesión puede ser idiosincrásico, impredecible e independiente de la dosis [2]. La insuficiencia hepática inducida por paracetamol puede ocurrir después de una dosis grande, pero existe un mayor riesgo cuando se consume dosis graduales en horas o días [10]. Pacientes en estado de desnutrición y con historia de alcoholismo están en mayor riesgo. El paracetamol es un cofactor potencial para la lesión hepática en pacientes que lo consumen para el alivio de los síntomas en el contexto de enfermedad hepática por otras causas [11,12]. La enfermedad idiosincrásica inducida por otros fármacos en rara incluso en pacientes que están expuestos a medicamentos hepatotóxicos, y pocos pacientes con lesión hepática inducida por drogas tiene progresión e encefalopatía e IHA [13]. Factores como edad avanzada, niveles de aminotransferasas y bilirrubinas elevados, y coagulopatía se asocian con mayor riesgo de muerte [9,14].
Otras causas
La lesión hepatocelular isquémica aguda o hepatitis hipóxica, puede ocurrir en pacientes críticamente enfermos con insuficiencia cardiaca, circulatoria o respiratoria. Puede ser causada por una sepsis grave acompañada de signos de insuficiencia cardíaca y elevaciones transitorias en los niveles de aminotransferasas [15,16], en estos casos es necesario tratar la condición básica especifica e iniciar medidas para evitar la progresión de la lesión hepática. El pronóstico depende de la causa y la gravedad de la falla hepática. Un patrón de lesión similar puede verse en pacientes con intoxicación por el uso de sustancias recreativas [2].
Otras causas menos frecuentes son la infiltración neoplásica, síndrome de budd-chiari, insolación, ingestión de hongos y enfermedades metabólicas como la enfermedad de Wilson [7,8]. La falla hepática aguda que ocurre durante el embarazo puede indicar desembarazo temprano, esta indicación debe ser discutida con un especialista en un centro de referencia con capacidad para manejo del binomio materno fetal. En muchos las causas pueden permanecer desconocidas y las tasas de supervivencia son pobres sin trasplante [2].
Evaluación clínica: Abordaje inicial
Reconocer rápidamente la IHA puede ser difícil por la sintomatología inespecífica y de rápida evolución. La anamnesis y una evaluación clínica exhaustiva son esenciales para determinar etiología a través de antecedentes exposicionales, viajes recientes, condiciones comórbidas, ingesta medicamentosa (Figura 1A). Igualmente permite definir el intervalo entre la ictericia y los primeros signos de encefalopatía hepática(EH) para clasificar el subtipo de IHA [2].
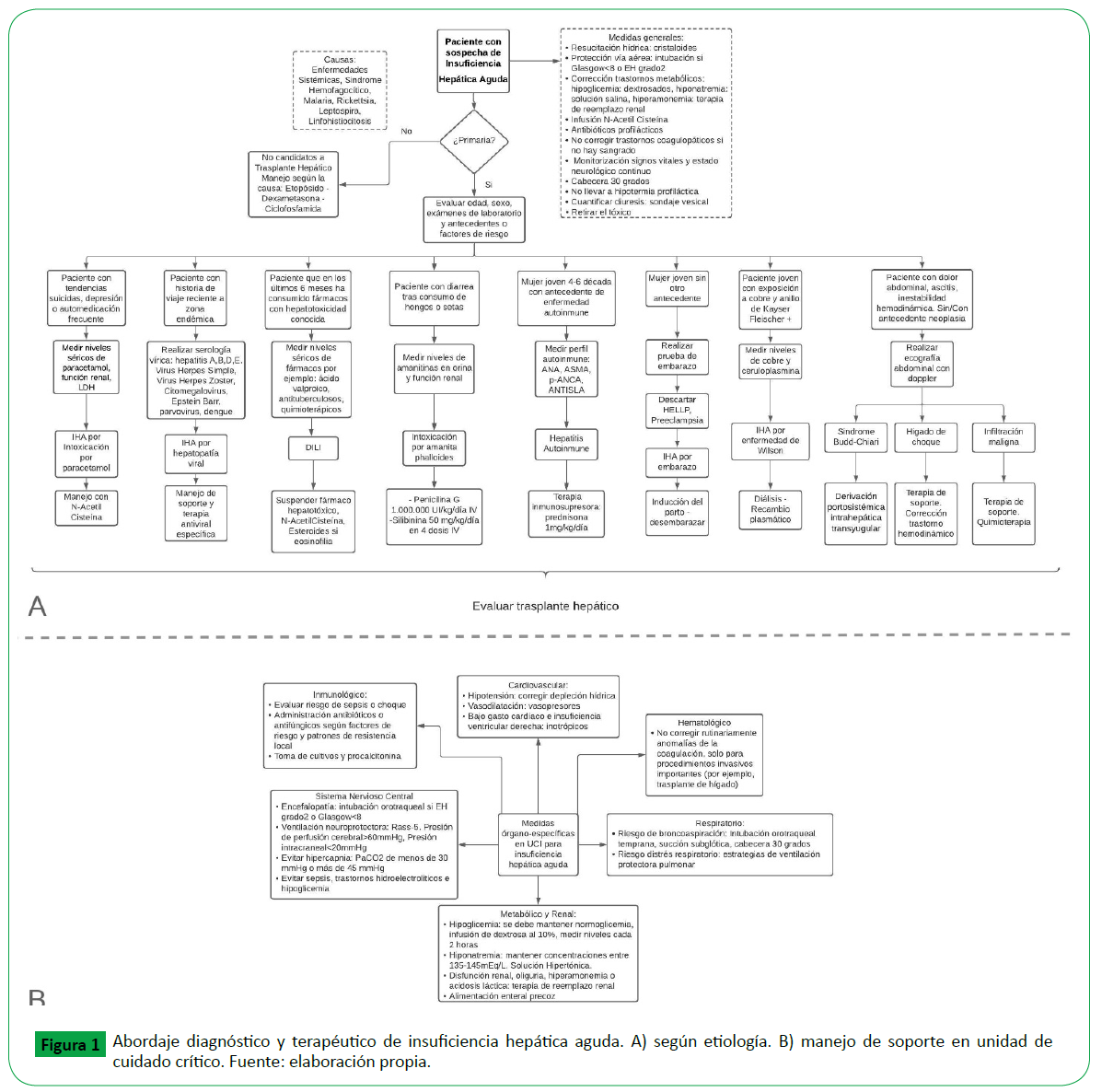
Figure 1: Abordaje diagnóstico y terapéutico de insuficiencia hepática aguda. A) según etiología. B) manejo de soporte en unidad de cuidado crítico. Fuente: elaboración propia.
Los síntomas iniciales son inespecíficos, tales como dolor en hipocondrio derecho, ascitis, distensión abdominal, emesis, náuseas, astenia y adinamia. A medida que avanza la IHA, los pacientes pueden desarrollar ictericia en un 70%, cambios evidentes del estado mental 60%, disminución de la matidez hepática 28% y signos de sangrado 5%, equimosis, hematomas. Se deben buscar signos de hepatopatía crónica: visceromegalias, eritema palmar, telangiectasias, circulación colateral. Cuando la presentación inicial es confusión o agitación es el signo o síntoma dominante [2], especialmente en casos hiperagudos o subagudos donde la ictericia es mínima, puede confundirse con una enfermedad hepática crónica.
La presencia de EH es uno de los criterios diagnósticos de la IHA, los hallazgos son variables por lo que se evalúa a través de la clasificación de West Heaven (Tabla 1). Puede desarrollarse edema cerebral que conduce a un aumento de la presión intracraneal en el 25% al 35% de aquellos con encefalopatía de grado III y en aproximadamente el 75% de aquellos con encefalopatía de grado IV por lo que es primordial la valoración pupilar como signo de aumento de la presión intracraneal [2].
| Grado de encefalopatía |
Estado de Conciencia |
Función Intelectual |
Cambios de Personalidad |
Anormalidades Neuromusculares |
| Grado 0 Normal |
Sin anormalidades |
Sin anormalidades |
Sin anormalidades |
Sin anormalidades |
| Grado 1 Leve |
Patrón invertido de sueño: lnsomnia I Hipersomnia |
Alteraciones en el cálculo Períodos cortos de atención |
Euforia, depresión, irritabilidad |
Temblor, alteración en la concentración.
Asterixis grado 1 |
| Grado 2 Moderada |
Respuesta lenta, letargo |
Amnesia de eventos recientes,
Desorientación en tiempo |
Cambios en la conducta, ansiedad, apatía, comportamiento inapropiado |
Hiperreflexia, ataxia, dificultad para hablar. Asterixis grado 2- 3 |
| Grado 3 Severo |
Somnolencia Confusión |
Incapacidad para el cálculo
Desorientación en lugar |
Comportamiento bizarro, ira, paranoía |
Clonus, rigidez, nistagmus,
Signo de babinsky + |
| Grado 4 Coma |
Estupor - Coma - Inconsciencia |
No valorable |
No valorable |
Descerebración, midriasis, opistótonos |
Tabla 1. Clasificación de West Heaven. Fuente: Elaboración propia.
En este tipo de pacientes es prioridad identificar las causas, restaurar el volumen intravascular y la perfusión sistémica para prevenir o mitigar la gravedad de la falla orgánica en pacientes con intoxicación severa por paracetamol [2], el intervalo entre la ingestión de droga y el inicio de tratamiento con N-acetil cisteína (NAC) está estrechamente relacionado con el resultado [10,17]. Sin embargo, solo se ha demostrado su utilidad en la disminución de las tasas de supervivencia entre pacientes con EH de bajo grado [18].
La EH puede progresar rápidamente, particularmente en los estados hiperagudos con presión a agitación y coma. La práctica varía según el centro donde encontremos, pero, en estos pacientes se recomienda la intubación temprana y sedación para facilitar el cuidado general, prevenir la neumonitis por aspiración [2]. Es común en estos pacientes encontrar una presión arterial baja y vasodilatación sistémica con o sin sepsis. Esta condición se asocia con EH más severa y aumento en la mortalidad [19,20]. La hemorragia manifiesta es poco común en pacientes con IHA y refleja una hemostasia equilibrada. En la mayoría de los casos, la perdida de la síntesis de factores procoagulantes es paralela a la perdida de anticoagulantes derivados de la hepatitis. Inicialmente las pruebas de coagulación pueden indicar que no hay tendencia hemorragia mayor [21,22].
La evaluación seriada de pruebas de coagulación es indispensable para establecer pronóstico, se debe evitar administración de factores de la coagulación, excepto cuando sea necesario para tratar el sangrado o ante la realización de procedimientos invasivos.
La gravedad de la enfermedad, la rapidez del cambio y la participación de órganos extrahepáticos requieren un ingreso rápido a UCI. Sin embargo, la prioridad en estos pacientes es predecir la necesidad de TH dado que la progresión de la enfermedad puede contraindicar la realización del mismo [2].
En el momento del ingreso, ante la sospecha de IHA, se necesitan además de los exámenes de medio interno, análisis de laboratorio (Tabla 2) y estudios de imágenes para excluir cirrosis, evaluar la gravedad, establecer la etiología de la enfermedad, definir pronóstico, candidatos a TH y descartar complicaciones. Como estudios etiológicos se deben valorar virus hepatotrópos, serología vírica, perfil toxicológico incluyendo níveles farmacológicos, estudio de autoinmunidad y prueba de embarazo [7].
| Hematología y química sanguínea |
• Hemograma completo
• Glicemia central
• Creatinina, nitrógeno ureico,ionograma con calcio,magnesio y fósforo
• Transaminasas,bilirrubina total y directa, fosfatasa alcalina, gamma glutamil transferasa, albúmina, LDH
• PT,TPT,INR,fibrinógeno,amonio arterial,lactato arterial
• Gases arteriales
• Hemoclasificación
• Prueba de embarazo en mujeres
• Nivel de acetaminofén y rastreo de tóxicos (casos seleccionados) |
| Infecciosas |
• lgM hepatitis A,lgA e lgM hepatitis E, anticuerpos hepatitis C
• Antígeno de superficie,core total,core lgM hepatitis B
• VIH,lgG e lgM citomegalovirus, virus de Epstein-Barr,herpes simplex I,virus herpes zoster,parvovirus |
| Metabólicas y autoinmunidad |
• Ceruloplasmina, cobre sérico y urinario (casos seleccionados)
• Anticuerpos antinucleares (ANA),anticuerpos antimúsculo liso (ASMA), nivel de lgG,HLA.
• Antígeno hepático soluble (anti-SLA) y los anticuerpos anticitoplasma de neutrófilo perinuclear (p-ANCA) |
Tabla 2. Exámenes de laboratorio a solicitar en pacientes con sospecha de IHA. Fuente: elaboración propia.
Las anomalías características en las pruebas de laboratorio estándar son la elevación de los niveles de transaminasas e hiperbilirrubinemia por necrosis de hepatocitos. La hipertransaminasemia puede orientar la etiologi?a >1.000 U/L: sospecha de etiologi?a viral, isquemia o <300 U/L: sospecha de Síndrome de Reye, Budd-Chiari, Wilson, esteatosis aguda del embarazo [7]. Dada la pérdida de la función hepática sintética se evidencian alteraciones coagulopáticas: prolongación del INR, consumo fibrinógeno y trombocitopenia como reflejo de aumento presión portal. La medición de gasometría arterial con lactato y los niveles de amoníaco son útiles ya que una acidosis láctica y un nivel de amoniaco >150-200micromol/l se han asociado a un mayor riesgo de hernia cerebral [7]. En caso de sospecha de proceso infeccioso requiere hemocultivos para pio?genos y hongos, paracentesis si ascitis, uroana?lisis con urocultivo, radiografi?a de to?rax.
Los estudios imagenológicos son de utilidad para descartar cambios de hepatopatía crónica, hipertensión portal, congestión, trombosis venas hepáticas (Budd-Chiari) o infiltración maligna por lo que se recomienda realizar una ecografía abdominal con evaluacio?n de la circulacio?n hepa?tica. El papel de la biopsia hepática es limitado, ya que a menudo es problemática en vista de la inestabilidad hemodinámica y la coagulopatía asociada. Los hallazgos ma?s comunes son necrosis hepa?tica masiva o submasiva, los cuales vari?an de acuerdo con cada etiologi?a [7]. En pacientes con deterioro neurológico severo se puede realizar una tomografía cerebral para descartar sangrado, edema cerebral u otra alteración.
Complicaciones
Disfunción circulatoria y respiratoria
La disfunción circulatoria y la hipotensión son común en pacientes con IHA y generalmente son de origen multifactorial. El volumen efectivo puede ser bajo inicialmente por vómitos y baja ingesta de líquido y el desarrollo de vasodilatación, que lleva a una condición consistente principalmente con hipovolemia y choque.
El soporte cardiovascular no difiere notablemente de los utilizados en pacientes con otras enfermedades críticas. La restauración temprana del volumen circulante, perfusión sistémica y entrega de oxígeno. En pacientes que continúan con hipotensión a pesar de reposición de volumen es mandatorio iniciar soporte vasopresor con noradrenalina asociado a terlipresina, Asimismo, se pueden presentar alteraciones ventilatorias dadas por síndrome de distrés respiratorio agudo, hipoxemia multifactorial, neumonia por aspiración, hiperventilación con alcalosis respiratoria, edema pulmonar [23].
Condición neurológica
La EH orienta al pronóstico y su desarrollo refleja la función hepática críticamente alterada. Sin embargo, la velocidad de desarrollo es importante para el diagnóstico diferencial. En las presentaciones subagudas, incluso cuando está en bajo grado indica un pobre pronóstico [24]. El objetivo de las estrategias de tratamiento en prevenir la aparición o aumento en el grado de encefalopatía, es limitar su gravedad con el fin de reducir el riesgo de daño cerebral. Hipertensión intracraneal (HIC) y el edema cerebral sigue siendo una complicación temida [24].
No se entiende aun la patogenia de la encefalopatía y el edema cerebral en la IHA, existe evidencia que sugiere la implicación de inflamación local, neurotoxinas circulantes particularmente el amoniaco juegan un papel importante [25,26]. Los procesos infecciosos pueden precipitar la encefalopatía en pacientes que cursan con hipotensión y vasodilatación [27,28]. Los mediadores inflamatorios pueden desencadenar o empeorar la encefalopatía a través de la alteración de la permeabilidad endotelial cerebral alterando el flujo sanguíneo cerebral. Existe una relación directa entre el nivel de amoniaco elevado y el desarrollo de encefalopatía. Siendo de mayor riesgo niveles de 150-200micromol/l [27,29], produciendo alteración en la función cerebral por edema cerebral [25,26]. La velocidad de instauración de la hiperamonemia hace que fallen los mecanismos osmóticos habituales en casos de IHA, en contraste con los casos crónicos o subagudos [25,26].
Disfunción renal
La disfunción renal puede ocurrir en más del 50% de los pacientes esta complicación es más común en los ancianos [30]. Aunque la disfunción renal está asociada con mayor mortalidad, la resolución de la disfunción hepática se asocia con un retorno a niveles séricos preexistentes de filtrado glomerular [31]. La terapia de reemplazo renal en estos pacientes se utiliza generalmente para conseguir una mayor estabilidad metabólica y hemodinámica al lograr controlar hiperamonemia y mejorar el desequilibrio ácido base [32].
Tratamiento
En pacientes con IHA el soporte se proporciona igual que para otros pacientes críticamente enfermos; con algunos objetivos específicos según la etiología y complicaciones extrahepáticas (Figura 1B). El objetivo de tratamiento es lograr una meta metabólica estable y estabilidad hemodinámica, con el fin de mejorar la regeneración y minimizar el riesgo de complicaciones. Tras reconocer la IHA se debe realizar una reanimación rápida con fluidoterapia intravenosa, protección de la vía aérea mediante intubación endotraqueal si el nivel de conciencia está reducido o presenta una EH grado 2, corrección de trastornos metabólicos graves y derivación a centros especializados.
Estos pacientes tienen mayor riesgo de hipoglucemia que puede prevenirse con infusión endovenosa de glucosa. Tener especial cuidados con las infusiones de líquidos hipotónicos que pueden llevar a hiponatremia y edema cerebral. Los pacientes con IHA tienen alto gasto energético con aumento en el consumo de proteínas por lo que requieren un apoyo controlado para preservar la masa muscular y la función inmune(33, 34). De forma arbitraria podemos administrar 1.0-1.5gr/kg día de proteínas. Se debe tener en cuenta los niveles de amoniaco para vigilancia y ajuste del soporte nutricional, en presencia de niveles elevados de amoniaco tendríamos que disminuir el tiempo de infusión del soporte nutricional o disminuir la rata proteica dada su asociación con aumento del riesgo de HIC [23].
Evaluación pronóstica
La identificación temprana de pacientes que no sobrevivirán con la terapia medica sola es de gran utilidad práctica, candidatos a TH deben ser identificados lo más rápido possible [35]. La presencia de encefalopatía es un indicador clave, con mayor consideración teniendo en cuenta la edad del paciente y la gravedad de la lesión hepática evaluada por la presencia de coagulopatía o ictericia [36,37].
Los pacientes tienen una elevada mortalidad con tratamiento médico (40-70%). La supervivencia de estos pacientes se eleva con el TH (65%). Factores como la escasez de órganos, aparición temprana de complicaciones pueden tener implicaciones en trasplantar a un paciente potencialmente recuperable con tratamiento médico, por esta razón es importante determinar la existencia de factores pronostico con el fin de hacer una mejor selección de los candidatos a trasplante [38]. Factores como la coagulación, bilirrubina, creatinina, pH, lactato, edad y grado de EH son frecuentemente utilizados. Por otra parte, factores como alfa-feto proteína, amonio, fosforo y ferritina no se utilizan con frecuencia y podrían tener alguna utilidad [38,39]. En estos pacientes es recomendable la utilización de scores pronósticos para los cuales se han evaluado varias escalas, dentro de las cuales las más utilizadas son los criterios del kings college (CKC) y criterios de MELD (Tabla 3).
| Criterios King's College Hospital |
| Falla hepática aguda no asociada al acetaminofén |
Falla hepática aguda por acetaminofén |
| INR mayor de 6,5 independiente del grado de encefalopatía |
pH menor de 7,3 y lactato mayor de 3 mmol/L, después de reanimación adecuada y más de 24 horas post ingesta de acetaminofén |
| |
o Lactato mayor de 3,5 mmol/L tras reanimación |
o 3 de los siguientes criterios:
• Edad menor de JO años o mayor de 40 años
• Tiempo de evolución mayor de 7 dias entre la ictericia y la encefalopatía
• INR mayor de 3,5 11 PT mayor a 50
segundos
• Bilirrubina total mayor de 17,5 mg/dL
• Etiología no favorable (enfermedad de Wilson, hepatotoxicidad, idiopática) |
o Cumple con todos estos tres parámetros en 24 horas:
• Encefalopatía grado III-IV
• Creatinina mayor de 3,4 mg/dL
• INR mayor de 6,5 11 PT mayor a 100 segundos |
| MELD SCORE |
| MELD = 3,78 [log Bilirrubina total] + 11,2 [log lNR] + 9,6 [log Creatinina] + 6,4 |
Tabla 3. Scores pronósticos para trasplante hepático. Fuente: elaboración propia.
La aplicación dinámica de los criterios mejora la sensibilidad, la valoración del lactato no mejora los resultados, el APACHE II, alfafetoproteína y los niveles de fósforo parecen tener elevada sensibilidad, pero faltan ser validados en estudios más amplios [39]. Los CKC tienen una especificidad del (82-95%) alcanzando las cifras más altas en pacientes con encefalopatía avanzada, cuando se aplica en forma dinámica y en casos relacionados con paracetamol [37]. Estos criterios no han sido validados en grupos específicos como en el embarazo, Enfermedad de Wilson, tóxicos y los parámetros modificables con el tratamiento. La mejoría en valores de MELD en las 24 horas posterior al inicio de los síntomas o un delta tiene un valor predictivo de supervivencia. El delta de MELD, delta de INR tienen el mismo valor pronostico que los criterios [40]. En la intoxicación por paracetamol un MELD>18 medido a las 48-72 horas posterior a la intoxicación tiene un alto valor predictivo en el desarrollo de falla hepática aguda fulminante [37]. Al comparar el MELD y CKC en la intoxicación por paracetamol los CKC son superiores, pero el alto valor predicativo negativo de MELD hace que se sugiera utilizarlo en conjunto con CKC para evitar el trasplante en pacientes que se van a recuperar con tratamiento medico [41]. En los pacientes con IHA no relacionado con paracetamol MELD es superior CKC [42,43]. Se han tratado de hacer modificaciones a los criterios de MELD, pero hasta ahora ninguno han mejorado su valor predicativo [44].
Manejo del paciente con falla hepática aguda
El manejo de IHA depende del grado de compromiso del paciente y de las manifestaciones extrahepáticas o falla de otros órganos que comprometan el estado general (Figura 1B). Las complicaciones se dan en la primera fase de sindrome de respuesta inflamatoria sistémica (SIRS) que condiciona a falla multiorgánica y en la segunda fase de sindrome de respuesta antiinflamatoria compensadora que predispone a infecciones [23].
Las infusiones de NAC deben iniciarse inmediatamente en todos los casos de IHA por sobredosis de paracetamol sospechada o confirmada y pueden ser útiles cuando se inician temprano en la lesión hepática inducida por fármacos no paracetamol y la hepatitis hipóxica. La dosis es un bolo de 150 mg/kg, que se continu?a con 50mg/kg en 4 horas, y posteriormente con 100mg/ kg en 16 horas. Esta infusio?n puede prolongarse hasta 48 o? 72 horas.
La presión intracranial (PIC) es determinante en el manejo de pacientes con IHA, la frecuencia global de utilización de PIC es cercana al 27,7% con una duración promedio 4,4-2,3 días [45]. El reconocimiento precoz de HIC es vital para determinar la posibilidad de TH, se recomienda la medición en pacientes con encefalopatía hepática grado 3-4 con un objetivo de PIC<20 mmHg y presión de perfusión cerebral(PPC)>60 mmHg. Cuando este objetivo no se logra y sostenidamente encontramos PPC<40 mmHg por más de dos horas el pronóstico suele ser ominoso. Se recomienda además valorar respuesta al tratamiento, este procedimiento aumenta el riesgo de hemorragia cerebral, infecciones y no es claro el beneficio en supervivencia a 30 días postrasplante, mayor agresividad en el tratamiento de la HTIC, con un aumento claro en la mortalidad [45,46]. Además, no hay consenso sobre su ubicación (intraparenquimatosa, epidural, subdural). Sin embargo, la posición más utilizada es la subdural con 64%, razón por la cual se acepta como alternativa la medición ecografía del diámetro del nervio óptico [38].
En cuanto a los trastornos de coagulación, evite su corrección a menos que haya sangrado activo o antes de procedimientos invasivos mayores; no hay evidencia de beneficio de las transfusiones profilácticas [7].
La infección es una complicación tardía frecuente de la IHA y una de las principales causas de mortalidad. Las infecciones bacterianas son las más frecuentes, pero se han notificado infecciones fúngicas hasta en un tercio de los pacientes, principalmente candidiasis [7]. La profilaxis antimicrobiana todavía es discutible considerando la incertidumbre del valor pronóstico para los pacientes, sin embargo se recomienda en pacientes con alta sospecha la toma de cultivos y procalcitonina para determinar requerimiento de antibioticoterapia [30]. Las guías recomiendan el tratamiento empírico con antimicrobianos de amplio espectro para los pacientes con IHA con SIRS, hipotensión refractaria o empeoramiento de la EH; así como los pacientes incluidos en la lista de trasplantes de hígado de urgencia [7,30].
Métodos de soporte hepático artificial
Los métodos de soporte artificial se han utilizado ampliamente en el manejo de pacientes con IHA. Se han utilizado métodos no biológicos como el sistema de recirculación molecular absorbente (MARS), PROMETHEUS, La diálisis con albúmina de paso único (SPAD), plasmaféresis y métodos biológicos como hepatocitos humanos o animales, hasta ahora no se conoce un beneficio en mortalidad [47], pero dentro de los beneficios que se podrían tener con estos métodos se encuentra la mejoría en la ictericia, hemodinámica, reducción de la presión portal, reducción de la PIC, mejoría de la encefalopatía [48,49]. Estos sistemas también pueden ser útiles como terapia puente para el TH donde se ha demostrado mejoría del 20% comparado con el método convencional, con algunas limitaciones como el tiempo y el número de terapias requeridas para lograr los objetivos [50,51]. La supervivencia en pacientes con TH es similar en MARS que, en el tratamiento convencional, esta supervivencia se logra con un mínimo de 3 sesiones MARS, la supervivencia es mayor en pacientes con intoxicación por paracetamol, sin diferencias en el grupo de no paracetamol. Hay una disminución significativa en los niveles de bilirrubinas, urea, creatinina y lactato con el método MARS. Pero, los eventos adversos como hemorragia, sepsis y muerte son similares en ambos grupos [51]. El MARS puede mejorar la supervivencia en el paciente con falla hepática aguda pero no en el paciente crónico agudizado [52]. La plasmaféresis de gran volumen (8-12 litros/sesión) mejora la supervivencia en pacientes libres de trasplante incluso en el subgrupo con criterios de trasplante, con mejoría de los índices de SIRS y SOFA pero no impacto en supervivencia después del trasplante [53].
Trasplante hepático
Aunque el trasplante es una opción de tratamiento para algunas causas de IHA, este tratamiento no se encuentra disponible universalmente y menos del 10% de los trasplantes de hígado se realizan en pacientes con IHA [52,53]. En pacientes con alto riesgo de HIC intraoperatoria y posoperatoria se convierte en un desafío y las tasas de supervivencia son mucho mas bajas comparadas con las demostradas en trasplante hepático electivo. Con el tiempo estos registros han mejorado y las tasas de supervivencia actuales están alrededor de 79% a un año y 72% a 5 años. La mayoría de las muertes se producen en los primeros 3 meses posoperatorios siendo la causa mas frecuente los procesos infecciosos. Este riesgo se aumenta en pacientes de edad avanzada, aquellos que reciben injertos anteriores o parciales, o injertos de donantes sin un ABO idénticos.
Los predictores de mortalidad son una piedra angular importante para la toma de decisiones al incluir a los pacientes para TH de manera emergente, los criterios de CKC son los que nos ayudan a seleccionar los pacientes [35]. En Colombia, de acuerdo a la comisión de TH [54] tienen prioridad para trasplantes los pacientes urgencia 0 (Tabla 4), se tienen en cuenta características sociodemográficas, la diferencia de superficie corporal entre el 20- 25%, el isogrupo sanguíneo donante-receptor y compatibilidad. En las últimas decadas ha habido una variación importante en la superviviencia de los pacientes con IHA, de menos del 20% en la década de 1970 a más del 60% en la última década, en gran parte debido al TH de emergencia. Las tasas de supervivencia en los pacientes trasplantados ha mejorado con un estimado de vida de 80-90% en el primer año [7].
Paciente Urgencia 0 para Trasplante Hepático
Se encuentra en UCI por IHA, expectativa de vida menor a 7 días y alguno de los siguientes criterios: |
| Criterio |
Definición |
| IHA subaguda |
Criterios Kinas College |
Disfunción primario higado trasplantado primaria
dentro de los primeros 7 días |
AST > 3000mg/dl y al menos 1 de los
siguientes:
- INR >2,5
- pH < 7,3
- Lactato > 4 mmol/L |
| Trombosis de la arteria hepática de un hígado trasplantado dentro de los primeros 7 días a su trasplante |
Visualización ecográfica |
| Enfermedad de Wilson agudamente descompensada que no responde a manejo médico |
Confirmada por laboratorio |
| United Network for Organ Sharing |
• Expectativa de vida menor a 7 días sin trasplante previo.
• Encefalopatía hepática dentro de las 8 semanas después del inicio de los
síntomas.
• Ausencia de enfermedad hepática preexistente
• Admisión en UCI, y al menos una de las siguientes condiciones:
• Dependencia al ventilador
• Terapia de reemplazo renal
• INR >2 |
Tabla 4. Criterios de selección trasplante hepático en Colombia. Fuente: elaboración propia.
Las contraindicaciones son situaciones que te?cnicamente el trasplante no disminuyen las posibilidades de supervivencia, las contraindicaciones absolutas incluyen enfermedad maligna extrahepática, malignidad hepática avanzada, hepatopatía alcohólica, daño cerebral irreversible, disfunción cardiopulmonar: hipertensión pulmonar severa/insuficiencia cardíaca, HIC severa no controlada, SIDA con infecciones oportunistas, sepsis no controlada, hipoxemia refractaria vasopresores a dosis altas. Las contraindicaciones relativas no excluyen de manera definitiva pero inciden negativamente en el resultado, suelen ser impedimentos de i?ndole anato?mico para realizar una correcta te?cnica quiru?rgica o enfermedades que conllevan un peor prono?stico postrasplante [54].
Conclusión
La IHA es un síndrome complejo poco frecuente pero con una alta tasa de mortalidad por sus complicaciones: sepsis, HIC, edema cerebral, disfunción orgánica múltiple. En el abordaje es importante una evaluacio?n detallada para determinar la causa etiológica y dar manejo oportuno en UCI a las alteraciones hepa?ticas y extrahepa?ticas. Existen indicaciones claras como pacientes con MELD>30 y CKC que determinan el momento y la población candidata a TH.
37171
References
- Wlodzimirow KA, Eslami S, Chamuleau RA, Nieuwoudt M, Abu-Hanna A (2012) Prediction of poor outcome in patients with acute liver failure-systematic review of prediction models. PloS One 7: e50952.
- Bernal W, Auzinger G, Dhawan A, Wendon J (2010) Acute liver failure. The Lancet 376: 190-201.
- Hoofnagle JH, Nelson KE, Purcell RH (2012) Hepatitis E. N Eng J Med 367: 1237-1244.
- Wasley A, Fiore A, Bell BP (2006) Hepatitis A in the era of vaccination. Epidemiologic Reviews 28: 101-111.
- Khuroo M, Kamili S (2003) Aetiology and prognostic factors in acute liver failure in India. Journal of Viral Hepatitis. 10: 224-231.
- Chiu HY, Chen CH, Wu MS, Cheng YP, Tsai TF (2013) The safety profile of ustekinumab in the treatment of patients with psoriasis and concurrent hepatitis B or C. Br J Dermatol 169: 1295-1303.
- Ichai P, Samuel D (2008) Etiology and prognosis of fulminant hepatitis in adults. Liver Transplantation. 2008;14: 1-10.
- Ostapowicz G, Fontana RJ, Schiødt FV, Larson A, Davern TJ, et al. (2002) Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Annals of Internal Medicine 137: 947-954.
- Reuben A, Koch DG, Lee WM (2005) Drug‐induced acute liver failure: results of a us multicenter, prospective study. Hepatology 52: 2065-2076.
- Craig DG, Bates CM, Davidson JS, Martin KG, Hayes PC (2012) Staggered overdose pattern and delay to hospital presentation are associated with adverse outcomes following paracetamol‐induced hepatotoxicity. British Journal of Clinical Pharmacology 73: 285-294.
- Rezende G, Roque‐Afonso AM, Samuel D, Gigou M, Nicand E, et al. (2003) Viral and clinical factors associated with the fulminant course of hepatitis A infection. Hepatology 38: 613-618.
- Khandelwal N, James LP, Sanders C, Larson AM, Lee WM (2011) Unrecognized acetaminophen toxicity as a cause of indeterminate acute liver failure. Hepatology 53: 567-576.
- Chalasani N, Fontana RJ, Bonkovsky HL, Watkins PB, Davern T, et al. (2008) Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United States. Gastroenterology 135: 1924-1934.
- Björnsson E, Olsson R (2005) Outcome and prognostic markers in severe drug‐induced liver disease. Hepatology 42: 481-489.
- Lescot T, Karvellas C, Beaussier M, Magder S (2012) Acquired liver injury in the intensive care unit. Anesthesiology: The Journal of the American Society of Anesthesiologists 117: 898-904.
- Çağlı K, Başar FN, Tok D, Turak O, Başar Ö (2015) How to interpret liver function tests in heart failure patients? Turk J Gastroenterol 26: 197-203.
- Dodd S, Dean O, Copolov DL, Malhi GS, Berk M (2008) N-acetylcysteine for antioxidant therapy: pharmacology and clinical utility. Expert Opinion on Biological Therapy 8: 1955-1962.
- Lee WM, Hynan LS, Rossaro L, Fontana RJ, Stravitz RT, et al. (2009) Intravenous N-acetylcysteine improves transplant-free survival in early stage non-acetaminophen acute liver failure. Gastroenterology 137: 856-864.
- Vaquero J, Polson J, Chung C, Helenowski I, Schiodt FV, et al. (2003) Infection and the progression of hepatic encephalopathy in acute liver failure. Gastroenterology 125: 755-764.
- Karvellas CJ, Pink F, McPhail M, Cross T, Auzinger G, et al. (2009) Predictors of bacteraemia and mortality in patients with acute liver failure. Intensive Care Medicine 35: 1390-1396.
- Agarwal B, Wright G, Gatt A, Riddell A, Vemala V, et al. (2012) Evaluation of coagulation abnormalities in acute liver failure. Journal of Hepatology 57: 780-786.
- Stravitz RT, Lisman T, Luketic VA, Sterling RK, Puri P, et al. (2012) Minimal effects of acute liver injury/acute liver failure on hemostasis as assessed by thromboelastography. Journal of Hepatology 56: 129-136.
- Bernal W, Wendon J (2013) Acute liver failure. New England Journal of Medicine 369: 2525-2534.
- Bernal W, Hyyrylainen A, Gera A, Audimoolam VK, McPhail MJ, et al. (2013) Lessons from look-back in acute liver failure? A single centre experience of 3300 patients. Journal of Hepatology 59: 74-80.
- Vaquero J (2012) Therapeutic hypothermia in the management of acute liver failure. Neurochemistry International 60: 723-735.
- Desjardins P, Du T, Jiang W, Peng L, Butterworth RF (2012) Pathogenesis of hepatic encephalopathy and brain edema in acute liver failure: role of glutamine redefined. Neurochemistry International 60: 690-696.
- Bernal W, Hall C, Karvellas CJ, Auzinger G, Sizer E, et al. (2007) Arterial ammonia and clinical risk factors for encephalopathy and intracranial hypertension in acute liver failure. Hepatology 46: 1844-1852.
- Kitzberger R, Funk GC, Holzinger U, Miehsler W, Kramer L, et al. (2009) Severity of organ failure is an independent predictor of intracranial hypertension in acute liver failure. Clinical Gastroenterology and Hepatology 7: 1000-1006.
- Kumar R, Sharma H, Prakash S, Panda SK, Khanal S, et al. (2012) Persistent hyperammonemia is associated with complications and poor outcomes in patients with acute liver failure. Clinical Gastroenterology and Hepatology 10: 925-931.
- Leithead JA, Ferguson JW, Bates CM, Davidson JS, Lee A, et al. (2009) The systemic inflammatory response syndrome is predictive of renal dysfunction in patients with non-paracetamol-induced acute liver failure. Gut 58: 443-449.
- O'riordan A, Brummell Z, Sizer E, Auzinger G, Heaton N, et al. (2011) Acute kidney injury in patients admitted to a liver intensive therapy unit with paracetamol-induced hepatotoxicity. Nephrology Dialysis Transplantation 26: 3501-3508.
- Lee KC, Palacios Jimenez C, Alibhai H, Chang YM, Leckie PJ, et al. (2013) A reproducible, clinically relevant, intensively managed, pig model of acute liver failure for testing of therapies aimed to prolong survival. Liver International 33: 544-551.
- Walsh TS, Wigmore SJ, Hopton P, Richardson R, Lee A (2000) Energy expenditure in acetaminophen-induced fulminant hepatic failure. Critical Care Medicine 28: 649-654.
- Plauth M, Cabre E, Riggio O, Assis-Camilo M, Pirlich M, et al. (2006) ESPEN guidelines on enteral nutrition: liver disease. Clinical Nutrition 25: 285-294.
- Simpson KJ, Bates CM, Henderson NC, Wigmore SJ, Garden OJ, et al. (2009) The utilization of liver transplantation in the management of acute liver failure: Comparison between acetaminophen and non‐acetaminophen etiologies. Liver Transplantation 15: 600-609.
- O'Grady JG, Alexander GJ, Hayllar KM, Williams R (1989) Early indicators of prognosis in fulminant hepatic failure. Gastroenterology 97: 439-445.
- McPhail MJ, Wendon JA, Bernal W (2010) Meta-analysis of performance of Kings’s College Hospital Criteria in prediction of outcome in non-paracetamol-induced acute liver failure. Journal of Hepatology 53: 492-429.
- Escorsell À, Mas A, de la Mata M, Failure SGftSoAL (2007) Acute liver failure in Spain: Analysis of 267 cases. Liver Transplantation 13: 1389-1395.
- Craig DGN, Ford A, Hayes PC, Simpson K (2010) Systematic review: Prognostic tests of paracetamol‐induced acute liver failure. Alimentary Pharmacology & Therapeutics 31: 1064-1076.
- Schmidt LE, Larsen FS (2007) MELD score as a predictor of liver failure and death in patients with acetaminophen‐induced liver injury. Hepatology 45: 789-796.
- Renner EL (2007) How to decide when to list a patient with acute liver failure for liver transplantation? Clichy or King’s College criteria, or something else? Journal of Hepatology 46: 554-557.
- Yantorno SE, Kremers WK, Ruf AE, Trentadue JJ, Podestá LG, et al. (2007) MELD is superior to King's college and Clichy's criteria to assess prognosis in fulminant hepatic failure. Liver Transplantation 13: 822-828.
- McPhail MJ, Shawcross DL, Abeles RD, Chang A, Patel V, et al. (2015) Increased survival for patients with cirrhosis and organ failure in Liver Intensive Care and Validation of the chronic Liver Failure–Sequential Organ Failure Scoring System. Clinical Gastroenterology and Hepatology 13: 1353-1360.
- McPhail MJ, Farne H, Senvar N, Wendon JA, Bernal W (2016) Ability of King's College criteria and model for end-stage liver disease scores to predict mortality of patients with acute liver failure: A meta-analysis. Clinical Gastroenterology and Hepatology 14: 516-525.
- Vaquero J, Fontana RJ, Larson AM, Bass NM, Davern TJ, et al. (2005) Complications and use of intracranial pressure monitoring in patients with acute liver failure and severe encephalopathy. Liver Transplantation 11: 1581-1589.
- Poonja Z, Brisebois A, van Zanten SV, Tandon P, Meeberg G, et al. (2014) Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management. Clinical Gastroenterology and Hepatology 12: 692-698.
- Zheng Z, Li XU, Li Z, Ma X (2013) Artificial and bioartificial liver support systems for acute and acute-on-chronic hepatic failure: A meta-analysis and meta-regression. Experimental and Therapeutic Medicine 6: 929-936.
- Bañares R, Catalina MV, Vaquero J (2014) Molecular adsorbent recirculating system and bioartificial devices for liver failure. Clinics in Liver Disease 18: 945-956.
- Lee KC, Stadlbauer V, Jalan R (2016) Extracorporeal liver support devices for listed patients. Liver Transplantation 22: 839-848.
- Zheng Z, Li X, Li Z, Ma X (2013) Artificial and bioartificial liver support systems for acute and acute-on-chronic hepatic failure: A meta-analysis and meta-regression. Experimental and Therapeutic Medicine 6: 929-936.
- Saliba F, Camus C, Durand F, Mathurin P, Letierce A, et al. (2013) Albumin dialysis with a noncell artificial liver support device in patients with acute liver failure: a randomized, controlled trial. Annals of Internal Medicine 159: 522-531.
- He GL, Feng L, Duan CY, Hu X, Zhou CJ, et al. (2015) Meta-analysis of survival with the molecular adsorbent recirculating system for liver failure. International Journal of Clinical and Experimental Medicine 8: 17046.
- Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, et al. (2016) High-volume plasma exchange in patients with acute liver failure: an open randomised controlled trial. Journal of Hepatology 64: 69-78.
- Instituto Nacional de Salud (2018) Criterios de Asignación para Trasplante Hepático en Colombia. Dirección redes en salud pública Subdirección Red Nacional de Trasplantes y Bancos de Sangre Coordinación Red Nacional de Donación y Trasplantes.






