Antecedentes
Se ha identificado un exceso del factor-alfa necrosis tumoral (TNF) como diana terapéutica en la enfermedad de Alzheimer (AD) [1]. Se ha demostrado un exceso de TNF en el líquido cefalorraquídeo (LCR), con concentraciones 25 veces más altas que en los controles, en AD, y podría predecir la progresión de la enfermedad [2].
Etanercept es una proteína recombinante dimérica de fusión que consiste en porciones extracelulares ligandas de dos receptores humanos p75 TNF vinculados con el fragmento Fc del IgG1 humano, que funciona en vivo como potente terapéutico anti-TNF. Recientes informes de una rápida mejoría clínica en pacientes con AD y desordenes relacionados después de la administración periespinal de etanercept (MW = 150,000) sugirieron que etanercept tenía la capacidad de penetrar en el LCR del cerebro con una concentración terapéuticamente efectiva [3,4], una capacidad que recientemente fue demostrada para otro antagonista de citoquina, el receptor antagonista interleukina-1 (IL1-RA) (MW = 17,000) [5].
Para investigar esta posibilidad se conjugó el etanercept con 64Cu, usando un método desarrollado por uno de los autores [6].
64Cu es emisor de positrones. Cuando se ata al etanercept, utilizando el agente quelante (1,4,7,10-tetraazadodecane-N,N’,N”,N”’-ácido tetracético (DOTA), se produce una molécula, 64Cu-DOTA-etanercept, cuya distribución anatómica puede ser puesta en imagen con tomografía de emisión de positrones (PET) [6]. Para examinar la distribución intracraneal de etanercept radio-etiquetado, se efectuó una imagen microPET del cerebro de una rata viva seguida por la administración periférica de 64Cu- DOTA-etanercept.
Métodos
Se condujeron estudios en animales de acuerdo con los protocolos aplicables por el Stanford Animal Care Committee.
Se compró Etanercept (Immmunex, Amgen) en forma de polvo. Se prepare el ácido 64Cu-(1,4,7,10-tetraazadodecano-N,N’,N”,N”’-tetracético (DOTA)-etanercept según descrito previamente [6]. Se inyectaron 150 microlitros de solución de 64Cu-DOTA-etanercept (ca. 1 mCi) sobre la espina cervical de una rata. Sprague-Dawley de 250gr a nivel C 6–7 con una aguja de 30 gauge en una profundidad de 6 mm mientras la rata estaba anestesiada con 2.5% isoflurano inhalado. Luego se colocó la rata cabeza abajo suspendida del rabo durante tres minutos, inmediatamente seguido con una posición horizontal en la cama de un escáner de imágenes microPET (microPET R4 escáner modelo para roedores, Siemens Medical Solutions USA, Inc.) diseñado para escáneres estáticos de 5-minutos; se iniciaba el escáner dos minutos después de poner la rata en la cama del escáner y se efectuó entre cinco y diez minutos después de administrar el etanercept. La rationale para este método de administración periférica es liberar el etanercept en el sistema venoso cerebroespinal como discutido previamente [3,4,7-9]. Se reconstruían las imágenes con un algoritmo máximo de 2-dimensiones de expectación de subgrupos ordenados (OSEM), y no se necesitó corrección para atenuar o corrección del scatter.
Resultados
Las imágenes MicroPET revelaban acumulación de 64Cu-DOTAetanercept dentro de los ventrículos cerebrales lateral y tercero pocos minutos después de la administración periférica perispinal, con una concentración en le plexo choroide y en el LCR sugerido por las imágenes microPET (Figura 1). Estos resultados PET no-invasivos son bastante análogos con los resultados de previos estudio autorradiográficos con [125I] etiquetado TNF, IL-1, y IL1-RA que demostraron una penetración en el LCR dentro de los ventrículos cerebrales en ratones después de la administración periférica de cada una de estas grandes moléculas [10].
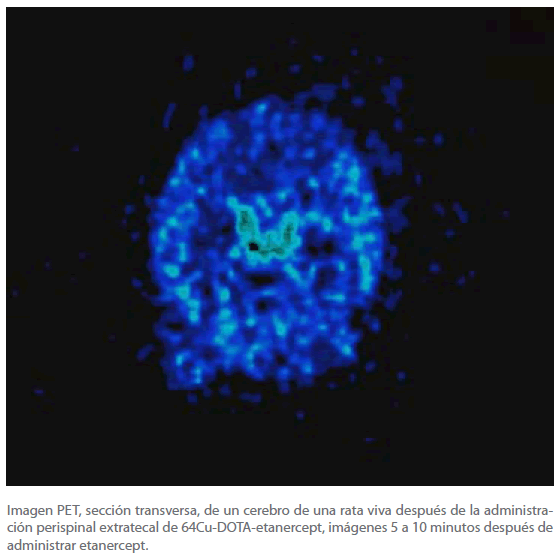
Figura 1: Imagen PET, sección transversa, de un cerebro de una rata viva después de la administración perispinal extratecal de 64Cu-DOTA-etanercept, imágenes 5 a 10 minutos después de administrar etanercept.
El patrono es consistente con la penetración de 64Cu-DOTA-etanercept en el líquido cerebroespinal en los ventrículos lateral y tercero. Noten el realce lineal horizontal en los ventrículos laterales que es sugestivo de la acumulación del trazador en el plexo choroide.
Discusión
La aparente capacidad de etanercept de traspasar la BCSFB y de entrar en el LCR del cerebro demostrado en este experimento sugiere que etanercept se reúne con interleukina 1-RA (IL1- RA), interleukina-1 (IL-1) (MW = 17,000) y TNF (MW = 17,000 como monomero; 51,000 como trimero soluble) como moléculas grandes que penetran en el líquido cerebroespinal del cerebro después de la entrega periférica [5,10,11]. Estos hallazgos pueden tener significativas implicaciones para el tratamiento de ciertos desordenes del cerebro, incluyendo el uso de IL1-RA para el tratamiento de infarto y el uso de etanercept para tratar la enfermedad de Alzheimer [1,3-5,7].
La rápida entrega de etanercept en el LCR dentro de los ventrículos cerebrales después de la entrega periférica fue subsiguientemente confirmada en un experimento separado, más tardío en múltiples ratas, efectuado en la Universidad de British Columbia en Vancouver que empezó varios meses después de haber completado este estudio hecho en Stanford (manuscrito en preparación) [1].
Estos resultados destacan las importantes diferencias funcionales entre la barrera sangre-líquido cerebroespinal (BCSFB) y la barrera sangrecerebro (BBB) [12,13]. La BBB, formada por uniones estrechas entre las células endoteliales de las capilares del cerebro, previene el pasaje de esencialmente todas las moléculas grandes, i.e. las con un peso molecular (MW) mayor que aproximadamente 500 daltons [14].
La BCSFB, formada primariamente por células epiteliales del plexo choroide, aparece ser más permeable con respecto a las moléculas grandes que la BBB [13]. Por esto es verosímil que IL1-RA, IL-1, TNF y etanercept entren en el LCR atravesando la BCSFB vía el plexo choroide [1,10,11]. El no conseguir poner en imagen los ventrículos cerebrales, o con autorradiografía, o con imágenes PET, como en el experimento presente (Figura 1), puede haber llevado, en un estudio [15], a un fallo en la detección de la entrega de las grandes moléculas en el líquido cerebroespinal y en el plexo choroide.
La entrega de etanercept al plexo choroide (CP) puede tener significativas implicaciones fisiológicas. El CP es la fuente de síntesis de numerosas moléculas, incluyendo citoquinas y factores de crecimiento, incluyendo TNF, TGF-alfa, TGF-beta, FGF2 y IGF-II [12,13,16]. Las células epiteliales del plexo choroide se conocen como TNF expreso [17]. Se ha postulado que el CP está centralmente implicado en la patogénesis de AD [12,13,16]. Es posible que cuando el etanercept llegue al CP tenga efectos intrínsicos en la función celular del PC y en la síntesis de citoquinas y del factor de crecimiento. Cuando el Etanercept llega al PC podría tener efectos paracrinos o autocrinos sobre el PC, o podría potencialmente afectar a la parenquima en las regiones cerebrales periventriculares u adicionales por el bulk flow endocrine-like del LCR [12,13]. Adicionalmente, cuando el etanercept llega al PC, el LCR podría tener efectos gliales [1]. La alteración de la modulación glial de la función neuronal mediada por el TNF, empezando dentro del PC, podría potencialmente producir generalizados efectos neuronales y corticales [1,3,4].
El efecto de la entrega intracerebroventricular de cualquier biológico anti-TNF ha sido recientemente examinada en dos modelos experimentales que investigaban los mecanismos de la EA [18,19]. En el primer estudio, la entrega intracerebroventricular de infliximab, un anticuerpo monoclonal anti-TNF, prevenía la inhibición del LCR en las sinapsis hipocampales CA1 causada por la inyección intracerebroventicular de beta-amiloide [18]. En el segundo estudio, la entrega intracerebroventricular de un anticuerpo monoclonal anti-TNF prevenía la nitración de proteínas en el hipocampo y el deterioro de la memoria de reconocimiento en ratones inducida por fragmentos beta-amiloides [19].
Los resultados de estos modelos experimentales adicionales, juntos con la conocida implicación del PC en la síntesis de citoquinas, sugieren que la rápida entrega de 64Cu-DOTA etanercept en el CP puede proporcionar una potencial explicación de la rápida mejoría clínica notada después de la administración periespinal de etanercept en la EA [1,3,4]. Se sabe que el TNF es capaz de producir efectos sinápticos en cuestión de minutos [20].
Se necesitan más investigaciones respecto los mecanismos con los que etanercept entra en los ventrículos cerebrales, presumiblemente al cruzar la BCSFB. Por ahora se desconoce el exacto mecanismo con lo que esto ocurre en el PC. En el PC existe, además de específicos sistemas de transporte saturable para selectas moléculas grandes, también una vía de difusión paracelular menos conocida, que pueden utilizar los solubles hidrofílicos para penetrar en el LCR, difundiendo entre las células epiteliales choroidales, más que a través de ellas [13].
Se ha demostrado que el polisacárido inulina, intravascularmente administrada (MW = 5,500), por ejemplo, llega al LCR mediante esta vía de difusión paracelular a través de la BCSFB en el PC [13,21,22]. Alternativamente es posible que etanercept se trasporta activamente a través del epitelio del PC.
Se podría postular que esto podría ocurrir vía un mecanismo “piggyback”, asociado con la unión de etanercept al TNF, mientras el TNF mismo es activamente trasportado a través del epitelio del PC [10,11]. Este mecanismo “piggyback” podría ser facilitado por la ocurrencia natural de los trimeros de TNF en circulación que presentarían más de un sitio de unión por ligando. Esta especulación requerirá más estudio para que surjan respuestas definitivas. La literatura adicional apoya el argumento que el plexo choroide y las regiones ependimales cercanas pueden ser los puntos de entrada de las macromoléculas en el LCR, particularmente después de la postura con la cabeza hacía abajo. Esta literatura incluye la demostración que la postura con la cabeza hacía abajo, aunque solo sea por cinco minutos, interrumpe la barrera sangre-LCR de los conejos, permitiendo que el azul tripano penetre en el SNC [23]; que las proteínas del plexo choroide estén expresadas/localizadas en la membrana apical mirando de cara al ventrículo y que la producción de LCR choroidal está incrementada, corto después de realizar la postura con la cabeza hacía abajo con la suspensión por las patas traseras en ratas [24]; y que las macromoléculas pueden ganar acceso al cerebro y al LCR por rutas extracelulares (no-BBB) [25]. Anteriormente se había postulado que las macromoléculas, como los anticuerpos dirigidos contra la proteína amiloide y la eritropoietina, pueden ejercer efectos del SNC al pasar al cerebro por las vías extracelulares [25]. Etanercept es altamente potente, y puede tener significativos efectos fisiológicos con bajas concentraciones [26].
Se necesitará más estudio para aclarar si la distribución de etanercept por vías extracelulares, en adición a los efectos en el plexo choroide y en el LCR, contribuye a los efectos fisiológicos observados después de la administración periespinal de etanercept en condiciones como con la enfermedad de Alzheimer. Con respecto a la extrapolación de los resultados del presente experimento en la EA, es necesaria una consideración adicional.
El modelo experimental utilizado en el presente estudio incluía solo animales normales, pero los cambios en la fisiología del PC y la función de barrera pueden acompañar tanto el envejecimiento, como la EA, y estos cambios podrían influenciar más el paso de etanercept a través de la BCSFB [12,13,16,27]. En los estudios clínicos del etanercept periespinal en la EA, se utiliza la postura con la cabeza hacía abajo Trendelenburg seguida por la inyección cervical periespinal, postulando que incremente el acceso de etanercept al plexo choroide vía el sistema cerebrospinal venoso [1,4,9]. Se postula que la postura con la cabeza hacía abajo, al incrementar la presión venosa en el PC, puede tener el potencial de influenciar en el trasporte a través de la BCSFB o a través del ependima o con los órganos circumventriculares al parenquima periventricular cerebral [1,4,23,28].
Recientemente se informó de los efectos de la suspensión por el rabo sobre la ultraestructura ependimal [29]. Se precisa más estudio para confirmar esta hipótesis. El tiempo limitado de las imágenes del cerebro, 10 minutos después de la administración de etanercept en este estudio, no permite una definitiva declaración respecto la entrega parenquimal más tardía.
Estudios futuros revelarán esto. Se sabe que estas sustancias que alcanzan el líquido cefalorraquídeo intraventricular a menudo llegan a las parenquimas periventriculares del cerebro, incluyendo al hipocampo, así la eventual entrega parenquimal no puede ser excluida con estos resultados [12,13,25]. Las macromoléculas que llegan al LCR penetran de forma característica en los parenquima cerebrales periventriculares porque las “gap junctions” entre las paredes de las células ependimales de los ventrículos “pierden”, de allí la popularidad de la entrega intracerebroventricular para pasar tanto la BBB, como la BCSFB [12,13,30]. Alternativamente, es probable que algunos de los efectos fisiológicos del etanercept periespinal son primariamente mediados a nivel del plexo choroide. Se necesitarán más estudios para definir los sitios de acción de etanercept en el cerebro con EA, los efectos de etanercept sobre el plexo choroide en la EA, y de caracterizar la distribución en el parenquimal cerebral de etanercept después de la entrega al LCR.
Abreviaciones
EA: enfermedad de Alzheimer; BBB: barrera sangre-cerebro; BCSFB: barrera sangre-líquido cerebroespinal; PC: plexo choroide; LCR: líquido cefalorraquídeo; DOTA: (ácido 1,4,7,10-tetraazadodecano- N,N’,N”,N”’- tetraacético); FGF2: básico factor de crecimiento fibroblasto2; IGF-II: factor de crecimiento insulin-like II; IL- 1: Interleukina-1; IL-1RA: Interleukina- 1 receptor antagonista; KD: kilodalton; MW: peso molecular; PET: tomografía por emisión de positrones; TGF-alpha: factor alfa de crecimiento trasformador; TGF-beta: factor beta de crecimiento trasformador; TNF: factor-alfa de necrosis tumoral.
Intereses competentes
El autor Edward Tobinick tiene múltiples patentes emitidos y pendientes, asignados a TACT IP LLC, que describen el uso parenteral y periespinal de etanercept para tratar la enfermedad de Alzheimer y otros desordenes neurológicos, incluyendo, pero no limitado a los patentes de los EEUU 6015557, 6177077, 6419934, 6419944, 6537549, 6982089, 7214658 y de Australia 758523. Posee acciones en Amgen, el fabricante de etanercept. Tiene, además patentes pendientes que describen el uso de la administración al sistema venoso cerebroespinal y/o periespinal para entregar otros agentes terapéuticos diagnósticos a cerebro, ojo, espina dorsal y otras estructuras anatómicas. Los otros autores no tienen intereses competentes.
Contribuciones de los autores
Todos los autores leyeron y aprobaron el manuscrito final. ET hizo el borrado del manuscrito, concibió y participó en el diseño del estudio e asistió en la ejecución del estudio animal. KC participó en la ejecución del estudio animal, incluyendo la adquisición y el análisis de las imágenes, y contribuyó al borrador de la versión final del manuscrito. XC desarrolló el método del radio-etiquetaje del etanercept utilizado en el estudio, participó en el diseño del estudio, participó en la ejecución del estudio animal, ejecutó la adquisición y el análisis de las imágenes y participó en el borrador de la versión final del manuscrito.
Información sobre los autores
Edward Tobinick MD es Profesor Clínico Asistente de Medicina en la David Geffen School of Medicine en:
UCLA. Xiaoyuan Chen, Ph.D. es un Profesor Asociado ( Investigación) en el Departamento de Radiología en la Stanford University School of Medicine. Kai Chen, Ph.D. es postdoctorado en el Programa de Imágenes Moleculares en la Stanford University School of Medicine.
Agradecimientos
Patrocinio: Este trabajo fue financiado, en parte, por el National Cancer Institute (NCI R01 CA119053, R21 CA121842, P50 CA114747 y U54 CA119367).
913
References
- Tobinick E: Perispinal etanercept for neuroinflammatory disorders. Drug Discov Today 2009, 14(3–4):168-77.
- Tarkowski E, Andreasen N, Tarkowski A, Blennow K: Intrathecal inflammation precedes development of Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2003, 74(9):1200-5.
- Tobinick EL, Gross H: Rapid cognitive improvement in Alzheimer’s disease following perispinal etanercept administration. J Neuroinflammation 2008, 9(5):2.
- Tobinick EL, Gross H: Rapid improvement in verbal fluency and aphasia following perispinal etanercept in Alzheimer’s disease. BMC Neurol 2008, 21(8):27.
- Clark SR, McMahon CJ, Gueorguieva I, Rowland M, Scarth S, Georgiou R, Tyrrell PJ, Hopkins SJ, Rothwell NJ: Interleukin-1 receptor antagonist penetrates human brain at experimentally therapeutic concentrations. J Cereb Blood Flow Metab 2008, 28(2):387-94.
- Cao Q, Cai W, Li ZB, Chen K, He L, Li HC, Hui M, Chen X: PET imaging of acute and chronic inflammation in living mice. Eur J Nucl Med Mol Imaging 2007, 34(11):1832-42.
- Tobinick E: Perispinal etanercept for treatment of Alzheimer’s Disease. Curr Alzheimer Res 2007, 4(5):550-552.
- Tobinick E, Gross H, Weinberger A, Cohen H: TNF-alpha modulation for treatment of Alzheimer’s disease: a 6-month pilot study. MedGenMed 2006, 8(2):25.
- Tobinick E, Vega CP: The cerebrospinal venous system: anatomy, physiology, and clinical implications. MedGenMed 2006, 8(1):53.
- Maness LM, Banks WA, Zadina JE, Kastin AJ: Selective transport of bloodborne interleukin-1 alpha into the posterior division of the septum of the mouse brain. Brain Res 1995, 700(1–2):83-8.
- Banks WA, Kastin AJ, Broadwell RD: Passage of cytokines across the bloodbrain barrier. Neuroimmunomodulation 1995, 2(4):241-8.
- Johanson CE, Duncan JA 3rd, Klinge PM, Brinker T, Stopa EG, Silverberg GD: Multiplicity of cerebrospinal fluid functions: New challenges in health and disease. Cerebrospinal Fluid Res 2008, 14(5):10.
- Johanson CE, Duncan JA, Stopa EG, Baird A: Enhanced prospects for drug delivery and brain targeting by the choroid plexus- CSF route. Pharm Res 2005, 22(7):1011-37.
- Pardridge WM: The blood-brain barrier: bottleneck in brain drug development. NeuroRx 2005, 2(1):3-14.
- Banks WA, Plotkin SR, Kastin AJ: Permeability of the blood-brain barrier to soluble cytokine receptors. Neuroimmunomodulation 1995, 2(3):161-5.
- Serot JM, Bene MC, Faure GC: Choroid plexus, aging of the brain, and Alzheimer’s disease. Front Biosci 2003, 1(8):s515-21.
- Tarlow MJ, Jenkins R, Comis SD, Osborne MP, Stephens S, Stanley P, Crocker J: Ependymal cells of the choroid plexus express tumour necrosis factor-alpha. Neuropathol Appl Neurobiol 1993, 19(4):324-8.
- Rowan MJ, Klyubin I, Wang Q, Hu NW, Anwyl R: Synaptic memory mechanisms: Alzheimer’s disease amyloid beta-peptideinduced dysfunction. Biochem Soc Trans 2007, 35(Pt 5):1219-23.
- Alkam T, Nitta A, Mizoguchi H, Saito K, Seshima M, Itoh A, Yamada K, Nabeshima T: Restraining tumor necrosis factor-alpha by thalidomide prevents the amyloid beta-induced impairment of recognition memory in mice. Behav Brain Res 2008, 189(1):100-6.
- Youn DH, Wang H, Jeong SJ: Exogenous tumor necrosis factoralpha rapidly alters synaptic and sensory transmission in the adult rat spinal cord dorsal horn. J Neurosci Res 2008, 86(13):2867-75.
- Johanson CE: Permeability and vascularity of the developing brain: cerebellum vs cerebral cortex. Brain Res 1980, 190(1):3-16.
- Murphy VA, Johanson CE: Adrenergic-induced enhancement of brain barrier system permeability to small nonelectrolytes: choroid plexus versus cerebral capillaries. J Cereb Blood Flow Metab 1985, 5(3):401-12.
- Wen TS, Randall DC, Zolman JF: Protein accumulation in cerebrospinal fluid during -90 degrees head-down tilt in rabbit. J Appl Physiol 1994, 77(3):1081-6.
- Masseguin C, Mani-Ponset L, Herbute S, Tixier-Vidal A, Gabrion J: Persistence of tight junctions and changes in apical structures and protein expression in choroid plexus epithelium of rats after short-term head-down tilt. J Neurocytol 2001, 30(5):365-77.
- Banks WA: Are the extracellular [correction of extracelluar] pathways a conduit for the delivery of therapeutics to the brain? Curr Pharm Des 2004, 10(12):1365-70.
- Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP: Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther 2008, 117(2):244-79.
- Hampel H, Kotter HU, Moller HJ: Blood-cerebrospinal fluid barrier dysfunction for high molecular weight proteins in Alzheimer disease and major depression: indication for disease subsets. Alzheimer Dis Assoc Disord 1997, 11(2):78-87.
- Plotkin SR, Banks WA, Kastin AJ: Comparison of saturable transport and extracellular pathways in the passage of interleukin- 1 alpha across the bloodbrain barrier. J Neuroimmunol 1996, 67(1):41-7.
- Sidorenko LA, Krasnov IB, Gulevskaja TS, Morgunov VA: Ultrastructure of ependyma in brain third ventricle of the rats exposed to repeated tail-suspension. Scanning electron microscopical study. J Gravit Physiol 2007, 14(1):P77-8.
- Medeiros R, Prediger RD, Passos GF, Pandolfo P, Duarte FS, Franco JL, Dafre AL, Di Giunta G, Figueiredo CP, Takahashi RN, Campos MM, Calixto JB: Connecting TNF-{alpha} Signaling Pathways to iNOS Expression in a Mouse Model of Alzheimer’s Disease: Relevance for the Behavioral and Synaptic Deficits Induced by Amyloid {beta} Protein. J Neurosci 2007, 27(20):5394-5404.






