Keys words
Pathogenic E. coli, Bacterial adherence, Adherence patterns.
Introducción
La interacción entre las bacterias patógenas y los tejidos del hospedero constituye un evento crucial para la adhesión primaria y la colonización tejido-específica, ya que permite el establecimiento y desarrollo de la mayoría de las enfermedades infecciosas. La adherencia bacteriana ocurre entre moléculas de la superficie bacteriana denominadas adhesinas que, de acuerdo a su estructura, pueden ser clasificadas como fimbriales o no fimbriales; y receptores celulares del hospedero, generalmente compuestos por glicolípidos o glicoproteínas [1,2].
El mecanismo de adherencia más estudiado es el mediado por las fimbrias. Las fimbrias son estructuras bacterianas en forma de varilla constituidas por subunidades proteínicas que contienen carbohidratos en su extremo más distal, a través de las cuales se da el reconocimiento de los receptores del hospedero. Los receptores son moléculas transmembranales que fisiológicamente participan como receptores para factores de crecimiento, hormonas u otros ligandos [2].
La adherencia bacteriana es sólo un paso en el proceso infeccioso, y se considera un prerrequisito para la colonización ya que las bacterias no adherentes son rápidamente eliminadas por mecanismos inespecíficos de defensa del hospedero, tales como el peristaltismo, el movimiento ciliar y el flujo de líquidos, o por el recambio de células del epitelio y de la capa mucosa [1,2].
Escherichia coli patogénica es el agente etiológico de varias infecciones en humanos y en animales [3]. En humanos, E. coli patogénica puede causar enfermedades intestinales o extraintestinales, las primeras asociadas con diarrea [4] y entre las segundas destaca la meningitis del recién nacido [5] y las infecciones de tracto urinario en mujeres [6]. En aves, E. coli patogénica causa la colibacilosis la cual es una enfermedad de importancia económica en la industria avícola por las pérdidas que ocasiona debido a la morbilidad y mortalidad; la colibacilosis aviar puede ocasionar múltiples síndromes [7-9].
Las cepas de E. coli patogénica de diferentes hospederos han mostrado tener factores de virulencia en común, tales como los sistemas de secuestro de hierro (aerobactina y genes iro), hemolisinas, cápsula (K1, K5), la proteína IbeA y el autotransportador Tsh, al cual, entre otras funciones, se le atribuye una actividad proteasa para la IgA. Asimismo, estas cepas expresan en común varias adhesinas implicadas en la unión bacteriana a epitelios, entre ellas, la fimbria tipo 1, la fimbria P y la fimbria S y curli [10-13].
Como se señaló anteriormente, el proceso de adherencia es fundamental en el desarrollo de la mayoría de las infecciones ocasionadas por E. coli y las investigaciones encaminadas a analizar este evento incluyen estudios in vitro utilizando cultivos de líneas celulares. Inicialmente, en E. coli patogénica intestinal de humanos se reportaron tres patrones morfológicos de adherencia in vitro a células epiteliales: adherencia localizada, adherencia difusa y adherencia agregativa [4].
La adherencia localizada se caracteriza por la formación de microcolonias bacterianas sobre áreas restringidas de la superficie celular la adherencia difusa se observa como la unión de bacterias sobre toda la superficie de la célula, mientras que el patrón de adherencia agregativa se caracteriza por la unión de las bacterias a las células en una forma apilada. De hecho, esta última se ha descrito como un “apilamiento de ladrillos”, el cual está dado por la unión de bacterias entre célula-célula [4].
Los diferentes patrones de adherencia de E. coli patogénica intestinal de humanos se han relacionado con los procesos patogénicos específicos que ocasionan; por ejemplo, el patrón de adherencia localizada fue detectado inicialmente en E. coli enteropatogénica (EPEC), mientras que cepas de E. coli que muestran patrones de adherencia difusa (DAEC), han sido aisladas de heces de infantes con diarrea aguda. Por su parte, E. coli enteroagregativa (EAEC) ha sido asociada a brotes o casos esporádicos de diarrea persistente [14,15]. Además, cada patrón de adherencia se ha correlacionado con ciertas adhesinas; en el caso de cepas de EAEC, la adherencia agregativa es mediada por la fimbria AAF/I y por la fimbria AAF/II [4,16], mientras que en la adherencia localizada participa la fimbria Bfp y la adherencia difusa es atribuida a fimbrias de las familias Dr y K88 [12,15].
Más recientemente se han observado estos patrones de adherencia in vitro en ensayos con aislados de E. coli uropatogénica, siendo la adherencia agregativa la que se presenta más frecuentemente. Sin embargo, los resultados no han sido concluyentes respecto a las adhesinas asociadas a este tipo morfológico de unión bacteriana ya que los aislados no portan los genes de las fimbrias AAF/I y AAF/II que, como se mencionó anteriormente, se asocian a la adherencia agregativa en E. coli patogénica intestinal [17].
En contraparte, existen pocos estudios en relación a los fenotipos de adherencia in vitro de E. coli patogénica aviar (APEC) que ocasiona la colibacilosis aviar. Dias da Silveira et al. [18] reportaron que aislados de APEC se adhirieron a células HeLa y HEp- 2, mostrando un patrón difuso, mientras que La Ragione et al. [19] observaron este mismo patrón de adherencia en células HEp-2, coincidiendo con lo observado por Stehling et al [20].
El presente trabajo tuvo como objetivo determinar los fenotipos de adherencia de un grupo de aislados de APEC en células epiteliales en cultivo y compararlos con lo reportado para E. coli que ocasiona enfermedades en humanos.
Material y métodos
Aislados bacterianos y condiciones de cultivo:
se utilizaron 21 aislados de E. coli patogénica aviar obtenidos de casos clínicos de colibacilosis aviar. Las bacterias se cultivaron en 1 ml de caldo infusión cerebro corazón (CICC) por 24 h a 37°C. Pasado este tiempo se resembraron 150 μl de este cultivo en 5 ml de CICC fresco y se incubaron a 37°C en agitación continúa hasta alcanzar la fase de crecimiento logarítmico. Las bacterias se cosecharon por centrifugación a 6000 g por 10 minutos a 4ºC, se eliminó el sobrenadante y el botón celular se suspendió en buffer de fosfatos (PBS). El inóculo bacteriano se ajustó a 107 ufc/ml.
Línea celular y condiciones de cultivo: se utilizó la línea celular MDCK (ATCC). Las células fueron cultivadas en medio Eagle Modificado por Dulbecco (DMEM) suplementado con 10% de suero fetal bovino, 0.08% de insulina, 100 UI/ml de penicilina y 100 μg/ml de estreptomicina. Los cultivos se mantuvieron a 37°C en una atmósfera de 5% de CO2 y 95% de humedad relativa hasta alcanzar confluencia.
Pases Celulares: células MDCK fueron cultivadas a confluencia en frascos de cultivo de 50 cc, fueron lavadas con solución de Hank, se agregó 3 ml de solución amortiguadora de Earle libre de Ca y Mg y se incubó por 25 minutos a 37ºC. Transcurrido el tiempo, se eliminó la solución de Earle y se agregaron 2 ml de tripsina-verseno al 0.05%. Se incubó por 10 minutos en las mismas condiciones y se procedió a desprender las células agitando el frasco de cultivo. Luego se agregó 3 ml de medio DMEM, se centrifugó a 200 g durante 5 minutos en un tubo cónico de 15 ml y se eliminó el sobrenadante. El botón de células se suspendió en 3 ml de medio DMEM y se realizaron pases celulares a cajas de cultivo de 24 pozos que en el fondo contenían cubreobjetos de vidrio de 15 mm de diámetro previamente esterilizados.
Ensayo de adherencia bacteriana a células epiteliales: las células MDCK fueron sembradas sobre los cubreobjetos de vidrio de 15 mm antes señalados. Los cultivos se ajustaron a una densidad de 105 células/pozo y se incubaron por 18 horas en medio DMEM libre de antibióticos. Pasado este tiempo se eliminó el medio de cultivo de la monocapa, se lavó con solución de Hank, se agregó el inóculo bacteriano conteniendo 107 UFC/ml de cada aislado APEC a analizar y se incubó durante 90 minutos. Luego se eliminó el medio de cultivo y se lavó 3 veces con PBS exhaustivamente usando bomba de vacío para eliminar las bacterias que no se unieron. Posteriormente, las monocapas celulares con las bacterias adheridas se fijaron con metanol absoluto por 15 minutos y se lavaron con agua destilada. Finalmente, se realizó una tinción con Giemsa al 10% durante 25 minutos a temperatura de ambiente. Se realizaron cuatro lavados con agua destilada para eliminar el exceso de colorante y los cubreobjetos se fijaron con resina sobre portaobjetos y fueron observados al microscopio.
Resultados
De los 21 aislados de APEC analizadas, el 76% (16/21) mostró adherencia a las células MDCK, mientras que el 24% (5/21) no se unió a las células (Tabla 1).
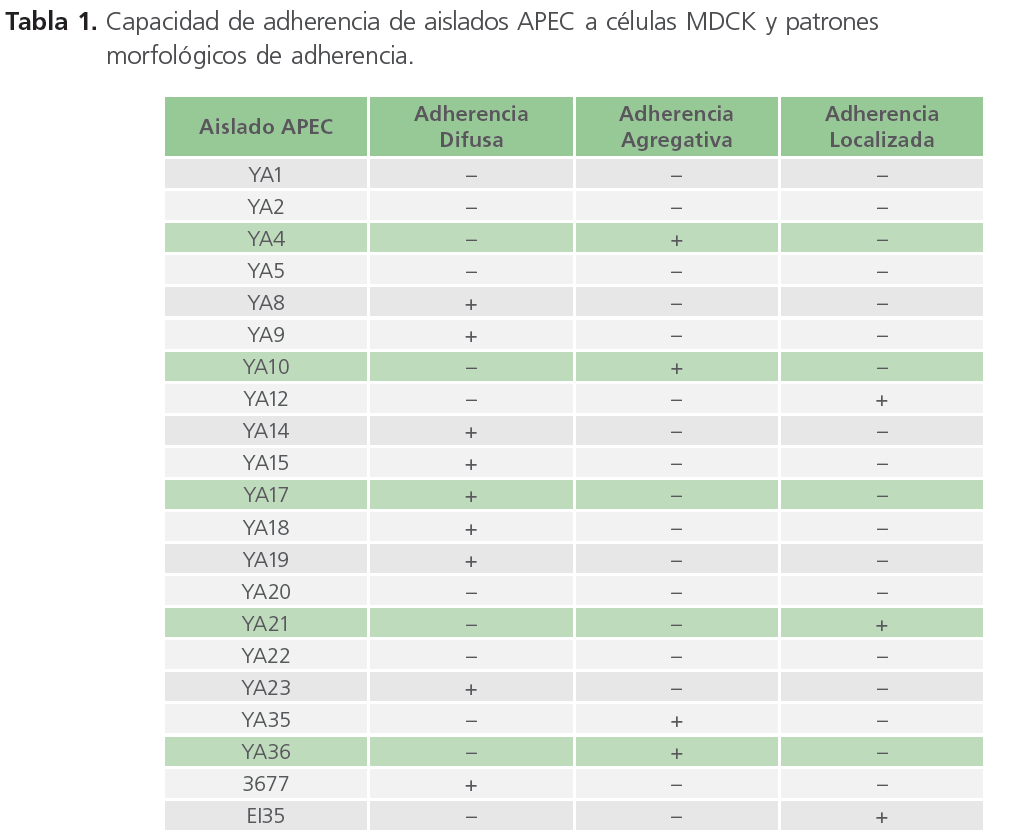
Tabla 1. Capacidad de adherencia de aislados APEC a células MDCK y patrones morfológicos de adherencia.
En los aislados APEC adherentes se observaron los tres patrones de adherencia descritos previamente en E. coli causantes de diarrea en humanos. Nueve aislados mostraron el típico patrón de adherencia difusa en el que las bacterias se pegan sobre toda la superficie celular. Cuatro aislados APEC mostraron una adherencia agregativa mientras que el patrón de adherencia localizada fue observado en tres aislados APEC (Figura 1).
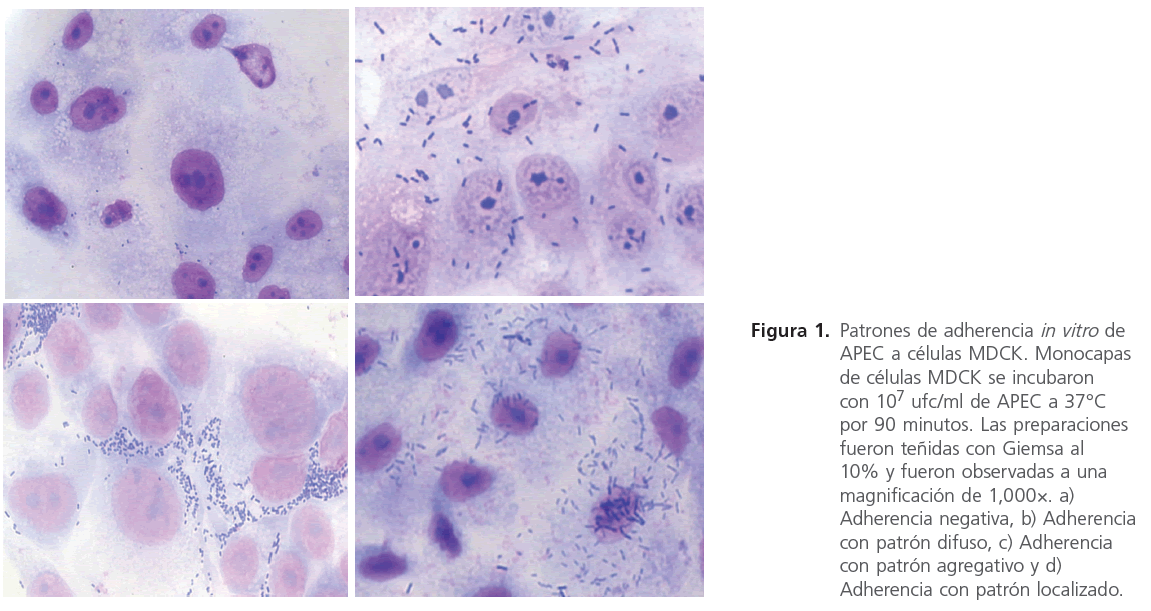
Figura 1. Patrones de adherencia in vitro de APEC a células MDCK. Monocapas de células MDCK se incubaron con 107 ufc/ml de APEC a 37°C por 90 minutos. Las preparaciones fueron teñidas con Giemsa al 10% y fueron observadas a una magnifi cación de 1,000×. a) Adherencia negativa, b) Adherencia con patrón difuso, c) Adherencia con patrón agregativo y d) Adherencia con patrón localizado.
Discusión
La presencia en común de un grupo de genes asociados a la virulencia en APEC y E. coli causantes de enfermedades intestinales y extraintestinales en humanos es indicativo de la relación genética entre las cepas de E. coli patogénica de diferentes hospederos [10-13,21].
Aun cuando se ha reportado la expresión de diferentes tipos de fimbrias, tanto en E. coli patogénica de humanos como en aislados APEC, son pocos los estudios enfocados en la comparación de los tipos morfológicos de adherencia entre cepas de diferente origen. Los resultados de este trabajo demuestran que la mayoría de los aislados APEC tienen la capacidad de unirse in vitro a células epiteliales MCDK cuando se incubaron por un lapso de 90 minutos. Algunos investigadores han establecido periodos de incubación bacteriana en monocapas de células epiteliales in vitro de hasta 6 h, encontrando resultados diferentes a los observados en periodos más cortos [14]; por lo tanto, no se descarta la posibilidad de que los aislados de APEC no adherentes en 90 minutos pueden mostrar esta capacidad al aumentar el tiempo de incubación. Sin embargo, también existe la posibilidad de que la falta de adherencia in vitro sea una característica de dichos aislados, dada la gran heterogeneidad de factores de virulencia que son expresados entre los aislados de APEC.
En relación a los patrones de unión bacteriana, encontramos que el 56.25% de los aislados APEC adherentes (9/16) mostraron un patrón de adherencia difusa, caracterizado por la unión de bacterias individuales sobre toda la superficie de la célula. Estos resultados coinciden con lo encontrado por Stehling et al. quienes reportan este mismo patrón de adherencia en APEC [20] y por Dias da Sirviera et al. quienes observaron que cepas aisladas de aves con colisepticemia, así como las obtenidas de aves con el síndrome de la cabeza hinchada, se unen a células HeLa y HEp-2 mostrando dicho patrón de unión [18]. Puesto que el patrón de adherencia difusa en aislados de APEC se ha asociado con las fimbrias tipo 1 y Stg [9,18,22], existe la posibilidad de que otras adhesinas puedan estar involucradas en este tipo de adhesión.
Por otro lado, los resultados obtenidos en este trabajo revelaron que un 43.75 % (7/16) de los aislados APEC adherentes mostraron patrones de adherencia localizada (3/16) y adherencia agregativa (4/16). Dichos patrones sólo han sido reportados en cepas patogénicas de humanos [4,23], por lo que este es el primer reporte que muestra la capacidad de algunos aislados de APEC para establecer patrones de adherencia similares a los establecidos por cepas de E. coli patogénicas de humanos. Por lo anterior, la búsqueda de estructuras fimbriales involucradas en la adhesión localizada y agregativa de cepas APEC, así como el establecimiento de la relación de estos tipos de adhesión con la virulencia de APEC in vivo, constituyen un aspecto importante en el estudio de los eventos iniciales del proceso patogénico de estas cepas.
Conclusiones
En el presente trabajo el uso de cultivos de células MDCK permitió discriminar entre aislados APEC adherentes y no adherentes a estas células. En los aislados adherentes se observaron los tres patrones de adherencia descritos inicialmente en los diferentes patotipos de E. coli patogénica intestinal en humanos y más recientemente reportados en E. coli uropatogénica. Es importante destacar que en este trabajo se observaron los patrones de la adherencia localizada y de la agregativa, aun cuando la mayoría de los aislados APEC mostraron un patrón de adherencia difuso. Sin duda, un aspecto relevante será dilucidar con mayor claridad qué estructuras bacterianas median esta unión y determinar si este evento de adherencia in vitro se correlaciona con la virulencia de APEC.
900
References
- Pizarro-Cerdá J, Cossart P. Bacterial adhesion and entry into host cells. Cell. 2006;124:715-27.
- Bacterial strategies for evading or surviving host defense systems. In: Wilson B, Salyers A, Whitt D, Winkler M, editors. Bacterial pathogenesis. A molecular approach. 3rd ed. Washington: ASM Press; 2011. p. 193-224.
- Croxen M, Finley B. Molecular mechanisms of Escherichia coli pathogenicity. Nat Rev Microbiol. 2010;8:26-38.
- Nataro J, Deng Y, Maneval D, German A, Martin W, Levine M. Aggregative adherence fimbriae I of enteroaggregative Escherichia coli mediate adherence to HEp-2 cells and hemagglutination of human erythrocytes. Infect Immun. 1992;60:2297-304.
- Johnson J, Oswald E, O’Bryan T, Kuskowski M, Spanjaard L. Phylogenetic distribution of virulence-associated genes among Escherichia coli isolates associated with neonatal bacterial meningitis in the Netherlands. J Infect Dis. 2002;185:774-84.
- Wiles T, Kulesus R, Mulvey M. Origins and virulence mechanisms of uropathogenic Escherichia coli. Exp Mol Pathol. 2008;85:11-9.
- Dho-Moulin M, Fairbrother J. Avian pathogenic Escherichia coli (APEC). Vet Res. 1999;30:299-316.
- Dziva F, Stevens M. Colibacillosis in poultry: unravelling the molecular basis of virulence of avian pathogenic Escherichia coli in their natural hosts. Avian Pathol. 2008;37:355-66.
- La Ragione R, Woodward M. Virulence factors of Escherichia coli serotypes associated with avian colisepticaemia. Res Vet Sci. 2002;73:27-35.
- Moulin-Schouleur M, Schouler C, Tailliez P, Kao M, Bree A, Germon P, et al. Common virulence factors and genetic relationships between O18:K1:H7 Escherichia coli isolates of human and avian origin. J Clin Microbiol. 2006;44:3484-92.
- Rodriguez-Siek K, Giddings C, Doetkott C, Johnson T, Fakhr M, Nolan L. Comparison of Escherichia coli isolates implicated in human urinary tract infection and avian colibacillosis. Microbiology. 2005;151:2097-110.
- Scaletsky I, Michalski J, Torres A, Dulguer M, Kaper J. Identification and characterization of the locus for diffuse adherence, which encodes a novel afimbrial adhesin found in atypical enteropathogenic Escherichia coli. Infect Immun. 2005;73:4753-65.
- Zhao L, Gao S, Huan H, Xu X, Zhu X, Yang W, et al. Comparison of virulence factors and expression of specific genes between uropathogenic Escherichia coli and avian pathogenic E. coli in a murine urinary tract infection model and a chicken challenge model. Microbiology. 2009;155:1634-44.
- Gomes T, Vieira M, Abe C, Rodrigues D, Griffin P, Ramos S. Adherence patterns and adherence-related DNA sequences in Escherichia coli isolates from children with and without diarrhea in São Paulo city, Brazil. J Clin Microbiol. 1998;36:3609-13.
- Laarmann S, Schmidt M. The Escherichia coli AIDA autotransporter adhesin recognizes an integral membrane glycoprotein as receptor. Microbiology. 2003;149:1871-82.
- Czeczulin J, Balepur S, Hicks S, Phillips A, Hall R, Kothary M, et al. Aggregative adherence fimbria II, a second fimbrial antigen mediating aggregative adherence in enteroaggregative Escherichia coli. Infect Immun. 1997;65:4135-45.
- Toval F, Köhler C, Vogel U, Wagenlehner F, Mellmann A, Fruth A, et al. Characterization of Escherichia coli isolates from hospital inpatients or outpatients with urinary tract infection. J Clin Microbiol. 2014;52:407-18.
- Dias da Silveira W, Ferreira A, Brocchi M, Maria de Hollanda L, Pestaña de Castro A, Tatsumi Yamada A, et al. Biological characteristics and pathogenicity of avian Escherichia coli strains. Vet Microbiol. 2002;85:47-53.
- La Ragione R, Cooley W, Woodward M. The role of fimbriae and flagella in the adherence of avian strains of Escherichia coli O78:K80 to tissue culture cells and tracheal and gut explants. J Med Microbiol. 2000;49:327-38.
- Stehling E, Yano T, Brocchi M, Dias da Silveira W. Characterization of a plasmid-encoded adhesin of an avian pathogenic Escherichia coli (APEC) strain isolated from a case of swollen head syndrome (SHS). Vet Microbiol. 2003;95:111-20.
- Johnson T, Wannemuehler Y, Johnson S, Stell A, Doetkott C, Johnson J, et al. Comparison of extraintestinal pathogenic Escherichia coli strains from human and avian sources reveals a mixed subset representing potential zoonotic pathogens. Appl Environ Microbiol. 2008;74:7043-50.
- Lymberopoulos M, Houle S, Daigle F, Léveillé S, Brée A, Moulin- Schouleur M, et al. Characterization of Stg fi mbriae from an avian pathogenic Escherichia coli O78:K80 strain and assessment of their contribution to colonization of the chicken respiratory tract. J Bacteriol. 2006;188:6449-59.
- Scaletsky I, Silva M, Trabulsi L. Distinctive patterns of adherence of enteropathogenic Escherichia coli to HeLa cells. Infect Immun. 1984;45:534-36.







