Palabras clave
Radioterapia, Cáncer de Próstata, Cáncer Vesical, Adulto Mayor, Tamizaje
Keywords
Radiotherapy, Prostate Cancer, Bladder Cancer, Elderly, Screening.
Introducción
En las últimas décadas, el envejecimiento de la población mundial ha adquirido importancia debido a la repercusión de este fenómeno en la dinámica social y económica de las naciones. Un factor adicional a la longevidad de la población es el aumento en la prevalencia de enfermedades degenerativas que incluye en este rubro a las neoplasias. Por otra parte, se sabe que por lo menos la mitad de la población de pacientes con cáncer recibirá radioterapia en alguna fase de su enfermedad y que además de la edad, las características individuales tienen influencia sobre la indicación y dosis de radioterapia a prescribir así como el pronóstico de la enfermedad.
La radioterapia con o sin quimioterapia ha demostrado ser segura y eficaz en una amplia variedad de tumores sólidos. No obstante, la literatura científica es escasa con respecto al empleo de estas modalidades terapéuticas en el adulto mayor debido a que las características de cada población varían, incluyendo desde individuos con un desempeño funcional adecuado hasta sujetos que dependen de un cuidador debido a sus comorbilidades.
Aunque 60% de los pacientes oncológicos en Europa y América tienen más de 65 años de edad [1], este grupo representa tan solo 25% de los sujetos reclutados en ensayos clínicos aleatorizados [2], lo cual explica la carencia de estudios que evalúen la tolerancia al tratamiento y resultados clínicos a largo plazo. Por lo tanto, existe poca información que justifique la toxicidad ocasionada por radioterapia con respecto al beneficio en prolongación de supervivencia global, supervivencia libre de recurrencia y de enfermedad, además de que no se ha establecido aún hasta qué punto las comorbilidades influencian la toxicidad aguda y tardía en estos pacientes.
Uno de los motivos que ocasiona diferencias en el manejo de los pacientes mayores de 65 años con cáncer es el temor a que la fragilidad propia de la edad avanzada se asocia a menor tolerancia al tratamiento. Sin embargo, se ha observado que los pacientes que alcanzan los ochenta años de edad tienen una esperanza de vida adicional en promedio de 7 años para hombres y 9 años para mujeres [3]. Lo anteriormente expuesto permite argumentar que la edad avanzada por sí misma no es justificación para omitir un tratamiento adyuvante, neoadyuvante, radical, paliativo e incluso combinado (p. j. quimioterapia y radioterapia) en un adulto mayor siempre y cuando tenga un desempeño físico y mental adecuados además de la valoración geriátrica correspondiente con respecto a su esperanza de vida.
Criterios de búsqueda y selección de información
Se realizó una búsqueda en PubMed sobre publicaciones en idioma inglés con un límite de edad de 65 años o más. Los términos de MeSH (Medical Subject Headings) utilizados incluyeron: elderly, aged, frail, prostate/bladder cáncer. Se incluyeron estudios aleatorizados controlados, meta-análisis, revisiones sistemáticas, estudios retrospectivos y cohortes desde 1985 a la fecha.
Consideraciones generales
Los principios fundamentales de radioterapia con respecto a la prescripción de dosis, fraccionamiento, volumen a irradiar y combinación con quimioterapia o anticuerpos monoclonales son similares entre jóvenes y adultos mayores. Además, el objetivo de lograr un control loco-regional adecuado con morbilidad tolerable es el mismo para todos los grupos de edad. No obstante, la edad avanzada como factor asociado al comportamiento tumoral, respuesta a tratamiento y tolerancia al mismo tiene importancia para asegurar que los pacientes reciban un tratamiento que logre un balance óptimo entre el control loco-regional y la toxicidad. Otro factor que debe evaluarse es la red de apoyo familiar y presencia de incapacidad física del individuo que en ocasiones puede dificultar su traslado diario al hospital a recibir un curso convencional de radioterapia que generalmente consta de 30-40 sesiones en promedio. La mayoría de los pacientes en este grupo de edad tienen comorbilidades que los predisponen a morir por causas no relacionadas al tumor que padecen, por lo que la radioterapia adyuvante con el objeto de prevenir una futura recurrencia puede no ser de utilidad dado el riesgo de muerte previo a que suceda esta recurrencia [4]. Es por eso que recientemente se han publicado estudios que evalúan la posibilidad de minimizar el tiempo total de tratamiento en esta población.
Aspectos fisiológicos de la vejez
La edad avanzada se asocia con una declinación en el funcionamiento de los órganos y la velocidad con que este proceso ocurre es única para cada individuo. A mayor edad, existe disminución en la masa cerebral [5-7] y los cambios neurológicos relacionados incluyen menor capacidad de reacción a estímulos externos y disminución en la habilidad para aprender información nueva [8-10]. Los cambios cardiovasculares incluyen el endurecimiento de las paredes arteriales con un aumento en la presión sistólica, mientras que la frecuencia cardiaca en reposo se conserva, ocurre una reducción de la frecuencia cardiaca máxima en respuesta al estrés y disminuye la fracción de eyección [11]. Los cambios en la fisiología pulmonar incluyen: Reducción en los volúmenes espiratorio forzado en un segundo (FEV1), capacidad vital y capacidad de difusión [12]. Con el aumento de la edad, ocurre además un cambio en la composición de la masa muscular y masa ósea [13]. Tanto la masa renal como la hepática y su riego sanguíneo se reducen con la edad avanzada, además de que las biopsias hepáticas de adultos mayores han demostrado una reducción en los niveles de citocromo P450 sin alteraciones en las pruebas de funcionamiento hepático [14]. Con respecto al sistema genitourinario, estos cambios no son evidentes en la creatinina sérica y en éste caso la tasa de filtración glomerular proporciona un estimado más preciso de la función renal [15-16]. Aunque la disminución de la tasa de filtración glomerular se estima en 0.75ml/minuto/año, hasta un tercio de los adultos mayores no llega a presentar éste cambio con la edad [17].
Importancia de la valoración geriátrica previa a tratamiento
Los pacientes ancianos representan un porcentaje significativo de la población que padece enfermedades oncológicas, constituyendo un desafío en la toma de decisiones. Esto debido a que las escalas de valoración funcional que tradicionalmente se emplean en oncología como el índice de Karnofsky o el estado funcional del Eastern Cooperative Oncology Group no toman en cuenta condiciones propias de la edad como la fragilidad, el deterioro cognitivo, la depresión y la dependencia en actividades de la vida diaria que predicen una menor tolerancia al tratamiento médico y se asocian a mayor mortalidad. La valoración del paciente con cáncer en la actualidad es multidisciplinario y en el caso de la persona adulta mayor es fundamental que el geriatra forme parte del equipo de oncología. Existen variadas herramientas para ser utilizadas en la valoración, sin embargo ninguna de ellas es diagnóstica y específica sino que brinda un panorama de la condición del paciente que junto con el criterio clínico del geriatra pueden establecer con mayor objetividad los factores de riesgo del paciente y plantear un abordaje con metas ajustadas a la condición del paciente geriátrico [18].
La radioterapia moderna y sus aplicaciones
Recientemente, la oncología geriátrica se ha visto beneficiada por los recursos terapéuticos más precisos contra el cáncer y algoritmos sofisticados que permiten oncólogos radioterápicos el equilibrio biológico entre control tumoral y toxicidad a órganos sanos en esta población [19, 20]. La radioterapia de intensidad modulada (de sus siglas en inglés IMRT) se utiliza ampliamente por la ventaja en la reducción de la toxicidad inherente a los grandes campos de irradiación utilizados en la radioterapia conformacional, además de que proporciona una dosis óptima al tumor y regiones ganglionares (Figura 1). Para los adultos mayores ofrece la posibilidad de otorgar dosis mayores al tumor respetando tejidos sanos [21-23]. Tanto la radioterapia estereotáxica corporal como los esquemas de irradiación hipofraccionados, es decir, técnicas que se aplican en 5 o 6 sesiones con una dosis mayor por sesión con el apoyo de herramientas de precisión milimétrica, son excelentes alternativas para pacientes que requieren paliación de algún síntoma o un tratamiento radical para ciertos tipos de tumores cerebrales, de pulmón, hígado o próstata, además de que son factibles en adultos mayores que enfrentan dificultades para el traslado diario a los centros oncológicos o incluso en aquellos con déficit cognitivo que pudiera impedir su cooperación en los esquemas convencionales de irradiación que se administran diariamente por más de 4 semanas [22-23].
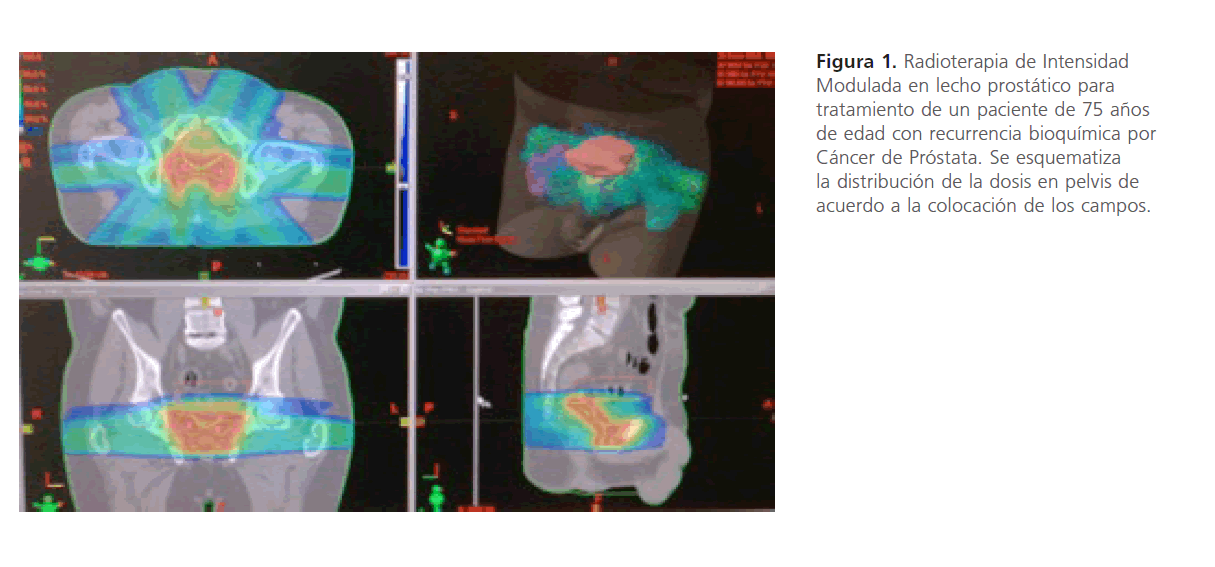
Figura 1: Radioterapia de Intensidad Modulada en lecho prostático para tratamiento de un paciente de 75 años de edad con recurrencia bioquímica por Cáncer de Próstata. Se esquematiza la distribución de la dosis en pelvis de acuerdo a la colocación de los campos.
Radioterapia en el adulto mayor con cáncer de próstata
El cáncer de próstata representa la neoplasia más común en hombres y 70% de los casos se diagnostican en pacientes mayores de 65 años de edad. Tí picamente los pacientes con enfermedad no metastásica se estratifican en tres categorías de riesgo de acuerdo a la determinación de antígeno prostático específico (APE), Clasificación Patológica de Gleason y etapa clínica. En la categoría de bajo riesgo se incluyen a los pacientes con Gleason <6, APE < 10 ng/mL y etapa clínica T1-T2a. La categoría de riesgo intermedio incluye pacientes con Gleason <7, APE 10-20 ng/mL y/o etapa clínica T2b. La categoría de alto riesgo incluye pacientes con Gleason >8, APE >20 ng/mL y/o etapa clínica T2c o mayor (24). Esta agrupación por categorías de riesgo correlaciona fuertemente con los resultados posteriores a un tratamiento local definitivo como prostatectomía radical, radioterapia externa o braquiterapia intersticial.
Efectividad de la radioterapia entre adultos jóvenes y adultos mayores
Con respecto a los resultados de una cohorte de pacientes con cáncer de próstata localizado, la efectividad de la radioterapia externa al compararse con observación, en términos de supervivencia específica para cáncer, ha sido demostrada en adultos mayores [25]. Resultados similares han sido ya publicados por Fiorica et al y Geinitz et al. [26- 27]. En la serie de Fiorica que incluyó 107 pacientes >75 años, no se detectó diferencia significativa para diferentes edades [26]. Geinitz et al reportaron su experiencia con el uso de radioterapia conformal 3D en 80 pacientes >75 años comparados contra 221 pacientes jóvenes tratados durante el mismo periodo (sin diferencias significativas entre las características de los pacientes). En esta serie no aleatorizada, los pacientes mayores tuvieron una supervivencia libre de enfermedad biológica a 4 años mejor que la de los pacientes jóvenes (76% vs 61%, p: 0.042) [27]. La eficacia de la braquiterapia (exclusiva o con radioterapia externa y/o bloqueo androgénico) fue evaluada recientemente en 145 pacientes >75 años de edad (edad promedio de 76 años). Con un seguimiento promedio de 5.8 años tanto la supervivencia causa específica a 9 años, supervivencia libre de progresión bioquímica como las tasas de supervivencia global para la cohorte entera fueron 99.3%, 97.1% y 64.5% respectivamente. La supervivencia global y las muertes no asociadas a cáncer fueron causadas por enfermedades cardiovasculares (22 pacientes) o segundas neoplasias (89 pacientes) [28].
Categoría de bajo riesgo
Los cánceres de próstata clasificados en esta categoría tienen una biología lentamente progresiva con un riesgo de muerte bajo durante los primeros 5 años del diagnóstico [30]. De acuerdo a las guías de la NCCN (National Comprehensive Cancer Network) se considera un tratamiento local definitivo solo para aquellos pacientes con una esperanza de vida al menos de 10 años [31]. Sin embargo, aunque la esperanza de vida puede estimarse de forma precisa en los adultos mayores, es difícil estimar de manera exacta la expectativa de vida en un adulto mayor de manera individual [32]. En una serie de los registros del SEER en Estados Unidos de Norteamérica (Surveillance, Epidemiology, and End Results Program) que comparó el tratamiento (excluyendo bloqueo hormonal) con la vigilancia expectante para pacientes entre 65-80 de edad, existió una diferencia significativa en favor del tratamiento, sin embargo los datos más recientes sugieren que las comorbilidades significativas en pacientes mayores de 75 años de edad son una contraindicación relativa al tratamiento agresivo en los pacientes de bajo riesgo [33]. Cuando por algún motivo se ha elegido a la radioterapia como modalidad de tratamiento, el beneficio del bloqueo androgénico en este grupo de pacientes no está comprobado [34]. Algunos urólogos ahora realizan una “Vigilancia Expectante con Intervención Selectiva Retardada” para la población de adultos mayores con cáncer de próstata de bajo riesgo detectado por tamizaje [35]. La vigilancia expectante con intervención retardada difiere de la vigilancia activa en que los pacientes que se someten a un curso de vigilancia expectante escogen eventualmente cualquier tipo de tratamiento local como manejo paliativo mientras que los pacientes en vigilancia activa escogen retrasar la terapia local hasta que exista evidencia clínica de progresión tumoral. Así, la vigilancia activa típicamente incluye determinación cuatrimestral de APE y examen clínico con biopsia prostática 1-2 años posterior al diagnóstico y de nuevo 5 y 10 años después. El tratamiento local se indica si el tiempo de doblaje del APE disminuye a <3 años, el Gleason resulta ser mayor que los previos o si existe evidencia clínica o patológica que sugiera un aumento en el volumen de la enfermedad [36].
Categorías riesgo intermedio
Existen algunos estudios aleatorizados que permitan guiar las decisiones de tratamiento local para hombres de cualquier edad con cáncer de próstata intermedio. Los datos maduros vienen del estudio número 4 publicado por el Grupo Escandinavo de Cáncer de Próstata que reclutó 699 pacientes con cáncer de próstata de riesgo bajo o intermedio que se aleatorizaron a vigilancia expectante o prostatectomía radical [37]. A 10 años de seguimiento, 15% de los hombres en el grupo de vigilancia expectante habían muerto por cáncer de próstata comparado con 10% de los que habían sido sometidos a prostatectomía radical. Este procedimiento quirúrgico también mejoró significativamente la supervivencia global y disminuyó el riesgo de progresión local y metástasis a distancia. Con respecto a la edad, este estudio solo incluyó hombres menores de 75 años y en el subanálisis, el beneficio de la prostatectomía radical se limitó a pacientes >65 años sugiriendo que este procedimiento puede no ser de beneficio en pacientes entre 65-75 años de edad.
Para este grupo de pacientes, grandes estudios aleatorizados han mostrado que la adición de 4-6 meses de bloqueo androgénico además de radioterapia externa aumenta la supervivencia a 5 años [38-39]. Sin embargo, no se estratificó a los grupos por comorbilidades.
Categoría de riesgo alto
Los pacientes con cáncer de próstata de alto riesgo, aún con enfermedad clínicamente localizada, expe rimentan un riesgo sustancial de muerte por cáncer si éste no se trata. Un estudio poblacional de 767 pacientes con enfermedad confinada a la glándula y que no fueron sometidos a cirugía, radioterapia o tratamiento hormonal al diagnóstico reportó una mortalidad específica por cáncer de próstata para los pacientes con Gleason 8-10 de 40% y 80% a 5 y 10 años respectivamente (40). Como resultado, el tratamiento del cáncer de próstata se recomienda en todos los pacientes con enfermedad de alto riesgo, independientemente de la edad y previa valoración geriátrica con excepción de aquellos con comorbilidades cardiovasculares severas que confieran un riesgo alto de muerte no debida a cáncer. El tratamiento estándar en este tipo de pacientes típicamente incluye hormonoterapia y/o radioterapia.
Hormonoterapia como modalidad única vs hormonoterapia y radioterapia
El estudio número 7 del Grupo Escandinavo de Cáncer de Próstata aleatorizó a una muestra de pacientes a bloqueo androgénico por tiempo indefinido vs bloqueo androgénico con radioterapia concomitante (50Gy a las vesículas seminales y 70Gy a la próstata) [36]. En este estudio la radioterapia confirió una mejoría en la supervivencia de 10% a 10 años, indicando un número necesario a tratar de 10 pacientes. El beneficio de la radioterapia en supervivencia fue mayor durante los primeros 5 y 10 años de seguimiento sugiriendo que el bloqueo androgénico como modalidad única es una alternativa razonable para los pacientes mayores con comorbilidades severas en quienes se prevé una esperanza de vida menor a 5 años.
Radioterapia como modalidad única vs radioterapia más hormonoterapia
La Organización Europea para la Investigación y Tratamiento del Cáncer (EORTC) condujo un estudio clínico aleatorizado (EORTC 22863) en 415 hombres con cáncer de próstata de riesgo alto definido como etapa clínica T3-4 de cualquier grado o etapa clínica T1-2 con Gleason 8-10 [41]. Los pacientes se aleatorizaron a radioterapia sola (50Gy a la pelvis y 70Gy a la próstata) o radioterapia con bloqueo androgénico consistente en un antiandrógeno esteroideo (acetato de ciproterona) por vía oral por 1 mes comenzando una semana previa a la radioterapia además de la inyección subcutánea de un agonista de la hormona liberadora de Gonadotrofina (Acetato de Goserelina) comenzando el primer día de la radioterapia con una duración de 3 años. El seguimiento promedio de este estudio es ahora de 9 años con resultados sólidos que confirman que la adición de terapia antiandrogénica confiere una mejoría de 67% en la supervivencia global a 10 años a diferencia de 40% en pacientes tratados con radioterapia únicamente y 58% en pacientes que reciben hormonoterapia concomitante (NNT=6). La edad promedio de los pacientes incluidos en este estudio fue de 70 años excluyendo a los mayores de 80, este estudio provee evidencia sólida del beneficio de la adición de la hormonoterapia a la radioterapia en adultos menores de 80 años de edad. En un estudio de seguimiento, el EORTC trató de determinar la duración apropiada de la terapia androgénica para los hombres con cáncer de próstata localmente avanzado (EORTC 22961). Este estudio demostró que 6 meses de bloqueo androgénico total eran inferiores a 3 años de la misma con una supervivencia global a 5 años de 80% para el brazo de tratamiento durante 6 meses comparado con 85% de los que recibieron tratamiento por 3 años [42].
Escalamiento de dosis en adultos mayores
Aunque la adición de Terapia Antiandrogénica a la radioterapia externa representa el avance más significativo en el tratamiento del cáncer de próstata, la literatura sugiere que el escalamiento de la dosis de radiación a 75-80Gy confiere una mejoría modesta en la supervivencia libre de recaída bioquímica y puede también prevenir el desarrollo de metástasis a distancia [43-45]. Tres estudios han demostrado una mejoría absoluta en la supervivencia libre de recaída bioquímica del 10-19% con el escalamiento de la dosis. Con respecto a los pacientes de mayor edad, la edad promedio de los sujetos reclutados oscila entre 67-69 años y el estudio multicéntrico alemán adicionalmente estratificó a los pacientes por edad [44].
Toxicidad de la radioterapia pélvica en pacientes con cáncer prostático
Generalmente la radioterapia prostática es bien tolerada, con un riesgo de toxicidad gastrointestinal tardía grado 2 de 5% y genitourinaria de 12% en pacientes tratados con radioterapia de intensidad modulada <80Gy [45]. Debido a que el estudio RTOG 94-13 no demostró un beneficio claro en la supervivencia derivado de la radioterapia pélvica [46], algunos autores recomiendan la omisión de la irradiación de los ganglios pélvicos en adultos mayores, a excepción de aquellos con enfermedad ganglionar comprobada, en un esfuerzo por minimizar la toxicidad intestinal y rectal (Figura 2) [47]. La tolerancia de los adultos mayores a la radioterapia se analizó en una cohorte que incluyó 322 pacientes con un seguimiento de 24 meses (Radioterapia Externa en 289 pacientes y braquiterapia en 33) comparado con un grupo control de 1,353 pacientes menores de 75 años (Radioterapia externa en 941 pacientes y braquiterapia en 412) [48]. No se encontraron diferencias significativas entre los dos grupos tratados con radioterapia externa, sin embargo los pacientes mayores de 75 años de edad experimentaron mayor toxicidad gastrointestinal grado 3 comparado con los pacientes jóvenes en las series de braquiterapia (3% vs 0.2%, p= 0.02). Sin embargo la edad no fue una variable predictiva de toxicidad cuando otros factores fueron controlados en el análisis estadístico.

Figura 2: Distribución de dosis de radiación en un paciente con cáncer prostático localmente avanzado en quien se irradiaron ganglios pélvicos.
Resultados de técnicas modernas de radioterapia para tratamiento de cáncer prostático
Radioterapia de Intensidad Modulada (IMRT). Su beneficio en el tratamiento de los adultos mayores se analizó en pacientes mayores de 75 años de edad en un estudio observacional del programa de registros del SEER que incluyó pacientes con cáncer de próstata no metastásico tratado con IMRT (5,845 pacientes) o radioterapia conformacional en tercera dimensión (6,753 pacientes) [49].
Hipofraccionamiento. Ha probado ser una alternativa al fraccionamiento convencional en pacientes con cáncer de próstata de alto riesgo con porcentajes de toxicidad aguda y tardía similares y una supervivencia libre de recurrencia bioquímica a 3 años de 87% en favor del hipofraccionamiento [50]. Este estudio reclutó pacientes con una edad promedio de 75 años (rango 54-82), por lo que este fraccionamiento es aplicable en adultos mayores. Sin embargo, hasta el momento no existe algún análisis reportado específicamente por grupos de edad.
La Sociedad Internacional de Geriatría Oncológica (SIOG) publicó en el año 2010 las guías de manejo de los adultos mayores con cáncer de próstata localizado y avanzado basándose en una revisión sistemática de la literatura [51]. El consenso menciona que los adultos mayores con cáncer de próstata deben ser manejados de acuerdo a su estado individual de salud dictado por la severidad de sus comorbilidades y no de acuerdo a su edad cronológica. La toma de decisiones en estos pacientes deberá basarse en una evaluación integral de su estado nutricional, comorbilidades, desempeño físico y una intervención geriátrica en caso de detectar a un paciente como “frágil” o “vulnerable”, y dependiendo de esta evaluación clasificar a los pacientes dentro de cuatro grupos pronósticos (Tabla 1).

Tabla 1: Categorías de Pronóstico de los Adultos Mayores de acuerdo a la SIOG [51].
Radioterapia en el adulto mayor con cáncer de vejiga
El cáncer vesical en los adultos mayores constituye un tercio de los tumores en hombres [52]. La elección del manejo multimodal con resección transuretral de vejiga (RTUV), quimioterapia y radioterapia, se prefiere con mayor frecuencia en adultos mayores portadores de comorbilidades significativas. En este contexto, la radioterapia radical se considera como una opción para los pacientes con contraindicaciones mayores para cirugía. La supervivencia a 5 años posterior a cistectomía radical para un paciente con cáncer vesical invasor de músculo es desalentadora con un porcentaje de 40-60% para los pacientes en etapa clínica pT2N0M0 hasta 15% para pacientes con enfermedad pT4. Para los pacientes operados con reporte histopatológico de enfermedad ganglionar suele ser de 6 a 24 meses [53-54].
Tratamiento preservador de órgano
Las estrategias para conservar la vejiga consisten en combinar tres modalidades terapéuticas: Resección transuretral de vejiga (RTUV) + Quimio-radioterapia concomitante. La resección transuretral de las lesiones resecables en vejiga (RTUV) suele seguirse de radioterapia externa con algún agente de quimioterapia. La quimioterapia se utiliza como sensibilizador a la radiación con diferentes fármacos, dosis y esquemas de administración. El cisplatino es el fármaco más utilizado para radiosensibilizar a esta neoplasia y puede administrarse solo o asociado a otros fármacos (p. j. 5-Fluorouracilo). Adicionalmente, puede utilizarse carboplatino en pacientes con alteraciones de la función renal. Los pacientes que logran respuesta completa a la resección transuretral deben completar quimio-radioterapia para consolidar la respuesta. Por el contrario, los pacientes con respuesta parcial o recurrencia posterior al manejo multimodal deben someterse a cistectomía radical. Las técnicas modernas de conservación de vejiga en pacientes debidamente seleccionados pueden lograr un porcentaje de preservación de órgano de hasta 65%, con supervivencia a largo plazo comparable a la de los pacientes tratados con cistectomía radical [54]. No obstante, las complicaciones potenciales relacionadas al tratamiento deben tomarse en cuenta. Las series quirúrgicas publicadas han reportado un incidencia relativamente alta de morbilidad y mortalidad perioperatoria en los adultos mayores que se someten a quimio-radioterapia [55, 56], y los ensayos clínicos sobre tratamiento multimodal han reportado que las toxicidades agudas gastrointestinal y hematológica grado 3 son frecuentes en este grupo de pacientes [57, 58]. En un estudio del 2004, Hollenbeck et al se demostró que la quimioradioterapia, radioterapia o RTUV como modalidades únicas de tratamiento en pacientes mayores de 80 años de edad, redujeron significativamente el riesgo de muerte por cáncer de vejiga cuando se comparó con los pacientes que se sometieron a vigilancia expectante [59].
Toxicidad pélvica por radioterapia en adultos mayores con cáncer vesical
El uso de la terapia multimodal para la preservación de vejiga con intento curativo en adultos mayores es posible y tolerable. El rango de toxicidad aguda reportado en los estudios prospectivos de la literatura es de 0-43% [58]. El análisis interino sobre toxicidades agudas en el análisis de la RTOG reportó que 7% de los pacientes experimentaron toxicidad pélvica tardía grado 3, con 5.7% de toxicidad gastrointestinal y 1.9% de toxicidad genitourinaria. Estas toxicidades aparecieron en los primeros 2 años posteriores al tratamiento y tuvieron una duración promedio de 7 meses sin persistencia posterior de los síntomas [57].
Radioterapia de intensidad modulada en pacientes con cáncer vesical
Los investigadores de la Universidad de Mc Gill, iniciaron un programa multidisciplinario de radioterapia de intensidad modulada en adultos mayores con cáncer de vejiga [59, 60], en donde se observó una mejoría en el número y grado de las toxicidades agudas. En los pacientes tratados con radioterapia de intensidad modulada (IMRT), 79% completaron quimio-radioterapia, la toxicidad hematológica aguda grado 3-4 ocurrió en 13%, y las toxicidades agudas gastrointestinal y genitourinaria grado 3 se reportaron en 4% de los pacientes [61].
Conclusión
La planeación y manejo de la toxicidad por radioterapia en tumores genitourinarios del adulto mayor representa un reto para los oncólogos radioterápicos por la carencia de ensayos clínicos en este grupo de edad. Hasta la fecha, los pacientes mayores de 75 años de edad están subrepresentados o incluso son excluidos de los estudios clínicos por las comorbilidades asociadas y las limitaciones funcionales propias de su edad aun cuando este subgrupo tiene mayor probabilidad de padecer neoplasias. Gracias a los avances de la ciencia moderna se ha logrado un aumento en la esperanza de vida que justifica la generación de evidencia que ayude a la toma de decisiones en el manejo de los adultos mayores.
530
References
- Jemal, A., Bray, F., Center, MM., Ferlay, J., Ward, E., Forman, D. Global cancer statistics. CA Cancer J Clin 2011; 61: 69-90.
- Talarico, L., Chen, G., Pazdur, R. Enrollment of elderly patients in clinical trials for cancer drug registration: a 7 year experience by the US Food and Drug Administration. J Clin Oncol 2004; 22: 4626-4631.
- Lichtman, SM. Management of advanced colorectal cancer in older patients. Oncology 2005; 19: 597-602.
- Wong, ND., Thakral, G., Franklin, S. et al. Preventing heart disease by controlling hypertension: impact of hypertensive subtype, stage, age, and sex. Am Heart J. 2003; 145 (5): 88–- 895.
- Larsson, A., Skoog, I., Aevarsson, A. et al. Regional cerebral blood flow in normal individuals aged 40, and 88 years studied by 99Tc(m)-d, l-HMPAO SPET. Nucl Med Commun. 2001; 22 (7): 74–-746.
- 6-Ito, H., Kanno, I., Ibaraki, M, et al. Effect of aging on cerebral vascular response to Paco2 changes in humans as measured by positron emission tomography. J Cereb Blood FlowMetab. 2002; 22 (8): 99–-1003.
- Meier-Ruge, W., Ulrich, J., Bruhlmann,. et al. Age-related white matter atrophy in the human brain. Ann N Y Acad Sci. 1992; 673: 26–-269.
- Fozard, JL., Vercryssen, M., Reynolds, S. et al. Age differences and changes in reaction time: the Baltimore Longitudinal Study of Aging. J Gerontol. 1994; 49 (4):P17–-189.
- Petersen, RC., Smith, G., Kokmen,. et al. Memory function in normal aging. Neurolog. 1992; 42 (2): 39–-401.
- Small, SA., Stern, Y., Tang,. et al. Selective decline in memory function among healthy elderly. Neurolog. 1999; 52 (7): 139–- 1396.
- Tanaka, H., Monahan, KD., Seals, DR. Age-predicted maximal heart rate revisited. J Am Coll Cardiol. 2001; 37 (1): 15–-156.
- Sawhney, R., Sehl, M., Naeim, A. Physiologic aspects of aging: Impact on cancer management and decision making, part I. Cancer J. 2005; 11 (6): 44–-460.
- Short, KR., Nair, KS. Mechanisms of sarcopenia of aging. J Endocrinol Invest. 1999; 22 (suppl. 5): 9–-105.
- Sotaniemi, EA., Arranto, AJ., Pelkonen,. et al. Age and cytochrome P450-linked drug metabolism in humans: an analysis of 226 subjects with equal histopathologic conditions. Clin Pharmacol Ther. 1997; 61 (3): 33–-339.
- Fehrman-Ekholm, I., Skeppholm, L. Renal function in the elderly _70 years old) measured by means of iohexol clearance, serum creatinine, serum urea and estimated clearance. Scand J Urol Nephrol. 2004; 38 (1): 7–-77.
- Rimon, E., Kagansky, N., Cojocaru,. et al. Can creatinine clearance be accurately predicted by formulae in octogenarian in-patients? Q J Med. 2004; 97 (5): 28–-287.
- Lindeman, RD., Tobin, J., Shock, NW. Longitudinal studies on the rate of decline in renal function with age. J Am Geriatr Soc. 1985; 33 (4): 27–-285.
- Kunkler, IH. Audisio, R., Belkacemi, Y. et al. Review of current best practice and priorities for research in radiation oncology for elderly patients with cancer: the International Society of Geriatric Oncology (SIOG) task force. Annals of Oncolog. 2014; 00: –-13
- Carbone, PP. Advances in the systemic treatment of cancers in the elderly. Crit Rev Oncol Hematol. 2000; 35: 20–-18.
- Zelefsky, MJ., Fuks, Z., Hunt,. et al. High-dose intensity modulated radiation therapy for prostate cancer: early toxicity and biochemical outcome in 772 patients. Int J Radiat Oncol Biol Phys. 2002; 53: 111–-6.
- Chao, KS., Ozyigit, G., Thorsdad, WL. Toxicity profile of intensity-modulated radiation therapy for head and neck carcinoma and potential role of amifostine. Semin Oncol. 2003; 30 (6 Suppl. 18): 10–-8.
- Mell, LK., Mundt, AJ. Radiation therapy in the elderly. Cancer J. 2005; 11: 49–-505.
- Sawaya, R. Considerations in the diagnosis and management of brain metastases. Oncology 2001; 15: 114–-54, 115–-8.
- D’Amico, AV., Whittington, R., Malkowicz, S. et al. Predicting prostate specific antigen outcome preoperatively in the prostate specific antigen era. J Urol. 2001; 166 (6): 218–-2188.
- Abdollah, F., Sun, M., Schmitges, J., Thuret, R., Tian, Z., Shariat, SF., Briganti, A., Jeldres, C., Perrotte, P., Montorsi, F., Karakiewicz, PI. Competing-risks mortality after radiotherapy vs. observation for localized prostate cancer: a population-based study. Int J Radiat Oncol Biol Phys. 2012; 84 (1): 9–-103.
- Fiorica, F., Berretta, M., Colosimo, C., Berretta, S., Ristagno, M., Palmucci, T., Palmucci, S. et al. Safety and efficacy of radiotherapy treatment in elderly patients with localized prostate cancer: a retrospective analysis. Arch Gerontol Geriatr. 2010; 51 (3): 27–- 82.
- Geinitz, H., Zimmermann, FB., Thamm, R., Schumertl, A., Busch, R., Molls, M. 3D conformal radiation therapy for prostate cancer in elderly patients. Radiother Oncol. 2005; 76 (1): 2–-34.
- Merrick, GS., Wallner, KE., Galbreath, RW., Butler, WM., Brammer, SG., Allen, ZA, Adamovich, E. Prostate brachytherapy in men > or =75 years of age. Int J Radiat Oncol Biol Phys. 2008; 72 (2): 41–-20.
- Bill-Axelson, A., Holmberg, L., Ruutu, M, et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med. 2005; 352 (19): 197–-1984.
- Mohler, JL., Armstrong, AJ., Bahnson, R. et al. Prostate cancer, Version 3.2012: Featured updates to the NCCN guidelines. J Natl Compr Canc Netw. 201p; 10 (9): 1081-7.
- McCloskey, SA., Kuettel, MR. Counterpoint: prostate cancer life expectancy ca not be accurately predicted from currently available tools. J Natl Compr Canc Netw. 2007; 5 (7): 70–-713.
- Bill-Axelson, A., Holmberg, L., Ruutu,. et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med. 2005; 352 (19): 197–-1984
- Daskivich, TJ., Chamie, K., Kwan, L. et al. Overtreatment of men with low-risk prostate cancer and significant comorbidity. Cancer 2011; 117: 2058–2066
- Jones, CU., Hunt, D., McGowan, DG. et al. Radiotherapy and short-term deprivation for localized prostate cancer. N Engl J Med 2011; 365: 10–-118.
- Wong, YN., Mitra, N., Hudes,. et al. Survival associated with treatment vs observation of localized prostate cancer in elderly men. J Am Med Assoc. 2006; 296 (22): 268–-2693.
- Klotz, L. Active surveillance for prostate cancer: for whom? J Clin Oncol. 2005; 23 (32): 816–-8169
- Widmark, A., Klepp, O., Solberg,. et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): An open randomised phase III trial. Lancet.2009; 373 (9660): 30–-308.
- Nguyen, PL., Chen, MH., Beard, CJ. et al. Radiation with or without 6 months of androgen suppression therapy in intermediate- and high-risk clinically localized prostate cancer: A postrandomization analysis by risk group. Int J Radiat Oncol Biol Phys 2010; 77: 104–-1052.
- Denham, JW., Steigler,., Lamb, DS. et al. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12: 45–-459.
- Albertsen, PC., Hanley, JA., Fine, J. 20-year outcomes following conservative management of clinically localized prostate cancer. J Am Med Assoc. 2005; 293 (17): 209–-2101.
- Bolla, M., Collette, L., Blank,. et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): A phase III randomised trial. Lance2 2002; 360 (9327): 10–-106.
- Bolla, M., van Tienhoven, G., de Reijke, T. et al. Concomitant and adjuvant androgen deprivation (ADT) with external beam irradiation (RT) for locally advanced prostate cancer: 6 months versus 3 years ADT – results of the randomized EORTC phase III trial 22961 [abstract]. J Clin Oncol. 2007; 25 (suppl. 18): 5238s.
- Kuban, DA., Tucker, SL., Dong,. et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys. 2008; 70 (1): 6–-74.
- Peeters, ST., Heemsbergen, WD., Koper, P. et al. Dose-response in radiotherapy for localized prostate cancer: Results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol. 2006; 24 (13): 199–- 1996.
- Zietman, AL., DeSilvio, ML., Slater, J. et al. Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: A randomized controlled trial. J Am Med Assoc. 2005; 294 (10): 123–-1239.
- Zelefsky, MJ., Levin, EJ., Hunt,. et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys. 2008; 70 (4): 112–-1129.
- Lawton, CA., DeSilvio, M., Roach, M. III, et al. An update of the phase III trial comparing whole pelvic to prostate only radiotherapy and neoadjuvant to adjuvant total androgen suppression: Updated analysis of RTOG 94-13, with emphasis onunexpected hormone/radiation interactions. Int J Radiat Oncol Biol Phys. 2007; 69 (3): 64–-655.
- Liu, M., Pickles, T., Keyes, M., Moravan, V., Agranovich, A., Morris, J. Tolerance of elderly patients (>75 years) to prostate external beam radiotherapy or brachytherapy. Eur J Cancer. 2005; 3: S23–-4.
- Bekelman, JE., Mitra, N., Efstathiou, J., Liao, K., Sunderland, R., Yeboa, DN., Armstrong, K. Outcomes after intensity-modulated versus conformal radiotherapy in older men with non metastatic prostate cancer. Int J Radiat Oncol Biol Phys. 2011; 81 (4): 32–- 34.
- Arcangeli, G., Saracino, B., Gomellini, S., Petrongari, MG., Arcangeli, S., Sentinelli, S., Marzi, S., Landoni, V., Fowler, J., Strigari L. A prospective phase III randomized trial of hypofractionation versus conventional fractionation in patients with high-risk prostate cancer. Int J Radiat Oncol Biol Phys. 2010; 78 (1): 1–-8.
- Droz, JP., Balducci, L., Bolla, M., Emberton, M., Fitzpatrick, JM., Joniau, S., Kattan, MW., Monfardini, Moul, JW., Naeim, A., van Poppel, H., Saad, F., Sternberg, CN. Management of prostate cancer in older men: recommendations of a working group of the International Society of Geriatric Oncology. BJU Int. 2010; 106 (4): 46–-9.
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013, CA Cancer J Clin. 201n; 63 (1): 11-30.
- Huria,iA., Cohen Harvey, J. Practical Geriatric Oncology. Cambridge University Press. 2010.
- Khosravi-Shahi, P., Cabezon-Gutierrez, L. Selective organ preservation in muscle-invasive bladder cancer: Review of the literature. Surg Oncol. 2012; 21: e1–-22.
- Weizer, AZ. Managing muscle-invasive bladder cáncer in the elderly. Expert Rev Anticancer Ther. 201:; 10 (6): 90–-15.
- Froehner, M., Brausi, MA., Herr, HW., Muto, G., Studer, UE. Complications following radical cystectomy for bladder cáncer in the elderly. Eur Urol. 200:; 56 (3): 44–-54.
- Efstathiou, JA., Bae, K., Shipley, WU., Kaufman, DS., Hagan, MP., Heney, N. et al. Late pelvic toxicity after bladder-sparing therapy in patients with invasive bladder cancer: RTOG 89-03, 95-06, 97-06, 99-06. J Clin Oncol 200:; 27 (25): 405–-61
- James, ND., Hussain, SA., Hall, E., Jenkins, P., Tremlett, J., Rawlings,. et al. Radiother- apy with or without chemotherapy in muscle-invasive bladder cancer. N Engl J Med 201:; 366 (16): 147–-88.
- Hollenbeck, BK., Miller, DC., Taub, D., Dunn, RL., Underwood, W. III, Montie, J. et al. Aggressive treatment for bladder cancer is associated with improved over- all survival among patients 80 years old or older. Urolog. 200:; 64 (2): 29–-7.
- Turgeon, GA., Souhami, L., Cury, FL., Faria, SL., Duclos, M., Sturgeon,. et al. Hypofractionated intensity modulated radiation therapy in combined modality treatment for bladder preservation in elderly patients with invasive bladder cancer. Int J Radiat Oncol Biol Phys 201:; 88 (2): 32–-31.
- Turgeon, GA., Souhami, L. Trimodality therapy for bladder preservation in the elderly population with invasive bladder cancer. Frontiers in Oncolog, 201; 4 (206): 1-9.








