Introducción
La capacidad del sistema nervioso de cambiar se le llama plasticidad neuronal, la cual está implicada en el desarrollo embriológico. Sin embargo, en el adulto la plasticidad también tiene un sitial importante para aprender nuevas habilidades, establecer nuevas memorias y responder a las adversidades del medio [1,2]. De hecho, el aprendizaje es el proceso por el cual los organismos modifican su conducta para adaptarse a las condiciones cambiantes del medio que los rodea. Es el modo principal de adaptación de los seres vivos. [3-6] Por lo tanto, el aprendizaje puede considerarse como un cambio en el sistema nervioso que resulta de la experiencia y que origina cambios duraderos en la conducta de los organismos.
El aprendizaje es el proceso por el que adquirimos el conocimiento sobre el mundo, mientras que la memoria es el proceso por el que el conocimiento es codificado, almacenado, consolidado, y posteriormente recuperado. El aprendizaje y la memoria son procesos íntimamente relacionados. No se consigue separar el aprendizaje de la memoria, ni resulta posible realizar dicha distinción dentro del circuito neuronal. [7,8] La medida de lo aprendido se relaciona con la memoria, siendo ésta la expresión de la capacidad de recuperar informaciones adquiridas. [9] Dado que no se producen grandes cambios en el número de neuronas a lo largo de la vida que puedan explicar los elevados volúmenes de información que se almacenan en forma de memoria, la sinapsis ha constituido un buen candidato del sustrato mnemónico. [10,11] La sinapsis constituye el sitio físico que sirve de puente para el paso de información de una neurona a otra, permitiendo que las diferentes partes del sistema interactúen funcionalmente. [12]
Las sinapsis o conexiones interneuronales se han calculado aproximadamente cien trillones en el cerebro. Estas conexiones están agrupadas en serie y en paralelo, en ellas se establecen las bases físicas de velocidad y sutileza de operación del cerebro, y hacen posible las diferentes funciones del sistema nervioso. [13,14] La figura 1 muestra la sinapsis y su complejidad.
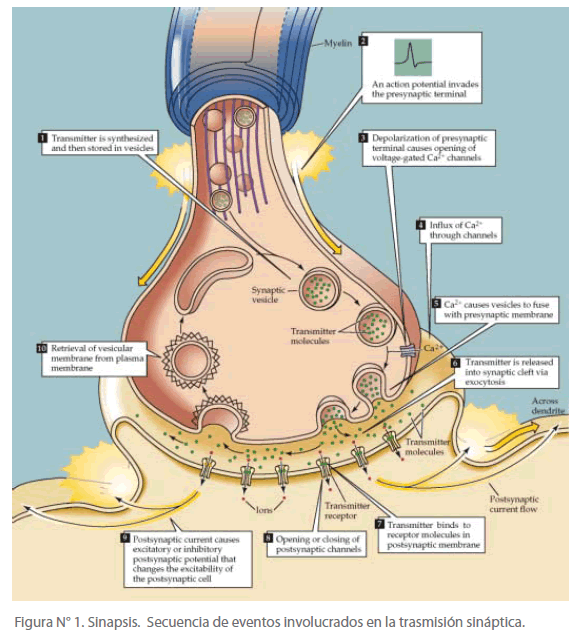
Figura N° 1. Sinapsis. Secuencia de eventos involucrados en la trasmisión sináptica.
Uno de los factores tróficos que hacen posible la estructuración de las uniones interneuronales y el que determina si es en serie o paralelo, la longitud de las fibras que forman el circuito, es el factor de crecimiento neural, el cual fue identificado por primera vez en 1971 por Rita Levi- Montalcini y Viktor Hamburger. [15]
Este estudio tiene como objetivo revisar los diferentes tipos de memoria, aclarar los mecanismos moleculares y celulares básicos implicados en los distintos tipos de memoria, al igual que sus sitios neuroanatómicos implicados.
Memoria
La memoria es un proceso cognitivo relativamente complicado y en consecuencia se presupone que el sistema neuroanatómico subyacente ha de ser complejo. En los últimos años, numerosos estudios en animales de laboratorio con alteraciones mnésicas tras lesiones cerebrales y humanos con alteraciones de la memoria han mejorado la compresión de cómo el cerebro controla el funcionamiento mnésico y el aprendizaje.
Fisiológicamente, los recuerdos se producen por variaciones de la sensibilidad de transmisión sináptica de una neurona a la siguiente. Estas variaciones a su vez generan nuevas vías o vías facilitadas de transmisión de señales por los circuitos neurales del cerebro. Las vías nuevas o facilitadas se llaman huellas de memoria. Son importantes porque una vez establecidas, la mente puede activarlas para reproducir los recuerdos. [16]
Clasificación de memorias
Memoria positiva y negativa
El cerebro es inundado de información sensitiva procedente de nuestros sentidos. Afortunadamente, el cerebro puede desechar la información carente de interés. Esto se debe a la inhibición de las vías sinápticas de esta información, un proceso llamado habituación. A nivel molecular, el mecanismo de la habituación de la terminal sensitiva es consecuencia del cierre progresivo de los canales de calcio de la terminal presináptica.
En cambio el cerebro tiene una capacidad de facilitar y almacenar las huellas de memoria con consecuencias importantes como el dolor o el placer. Ésta es la memoria positiva, resultado de la facilitación o sensibilización de las vías sinápticas. El mecanismo de la facilitación se estudió en el caracol del género Aplysia califórnica en el que actúa una terminal facilitadora sobre la terminal sensitiva. La estimulación de la terminal facilitadora libera serotonina sobre la terminal facilitadora. La serotonina actúa sobre receptores de serotonina a nivel de la membrana terminal sensitiva, los cuales inducen la formación de monofasfato de adenosina cíclico (AMPc). Éste activa una proteína cinasa dependiente de AMPc (PKA) que fosforila una proteína que forma parte de los canales de potasio (K+), bloqueando su conductancia. Esto permite que mayor cantidad de iones de Ca2+ penetre en la terminal sináptica prolongando el potencial de acción.
Otra clasificación es la de memoria a corto y largo plazo, concepto que ya anticipaba Herman Ebbinghausen en 1885, con su experimento en que él mismo memorizaba una lista de sílabas sin sentido. Logró describir las leyes básicas de la memorización, la curva de aprendizaje, y del olvido. [17,18]
Alteraciones físicas (estructurales) de la sinapsis ocurren cuando se desarrollan huellas de la memoria a largo plazo. Las alteraciones estructurales más importantes son:
1. Aumento del número de lugares de liberación de vesículas para la secreción de neurotransmisores.
2. Incremento del número de vesículas del transmisor
3. Aumento del número de terminales sinápticas
4. Modificaciones de las estructuras de las espinas dendríticas
A su vez, la memoria a largo plazo se puede clasificar basándose en el tipo de información, en cómo se almacena y se recuerda dicha información en:
1. Memoria explícita o declarativa,
2. Memoria implícita o procedimental o no declarativa. [19]
La memoria explícita almacena conocimientos, permite recordar acontecimientos, números, hechos, en esencia, el recuerdo de los detalles diversos de un pensamiento integrado, y requiere un esfuerzo consciente. En cambio, la memoria implícita almacena habilidades motoras, se asocia más con actividades motoras del cuerpo, y es inconsciente. [20,21]
Esta diferenciación se puso de manifiesto primero con las lesiones de las áreas de asociación límbicas del lóbulo temporal. El caso más famoso y estudiado fue el paciente H.M., estudiado por Brenda Miller. Este paciente sufría de crisis convulsivas bilaterales del lóbulo temporal durante 10 años rebeldes al tratamiento. Se le extirpó la formación del hipocampo, el núcleo amigdalino, y parte de las áreas de asociación límbicas del lóbulo temporal. Este paciente tenía una memoria a largo plazo normal, pero era incapaz de transformar la nueva memoria en memoria a largo plazo. También se demostró que podía aprender nuevas capacidades motoras a un ritmo normal. [22,23]
La memoria explícita es muy flexible y afecta a la asociación de múltiples fragmentos y trozos de información. Por el contrario, la memoria implícita es más rígida y está estrechamente conectada a las condiciones de los estímulos originales bajo los cuales se produjo el aprendizaje. [23]
Memoria explícita
El psicólogo Endel Tulving fue el primero en clasificar la memoria explícita en:
1. Episódica o autobiográfica para los acontecimientos y la experiencia personal
2. Semántica para los hechos, el conocimiento objetivo, el tipo de conocimiento que adquirimos en el colegio y los libros.
El conocimiento almacenado como memoria explícita se adquiere primero a través del procesamiento en las áreas de asociación prefrontal, límbica, y parietooccipitotemporal de la corteza que sintetizan la información visual, auditiva y somática. Desde allí la información se transporta a las cortezas parahipocámpicas y perirrinal, luego a la corteza entorrinal, la circunvolución dentada, el hipocampo, el subículo y finalmente hacia la corteza entorrinal. Desde aquí la información es devuelta hacia las cortezas del parahipocampo y perirrinal, y finalmente de nuevo a las áreas de asociación de la neocorteza. [24] (Ver figura N° 2)
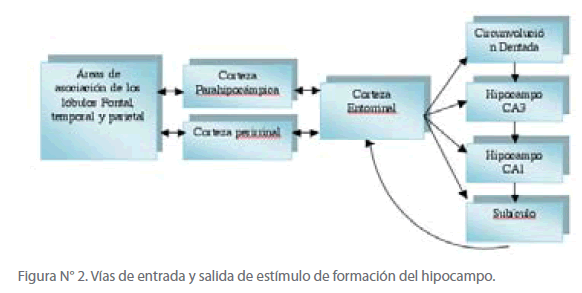
Figura N° 2. Vías de entrada y salida de estímulo de formación del hipocampo.
Así vemos, que en el procesamiento de la información para el almacenamiento de la memoria explícita, la corteza entorrinal tiene una doble función: es la principal fuente de aferencias hacia el hipocampo, y es la principal vía de salida del hipocampo.
Es por tanto comprensible que las alteraciones de la memoria por lesiones de la corteza entorrinal son particularmente graves, como en la enfermedad de Alzheimer, principal enfermedad degenerativa que afecta al almacenamiento en la memoria explícita.
El término hipocampo proviene del griego, que significa hippos = caballo, y kampos = monstruo marino Campe. [25] La siguiente figura muestra la forma del hipocampo, y como viaja la información desde la corteza entorrinal de vuelta a la corteza entorrinal para ir a las áreas de asociación de una forma más esquemática.
Las lesiones del lóbulo temporal medial como en el paciente H.M. interfieren sólo en el almacenamiento a largo plazo de recuerdos nuevos. Esto sugiere que el hipocampo es sólo una estación transitoria en el camino hacia la memoria a largo plazo. El almacenamiento a largo plazo de la memoria explícita tiene lugar en las áreas de asociación de la corteza cerebral que procesan inicialmente la información sensorial. [27] El conocimiento semántico (objetivo) tiene una organización notable y sorprendente. Este conocimiento no se almacena en una región única. Más bien, cada vez que el conocimiento sobre algo es recordado, el recuerdo se construye a partir de diferentes fragmentos diferentes de información, cada uno de los cuales se almacena en lugares especializados de memoria. Este tipo de memoria se almacena de forma distribuida en la neocorteza. [22,28]
En cambio, el conocimiento episódico (autobiográfico) sobre el tiempo y lugar se almacena en las zonas de asociación de los lóbulos frontales.
Memoria implícita
No depende directamente de los procesos conscientes ni su recuerdo requiere la búsqueda consciente de la información. Se construye lentamente, a través de la repetición, y se expresa principalmente en la ejecución, no en las palabras. Ejemplos de la memoria implícita son las capacidades motoras, y el aprendizaje de ciertos procedimientos y reglas. [29]
La memoria implícita puede ser no asociativa y asociativa. En el aprendizaje no asociativo el sujeto aprende sobre las propiedades de un único estímulo. Ejemplos de este tipo de memoria no asociativa son la habituación y la sensibilización, los cuales son los tipos más simple de aprendizaje. [30]
Se han diferenciado también dos tipos de aprendizaje asociativo basados en los procedimientos experimentales utilizados para establecer el aprendizaje. Tradicionalmente, los filósofos han pensado que el aprendizaje se logra a través de la asociación de ideas. De acuerdo con Ivan Pavlov, filósofo ruso, lo que los animales y los hombres aprenden cuando asocian ideas puede ser analizado en su forma más elemental estudiando la asociación de los estímulos. Estableció el condicionamiento clásico, en el que emparejaba un estímulo no condicionado (ENC) seguido de un estímulo condicionado (EC) en reiteradas ocasiones, el cual producía una respuesta refleja o incondicionada, hasta que el EC provocara la misma respuesta refleja, esta vez condicionada. Con la experiencia suficiente, un animal responderá al EC como si estuviera anticipando el ENC. Por ejemplo, si una luz se sigue reiteradamente de la presentación de un trozo de carne en un perro, finalmente la visión de la luz hará que el animal salive. [22,31]
Un segundo modelo fundamental del aprendizaje asociativo, planteado por Edgar Thorndike y estudiado sistemáticamente por B.F. Skinner es el condicionamiento operante, en el cual el animal es adiestrado a ejecutar alguna acción para obtener un reforzador positivo, es decir una recompensa o evitar un castigo. [31] El ejemplo característico es cuando se coloca una paloma hambrienta en una cámara de exploración en la que el animal es recompensado por una acción específica. Por ejemplo, la cámara puede tener una palanca en una de las paredes, la cual presionará ocasionalmente por su aprendizaje previo y su respuesta innata. Sin embargo, aprenderá que cada vez que presione la palanca recibirá un reforzador positivo, y de este modo la presionará más seguida.
Así el condicionamiento clásico se aprende una relación entre dos estímulos, y en el condicionamiento operante se aprende la relación entre la conducta y las consecuencias de dicha conducta. [22]
Diferentes formas de memoria implícita se adquieren a través de diferentes maneras de aprender y afectan a regiones cerebrales distintas. La memoria adquirida a través del temor, que tiene un componente emocional, implica al núcleo amigdalino. La memoria adquirida a través del condicionamiento operante requiere el estriado y el cerebelo. La memoria adquirida a través del condicionamiento clásico, sensibilización y habituación implica reflejos, sistemas sensoriales y motores. (Ver Figura N° 4)
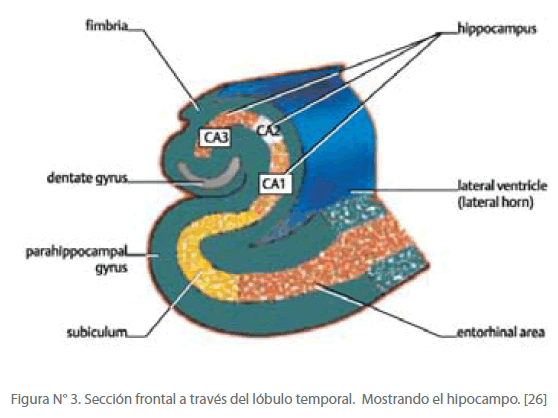
Figura N° 3. Sección frontal a través del lóbulo temporal. Mostrando el hipocampo. [26]
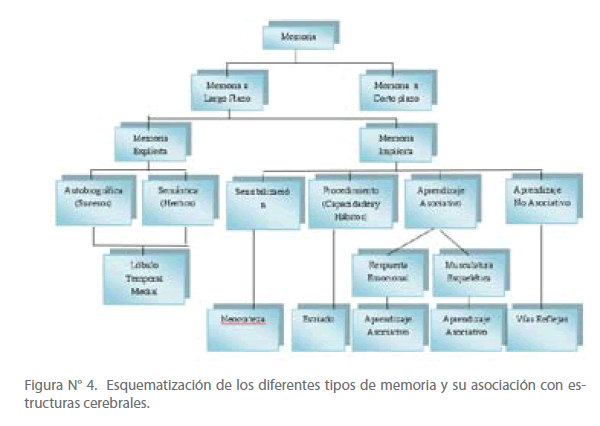
Figura N° 4. Esquematización de los diferentes tipos de memoria y su asociación con estructuras cerebrales.
Mecanismos moleculares del almacenamiento de la memoria
Almacenamiento de la memoria implícita
La experiencia repetida consolida la memoria convirtiendo la forma a corto plazo en la forma a largo plazo. Como hemos mencionado, una única aplicación de serotonina a las neuronas sensitivas de Aplysia, origina una sensibilización a corto plazo. Sin embargo, cinco aplicaciones producen sensibilización a largo plazo, de varios días de duración. El proceso por el cual la memoria a corto plazo se convierte en memoria a largo plazo estable se denomina consolidación.
Aquí intervienen tres procesos: expresión génica, nueva síntesis de proteínas, y crecimiento de conexiones sinápticas. Se ha definido que ocurre una aplicación repetida de serotonina, que activa la subunidad catalítica de PKA, el cual recluta otra cinasa segunda mensajera, la proteincinasa activada por mitógeno (MAPK), una cinasa que frecuentemente se asocia al crecimiento celular. Ambas cinasas son translocadas al núcleo de la neurona sensitiva. Ahí la subunidad catalítica activa un interruptor genético, el CREB-1 (proteína ligadora del elemento de respuesta al AMPc). Este factor de transcripción, cuando es fosforilado, se une a un elemento promotor denominado CRE (elemento de respuesta al AMPc). Por medio de la MAPK, la subunidad catalítica de PKA actúa también de forma indirecta aliviando las acciones inhibidoras de CREB-2, un represor de la transcripción. [22]
La supresión de la acción inhibidora de CREB-2 y la activación de CREB-1 inducen la expresión de dos genes: la enzima ubiquitina hidrolasa que activa el proteosoma para activar PKA persistentemente, y el factor de transcripción C/EBP, uno de los componentes de la cascada génica necesaria para el crecimiento de nuevas unidades sinápticas. [22] (Ver figura N° 5)
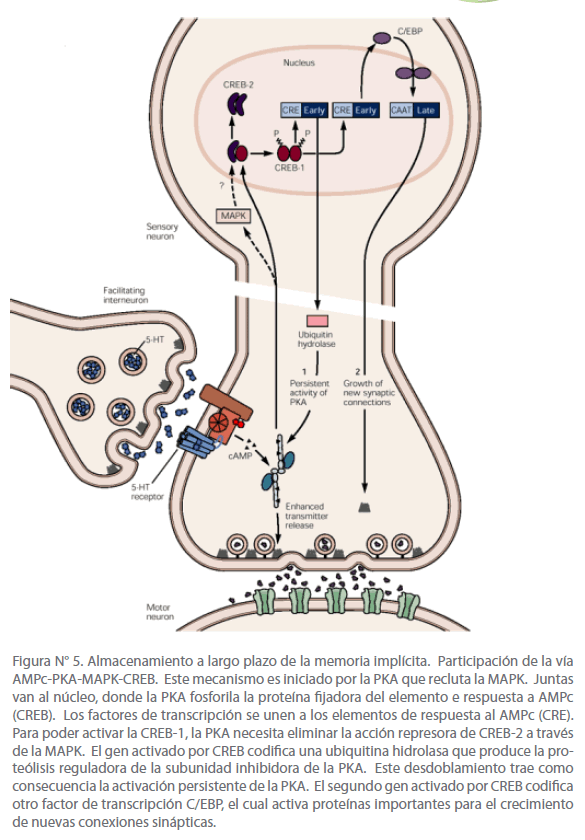
Figura N° 5. Almacenamiento a largo plazo de la memoria implícita. Participación de la vía AMPc-PKA-MAPK-CREB. Este mecanismo es iniciado por la PKA que recluta la MAPK. Juntas van al núcleo, donde la PKA fosforila la proteína fijadora del elemento e respuesta a AMPc (CREB). Los factores de transcripción se unen a los elementos de respuesta al AMPc (CRE). Para poder activar la CREB-1, la PKA necesita eliminar la acción represora de CREB-2 a través de la MAPK. El gen activado por CREB codifica una ubiquitina hidrolasa que produce la proteólisis reguladora de la subunidad inhibidora de la PKA. Este desdoblamiento trae como consecuencia la activación persistente de la PKA. El segundo gen activado por CREB codifica otro factor de transcripción C/EBP, el cual activa proteínas importantes para el crecimiento de nuevas conexiones sinápticas.
Almacenamiento de la memoria explícita
El componente importante del sistema temporal medial para el almacenamiento de la memoria explícita está en el hipocampo o Cuerno de Amón (CA) por la forma en que se representaba a este dios egipcio que se adoraba en la ciudad de Tebas. [32] Se caracteriza por sus grandes célula piramidales. El hipocampo está subdividido en cuatro subregiones: CA1, CA2, CA3, CA4. [33] El hipocampo recibe aferencias por tres vías principales (ver figura N° 6):
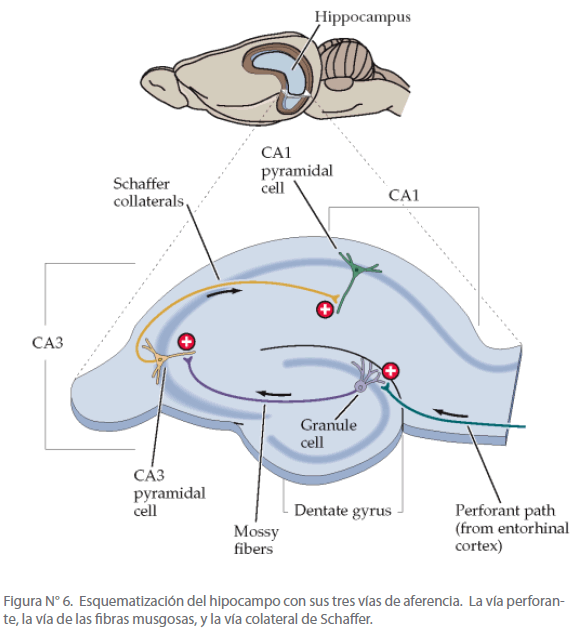
Figura N° 6. Esquematización del hipocampo con sus tres vías de aferencia. La vía perforante, la vía de las fibras musgosas, y la vía colateral de Schaffer.
1. La vía perforante, que se proyecta desde la corteza entorrinal a las células granulosas de la circunvolución dentada
2. La vía de las fibras musgosas, que contiene los axones de las células granulosas y se dirige a las células piramidales de la región CA3 del hipocampo
3. La vía colateral de Schaffer, que consiste en colaterales excitadoras en las células piramidales de la región CA3, termina en las células piramidales de la región CA1. [22]
En 1973, Timothy Bliss, et al descubrieron en estas vías lo que se conoce como potenciación sináptica a largo plazo (Long term potentiation (LTP), por sus siglas en inglés) el cual consiste en un incremento sostenido de la eficacia de la transmisión sináptica tras estimular una vía aferente con estímulos de alta frecuencia. Este fenómeno ha sido estudiado más que todo en la sinapsis entre la vía colateral de Schaffer y las células piramidales CA1. Sin embargo, se ha visto que la LTP ocurre en otras regiones como en la corteza, amígdala, y cerebelo.
La LTP posee las siguientes propiedades: [34]
1. Estado dependiente: la membrana postsináptica debe estar lo suficientemente despolarizada para propiciar la LTP.
2. Cooperatitividad: activación de múltiples entradas a la célula nerviosa.
3. Especificidad: cuando la LTP es inducida por la estimulación de una sinapsis, ésta no va a ocurrir en una sinapsis inactiva que esté en contacto con la misma neurona.
4. Asociatividad: una estimulación débil no desencadena LTP. Sin embargo, si una neurona presináptica es estimulada débilmente al mismo tiempo que la postsináptica, se dará una LTP. Esto constituye la ley de Hebb, en la que hay una activación simultánea de la neurona presináptica y la neurona postsináptica. [35]
Como la LTP es un fenómeno dependiente de la actividad, que posee fases y es específico de las sinapsis activadas, su rápida inducción, asociatividad, y prolongada duración, éste fenómeno se ha impuesto como un modelo sinaptocelular de la memoria a largo plazo. [36-39]
Mecanismo molecular de la LTP
A pesar que el fenómeno de la LTP fue descubierto hace 37 años, sus mecanismos moleculares no eran bien entendidos hasta ahora. Las sinapsis entre las colaterales de Schaffer y las dendritas de las células piramidales de CA1 son glutaminérgicas. La membrana postsináptica de las prolongaciones dendríticas posee tres tipos de receptores glutaminérgicos: el tipo NMDA (N-metil-D-aspartato), no NMDA como AMPA (_-amino-3-hidroxi-5-hidroxi-5-metil-4-isoxazolpropionato), y metabótropo. [40,41]
El receptor canal NMDA es permeable al Ca2+, pero es bloqueado fisiológicamente por Mg2+. Durante la transmisión sináptica de baja frecuencia, el glutamato liberado por las vías colaterales de Schaffer se unen a ambos receptores tanto NMDA como AMPA. Si la neurona postsináptica está en su potencial de membrana de reposo, los canales NMDA serán bloqueados por los iones de Mg2+. Debido a que el bloqueo de los canales de NMDA por el Mg2+ es voltaje-dependiente, la función de la sinapsis cambia drásticamente cuando la membrana postsináptica es despolarizada. Así, condiciones que inducen LTP, como estimulación de alta frecuencia causará una despolarización prolongada que expulsará el Mg2+ de los canales NMDA. Esto permitirá la entrada de Ca2+ y llevará a un incremento en la concentración de Ca2+ dentro de las espinas dendríticas de la neurona postsináptica desencadenando la LTP. (Ver Figura N° 7)
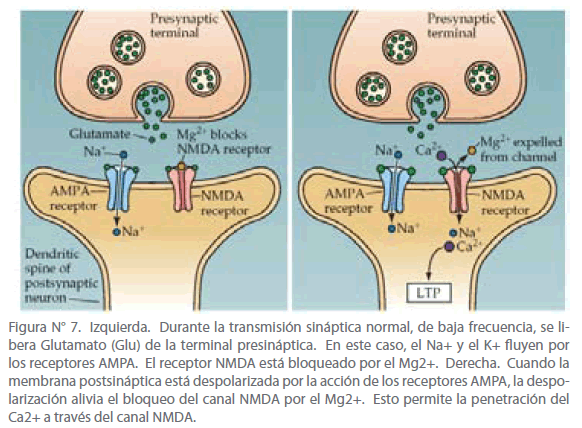
Figura N° 7. Izquierda. Durante la transmisión sináptica normal, de baja frecuencia, se libera Glutamato (Glu) de la terminal presináptica. En este caso, el Na+ y el K+ fluyen por los receptores AMPA. El receptor NMDA está bloqueado por el Mg2+. Derecha. Cuando la membrana postsináptica está despolarizada por la acción de los receptores AMPA, la despolarización alivia el bloqueo del canal NMDA por el Mg2+. Esto permite la penetración del Ca2+ a través del canal NMDA.
La subsiguiente elevación del Ca2+ en la espina dendrítica dispara las cinasas dependientes de calcio: Ca2+/Calmodulina cinasa II (CAMKII), proteincinasa C (PKC), y la tirosincinasa Fyn que juntas inducen LTP. La CAMKII y la PKC fosforila los receptores canales no NMDA (AMPA) y aumenta su sensibilidad al glutamato, activando de este modo algunos canales receptores de otro modo silentes. Estas alteraciones hacen una contribución postsináptica en la expresión y mantenimiento de la LTP. Así vemos como el mantenimiento de la LTP se debe a los receptores AMPA, mientras que la inducción depende en los receptores NMDA. [42] (Ver Figura N° 8)
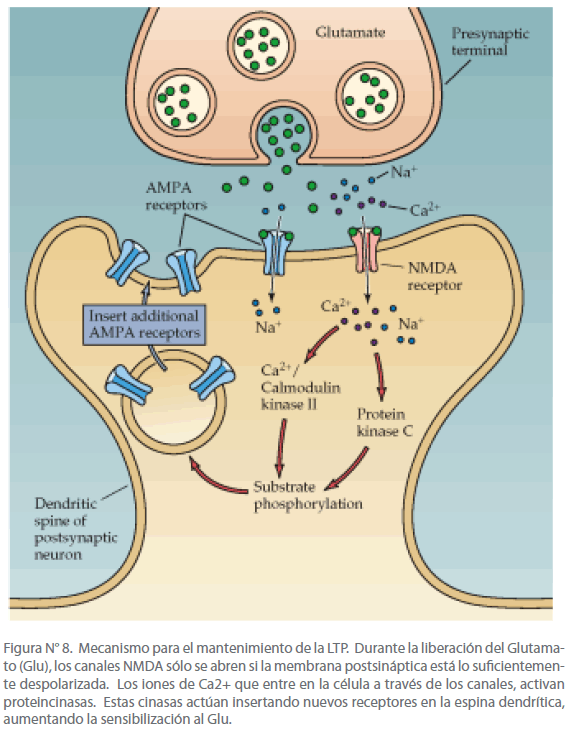
Figura N° 8. Mecanismo para el mantenimiento de la LTP. Durante la liberación del Glutamato (Glu), los canales NMDA sólo se abren si la membrana postsináptica está lo suficientemente despolarizada. Los iones de Ca2+ que entre en la célula a través de los canales, activan proteincinasas. Estas cinasas actúan insertando nuevos receptores en la espina dendrítica, aumentando la sensibilización al Glu.
Posteriormente, la célula presináptica ha de ser informada que se ha inducido la LTP. Se ha postulado que un segundo mensajero activado por el Ca2+ como el óxido nítrico (NO), el cual es un gas fácilmente difundible de una célula a otra, pudiera ser el mensajero retrógrado involucrado en la LTP.
Al igual que el almacenamiento de la memoria la LTP tiene dos fases:
1. LTP temprana o LTP precoz que dura de 1 a 3 horas. No requiere síntesis de nuevas proteínas. [43]
2. LTP tardía que dura más de 4 horas. Requiere síntesis de novo de proteína y ARN. [44-46]
Esta fase tardía recluta la vía de transmisión de señales del AMPc-PKAMAPK- CREB, la cual activa la expresión de un número de genes implicados en la activación persistente de PKA, y en el crecimiento de nuevas zonas de sinapsis. (Ver figura N° 9)
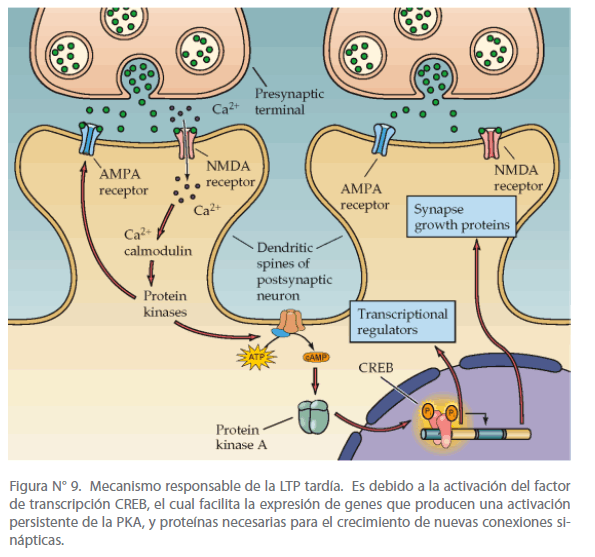
Figura N° 9. Mecanismo responsable de la LTP tardía. Es debido a la activación del factor de transcripción CREB, el cual facilita la expresión de genes que producen una activación persistente de la PKA, y proteínas necesarias para el crecimiento de nuevas conexiones sinápticas.
Conclusiones
En los seres humanos, los mecanismos más importantes a través de los cuales el medio altera la conducta son el aprendizaje y la memoria. Somos lo que somos por lo que aprendemos y lo que recordamos.
El aprendizaje y la memoria son dos procesos íntimamente relacionados, imposibles de separar.
La memoria, el resultado del aprendizaje, no es un proceso simple, tiene por lo menos dos formas. La memoria implícita (no declarativa) es una memoria inconsciente de destrezas perceptivas y motoras. Mientras que la memoria explícita (declarativa) es la memoria de personas, lugares y objetos que requieren una recuperación consciente.
La memoria está constituido por una alianza de diversos sistemas que interactúan sirviendo a diferentes funciones mnésicas que operan mediante circuitos neuroanatómicos y neuronales distintos.
El almacenamiento a largo plazo de la memoria implícita depende de la vía AMPc-PKA-MAPK-CREB, y el almacenamiento de la memoria explícita depende de la potenciación a largo plazo en el hipocampo. Los estudios sobre los mecanismos celulares y moleculares del aprendizaje y la memoria tienen su foco principal en la plasticidad neuronal promovida por la potenciación sináptica a largo plazo.
Los mecanismos neuronales implicados en el aprendizaje, adquisición y consolidación de la memoria no se conocen aún del todo y todavía tenemos mucho por descubrir.
Bibliografia
- Purves D, Agustine G, Fitzpatrick D, et al. Neurosience. 3th ed. Sunderland; Massachusetts. 2004. p. 575.
- Toro C. Neurogénesis, Plasticidad neuronal, Expresión Génica de Adultos en Ambientes Enriquecidos. [Monografía en internet]. [Citado el 24 de enero de 2010]. Disponible en: https://www.biodanza.org/index.php?option=com_content&view=arti cle&id=114%3Aneurogenesis-plasticidad-neuronal-&catid=35%3Abiodanza&Itemid= 1&lang=es
- Morgado I. Psicobiología del aprendizaje y la memoria. Rev Neurol 2005; 40: 289-97.
- Correa M. Neuroanatomía funcional de los aprendizajes implícitos: asociativos, motores y de hábito. Rev Neurol 2007; 44(4): 234-242.
- Cruz-Pérez G, Galeana L. Los fundamentos biológicos del aprendizaje para el diseño y aplicación de objetivos de aprendizaje. [Monografía en Internet] [Citado el 21 de enero de 2010] Disponible en: https://ceupromed.ucol.mx/revista/PdfArt/1/30.pdf
- Rivera-Molina G. Desarrollo neurobiológico del cerebro y sus implicaciones en el aprendizaje. [Monografía en internet]. [Citado el 21 de enero de 2010]. Disponible en: https://74.125.47.132/search?q=cache:8yCAZcV5_rcJ:www.redem.org/boletin/files/ Articulo%2520del%2520Desarrollo%2520Neurologico%2520del%2520Cerebro%252 0y%2520Su%2520Implicancia%2520en%2520el%2520Aprendizaje-1506.doc+gary+r ivera+molina.+Desarrollo+neurobiol%C3%B3gico+del+cerebro&cd=1&hl=es&ct=cln k&gl=es
- Machado S, Portella C, Silva J. Velásquez B, et al. Aprendizaje y memoria implícita: mecanismos y neroplasticidad. Rev Neurol 2008; 46 (9): 543-549.
- Poolton JM, Masters RS, Maxwell JP. The relationship between initial errorless learning conditions and subsequent performance. Hum Mov Sci 2005; 24: 362-78.
- Hummel F, Andres F, Altenmuller E, Dichgans J, Gerloff C. Inhibitory control of acquired motor programmes in the human brain. Brain 2002; 125: 404-20.
- López-Rojas J, Almaguer-Melián W, Bergardo-Rosado JA. La marca sináptica y la huella de la memoria. Rev Neurol 2007; 45 (10): 607-614.
- Fasce E. Bases neurobiológicas del aprendizaje. Boletín de la Academia Chilena N° XLIV 2007. Santiago de Chile; 2008. p. 123-138.
- Kandel ER, Siegelbaum SA. Overview of synaptic transmission. In Kandel ER, Schwartz JH, Jessell TM, eds. Principles of neural science. New York: McGraw-Hill, Health Professions Division; 2000. p. 175-86.
- Canchola-Martínez E. Plasticidad cerebral y aprendizaje. [Monografía en internet]. [Citado el 24 de enero de 2010] Disponible en: https://www.sabersinfin.com/index. php?option=com_content&task=view&id=431&Itemid=46
- Levi-Montalcini R. The nerve-Growth factor. Adv. Biochem. Psychopharmacol 1976; 15: 237-250.
- Shein MK, Rodríguez CA. Rita Levi-Montalcini y la perseverancia en el camino de la ciencia. An Med Asoc Med Hosp ABC 2004; 49 (4): 208-216
- Guyton AC. Tratado de Fisiología Médica. Editorial Mc Graw Hill Interamericana S.A., 10° edición; España, 2001. p. 799-814.
- Cisneros-Corral. Biología del Aprendizaje y la memoria. Anestesia en México. 2005; 17(2): 67-74
- Deus J, Pujol J, Espert R. Memoria y Ganglios Basales: Una Revisión Teórica. Psicología Conductual. 1996; 4(3): 337-361.
- Squire LR. Memory systems. C R Acad Sci III 1998; 321: 153-6.
- Fell J, Fernández G, Klaver P, Axmacher N, Mormann F, Haupt S et al. Rhinalhippocampal coupling during declarative memory formation: dependence on item characteristics. Neurosci Lett 2006; 407: 37-41.
- Hotermans C, Peigneux P, Maertens de Noordhout A, Moonen G, Maquet P. Early boost and slow consolidation in motor skill learning. Learn Mem 2006; 13: 580-3.
- Kandel, ER; Principios de Neurociencias. Editorial Mc Garw Hill Interamericana. 2001; 4 edición. p. 1227-1277.
- Benfenati F. Synaptic Plasticity and the neurobiology of learning and memory. Acta Biomed 2007: 78 (1): 58-66.
- Buffalo EA, Bellgowan PS, Martin A. Distinct roles for medial temporal lobe structures in memory for objects and their locations. Learn Mem 2006; 13: 638-43.
- Hipocampo (anatomía). [Monografía en internet]. Citado el 24 de enero de 2010. Disponible en: https://es.wikipedia.org/wiki/Hipocampo_%28anatom%C3%ADa%29
- Greenstein A. Color Atlas of Neuroscience. Neuroanatomy and Neruophysiology. 1 Edition. New York: Thieme; 2000. p. 319.
- Society for Neuroscience. Brain Facts. Learning and memory. A primer on the Brain and Nervous system. 2008. p. 22.
- Bruce D. Fifty years since Lashley’s. In search of the engram: refutations and conjectures. J Hist Neurosci 2001; 10: 308-18
- Kandel ER, Pittenger C. The past, the future and the biology of memory storage. Philos Trans R Soc Lond B Biol Sci 1999; 354: 2027-52.
- Simons-Weidenmaier NS,Weber M, Plappert CF, Pilz PK, Schmid S. Synaptic depression and short-term habituation are located in the sensory part of the mammalian startle pathway. BMC Neurosci 2006; 7: 38.
- Ganong W. Fisiología Médica. Editorial Manual Moderno, 19° edición; México, 2004. Pág. 295-306.
- Pitti F. El Sistema Límbico. [Disertación]. Panamá, Universidad de Panamá. 2005.
- Okada T, Yamada N, Tsuzuki K, Horikawa HP, Tanaka K, Ozawa S. Long-term potentiation in the hippocampal CA1 area and dentate gyrus plays different roles in spatial learning. Eur J Neurosci 2003; 17: 341-9.
- Popescu AT, Saghyan AA, Pare D. NMDA-dependent facilitation of corticostriatal plasticity by the amygdala. Proc Natl Acad Sci USA 2007; 104: 341-6.
- Casanova-Sotolongo P, Casanova-Carrillo P, Casanova-Carrillo C. La memoria. Introducción al estudio de los trastornos cognitivos en el envejecimiento normal y patológico. Rev Neurol 2004; 38: 469-72.
- Bliss TV, Lomo T. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J Physiol (Lond) 1973; 232: 331-56.
- Bliss TV, Gardner-Medwin AR. Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path. J Physiol (Lond) 1973; 232: 357-74.
- Frey U, Morris RGM. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends Neurosci 1998; 21: 181-8.
- Almaguer-Melián W, Bergado-Rosado JA. Interacciones entre el hipocampo y la amígdala en procesos de plasticidad sináptica. Una clave para entender las relaciones entre motivación y memoria. Rev Neurol 2002; 35: 586-93.
- Lynch MA. Long-term potentiation and memory. Physiol Rev 2004; 84: 87-136.
- Rang HP, Dale MM, Ritter JM, Moore PK. Farmacología. 5 edición. Madrid; España. 2004. p. 463.
- Matynia A, Kushner SA, Silva AJ. Genetic approaches to molecular and cellular cognition: a focus on LTP and learning and memory. Annu Rev Genet 2002; 36: 687- 720.
- Goelet P, Castellucci VF, Schacher S, Kandel ER. The long and the short of long-term memory –a molecular framework. Nature 1986; 322: 419-22.
- Frey U, Krug M, Reymann KG, Matthies H. Anisomycin, an inhibito of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain Res 1988; 452: 57-65.
- Krug M, Lössner B, Ott T. Anisomycin blocks the late phase of longterm potentiation in the dentate gyrus of freely moving rats. Brain Res Bull 1984; 13: 39-42.
- Frey U, Frey S, Schollmeier F, Krug M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. J Physiol 1996; 490: 703-11.
837














