Introducción
La actinomicosis es una enfermedad infecciosa supurativa crónica causada principalmente por un bacilo gram positivo, no esporulado, anaerobio facultativo denominado Actinomyces spp., el cual se encuentra habitualmente en la cavidad bucal, criptas amigdalianas e intestino y que por disrupción mecánica de la membrana mucosa del tracto digestivo y apéndice, penetra el tejido generando el cuadro patológico [1]. Dentro de las diferentes especies de Actinomyces capaces de generar enfermedad, la más importante es Actinomyces israelii; sin embargo, se ha aislado de algunas lesiones A meyeri, A. naeslundii, A odontolyticus, A. viscosus y A. eriksonii [2].
La actinomicosis puede ocurrir en hombres y mujeres de todas las edades con funciones inmunológicas normales; en las mujeres la presentación abdomino-pélvica de origen genital es la más frecuente. La presencia de la bacteria en la vagina se ha asociado con microbiota nativa, migración desde zona perineal o como consecuencia de relaciones sexuales orales y coito anovaginal [3-5].
El principal factor predisponente para la infección en la mujer es el uso del Dispositivo Intrauterino [DIU] que permite el ascenso de la bacteria desde la vagina hasta el endocérvix por medio de sus hilos salientes y que posteriormente, favorecido por el daño sobre la mucosa endometrial debida a una reacción de cuerpo extraño el Actinomyces spp., invade el tejido, donde las bajas concentraciones de oxígeno permiten su crecimiento, de esta forma ejerce su acción con la formación de abscesos, fístulas y tejido fibro-denso con "gránulos de azufre" como signo clásico [1,3].
La Actinomicosis pélvica es poco frecuente, las prevalencias reportadas son variables y dependen del método diagnóstico empleado y el estadio de la infección. Se estima en la población mundial una prevalencia de mujeres infectadas entre 1.6% y 11.6% [1] y en países subdesarrollados de América Latina de 15.2% en usuarias de DIU [3], la prevalencia para este grupo de mujeres varía según el tiempo de uso del dispositivo reportándose cifras de 7%, 19%, 57% y 90% [3,6-8]; siendo el grupo con edad entre 35 y 40 años el que presentan la mayor frecuencia de Actinomicosis genital [6,7,9].
Las manifestaciones clínicas de la enfermedad se presentan en 1 de 4 casos y se caracteriza por leucorrea marrón, oscura y maloliente; menorragia o sangrado anormal, fiebre, dispareunia, patrón de inflamación variable con dolor abdomino-pélvico, pérdida de peso. De no ser diagnosticado a tiempo puede llevar a una enfermedad inflamatoria pélvica, pelvis leñosa, endometritis, abscesos tubo-ováricos, esterilidad y muerte [3,4].
El diagnóstico de la Actinomicosis pélvica suele ser tardío y con alta frecuencia, pos-operatorio, pues pasa desapercibida por los clínicos al ser una “gran imitadora”. La enfermedad invasiva se diagnostica por el estudio patológico de la lesión (fístulas, abscesos, masas) o de endometrio, seguido del cultivo anaerobio por dos semanas, aunque éste es poco sensible (35%) y a menudo polimicrobiano [4]. Otra posibilidad de diagnóstico es a través de técnicas de imagen, aunque suelen confundirse con procesos neoplásicos [1,2]. Para etapas preoperatorias, se han desarrollado técnicas válidas de inmunofluorescencia (IF) con anticuerpos monoclonales anti-Actinomyces, pero la mayoría de los laboratorios no cuentan con ellas entre sus exámenes, lo cual impide su uso de manera rutinaria; por tal motivo se ha considerado a la citología un método de gran utilidad para su diagnóstico al reconocerse su papel para la detección de infecciones cervicovaginales y al ser un examen de rutina, aceptado por la mayoría de las mujeres, lo que garantizaría una mayor cobertura [10,11].
El desempeño de la citología cervicouterina o Papanicolaou (Pap) en la detección de Actinomicosis preoperatoria se ha descrito desde 1976 con una sensibilidad del 44% en mujeres sintomáticas [6]; sin embargo en mujeres asintomáticas, la presencia de este microorganismo en las muestra de Papanicolaou (Pap) solo hacen referencia a la colonización, más no permiten asegurar que se trate como tal de una enfermedad en proceso. La colonización genital por microorganismos tipo actinomyces (ALOs), en Pap de usuarias del DIU se detecta con una sensibilidad (8-98%) y especificidad (50-98%).
En el estudio citológico coloreado por Papanicolaou, se observan agregados basófilos en forma de filamentos radiados, con gran infiltrado leucocitario [12-15].
Este hallazgo en muestras citológicas cervicales se ha ligado a procesos inflamatorios que pueden envolver simultáneamente otras infecciones tales como Cándida, Vaginosis bacteriana y Tricomonas vaginales, probablemente asociadas también al uso del DIU [14] y probablemente a la asociación de las co-infecciones con actinomyces. Los pocos estudios al respecto han reportado una prevalencia del 15%, con mayor frecuencia la dupla ALOs – Vaginosis bacteriana (6.3%) y ALOs – Cándida spp (6.3%), ambos con gran asociación al uso del DIU. Específicamente la asociación a vaginosis se debe al hecho de compartir requerimientos de bajas concentraciones de oxígeno para su sobrevivencia, proliferación y acción en el medio genital [6,14,16].
En Colombia y concretamente en Medellín, se desconoce la prevalencia de ALOs, a partir de un estudio poblacional, la presente investigación permitirá obtener tasas de la colonización cervical por este microorganismo y sus factores asociados, poniendo de manifiesto la relevancia de la epidemiologia descriptiva como vía expedita para generar hipótesis sobre la ocurrencia y distribución de la infección, y para orientar acciones de salud colectiva posteriores.
El objetivo de este estudio fue determinar la prevalencia de ALOs, en mujeres atendidas en un programa de tamización de cáncer cérvicouterino de Medellín y su distribución según grupo etario, uso del Dispositivo Intra-Uterino (DIU), sintomatología y presencia de co-infecciones, 2010-2012.
Materiales y Metodos
Tipo de estudio
Descriptivo transversal.
Población de estudio
Mujeres que cumplieron los criterios de inclusión de ser residentes de Medellín, de cualquier edad, que participan del programa de detección y prevención del cáncer cervicouterino y que se realizaron la citología cérvico uterina entre enero de 2010 y diciembre de 2012. Criterios de exclusión: la presencia de datos incompletos y muestras insatisfactorias por ausencia de células, exceso de eritrocitos o leucocitos, y extendido defectuoso. En total, la población de este estudio estuvo conformada por 206.035 mujeres.
Recolección de la información
se utilizó fuente de información secundaria que correspondió a la base de datos de la Institución Prestadora de Servicios de Salud en la que se registran los datos sociodemográficos, clínicos y los hallazgos microbiológicos y oncológicos del Pap de mujeres atendidas en 50 centros de salud. Se obtuvieron variables como: edad, sector de residencia, método de planificación, sintomatología, presencia de coinfecciones (Cándida spp., Vaginosis bacteriana, Trichomonas spp.) y presencia de ALOs. Los reportes del Pap se realizaron conforme el sistema Bethesda 2001. Para el control de sesgos de información en la evaluación citológica los exámenes de laboratorio se realizaron por personal altamente entrenado (con experiencia laboral mínima de tres años en el área) y bajo altos estándares de calidad (el laboratorio cuenta con control de calidad interno y externo). En la extracción de la información se hizo doble digitación para todas las variables del estudio registradas en un mes corroborando la reproducibilidad de esta fase; en el análisis, se realizó verificación por rangos, es decir, que cada variable no presentase códigos fuera del límite propuesto en la base de datos y para la edad que no presentase valores incompatibles (15).
Análisis estadístico
para la descripción de la población se utilizaron frecuencias absolutas y relativas, para la edad se calcularon medidas de resumen. Se determinó la prevalencia global de infección y las prevalencias específicas según grupo etario, sector de residencia, método de planificación, sintomatología, y co-infecciones. La comparación de la presencia de ALOs., con las variables independientes se realizó mediante la prueba chi cuadrado de Pearson, con excepción de las co-infecciones que se hizo mediante la Prueba Z (dado el cumplimiento del teorema de aproximación a la distribución normal: np≥5); mientras que la comparación de las prevalencias específicas se hizo mediante razones de prevalencia con su intervalo de confianza del 95% tomando como categoría de referencia aquella que presentó la menor ocurrencia de la infección. La edad del grupo de infectados y no infectados se comparó con la prueba t Student. La modificación del efecto se determinó mediante modelos de regresión logística binaria, en este caso se identificaron posibles variables de confusión dado el cumplimiento de las siguientes condiciones: i) se halló asociación de las variables independientes con la infección por ALOs, ii) se halló asociación entre las variables independientes y iii) entres las variables independientes no existían pasos intermedios en el horizonte causal. La bondad de ajuste del modelo se determinó mediante el estadístico de Hosmer-Lemeshow y se tomaron como variables independientes aquellas con valores p menores a 0.05 en el análisis bivariado. Se tomó un nivel de significación estadística de 0.05.
Aspectos éticos
Esta investigación se clasifica como un estudio sin riesgo se acuerdo a la Resolución 8430 de 1993 del Ministerio de Salud de Colombia, además se respetaron los principios de la Declaración de Helsinki.
Resultados
La edad media fue 37 años ± 14.5, con rango intercuartil de 24 a 48 y rango entre 10 y 98. La distribución porcentual de las muestras analizadas en los tres años de estudios fue similar, 33.7% (n=69361) en 2010, 33.4% (n=68735) en 2011 y 33.0% (n=67939) en 2012.
El grupo etario más frecuente fue el de adultos jóvenes (20-44 años) con 56.6% (n=116.664), seguido de adultos medios (45- 64 años) con 28.7% (n=59.165) y adolescentes (10-19 años) con 10.9% (n=22418); las mujeres mayores de 64 años representaron el 3.7% de la población (n=7719). Referente al sector de residencia, el 33% (n=67935) no reportó el sector, el que registró la mayor proporción de personas fue Manrique con el 9.8% (n=20094) y la menor correspondió a San Antonio de Prado con el 3.0% (n=6160). Los métodos de planificación más utilizados fueron tubectomía con 24.7% (n=50893), hormonal 20.2% (n=41560) y DIU 6.1% (n=12545) El 41.8% (n=86184) no utiliza métodos de planificación (Figura 1).
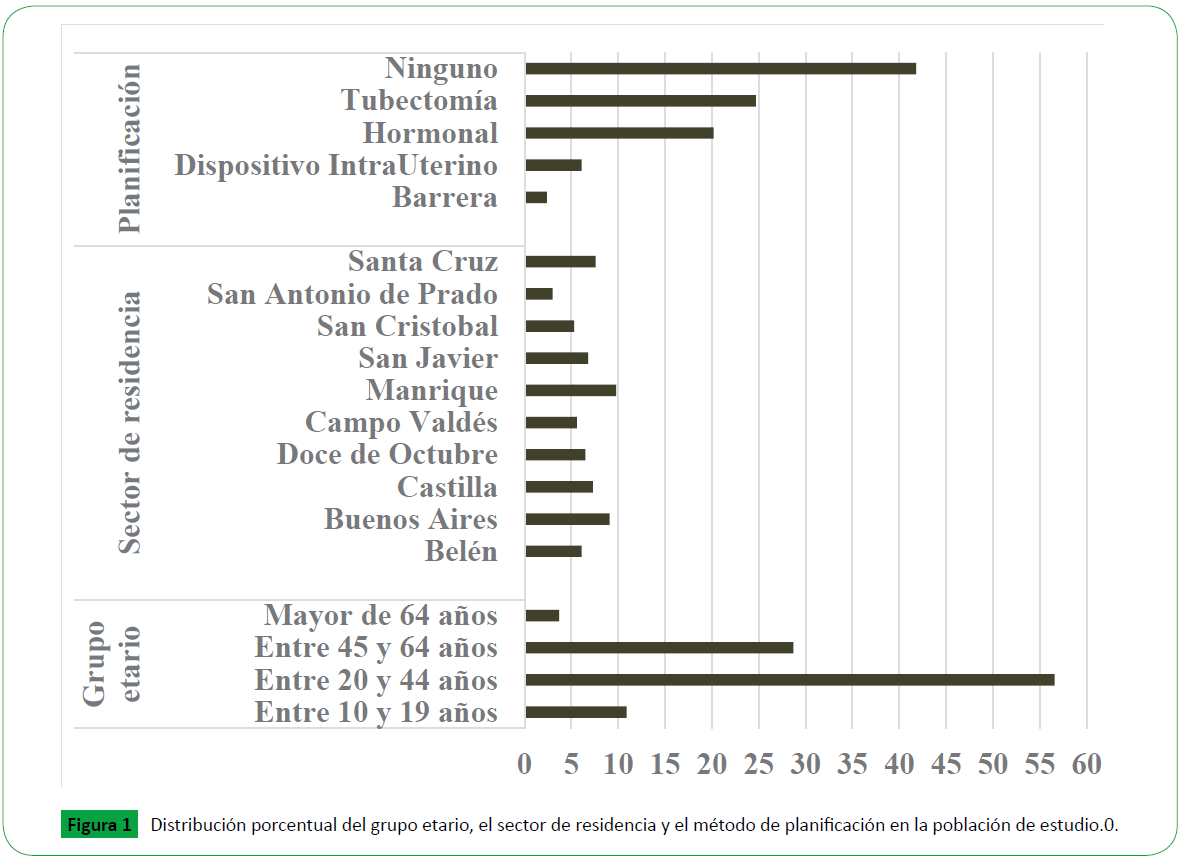
Figura 1: Distribución porcentual del grupo etario, el sector de residencia y el método de planificación en la población de estudio.0.
La prevalencia global de otras infecciones fue 31.2% (n=64.272), 37.063 con Vaginosis bacteriana, 17.218 Gardnerella vaginalis, 9.749 Cándida spp., y 1.713 Trichomonas vaginalis. La prevalencia de ALOs., fue 0.6% (n=1205).
En la sintomatología los hallazgos más frecuentes fueron la presencia de flujo vaginal: 39.9% (n=75829), ardor 20.6% (n=39852), prurito 19.5% (n=40041) y dolor pélvico 18.4% (n=35302) (Figura 2) y los de menor prevalencia fueron dispareunia con 0.2% (n=349) y amenorrea con 0.1% (n=97).
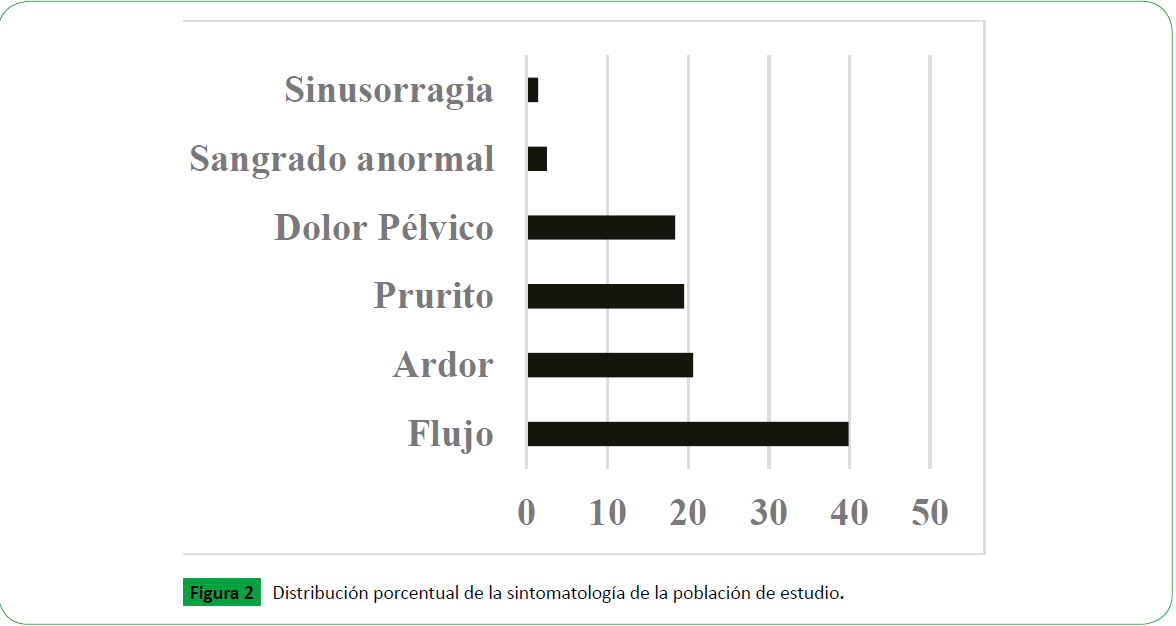
Figura 2: Distribución porcentual de la sintomatología de la población de estudio.
La presencia de ALOs presentó asociación estadística con el grupo etario, el sector de residencia, el método de planificación (Valor p Chi cuadrado=0.000) y la presencia de co-infecciones, flujo vaginal, sangrado anormal y sinusorragia (Valor p Prueba Z=0.000). La edad promedio en el grupo de infectadas (34.0 ± 1.4) fue estadísticamente diferente del grupo de mujeres sin la infección (37.1 ± 14.6) (t Student Valor p=0.000).
La mayor prevalencia de la infección se halló en mujeres entre 20 y 44 años (0.8%), de San Cristóbal (0.8%), coinfectadas (1.2%), con sangrado anormal (1.0%), sinusorragia (1.4%) y usuarias del DIU (8.9%). La prevalencia en el grupo etario entre 20-44 años fue 7 veces mayor frente a las mayores de 64 años. En quienes utilizan el DIU la prevalencia de ALOs fue 212 veces mayor que en las mujeres que no utilizan ningún método de planificación, y las coinfectadas fue 3 veces mayor en comparación con las mujeres sin co-infecciones (Tabla 1).
| Grupo Etario |
N |
ALOs% (N) |
RP (IC 95%) |
| Adulto mayor (>64) |
7.719 |
0.1 (8) |
1.00 |
| Adolescente (10-19) |
22.418 |
0.2 (41) |
1.76 (0.83-3.76) |
| Adulto joven (20-44) |
116.664 |
0.8 (938) |
7.76 (3.87-15.55)** |
| Adulto medio (45-64) |
59.165 |
0.4 (217) |
3.54 (1.75-7.16)** |
| Sector de residencia |
| Belén |
12.575 |
0.3 (42) |
1.00 |
| Buenos Aires |
18.806 |
0.7 (129) |
2.05 (1.45-2.91)** |
| Castilla |
15.068 |
0.5 (75) |
1.49 (1.02-2.17)* |
| Doce de Octubre |
13.480 |
0.5 (67) |
1.49 (1.01-2.19)* |
| Campo Valdés |
11.448 |
0.3 (39) |
1.02 (0.67-1.58) |
| Manrique |
20.094 |
0.6 (125) |
1.86 (1.31-2.64)** |
| San Javier |
13.935 |
0.7 (97) |
2.08 (1.45-2.99)** |
| San Cristóbal |
10.917 |
0.8 (86) |
2.36 (1.63-3.41)** |
| San Antonio de Prado |
6.160 |
0.5 (32) |
1.55 (0.98-2.46) |
| Santa Cruz |
15.617 |
0.7 (114) |
2.19 (1.53-3.11)** |
| Planificación |
| Ninguno |
86.184 |
0.0 (36) |
1.00 |
| Hormonal |
41.560 |
0.0 (11) |
0.63 (0.32-1.24) |
| Barrera |
4.888 |
0.2 (12) |
5.88 (3.06-11.29)** |
| Tubectomía |
50.893 |
0.0 (16) |
0.75 (0.42-1.36) |
| DIU |
12.545 |
8.9 (1.118) |
213.3 (153-297)** |
| Coinfecciones |
| Negativo |
141.763 |
(446) |
1.00 |
| Positivo |
64.272 |
1.2 (759) |
3.75 (3.34-4.21)** |
| Sintomatología |
| Prurito |
40.041 |
0.6 (242) |
1.000 |
| Ardor |
39.852 |
0.6 (223) |
0.92 (0.77-1.11) |
| Dolor pélvico |
35.302 |
0.6 (210) |
0.98 (0.82-1.18) |
| Flujo |
75.829 |
0.8 (582) |
1.27 (1.09-1.47)** |
| Dispareunia |
349 |
0.9 (3) |
1.42 (0.46-4.42) |
| Sangrado anormal |
5.144 |
1.0 (53) |
1.70 (1.27-2.29)** |
| Sinusorragia |
2.715 |
1.4 (37) |
2.25 (1.60-3.18)** |
| RP: Razon de prevalencia. *p<0.05. **p<0.01. |
Tabla 1: Prevalencia específica de ALOs según grupo etario, sector de residencia, método de planificación y coinfecciones.
Entre las variables independientes se hallaron asociaciones estadísticas con valores p de 0.000 en la prueba chi cuadrado, lo que evidencia la posible presencia de variables de confusión en los análisis bivariados descritos previamente. En el análisis multivariado se determinó que las asociaciones por grupo etario, la presencia de flujo vaginal y de sangrado anormal no eran reales sino producto de una modificación del efecto por una tercera variable, en este sentido se concluyó que los factores asociados con la infección por ALOs. son el sector de residencia, el método de planificación y la presencia de co-infección y sinusorragia; siendo el uso del DIU el factor que presentó la mayor fuerza de asociación al incrementar en más de 200 veces la probabilidad de presentar la infección ajustando por las demás variables independientes del modelo (Tabla 2).
| Variables del modelo |
Vp |
Razón de Odds |
IC 95% Razón de Odds |
| Grupo etario |
0.270 |
|
|
|
| 10-19 años/>64 años |
0.147 |
0.439 |
0.144 |
1.334 |
| 20-44 años/>64 años |
0.266 |
0.551 |
0.193 |
1.574 |
| 45-64 años/>64 años |
0.376 |
0.620 |
0.216 |
1.785 |
| Sector de residencia |
0.000 |
|
|
|
| Buenos Aires/Belén |
0.041 |
1.502 |
1.017 |
2.218 |
| Castilla/Belén |
0.578 |
1.126 |
.740 |
1.714 |
| Doce de Octubre/Belén |
0.830 |
.954 |
.622 |
1.464 |
| Campo Valdés/Belén |
0.775 |
.933 |
.579 |
1.504 |
| Manrique/Belén |
0.021 |
1.586 |
1.073 |
2.345 |
| San Javier/Belén |
0.046 |
1.511 |
1.008 |
2.265 |
| San Cristóbal/Belén |
0.014 |
1.683 |
1.113 |
2.547 |
| San Antonio de Prado/Belén |
0.699 |
1.106 |
.665 |
1.838 |
| Santa Cruz/Belén |
0.009 |
1.711 |
1.145 |
2.557 |
| Método de planificación |
0.000 |
|
|
|
| Hormonal/Ninguno |
0.333 |
0.663 |
0.289 |
1.523 |
| Tubectomía/Ninguno |
0.221 |
0.585 |
0.217 |
1.578 |
| Barrera/Ninguno |
0.000 |
7.823 |
3.398 |
18.007 |
| DIU/Ninguno |
0.000 |
237.180 |
148.356 |
379.184 |
| Coinfecciones (Si/No) |
0.000 |
2.845 |
2.431 |
3.329 |
| Sintomatología |
|
|
|
|
| Flujo (Si/No) |
0.835 |
1.017 |
0.867 |
1.193 |
| Sinusorragia (Si/No) |
0.043 |
1.602 |
1.001 |
2.574 |
| Sangrado (Si/No) |
0.296 |
1.234 |
0.831 |
1.833 |
Tabla 2: Modelo de ajuste para los factores asociados con la ocurrencia de ALOs vía regresión logística binaria múltiple.
Discusión
A partir de una población de 206.035 mujeres se halló una prevalencia global de ALOs del 0.6%, con prevalencias específicas que oscilaron entre 0.0% y 8.9% según las características estudiadas; además, los factores asociados con la infección fueron el sector de residencia, el método de planificación y la presencia de coinfecciones y sinusorragia; siendo el uso del DIU el factor que presentó la mayor fuerza de asociación al incrementar en más de 200 veces la probabilidad de presentar la infección; esto evidencia la diversidad en la ocurrencia y en los factores asociados con esta infección aún en subgrupos de una misma población, y pone al descubierto la necesidad de fomentar la epidemiología descriptiva como base para el conocimiento de la ocurrencia y distribución de las infecciones en diferentes poblacionales y para identificar potenciales factores causales como el uso del DIU en este caso.
La prevalencia global y las prevalencias específicas de esta población resultan mayores a lo reportado por López-Olmos con una prevalencia global de 0.1% [12] y Joo-Kim de 0.26% [6]; en este último el 80.1% eran usuarias del DIU, mientras que en el actual estudio el 93.7% de las positivas para ALOs, usaban el dispositivo; esto corrobora, aún más, la directa asociación del uso del DIU con este hallazgo microbiológico en la citología, el cual incrementa en más de 200 veces la probabilidad de presentar la infección.
En cuanto a la prevalencia específica de ALOs, entre usuarias del DIU, nuestro estudio revela cifras más altas (8.9%), que las reportadas por Nayar M. en India (3.4%) [14], Mali B (7%) [17] y Bonacho (5.9%) [18-20], pero más bajas que las del estudio de Kalaichelvan V en Singapur, cuyo resultado fue de 13.7% [21], Chatwani con 6.7% a 22% [13] y el de Merki-Field con el 30% [17]. Las diferencias en las prevalencias reportadas pueden deberse a aspectos como: los niveles de rigor empleados para el análisis de los frotis cervicales, la experticia del analista ligada a la posibilidad de malas interpretaciones [22] y el tipo y tiempo de uso del DIU, pues se han encontrado diferencias significativas para cada dispositivo, siendo el de cobre y plástico los más implicados y con más altas cifras en aquellas con un uso de 2-5 años [6,17,23].
Por otra parte, según la Encuesta Nacional de Demografía y Salud (ENDS) 2010 [24], el 38.8% de las mujeres colombianas no usan actualmente algún método de planificación y entre los métodos anticonceptivos el DIU se encuentra en baja proporción (5.6%) comparado con los más usados como la esterilización femenina (24.2%), métodos hormonales (14%) y el uso del condón (7.6%). Esta distribución es similar a la encontrada en presente estudio. La encuesta mencionada [24], también revela que las mujeres de 25-44 años son quienes emplean con mayor frecuencia el DIU, siendo este el segundo método más usado en ellas después de la esterilización femenina, lo que puede explicar el efecto confusor de la edad hallado en este estudio.
En el análisis bivariado, alrededor del 5.9% de las mujeres que referían algún síntoma, tenían ALOs, presentándose en el 3.9% de las que referían algún síntoma significativos para la infección (dolor pélvico, dispareunia, sangrado anormal o sinusorragia) [4]; en la regresión logística se encontró asociación entre actinomyces con la presencia de flujo, sinusorragia y sangrado. Lo anterior puede indicar que estas pacientes tienen una mayor probabilidad de cursar con un proceso infeccioso por este microorganismo y no tratarse de una simple colonización, necesitando de un manejo diferente para ellas, así como el empleo de métodos diagnósticos para confirmar el origen de los mismos [6,7,13,22].
La prevalencia de ALOs en co-infección con Vaginosis bacteriana, Cándida spp., o Trichomonas vaginalis fue del 1.2%; porcentaje mucho menor a la reportada por López-Olmos con el 15% o por Joo-Kim con 6% (3/52) [6,12,25]. En el estudio de Cardona, Valencia y Herrera que evaluaron los hallazgos microbiológicos para la misma población de Medellín, se encontró una prevalencia de hallazgos microbiológicos en la citología del 31.2% de las cuales Vaginosis bacteriana y cándida presentaban gran asociación al uso del DIU [24]; lo que podría suponer que los cambios ocasionados por el dispositivo en el microambiente vaginal, hacen más susceptible a la mujer a estas infecciones [18,26,27].
Comparando los hallazgos obtenidos en la presente investigación, con otros estudios que emplearon diferentes métodos en muestras cervicales, se observa una prevalencia de ALOs en usuarias del DIU de entre 2.8% y 44% por IF y 0.8% por cultivo [4,16,28] y en mujeres con EPI de 77% por Pap, 50% por estudio patológico y 11.1% por cultivo [9].
Es de anotar que la sensibilidad de la citología para la detección de actinomices, es de 94% cuando se correlaciona con la IF, presentando concordancias de 49% -100% [25,29-32]; ésta varía según los criterios tenidos en cuenta para el análisis de la Pap y la experticia del lector [12,13], pues este último método tiene un mayor riesgo de falsos positivos por la posible confusión con botriomicosis, Cándida, Aspergillus, Nocardia, Leptothrix, cocobacilos, espermatozoides, fibrina, moco, algodón o fibras dando a la Pap una especificidad el 50% [4,22]. Cuando los factores del análisis del Pap son controlados, se logra disminuir la probabilidad de falsos positivos para este microorganismo [4,6]. En la presente investigación, este aspecto se controló gracias a la amplia experiencia del personal encargado del análisis de las citologías y de la relectura por parte de especialistas de las citologías reportadas con actinomyces.
A pesar de lo anterior y teniendo en cuenta los hallazgos de Matsuda [9], se puede reconocer la gran utilidad del Pap en el diagnóstico preoperatorio de la actinomicosis pélvica, siendo una buena opción para orientar el diagnostico de pacientes sintomáticas; esto sumado a que la citología se practica de manera rutinaria y gratuita, permitiendo captar más casos de un microorganismo con gran potencial para generar una enfermedad con graves consecuencias para la salud de la mujer. Es decir, que podría considerarse la utilización de la IF como método de confirmación o seguimiento para las mujeres con citología positiva para actinomyces, en los sitios donde se disponga de esta tecnología [28].
Aun asumiéndose que una citología positiva para actinomices sea realmente positiva, el debate actual radica en el manejo clínico que se le debe dar a la mujer asintomática; ya que diversos autores no consideran justificable tratar con terapia antibiótica y/o con el retiro del DIU, encontrando injustificable exponer a la paciente a un riesgo de embarazo por un hallazgo que no confirma una infección basados en que, solo el 4.8% de los cultivos de biopsia de endometrio son positivos, indicando una colonización superficial del cérvix [31]; no obstante las complicaciones que acarrea una Actinomicosis pélvica deben hacer pensar a los clínicos que este hallazgo no puede ser pasado por alto sin tener en cuenta un seguimiento riguroso para las pacientes que garantice la saludable permanencia del DIU sin otro tipo de manejo. Sin embargo las barreras de acceso a los servicios de salud en países como Colombia, hacen muy difícil efectuar seguimiento adecuado a las mujeres, lo cual se evidencia en otros casos de gran importancia en salud pública como lo es la tamización del cáncer de cuello uterino, donde las pacientes de más bajos recursos económicos y menores niveles de educación, son la población con menos posibilidades de recibir un seguimiento completo y oportuno de las lesiones intraepiteliales aumentando el riesgo del desarrollo de lesiones cancerosas e invasivas [32-37].
Todo lo expuesto evidencia la necesidad de llevar a cabo estudios rigurosos y profundos que evalúen el riesgo a largo plazo de
Entre las limitaciones del estudio se encuentra el sesgo temporal propio de los estudios transversales, el carácter exploratorio de las asociaciones estadísticas y el hecho que la prevalencia reportada puede resultar menor a la real dado que no se empleó la prueba estándar y la citología cérvico-uterina puede presentar una proporción importante de falsos negativos.
Las principales ventajas de este estudio están dados por el elevado tamaño poblacional, ser uno de los pocos estudios sobre actinomyces, en el país, desarrollados en población general y por personal altamente calificado en la lectura de citología. Otros de los aportes importantes es el brindar una aproximación a un tema no incluido en las políticas, programas o planes de acciones territoriales sobre infecciones cérvico-vaginales, el generar antecedentes que permitan evaluar la pertinencia de la monitorización de resultados microbiológicos en la citología cérvico uterina dada su alta cobertura en algunas poblaciones.
Conclusión
Se halló una elevada diversidad en las prevalencias específicas de la infección en los diferentes grupos etarios, zonas de la ciudad y mujeres coinfectadas, además se confirmó que el principal factor asociado con la Actinomicosis es el uso del DIU. La variabilidad de prevalencias pone de manifiesto la relevancia de epidemiologia descriptiva como vía expedita para generar hipótesis sobre la ocurrencia y distribución de la infección, y para orientar acciones de salud colectiva posteriores.
Agradecimientos
A Metrosalud y a la Universidad de Antioquia.
Conflicto de Intereses
Ninguno.
8071
References
- Madrid S. F, DГaz Z. S, Mucientes F and Klaassen R (2003) Actinomicosis GinecolГіgica. Rev. chil. obstet. Ginecol 68: 21-27.
- Valour F, SГ©nГ©chal A, Dupieux C, Karsenty J, Lustig S, et al. (2014) Actinomycosis: etiology, clinical features, diagnosis, treatment, and management. Infect Drug Resist 7: 183-197.
- SГЎnchez HernГЎndez JA, Mercado Carrillo NA, Chilaca Rosas F and Rivera Tapia JA (2004) Uso del DIU asociado a la infecciГіn secundaria por Actinomyces en tracto genital femenino. Rev Esp Patol 37: 383- 90.
- Fiorino A.S (1996) Intrauterine Contraceptive Device-Associated Actinomycotic abscess and Actinomyces detection on Cervical smear. Obstetrics & Gynecology 87: 142-9.
- Jones JB, Kaplan W, Brown DM and White W (1983) Studies of cervicovaginal smears for the presence of actinomycetes. Mycopathologia 83: 53-5.
- Yeo Joo Kim, Youm J, Kim J.H, Jee B.C (2014) Actinomyces-like organisms in cervical smears: the association with intrauterine device and pelvic inflammatory diseases. Obstet Gynecol Sci 57: 393-6.
- Matsuda K, Nakajima H, Khan KN, Tanigawa T, Hamaguchi D, et al. (2012) Preoperative diagnosis of pelvic actinomycosis by clinical cytology. Int J Womens Health 4: 527-533.
- Westhoff C (2007) IUDs and colonization or infection with Actinomyces. Contraception 75: S48-50.
- Bonacho I, Pita S, GГіmez-Besteiro MI (2001) The importance of the removal of the intrauterine device in genital colonization by actinomyces. Gynecol Obstet Invest 52: 119-123.
- Castro MI, Abratte O, Barocchi M, Musacchio M.L (2004) ColoraciГіn de Papanicolaou y su importancia en el diagnГіstico de las infecciones cervicovaginales. Acta BioquГm ClГn Latinoam 38: 199-202.
- Tamayo Acevedo L.S, Guevara Romero E, LГіpez M.I (2010) Vaginosis bacteriana, Candidiasis y Tricomoniasis por citologГa cervico-vaginal en mujeres del rГ©gimen subsidiado, MedellГn – Colombia, 2008. Revista Salud PГєblica de MedellГn 4: 87-100.
- Lopez-Olmos J.A, Gasull J, Vivar B (2010) Actinomyces e infecciones mixtas en la citologГa cervicovaginal, en portadoras de DIU. Clin Invest Gin Obst 37: 134-40.
- Chatwani A, Amin-Hanjani S (1994) Incidence of actinomycosis associated with intrauterine devices. J Reprod Med 39: 585-587.
- Demirezen S, Kaya D, Beksaç S (2005) Cytologic findings in pap smears with Actinomyces-like organisms. Acta Cytol 49: 257-261.
- HernГЎndez B, Velasco-MondragГіn HE (2000) [Cross-sectional surveys]. Salud Publica Mex 42: 447-455.
- Nayar M. Chandra M, Chitraratha K, Kumari Das S and Rai Chowdhary G (1985) Incidence of actinomycetes infection in women using intrauterine contraceptive devices. Acta Cytol 29: 111-6.
- Merki-Feld G.S, Lebeda E, Hogg B, Keller P.J (2000) The Incidence of Actinomyces-like Organisms in Papanicolaou-stained Smears of Copper- and Levonorgestrel-Releasing Intrauterine Devices. Contraception 61: 365-8.
- BariГ…Её II, Arman Karakaya Y (2013) Effects of contraception on cervical cytology: data from Mardin City. Turk Patoloji Derg 29: 117-121.
- Mali B, Joshi JV, Wagle U, Hazari K, Shah R, et al. (1986) Actinomyces in cervical smears of women using intrauterine contraceptive devices. Acta Cytol 30: 367-371.
- Bonacho I, Pita S, GГіmez-Besteiro MI (1999) Eight years with the same IUD. Contraception 59: 233-236.
- Kalaichelvan V, Maw AA, Singh K (2006) Actinomyces in cervical smears of women using the intrauterine device in Singapore. Contraception 73: 352-355.
- Jabib A, Ferreiro J, Chappe M, Albini M (2008) Actinomicosis pГ©lvica: dificultades diagnГіsticas. Arch Gin Obstet 46: 69-99.
- SГЎnchez HernГЎndez J.A, Mercado Carrillo N.A, Chilaca Rosas F, Rivera Tapia J.A (2004) Uso del DIU asociado a la infecciГіn secundaria por Actinomyces en tracto genital femenino. Rev Esp Patol 37: 383-390.
- Profamilia (2010) PlanificaciГіn Familia: Encuesta Nacional de DemografГa y Salud-ENDS 127-58.
- Chatwani A, Amin-Hanjani S (1993) Management of intrauterine deviceassociated actinomycosis. Infect Dis Obstet Gynecol 1: 130-133.
- Cardona-Arias J.A, Herrera-Posada D, Valencia-Arredondo M (2014) Prevalencia de resultado positivo de la citologГa para vaginosis bacteriana, candidiasis y tricomoniasis en una Empresa Social del Estado de MedellГn (Colombia), 2010-2012. Revista Colombiana de Obstetricia y GinecologГa 65: 206-14.
- Ocak S, Cetin M, Hakverdi S, Dolapcioglu K, Gungoren A, et al. (2007) Effects of intrauterine device and oral contraceptive on vaginal flora and epithelium. Saudi Med J 28: 727-731.
- Leslie DE, Garland SM (1991) Comparison of immunofluorescence and culture for the detection of Actinomyces israelii in wearers of intra-uterine contraceptive devices. J Med Microbiol 35: 224-228.
- Gupta PK, Hollander DH, Frost JK (1976) Actinomycetes in cervicovaginal smears: an association with IUD usage. Acta Cytol 20: 295-297.
- Valicenti J.F, Pappas A.A, Graber C.D, Williamsom H.O and Fowler Willis N (1982) Detection and Prevalence of IUD-Associated Actinomyces Colonization and Related Morbidity A Prospective Study of 69,925 Cervical Smears. JAMA 247: 1149-52.
- Singh MM, Ingham HR, Wadehra V, Morris K: (1989) Endometrial culture in IUD users with actinomycosis-like organisms (ALOs) on cervical smears. Br J Family Planning 15: 3-6.
- Kupets R, Paszat L (2011) How are women with high grade Pap smear abnormalities managed? A population based study. Gynecol Oncol 121: 499-504.
- Paolino M. and Arrossi S (2012) AnГЎlisis de los motivos del abandono del proceso de seguimiento y tratamiento por parte de mujeres con lesiones precursoras de cГЎncer de cuello uterino en la provincia de Jujuy: implicancias para la gestiГіn. Salud Colectiva 8: 247-61.
- AlcaldГa de MedellГn, (2005) San CristГіbal Plan de Desarrollo Participativo Corregimental 2006-2016. AlcaldГa de MedellГn- CorporaciГіn EcolГіgica Penca de SГЎbila 1-84.
- Gaviria-Correa A (2012) Proyecto de Acuerdo Plan de Desarrollo “MedellГn un hogar para la vida” 2012-2015. AlcaldГa de MedellГn 1-267.
- Mao K, Guillebaud J (1984) Influence of removal of intrauterine contraceptive devices on colonisation of the cervix by actinomyceslike organisms. Contraception 30: 535-544.
- Valencia M (2013) Otra cara del cГЎncer cГ©rvicouterino: una cuestiГіn de clase social y cultura de gГ©nero. Tesis para optar al tГtulo de doctora en Salud PГєblica. Facultad Nacional de Salud PГєblica. Universidad de Antioquia. MedellГn.







