Keywords
Vitrinectin, antiserum anti-vitronectin, chromatography.
Introducción
La vitronectina (VN) es una glicoproteína plasmática y de matriz extracelular, que se encuentra circulando en plasma en una concentración de 0,2 μg/ml, en dos formas moleculares, una de cadena simple de 75 kDa y otra formada por dos subunidades de 65 kDa y 10 kDa; es una proteína adhesiva relacionada con la hemostasia al regular el sistema de la coagulación y el sistema fibrinolítico. Entre las funciones de la VN se encuentra la estabilización del inhibidor del activador tisular del plasminógeno tipo 1 (PAI-1), al formar con este inhibidor dímeros y multímeros estables mantenidos por enlaces disulfuros, lo que regula la actividad funcional del PAI-1 como serpina y su eliminación de la circulación, además la VN tiene un efecto antitrombótico al inhibir la agregación plaquetaria [1]. Existen trabajos que sugieren que la regulación de la actividad funcional del PAI-1 es importante en los fenómenos de trombosis vascular. Elevadas concentraciones de PAI-1 pueden constituir un importante factor de riesgo de infarto al miocardio [2]. El PAI-1 regula negativamente el funcionamiento del sistema fibrinolítico por lo que constituye uno de los principales objetivos de estudio en los tratamientos antitrombóticos actuales [3].
Para realizar estudios funcionales que relacionen la VN con la hemostasia, específicamente su papel como estabilizante del PAI-1, principal inhibidor del sistema fibrinolítico, es necesario tener en forma purificada esta proteína adhesiva. Considerando esto en el presente trabajo se aisló la VN a partir del plasma humano para así preparar un suero anti-vitronectina (anti-VN) en conejos Nueva Zelanda. Logrando obtener un método más rápido, económico y de buen rendimiento, que facilite el aislamiento de la VN, el cual servirá en futuros trabajos para aislar inmunoglobulina y IgG que servirán como ligando en una cromatografía de afinidad.
Materiales y métodos
Reactivos: Anticuerpo anti-VN humana comercial (American Diagnostica, USA); proteínas estándares de baja masa molecular para electroforesis (Bio Rad, USA); adyuvante completo de Freund's, los anticuerpos secundarios anti-IgG conjugados con peroxidasa, cloruro de bario, EDTA, PMSF, SDS, sulfato de amonio, TEMED, y demás reactivos químicos (Sigma Chemical Company, USA); BLUE-Sepharose, DEAE-Sephacel, Sephacryl S-200 (Pharmacia, Suecia); mercaptoetanol, persulfato y sulfato de amonio (Merck, Alemania). Equipos: Colector de fracciones modelo Fracc 100 unidad óptica, bomba peristáltica, (Pharmacia Fine Chemicals, Suecia); Cámara de electroforesis “Mini-Protean II” (Bio-RAD, USA).
Las muestras de plasma fresco fueron donadas, antes de ingresar al estudio, dieron su consentimiento por escrito, que fue aprobado por el Comité de Ética del IVIC y por el Banco Municipal de Sangre, Caracas, Venezuela. Se usó conejos Nueva Zelanda blancos con una peso promedio de 1,5 – 2,0 kg. Se siguieron las normas establecidas por el Manual de la Sociedad Fisiológica Americana y el modelo animal del Subcomité de la Sociedad Internacional de Trombosis y Hemostasia, y respetando los derechos del animal [4].
Se utilizó una modificación del método de Bjorn Dahlback y Eckhard [5]; 100 ml de una mezcla de plasma fresco humano se centrifugaron a 3.000 rpm por 15 minutos, se agregaron inhibidores de proteasas: benzamidina/HC1 (10 mmol/l) y PMSF (1 mmol/l); y glutation reducido (1 mmol/l). Se precipitó el plasma con BaCl2 1 mol/l (80 ml/l plasma), agregándose lentamente por 1 hora; se centrifugó a 9.500 rpm por 15 minutos; se recogió el sobrenadante en el cual está la VN y se dializó durante toda la noche contra el tampón fosfato de sodio 20 mmol/l, EDTA 2 mmol/l, pH 7,0 conteniendo glutation reducido 1 mmol/l (tampón 1 o de equilibrio).
El dializado anterior se centrifugó a 9.500 rpm por 15 minutos, y el sobrenadante se pasó por una columna de DEAE-Sephacel (30 x 2 cm) equilibrada con el tampón 1, y con el tampón de equilibrio conteniendo NaCl 50 mmol/l (tampón 2). Con las fracciones obtenidas se realizó electroforesis en geles de poliacrilamida-SDS (SDS-PAGE) al 12%, en condiciones de redución y aquellas donde se encuentra una mayor proporción de bandas de peso molecular semejante a la VN (65-75 kDa), fueron agrupadas y precipitadas con (NH4)2SO4, hasta un 70% de saturación; la solución se agitó por 1 hora y se centrifugó a 9.500 rpm por 15 min. El precipitado se resuspendió y dializó toda la noche con tampón Tris- HCl 50 mmol/l, NaCl 0,15 mol/l; pH 7,4 conteniendo Benzamidina-HCl 2 mmol/l, glutation reducido 1 mmol/l y EDTA 2 mmol/l (tampón 3) y luego se centrifugó a 9.500 rpm por 15 minutos. El sobrenadante fue pasado por una columna de BLUE-Sepharose (20 x 2 cm) equilibrada con el tampón 3, se hizo elución con tampón de equilibrio conteniendo NaCl 1 mol/l. Con estas fracciones se realizaron SDS-PAGE al 12%, en condiciones de reducción y donde se encontraron en mayor proporción bandas con peso molecular semejante a la VN (65-75 kDa) fueron recogidas y precipitadas con (NH4)2SO4, hasta un 70 % de saturación; la solución se agitó por 1 hora y se centrifugó a 9.500 rpm por 15 minutos.
El precipitado anterior se resuspendió en tampón 3 y se pasó por una columna de Sephacryl S-200 (70 X 1,5 cm); las proteínas se eluyeron con el tampón de equilibrio. Según los resultados de SDS-PAGE, las fracciones que podían contener la VN fueron colectadas, precipitadas con (NH4)2SO4 y centrifugadas; el precipitado se resuspendió en un mínimo volumen de tampón 3; y fue almacenada en alicuotas a –20ºC. La detección de la VN en la muestra obtenida en cada paso del procedimiento de purificación aplicado, se realizó por inmunotransferencia; la pureza de la preparación final de la VN obtenida se analizó por SDS-PAGE al 12% en condiciones reducidas, con la técnica de Laemmli [6].
La concentración de proteínas se determinó por el método de Lowry [7]. El análisis electroforético de las proteínas se realizó en geles de SDS-PAGE al 12%, y al 4% siguiendo la técnica descrita por Laemmli [6]. Las proteínas se separaron a 100 voltios y 40 mA, a temperatura ambiente, en geles de SDS-PAGE al 12% en condiciones de reducción, por el método de Laemmli [6]. Las proteínas se transfirieron a membranas de nitrocelulosa, utilizando el tampón Tris-HCl 25 mmol/l, glicina 192 mmol/l, metanol al 20%, pH 8,3 a 4ºC por 2 horas, usando 100 voltios y 250 mA. Se reveló la presencia de VN, en la membrana de nitrocelulosa colocando la membrana en solución de bloqueo (leche descremada al 5% en tampón fosfato salino-PBS, pH 7,0; conteniendo azida de sodio al 10%), durante toda la noche con agitación constante. Al día siguiente se agregó el anticuerpo primario anti-VN humano diluido 1/500 preparado en la solución de bloqueo, se incubó por 6 horas con agitación continua y luego se lavó con PBS, pH 7,0 durante 20 minutos; y se dejó la membrana toda la noche en PBS con agitación constante.
La membrana se lavó con Tris-HCl 50 mmol/l, pH 7,5; se agregó el anticuerpo secundario anti-IgG marcado con peroxidasa diluido 1/1.000 en solución bloqueadora libre de azida de sodio y fosfato, se mantuvo por 2 horas con agitación lenta; se lavó durante 20 minutos por 3 veces con tampón Tris-HCl 50 mmol/l, pH 7,5. El revelado se realizó utilizando una mezcla que contenía 6 mg de diaminobenzidina en 9 ml de tampón Tris-HCl 0,01 mol/l, pH 7,6; 1 ml de cloruro de cobalto al 0,3% y 10 μl de H2O2 al 30%. Se detuvo la reacción lavando la membrana con agua destilada, se tapó con papel aluminio y se fotografió de inmediato. Con la muestra de VN aislada, se procedió a la obtención del suero anti-VN, siguiendo el método descrito por Carvajal [8], se utilizaron conejos Nueva Zelanda blancos, los cuales fueron inoculados por inyección subcutánea de 0,5 ml de la VN purificada (1 mg/ml), mezclados con 0,5 ml del adyuvante completo de FREUND’S. Después de 21 días se administró una inyección intramuscular en diferentes lugares (patas, cuello), con 0,5 ml de VN (1 mg/ml) sin adyuvante.
A los 31 días los conejos fueron sangrados a través de la arteria central de la oreja, el suero obtenido se guardó en alícuotas a – 20ºC. Para detectar la presencia de anticuerpos anti-VN humana en el suero obtenido en los conejos, se utilizó la técnica de inmunodifusión radial descrita por Ouchterlony [9]. En placas de vidrio (2,6 x 7,6 cm) se agregaron 3 ml de agar al 1,1% preparado en tampón Veronal sódico (Veronal sódico 10,3 g/l, citrato trisódico 1,5 g/l, pH 8,8); se dejó solidificar el gel en una superficie nivelada, y se realizó orificios en la periferia. En los orificios periféricos se colocaron 5 μl del suero (diluciones seriadas desde 1/1 hasta 1/32) y en el orificio central 5 μl de la muestra de VN humana purificada, que se utilizó para la inmunización. La placa se colocó en una cámara húmeda por 24 horas a temperatura ambiente. Se comprobó la formación de bandas de precipitación y se tomaron fotografías. Para demostrar que el suero anti-VN preparado en conejos era específico para VN, se realizó una inmunodifusión.
Resultados
La VN fue aislada a partir del plasma humano, realizando primero una adsorción de los factores dependientes de la vitamina K con cloruro de bario, posteriormente precipitaciones con sulfato de amonio y cromatografías de intercambio iónico, afinidad sobre BLUE-Sepharose y gel filtración; procedimiento que se realizó en una semana. A partir de 100 ml de una mezcla de plasma fresco, se lograron obtener un 2,5% de VN del contenido en plasma. De las 150 fracciones (7 ml) que se colectaron; en la columna de DEAE-Sephacel, se agruparon las fracciones donde se detectaron con mayor intensidad bandas proteicas con masas moleculares entre 65 y 75 D, donde se esperaba migraría la VN. De las 110 fracciones (4 ml) obtenidas por BLUE-Sepharose, según las electroforesis, se agruparon las fracciones 16 a la 20 y fueron concentradas por precipitación con sulfato de amonio y cromatografiada sobre Sephacryl S-200 mostró que según el perfil electroforético las fracciones 18 a 20, contenían en mayor proporción a la VN, las cuales fueron concentradas y almacenadas para futuros experimentos.
La muestra de VN humana aislada por el procedimiento anterior, al ser analizada por electroforesis en geles de SDS-PAGE al 12%, en condiciones reducidas, mostró la presencia de una banda de masa molecular aproximada de 75 kDa, muy semejante a la VN humana comercial que se utilizó como referencia, sin la presencia de otras bandas proteicas contaminantes relevantes, (Figura 1).

Figura 1. Gel de SDS-PAGE al 12% A: marcadores de bajo peso molecular; B: VN comercial; C: VN purificada.
La VN obtenida fue identificada por medio de una inmunotransferencia, utilizando un anticuerpo anti-VN humana comercial; se detectó una banda proteica similar a la observada en la muestra de plasma humano, que se utilizó como control positivo, (Figura 2). El suero anti-VN humano preparado en los conejos, al evaluarlo con el ensayo de inmunodifusión formó arcos de precipitación con una dilución 1/16, de la muestra de VN que se utilizó como inmunógeno (Figura 3). Con el suero obtenido por medio de una inmunodifusión se mostró que el suero anti-VN humano obtenido formó un arco de precipitación bien definido, con una mezcla de plasmas humanos citratados (Figura 4); e igualmente con una muestra de VN humana comercial, (Figura 5).

Figura 2. Inmunotransferencia de la VN humana purificada (a) plasma humano diluido 1/10; (b) VN obtenida de DEAE-Sephacel; (c) VN obtenida de BLUE-Sepharose; (d) VN obtenida de Sephacryl S-200.
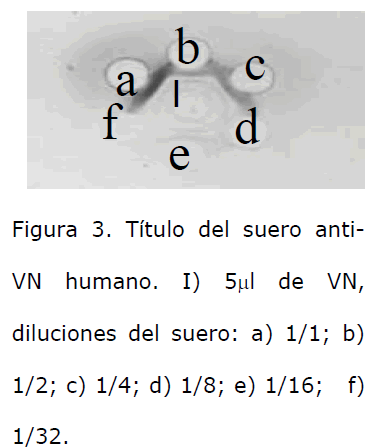
Figura 3. Título del suero anti- VN humano. I) 5μl de VN, diluciones del suero: a) 1/1; b) 1/2; c) 1/4; d) 1/8; e) 1/16; f) 1/32.
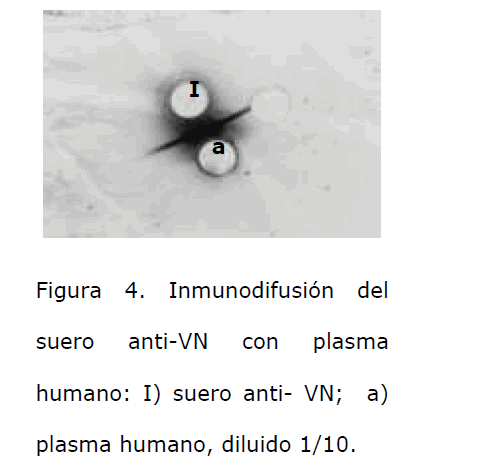
Figura 4. Inmunodifusión del suero anti-VN con plasma humano: I) suero anti- VN; a) plasma humano, diluido 1/10.
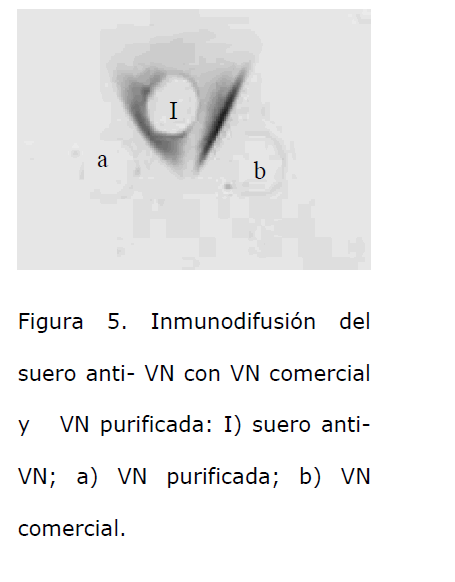
Figura 5. Inmunodifusión del suero anti- VN con VN comercial y VN purificada: I) suero anti- VN; a) VN purificada; b) VN comercial.
Discusión
El procedimiento que aplicamos para la obtención de la VN humana fue una modificación del método reportado por Bjorn Dahlback y col. [5], en el cual se realizaron precipitaciones previas con cloruro de bario y polietilenglicol, seguido de tres cromatografías sobre DEAE–Sephacel, BLUE-Sepharose y Sephacryl S-200. Entre las modificaciones se encuentra que, previo a las cromatografías, no se precipitó el plasma con polietilenglicol, debido a que este procedimiento incrementó la densidad de la muestra, retardando el tiempo de aplicación de la misma sobre la columna de DEAE-Sephacel; pensamos que la presión que se genera en el tope de la columna se debe en parte a la presencia en la muestra inicial, el plasma, del fibrinógeno plasmático, el cual puede estar coagulándose, formando monómeros de fibrina, lo que aumenta la viscosidad del plasma; la omisión de la precipitación con polietilenglicol permitió pasar la muestra a través de la primera columna con mayor facilidad y en un menor tiempo, evitando la degradación de la VN. La muestra de VN obtenida, presentó un alto grado de pureza, y un peso molecular de alrededor 75 kDa, valor que coincide con el reportado por otros autores [1,2]. En la muestra obtenida se comprobó inmunológicamente la presencia de la VN por medio de una inmunotransferencia con un anticuerpo anti-VN humana comercial. La recuperación de VN en nuestro caso fue del 2,5%, la cual fue calculada según la concentración de proteínas en la muestra obtenida, tomando como referencia los niveles teóricos de esta proteína en plasma (alrededor de 0,2 ug/ml). Otros procedimientos de purificación de VN, tales como el desarrollado por Mimuro y Loskutoff [10] reportan una recuperación del 0,5 y 0,6 %, atribuido a la alta tendencia de esta proteína de agregarse.
La absorción de las proteínas dependientes de la vitamina K, con Cloruro de bario, evita la activación de la cascada de la coagulación, con la subsiguiente generación de trombina, que activa otras pro-enzimas de la hemostasia que pueden producir proteólisis de la VN. La adicción de inhibidores de proteasas desde el inicio del proceso de purificación: benzamidina (inhibidor de proteasas tipo serina) y EDTA (inhibidor de metaloproteasas); y la presencia de benzamidina evita la degradación de la VN por proteasas que pueden generarse durante el proceso; la inclusión del agente reductor “glutation reducido” evita la formación de agregados de VN, los cuales pueden dificultar el proceso de aislamiento y el rendimiento final.
Tomando como referencia la movilidad electroforética de la VN, reportada en la literatura, entre 65 y 75 kDa [1,2], las electroforesis en geles de poliacrilamida- SDS al 12%, en condiciones reducidas, nos permitieron el rastreo de la VN en las diversas fracciones, para así poder agrupar aquellas donde había mas probabilidad de encontrar esta proteína. Con las diferentes muestras obtenidas en cada paso, por medio del reconocimiento inmunológico por inmunotransferencia con un anticuerpo anti-VN comercial, se avanzó en el procedimiento, de una manera más segura y a un costo razonable. La cromatografía de intercambio iónico sobre DEAESephacel fue el paso crítico en relación con la recuperación; probablemente existan isoformas de la VN que pueden estar siendo eluidas a diferentes fuerzas iónicas.
Para la inmunización de conejos, es evidente que la metodología utilizada [8] resultó favorable para nuestro estudio, ya que para la inoculación se usaron cantidades muy pequeñas de VN purificada, lográndose una muy buena respuesta inmunológica; el título del suero obtenido, determinado por la técnica de inmunodifusión radial, resultó ser de 1/16. Con el suero preparado se lograron obtener bandas de precipitación por inmunodifusión, utilizando como antígeno muestras de plasma humano y VN humana comercial, lo que confirma la presencia en este suero de anticuerpos específicos contra VN humana.
La baja recuperación de la VN obtenida con procedimientos de purificación convencionales [5] justifica el desarrollo de una nueva metodología, aplicando nuestros recursos metodológicos y reactivos, tal como una cromatografía por afinidad con los anticuerpos anti- VN aislados del suero preparado en este trabajo. La incorporación de esta nueva herramienta permitirá aislar de forma rápida, económica y con una mayor recuperación la VN, para futuros estudios bioquímicos y funcionales relacionados con la hemostasia.
1385
References
- Tomasini B. y Mosher D. Vitronectin. Prog Haemost Thromb 1991; 10:269-305.
- Schwartz I., Seger D. y Shmuel S. Molecules in focus. Vitronectin. Int. J. Biochem Cell Biol 1999; 31: 539-544.
- Wiman B. y Hamsten A. The fibrinolytic enzyme system and its role in the etiology of thromboembolic disease. Semin Thromb Hemost 1990; 16:207-216.
- Giles A. Guidelines for the use of animals in biomedical research. Thromb Haemost 1987; 58: 1078-84.
- Björn W. Plasminogen activator inhibitor 1 in thrombotic disease. Current Op Hematol 1996; 3: 372-378.
- Laemmli V. Cleavage of structural proteins during the assembly of the heard of bacteriophage T4. Nature 1970; 227: 680-685.
- Lowry O., Rosebrough N., Farr R. y Randall R. Protein measurement with the phenol reagent. J Biol Chem 1951; 193: 265-375.
- Carvajal Z. InvestigaciГіn de la Capacidad Secretora del Endotelio Vascular por Medio de la DosificaciГіn InmunolГіgica de la Trombomodulina. Trabajo de Grado para Magister Scientiarum en BiologГa. Instituto Venezolano de Investigaciones CientГficas. Centro de Estudios Avanzados. Altos de Pipe, Venezuela, 1991: 134.
- Ouchterlony A. Antigen- antibodies reaction in gels. Acta Path Scand 1949; 26. 507.
- Mimuro, J. y Loskutoff, D. Purification of protein from bovine plasma that binds to type 1 plasminogen activator inhibitor and prevents its interaction with extracellular matrix. J Biol Chem 1989; 264: 936-939.










