Keywords
Guillain-Barré syndrome; Zika virus; Review literature as topic
Introducción
El Virus Zika (ZIKV) pertenece al género flavivirus y a la familia Flaviviridae. Este virus es transmitido por mosquitos del género Aedes spp. y recientemente también se ha reportado su transmisión por vía sexual y transfusión sanguínea [1,2].
Este virus se aisló por primera vez en 1947 en Uganda, en suero de monos Rhesus; desde entonces se han reportado casos esporádicos en África y Asia, pero la primera epidemia se dio en Micronesia en 2007, seguido de la Polinesia francesa en 2013. El brote más reciente comenzó en Brasil en 2015 y se ha propagado rápidamente a través de Sur y Centroamérica. En Colombia a partir del inicio de la fase epidémica en el país (semana epidemiológica 40 de 2015) hasta la semana epidemiológica 12 de 2016, se notificaron 2.603 casos confirmados y 58.790 sospechosos por clínica [3,4]. La mayoría de los casos de la infección son asintomáticos (aproximadamente el 80%); en el 20% de los casos restantes, los síntomas suelen ser leves y duran entre 3 y 7 días. Las infecciones que presentan manifestaciones clínicas cursan con síntomas similares a los presentados en infecciones por otros arbovirus, es decir, cefalea, febrícula o fiebre menor de 38,5°C, dolores musculares y articulares de intensidad leve a moderada, exantema maculopapular pruriginoso y conjuntivitis no purulenta [5]. Con menor frecuencia se ha descrito dolor retro-orbital, anorexia, náuseas, vómitos, malestar abdominal y diarrea. A diferencia de las infecciones producidas por el virus de la fiebre amarilla y el dengue (DENV), en la infección con ZIKV no suelen presentarse complicaciones hemorrágicas, hospitalización o muerte [6].
Los casos sospechosos deben ser confirmados por el laboratorio. Aunque no existe una prueba comercial disponible para ZIKV, su diagnóstico sólo se confirma en laboratorios de referencia mediante la detección del ARN viral por RT-PCR (durante la fase aguda); también puede usarse serodiagnóstico, aunque éste es limitado por el alto grado de reacciones cruzadas con otros flavivirus [7].
Aunque la enfermedad es leve y autolimitada, se ha relacionado con graves complicaciones neurológicas [8]. Debido al aumento en el número de casos de microcefalia y Síndrome de Guillain- Barré (SGB) los cuales coinciden espacial y temporalmente con los recientes brotes, se declaró en febrero de 2016 por la Organización Mundial de la Salud como una emergencia de salud pública internacional [9].
Durante el brote de la Polinesia francesa, se detectó un grupo de casos de SGB, de los cuales 42 estaban potencialmente asociados con la infección por ZIKV. A su vez se presentó un aumento en la incidencia de SGB en varios países de América, donde la epidemia por ZIKV se ha extendido desde el 2015 [3]. En Colombia desde el 15 de diciembre de 2015 y con corte a la semana epidemiológica 12 de 2016 se han notificado al sistema de vigilancia epidemiológica 401 casos de síndromes neurológicos (SGB, polineuropatías ascendentes, entre otras afecciones neurológicas similares) con antecedente de enfermedad febril compatible con infección por ZIKV [4].
Específicamente el SGB es una neuropatía autoinmune aguda, que se desencadena generalmente luego de infecciones virales o bacterianas. Clínicamente, se manifiesta como debilidad progresiva, que inicia en las extremidades inferiores y asciende de forma proximal en unas pocas semanas. Los pacientes presentan típicamente disfunción motora y parálisis, reducción o ausencia de reflejos tendinosos profundos y también pueden desarrollar trastornos de los nervios craneales [10].
Uno de los mecanismos moleculares que contribuyen a la patogénesis del SGB, son los anticuerpos tipo IgG anti-glicolípidos dirigido contra los gangliósidos. El mecanismo mediante el cual el ZIKV induce estas complicaciones asociadas al sistema nervioso no es claro, aunque se debe posiblemente a la reacción cruzada dada por la similitud entre antígenos virales y los péptidos de mielina [11].
A pesar de que se han realizado muy pocos estudios acerca de la relación entre la infección por ZIKV y el SGB, por su rápida propagación y graves secuelas neurológicas es necesario reunir evidencia que explique de manera clara y resumida, los nexos potenciales entre estas dos entidades. Por ello, el objetivo de este estudio fue describir los estudios que han reportado la relación entre el SGB y ZIKV, a partir de la revisión de publicaciones de la literatura científica.
Material y Métodos
Tipo de estudio: Revisión sistemática de la literatura.
Protocolo de búsqueda y selección de estudios
Identificación de estudios: Se realizó una búsqueda de información por sensibilidad, garantizando la exhaustividad al incluir cuatro bases de datos especializadas y multidisciplinarias (Medline-PubMed, Science-Direct, Scielo y Scopus), un motor de búsqueda abierto (Scholar-Google) y seis estrategias de búsqueda diferentes, las cuales se construyeron a partir de la identificación de términos sinónimos para Virus Zika y síndrome Guillain Barré vía cosecha de perlas.
Las seis estrategias de búsqueda fueron: Zika and Guillain Barré, ZIKV and Guillain Barré, Zika and Fisher, ZIKV and Fisher, Zika and Polyradiculoneuropathy, ZIKV and Polyradiculoneuropathy. Algunas sintaxis empleadas fueron: (Zika[Title/Abstract]) and Guillain Barré[Title/Abstract]; TITLE-ABSTR-KEY(Zika) and TITLEABSTR- KEY(Polyradiculoneuropathy); (ab:((ti:(zika) and (Guillain Barré)))).
Tamización y elección de los estudios: en esta fase se aplicaron los siguientes criterios, estudios clínicos, originales, disponibles en inglés, español o portugués, y que hicieran explícito en el texto algún tipo de relación entre la infección por ZIKV y el SGB. Se debe precisar que también se hizo una búsqueda y tamización de los estudios referenciados en los artículos seleccionados.
Inclusión: Se realizó una síntesis de cualitativa de los estudios que cumplían el protocolo de investigación clasificándolos en estudios de caso, descriptivos y analíticos, para cada uno se hizo una extracción de variables que permitieran una caracterización de los manuscritos en términos de tiempo, lugar y persona.
Análisis de reproducibilidad
La búsqueda y selección de los estudios se hizo de manera independiente por parte de dos investigadores. Para garantizar la reproducibilidad de esta fase, las discrepancias se resolvieron por consenso. En la extracción también se garantizó la reproducibilidad a partir del diligenciamiento independiente de las variables de los estudios en un archivo plano en Excel.
Dado que la relación entre la infección por ZIKV y el SGB es muy reciente, y los estudios corresponden a diseños de investigación diversos, no se aplicó ninguna guía de evaluación de la calidad metodológica de los manuscritos ni análisis estadísticos, sólo se realizó una síntesis cualitativa de los principales hallazgos de cada tipo de estudio incluido (de casos u observacionales).
Resultados
En la búsqueda sin aplicación de los filtros propios de cada base de datos se obtuvieron 7.020 publicaciones que relacionan los términos de búsqueda y de éstos sólo 47 los incluían en título o resumen. Se excluyeron 4 estudios, dos de ellos consistían en el desarrollo de modelos murinos; en uno Lazear et al. utilizaron ratones carentes de componentes de la respuesta antiviral (knockout para diferentes IRFs e Ifnar1), los cuales producían pocas cantidades de interferón α/β para estudiar la patogénesis y el desarrollo de complicaciones neurológicas comparados con ratones wild type. En este estudio, se observó que los ratones con déficit en estas vías de señalización (responsables en parte de la respuesta antiviral) presentaron alta carga viral en suero, bazo, cerebro, médula espinal y testículos; además desarrollaron signos de enfermedad neurológica como debilidad y parálisis de las extremidades, consistente con lo observado en la infección viral en humanos [12]. En el otro estudio, se empleó el modelo murino A129 carente de receptores para IFN tipo I y el modelo AG129 carente de receptores para IFN tipo I y II; éstos mostraron signos de la enfermedad y afectación neurológica dependiente de la edad (los ratones más viejos no murieron y mostraron poca enfermedad) [13].
Los otros dos estudios comprendían caracterizaciones filogenéticas. En uno de ellos se reporta la secuencia genética completa de la primera cepa aislada en el caribe de una paciente de Martinica en diciembre de 2015; ésta pertenece al linaje asiático y comparte 99,9% de identidad con cepas que circularon previamente en la Polinesia Francesa y posteriormente en Sudamérica [14]. En el otro estudio se analizaron los datos genómicos de ZIKV disponibles en GenBank y se compararon las secuencias genéticas de las cepas pre-epidémicas y epidémicas, este estudio reveló cambios en la región codificante de la proteína NS2B, lo que sugiere recombinación genética, además se evidenciaron cambios en la región 3?UTR de la proteína NS5, concluyendo que las mutaciones en otros flavivirus pueden asociarse con cambios en la virulencia, la eficacia de replicación, epítopes antigénicos y tropismo; se deben realizar más estudios para indagar sobre la importancia biológica de estos cambios [15,16].
Adicional a lo anterior, se excluyeron 30 estudios que correspondían a revisiones de tema, editoriales o comunicados de OMS, CDC u otras organizaciones de salud, así como dos estudios de caso de infección por ZIKV sin SGB, un estudio descriptivo publicado como ponencia que usó datos de otras investigaciones y un artículo no disponible. En total se incluyeron 9 estudios, 4 correspondían a reportes de caso, 4 a estudios descriptivos y un estudio de casos y controles (Figura 1).
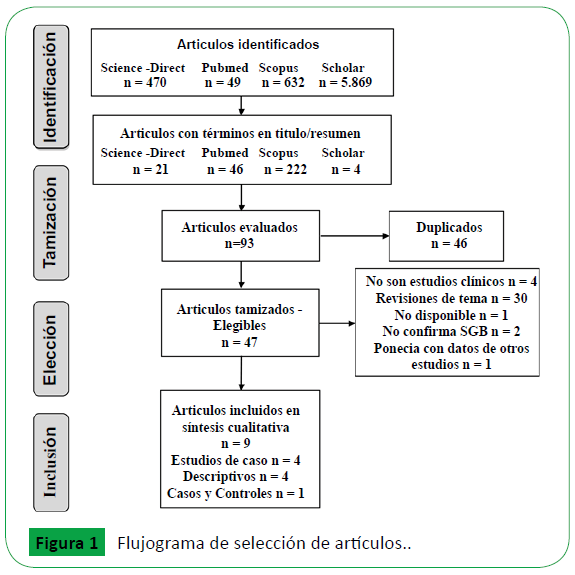
Figure 1: Flujograma de selección de artículos.
La ventana de tiempo de las publicaciones fue de 4 años (2013- 2016), la mayoría de la Polinesia francesa, con un bajo número de pacientes que simultáneamente presentaron la infección viral y el SGB, y un bajo grado de calidad de evidencia de la relación de estas dos entidades (Tabla 1).
| Autor |
Año |
Lugar de estudio |
N |
| Publicación |
Reporte |
| De caso |
| Oehler E [16] |
2014 |
2013 |
Polinesia francesa |
1 |
| Brasil P [17] |
2016 |
2014 |
Rio de Janeiro, Brasil |
1 |
| Rozé B [18] |
2016 |
2016 |
Martinica |
2 |
| van den Berg B [19] |
2016 |
2016 |
Países bajos |
1 |
| Descriptivo |
| Watrin L [7] |
2016 |
2014 |
Polinesia Francesa |
42 |
| Thomas D [20] |
2016 |
2015-2016 |
Puerto Rico |
29 |
| Cardoso C [21] |
2015 |
2015 |
Salvador y Brasil |
24a |
| García E [22] |
2016 |
2016 |
Polinesia Francesa, Brasil, Colombia, El Salvador y Venezuela |
1708b |
| Caso Control |
| Cao-Lormeau V [10] |
2016 |
2014 |
Polinesia Francesa |
42 |
| a: 14835 con exantema, 24 con SGB de los cuales se confirmaron 3 con ZIKV; b: Con SGB. |
Tabla 1: Descripción de los estudios.
En la Tabla 2 se presenta un resumen de los principales datos de los estudios de caso incluidos en esta revisión, se destacan el hecho que todos correspondían a casos de SGB con diagnóstico confirmado de infección por ZIKV, o infectados que subsecuentemente desarrollaron el SGB. Se destaca el hecho de que para el diagnóstico de SGB se emplearon los mismos métodos, es decir, anamnesis, electromiograma, MRI, examen neurológico y estudios de conducción nerviosa; mientras que en la parte microbiológica se hizo diagnóstico molecular (RTPCR) y serológico (detección de anticuerpos IgG o IgM) del ZIKV, al tiempo que se descartan infecciones que cursan con cuadros clínicos similares (Tabla 2).
| Estudio |
Descripción de casos |
Ayudas diagnósticas y resultados |
| Oehler [16] |
Mujer de 40 años con trastornos neurológicos (parestesia de las cuatro extremidades que evolucionó hasta debilidad muscular ascendente) de SGB. 7 días antes del ingreso al hospital presentó mialgia, febrícula, erupción cutánea y conjuntivitis. En el día 3 desarrolló tetraparesis, mialgia difusa, parálisis facial periférica bilateral asimétrica y ausencia de reflejos tendinosos profundos. |
Electromiograma que confirmó trastorno difuso desmielinizante, sin anomalías axonales. Pruebas serológicas negativas (día 8) para VIH, hepatitis B y C, Campylobacterjejuni y Leptospira. IgG de una infección resuelta por CMV, virus de Epstein-Barr y Herpes simple 1 y 2. Se detectóIgG anti DENV e IgM anti ZIKV. La prueba de neutralización por reducción en placa reveló infección reciente por ZIKV y resuelta por DENV. |
| Brasil [17] |
Ama de casa de 24 años con cefalea, fiebre, erupción eritematosa macular difusa, hiperemia conjuntival bilateral no purulenta, enantema del paladar, un ganglio linfático cervical agrandado e indoloro, hinchazón de las manos y los pies sin signos de meningismo. Fuerza reducida en las piernas, ausencia de reflejos tendinosos profundos en las rodillas, tobillos y plantas; reducida sensación al tacto suave en las piernas. |
El examen neurológico de los brazos, punción lumbar (día 6), estudios de conducción nerviosa, electromiograma (día 10), y la resonancia magnética de médula espinal MRI (día 13) fueron normales. Se aisló ZIKV mediante RT-PCR en suero (día 5), LCR (día 6), saliva (día 10) y en la orina (día 11); No se detectó DENV y CHIKV. El LCR y suero fueron negativos para IgM anti-DENV e IgM anti-CHIKV (ELISA). |
| Rozé [18] |
Diagnóstico de SGB con anamnesis, 15 después del inicio de los síntomas neurológicos dio positivo en orina para ZIKV (negativo en plasma y LCR) |
Diagnóstico neurológico apoyado en MRI), electromiografía y estudios de conducción nerviosa. ZIKV por RT-PCR de LCR, plasma y orina. Descartaron por test serológico Campylobacterjejuni, C. fetus, Mycoplasmapneumoniae y VIH; por PCR de LCR virus herpes simple, varicela zoster y CMV |
| van den Berg[19] |
Mujer de 60 años con diarrea, fiebre, marcha inestable, elevación de creatina quinasa y diagnóstico inicial de rabdomiólisis asociada a miositis o el uso de medicamentos. Los niveles de creatina quinasa se normalizaron rápidamente y el paciente desarrolló debilidad muscular, alteraciones sensoriales, hiporreflexia en sus extremidades y diplejía facial |
El diagnóstico de SGB se apoyó en análisis de LCR y electromiografía. ZIKV se detectó en suero y orina. El paciente fue tratado con inmunoglobulinas intravenosas, y se recupera |
Tabla 2: Descripción de los estudios de casos.
`
En algunos reportes de caso se hacía explícita la evolución del paciente con resolución de las erupciones, la hinchazón y otros síntomas relacionados con la movilidad, en menos de dos semanas, y una completa recuperación de la fuerza muscular cerca del día 40 [16,17].
En la Tabla 3 se resumen las principales mediciones y resultados reportados en los cuatro estudios descriptivos incluidos en esta revisión, al igual que en los estudios de caso, el diagnóstico de ZIKV se basó en pruebas moleculares (RT-PCR) en diferentes muestras como orina, plasma o LCR, mientras que el diagnóstico del SGB se basó en evaluación neurológica con tomografía axial computarizada, resonancia magnética y clínica. En los resultados de estos estudios sólo se presentan nexos espaciales y temporales entre el aumento de casos de SGB en zonas endémicas o posteriores a brotes por ZIKV.
| Estudio |
Métodos |
Resultados |
| Watrin L [7] |
Diagnóstico de SGB pocas semanas después la epidemia causada por el ZIKV que afectó al 10% de la población. Datos retrospectivos, clínicos, electrofisiológicos, biológicos y radiológicos (tomografía axial computarizada de cerebro, resonancia magnética del cerebro y la columna vertebral) |
45% no eran capaces de caminar sin ayuda, 24% tragaba con dificultad, 74% tenía debilidad motora de las extremidades, casi la totalidad con reflejos tendinosos profundos disminuidos o ausentes, 38% ingresaron a UCI. La punción lumbar mostró proteínas elevadas en el 90% de los casos, 100% con conteo celular menor a 50/mL |
| Thomas [20] |
Detección de ZIKV por RT-PCR y ELISA para IgM anti-ZIKV. Se descartó DENV mediante la detección de IgM anti-DENV. Se definió como enfermedad por ZIKA confirmada por laboratorio cuando se detectó ARN de ZIKV por RT-PCR o IgM anti-ZIKV, con IgM anti-DENV negativo |
Durante noviembre 23 de 2015 y enero 28 de 2016 se reportaron 155 casos sospechosos de ZIKV y se confirmaron 30 casos. 77% con rash, 77% mialgia, 73% artralgia y 73% fiebre, 3,3% (un paciente) desarrolló SGB caracterizado por parestesias y debilidad en extremidades, debilidad facial bilateral, arreflexia y parálisis ascendente; correspondiente polineuropatíadesmielinizante inflamatoria aguda (una de las variantes del SGB) |
| Cardoso [21] |
En 10 centros de salud pública se hizo vigilancia centinela para pacientes con enfermedad exantemática aguda de causa desconocida asociada con virus Zika, Chikungunya y Dengue; con búsqueda retrospectiva y prospectiva de casos sospechosos. Se descartó rubeola (IgM e igG), sarampión (IgM), DENV (NS1, IgM), parvovirus B19 (IgM e IgG) y CHIKV (RT-PCR). Se hizo detección de ZIKV con RT-PCR |
Se reportaron 14.835 casos de enfermedad exantemática aguda indeterminada, la tasa global de ataque fue de 5,5 casos/1.000 personas. En el mismo periodo se reportaron 2.630 casos sospechosos de DENV, 58 casos sospechosos de Chikungunya, 24 pacientes con sospecha de SGB y sólo se confirmó ZIKV en 3 de ellos |
| Garcia[22] |
Se describe la evolución del ZIKV desde el primer aislamiento en África, hasta la reciente epidemia en América, con el aumento de casos de SGB y microcefalia que coinciden espacial y temporalmente con la epidemia del ZIKV |
Aumento de casos de SGB durante los brotes de ZIKV en Brasil, Colombia, El Salvador y Venezuela |
Tabla 3: Caracterización de los estudios descriptivos.
En general, los estudios descriptivos sugieren una covariación entre brotes de ZIKV y el aumento de SGB, enfatizan la ausencia de una relación causal y la baja calidad de los datos disponibles para consolidar esta hipótesis.
Finalmente, el único estudio analítico tomó un grupo de 42 casos de SGB y los comparó con dos grupos control, el primero conformado por 98 pacientes con enfermedad no febril equiparados por edad, sexo y residencia, el segundo conformado por 70 pacientes con ZIKV sin síntomas neurológicos equiparados por edad; en todos se aplicó RT-PCR, inmunofluorescencia y seroneutralización para ZIKV y DENV. Entre los pacientes con SGB, 98% tenían IgM o IgG anti-ZIKV, 100% anticuerpos neutralizantes, 88% presentaron síntomas sugestivos de infección por ZIKV entre 4 y 6 días previos a las alteraciones neurológicas y una recuperación más rápida a la normal, sugiriendo una potencial mediación de anticuerpos diferentes a los anticuerpos antiglicolípidos o por factores neurotóxicos desconocidos [10].
Discusión
De los 9 estudios seleccionados sólo uno fue de casos y controles, este brinda la información más relevante y concluyente de todos los estudios, pues es el primero y único que proporciona evidencia relativamente alta sobre la relación de la infección por ZIKV y el subsecuente desarrollo de SGB. En este estudio además se descarta la relación de infección anterior con DENV, pues no hubo diferencias significativas entre los casos de SGB y los grupos control, en cuanto a co-infección o inmunidad previa.
Debido a que la mayoría de las personas infectadas con ZIKV no manifiestan síntomas, o las que presentan síntomas leves de la enfermedad podrían no haber buscado atención médica, los casos reportados podrían subestimar la incidencia de la infección por ZIKV. Sin embargo, en el estudio de casos y controles la mayoría de los pacientes con SGB tenían antecedente de infección reciente por ZIKV confirmado por laboratorio (todos tenían anticuerpos neutralizantes anti ZIKV) y 88% fueron sintomáticos, reportando como síntomas más comunes el rash (81%), artralgia (74%) y fiebre (58%) [10]. El hecho que casi todos los casos de SGB se presentaron entre 4 y 6 días antes de los síntomas neurológicos resulta relevante por la relativa rapidez en la aparición de dichas manifestaciones clínicas.
Los estudios descriptivos no son concluyentes con respecto a la asociación entre infección por ZIKV y posterior desarrollo de SGB, si bien se acepta que hay un aumento coincidente de casos de SGB con el comienzo de las epidemias del ZIKV en diferentes países de zonas tropicales y subtropicales, y a pesar de exhibir información epidemiológica y clínica útil, se sugiere más investigación del tema.
Uno de estos estudios sugiere además una potenciación del SGB mediada por una posible interacción del ZIKV con el HLA de la población polinesia [7]. Si bien esta hipótesis no ha sido demostrada, los casos posteriores en países de latinoamérica, como Brasil, Colombia y El Salvador suponen que, aunque pueden existir factores del hospedero implicados en el desarrollo del síndrome, estos no necesariamente se relacionan con características propias de cada población, tales como la etnia [10,22]. A su vez también se sugiere la hipótesis de la evolución genética del virus, haciéndolo más patógeno, con base en la aparición de complicaciones no registradas durante el reporte de casos esporádicos en Asia y África [16].
En relación con el protocolo para la confirmación por laboratorio de infección vigente o previa por ZIKV, existen discrepancias debido a que cada país y sus diferentes laboratorios de referencia procesan las muestras según sus estándares, normativas o recursos; cabe mencionar que las muestras también pueden variar según el estadio de la enfermedad, aunque a la fecha no se dispone de estudios rigurosos que den cuenta de las potenciales variaciones en la utilidad diagnóstica de diferentes pruebas, así como la potencial variabilidad de su validez y desempeño en diversas muestras biológicas.
El método más aceptado para la detección de ZIKV es RT-PCR, pero este tiene limitaciones, ya que la viremia sólo dura en promedio 5 días luego del comienzo de los síntomas (en caso de presentarse), pasado este tiempo el ARN del virus en suero o plasma es indetectable. Se ha sugerido entonces el uso de otras muestras y algunos estudios han demostrado que el virus puede detectarse en orina por más de 15 días [18], así como en semen y saliva [17]. A partir de esto, surge la hipótesis que el compartimento genitourinario posee tolerancia inmune para la replicación del ZIKV [18].
Cuando la toma de muestra es posterior a la infección, es útil la detección de IgM e IgG, que en el caso de los estudios analizados se realizó con diversas técnicas como inmunofluorescencia indirecta, ELISA y seroneutralización [10,17,20,23]. Las metodologías basadas en el estudio serológico tienen una gran desventaja, puesto que suelen presentar reacciones cruzadas entre los anticuerpos anti-ZIKV y anticuerpos contra otros flavivirus, dando lugar a falsos positivos [24]. Además, la circulación simultánea de otros virus que cursan con una sintomatología similar, da lugar a la necesidad de que todo caso sospechoso de infección por ZIKV inicie descartando infección por DENV y CHIKV [20].
Las metodologías descritas son útiles para la confirmación de caso sospechoso de ZIKV, pero si se sospecha SGB debe realizarse además diagnóstico diferencial con otros agentes patógenos susceptibles de producir el síndrome como Campylobacter jejuni, C. fetus, Mycoplasma pneumoniae, VIH, hepatitis By C, Leptospira, CMV, virus de Epstein-Barr, Herpes simplex tipo 1 y 2, Varicella zoster, virus de la rubeola, sarampión, parvovirus B19, DENV e incluso poliovirus [16,18,21].
Con respecto al diagnóstico de SGB, se sospecha cuando la persona presenta debilidad en las extremidades (primero en las piernas y luego en los brazos), acompañado a menudo de adormecimiento y/u hormigueo en las extremidades afectadas [16]. En los estudios analizados, el diagnóstico se realizó por neurólogos de acuerdo a estándares internacionales (Diagnosis of Guillain-Barré syndrome and validation of Brighton criteria), en los cuales se tienen en cuenta la anamnesis, junto con los datos clínicos y electrofisiológicos; si el examen neurológico muestra pérdida de reflejos tendinosos profundos en áreas como tobillos o rodillas, corrobora el diagnóstico de SGB. Adicional a ello, en uno se recogió datos biológicos y radiológicos (tomografía axial computarizada de cerebro, resonancia magnética del cerebro y la columna vertebral) para el diagnóstico diferencial [7].
Con respecto a la variante de SGB post infección por ZIKV, la información es aún controversial, hay casos concretos (incluido el artículo de casos y controles) que lo clasifican como Neuropatía Axonal Motora Aguda (NAMA) [7,10], pero en otros lo clasifican como Polineuropatía Desmielinizante Inflamatoria Aguda (PDIA) [7,20]. Sólo en el estudio de casos y controles, justifican esta discordancia argumentando que las latencias distales prolongadas y el reducido potencial de acción muscular compuesto, registrado al ingreso de los pacientes, podrían haber sido interpretadas como enlentecimiento desmielinizante y bloqueo de la conducción, lo que lleva a la clasificación del patrón de síndrome de Guillain-Barré variante PDIA con una posible degeneración axonal. Sin embargo, la desaparición de las alteraciones de conducción motora distal durante el seguimiento de un subgrupo de pacientes, sin desarrollo de dispersión temporal anormal o desaceleración de la conducción en segmentos de nervio intermedio, fue consistente con "fallo de conducción reversible" descrito en AMAN [10].
Por último, en relación a la posible explicación de cómo el ZIKV causa el SGB, se mencionan varias teorías, entre ellas presencia de anticuerpos antiglicolípidos y neurotoxicidad; sin embargo, no se ha comprobado aún ninguno de estos mecanismos. En el artículo de casos y controles se estudió la actividad de anticuerpos antiglicolípidos comunes en SGB causado por Campylobacter: GM1, GA1, GM2, GD1a, GD1b y GQ1b usando ELISA y glucoensayo; sólo se detectaron anticuerpos antiglicolípidos en 31% de los casos por ELISA y en un 46% por glucoensayo. Los autores sugieren que el síndrome podría no ser mediado por anticuerpos antiglicolípido, sino más bien ser mediado por otros autoanticuerpos específicos o factores neurotóxicos desconocidos [10].
En conjunto, los resultados de la revisión sistemática muestran un potencial efecto neurotrópico del ZIKV, un profundo desconocimiento sobre mecanismos fisiopatológicos que brinden plausibilidad teórica y biológica a la relación ZIKV y SGB, así como de la coestimulación que puede presentarse por infecciones con otros arbovirus. A ello se suma la identificación de múltiples retos diagnósticos como la corta viremia, la reactividad cruzada, baja viremia en casos asintomáticos y controversias sobre la duración de la viruria [18].
En Colombia se han definido recomendaciones para las acciones de vigilancia epidemiológica de los casos de Síndrome de Guillain- Barré con antecedentes de enfermedad febril compatible con infección por virus Zika. Entre estas recomendaciones, se encuentra la notificación individual e inmediata de los casos sospechosos de Zika, así como de las complicaciones neurológicas con posible antecedente de enfermedad por virus Zika a través de fichas del Sivigila. Además, se recomienda la toma de muestras de suero a todos los pacientes que presenten algún tipo de complicación neurológica y de líquido cefalorraquídeo si las condiciones médicas y el criterio del médico tratante lo permiten.
Desde el 15 de diciembre de 2015 hasta la semana epidemiológica 32 de 2016, se han notificado al sistema de vigilancia epidemiológica 616 casos de síndromes neurológicos (Síndrome de Guillain-Barré, polineuropatías ascendentes, entre otras afecciones neurológicas similares), con antecedentes de enfermedad febril compatible con infección por virus Zika. El 65,74% de estos casos, notificados bajo la vigilancia especial de síndromes neurológicos correspondieron a casos de Síndrome de Guillain-Barré (SGB) con antecedente de enfermedad compatible con infección por virus Zika (405 casos). La mayor proporción de estos casos se registraron en el departamento de Norte Santander con 83 casos (el 13,47%), mientras que el departamento de Antioquia registró 44 casos (7,14%) [25].
Como conclusión se plantea la baja calidad de la evidencia y la poca disponibilidad de estudios que permitan consolidar la hipótesis sobre la relación entre ZIKV y SGB. La confirmación de ZIKV como agente susceptible de causar SGB y no sólo una enfermedad leve y autolimitada, exige una mayor vigilancia e intensificación de la investigación epidemiológica y fisiopatológica. En términos de salud pública, los estudios sistematizados redundan en la necesidad de implementar acciones de control vectorial, a pesar del grado especulativo de la evidencia sobre ZIKV y SGB, ello sustentado en los nexos temporales y espaciales de su ocurrencia, su presencia en zonas con alta densidad vectorial para otros arbovirus, la simultaneidad de la transmisión con DENV y CHIKV, y la expansión de estas entidades en el continente americano y zonas tropicales y subtropicales en general.
11383
References
- Zanluca C, Dos Santos CN (2016) Zika virus-an overview. Microbes Infect 18:295-301.
- Mansuy JM, Dutertre M, Mengelle C, Fourcade C, Marchou B, et al. (2016) Zika virus: high infectious viral load in semen, a new sexually transmitted pathogen? Lancet Infect Dis 16:405.
- Weaver SC, Costa F, Garcia-Blanco M, Ko AI, Ribeiro GS, et al. (2016) Zika Virus: History, Emergence, Biology, and Prospects for Control Antiviral Research130:69-80.
- InstitutoNacional de Salud de Colombia, Dirección de Vigilancia y AnálisisdelRiesgo en SaludPública (2016) Boletínepidemiológicosemanal. InstitutoNacional de Salud, Bogotá.
- Chang C, Ortiz K, Ansari A, Gershwin ME (2016) The Zika outbreak of the 21st century. J Autoimmun 68:1-13.
- Carod-Artal FJ (2016) Epidemiology and neurological complications of infection by the Zika virus: a new emerging neurotropic virus. Rev Neurol 62:317-328.
- Watrin L, Ghawché F, Larre P,Neau JP, Mathis S, et al. (2016) Guillain-Barré Syndrome (42 Cases) Occurring During a Zika Virus Outbreak in French Polynesia. Medicine (Baltimore) 95:e3257.
- Anaya JM, Ramirez-Santana C, Salgado-Castaneda I, Chang C, Ansari A, et al. (2016) Zika virus and neurologic autoimmunity: the putative role of gangliosides. BMC Med 14:49.
- Cao-Lormeau V, Blake a, Mons S, Lastere S, Roche C, et al. (2016) Guillain-Barré Syndrome outbreak caused by ZIKA virus infection in French Polynesia. Lancet 387:1531-1539.
- Willison H (2007) Gangliosides as targets for autoimmune injury to the nervous system. J Neurochem 103:143–149.
- Lazear HM, Govero J, Smith AM, Platt DJ, Miner JJ, et al. (2016) A Mouse Model of Zika Virus Pathogenesis. Cell Host Microbe 19:720-730.
- Rossi SL, Tesh RB, Azar SR, Muruato AE, Hanley KA, et al. (2016) Characterization of a Novel Murine Model to Study Zika Virus. Am J Trop Med Hyg 94:1362-1369.
- Piorkowski G, Richard P, Baronti C, Gallian P, Charrel R, et al. (2016) Complete coding sequence of Zika virus from Martinique Outbreak in 2015. New Microbes New Infect 11:52-53.
- Zhu Z, Chan JFW, Tee KM, Choi GKY, Lau SKP, et al. (2016) Comparative genomic analysis of pre-epidemic and epidemic Zika virus strains for virological factors potentially associated with the rapidly expanding epidemic. Emerg Microbes Infect 5:e22.
- Oehler E, Watrin L, Larre P, Leparc-Goffart I, Lastere S, et al. (2014) Zika virus infection complicated by Guillain-Barre syndrome--case report, French Polynesia, December 2013. Euro Surveill 19:7-9.
- Brasil P, Carvalho S, D’Avila F, Einsfeld Z, Amaral C, et al. (2016) Guillain-Barré syndrome associated with Zika virus infection.The lancet 387:1482.
- Rozé B, Najioullah F, Fergé JL, Apetse K, Brouste Y, et al. (2016) Zika virus detection in urine from patients with Guillain-Barré syndrome on Martinique, January 2016. Eurosurveillance 21:30154.
- van den Berg B, van den Beukel JC, Alsma J, van der Eijk AA, Ruts L, van Doorn PA, et al. (2016) Guillain-Barre syndrome following infection with the Zika virus. NederlandsTijdschriftVoorGeneeskunde 160:D155.
- Thomas DL, Sharp TM, Torres J, Armstrong PA, Munoz-Jordan J, et al. (2016) Local Transmission of Zika Virus - Puerto Rico, November 23, 2015-January 28, 2016. MMWR Morb Mortal Wkly 65:154-158.
- Cardoso CW, Paploski IAD, Kikuti M, Rodrigues MS, Silva MMO, et al. (2015) Outbreak of Exanthematous Illness associated with Zika, Chikungunya, and Dengue viruses, Salvador, Brazil. Emerging Infectious Diseases 21:2274-2276.
- García E, Yactayo S, Nishino K, Millot V, Perea W, et al. (2016) Zika virus infection: global update on epidemiology and potentially associated clinical manifestations. WklyEpidemiol Rec 7: 73-88.
- Huang ASE, Shu PY, Yang CH (2016) A new reportable disease is born: Taiwan Centers for Disease Control’s response to emerging Zika virus infection. J Formos Med Assoc 115:223-225.
- Lazear HM, Diamond MS (2016) Zika Virus: New Clinical Syndromes and its Emergence in the Western Hemisphere. J Virol JVI.00252-16.
- InstitutoNacional de Salud de Colombia, Dirección de Vigilancia y AnálisisdelRiesgo en SaludPública (2016) Boletínepidemiológicosemanal. SemanaEpidemiológicanúmero 32 de 2016.07 de Agosto-13 de Agosto.InstitutoNacional de Salud, Bogotá.






