Keywords
TNF-alpha, Alzheimer, etanercept, perispinal
Introducción
La neuroinflamación con una sobreexpresión de citocinas es una característica estándar de la patología cerebral presente en la enfermedad de Alzheimer [1-4]. Durante mucho tiempo se ha sospechado la implicación de la citocina proinflamatoria factor-alfa necrótico tumoral (TNF-alfa) en la patogénesis de la enfermedad de Alzheimer [5-9]. Hay un incremento de evidencias de la ciencia básica, genética y clínica que ahora apoyan el concepto que un exceso de TNF-alfa juega un papel central en la enfermedad de Alzheimer [5-25].
En 1998 se aprobó para uso humano el etanercept, potente anti-TNF terapéutico, con la artritis reumatoide como indicación inicial. Etanercept es una proteína de fusión recombinante dimérica que consiste de porciones extracelulares de ligando de dos receptores humanos de p75 TNF-alfa vinculados con el fragmento Fc del IgG1 humano. Etanercept se ata al TNF-alfa y bloquea su interacción con la superficie celular de los receptores TNF-alfa, reduciendo con esto el efecto biológico del exceso de TNF-alfa. La comunidad médica tiene ahora más de1 millón de pacientes por año de experiencia con el uso de etanercept para tratar una variedad de desordenes inflamatorios en los que se ha postulado que el TNF-alfa juega un papel [26].
En el 2006 los autores presentes publicaron un estudio piloto que proporcionó la prueba del concepto que un método novel de administración del etanercept era eficaz para tratar la enfermedad de Alzheimer [20]. Se postuló que este método novel, la administración periespinal extratecal en la nuca posterior, mejoraba la liberación de etanercept al cerebro vía el sistema venoso cerebroespinal [21,27]. En un estudio abierto de 15 pacientes tratados semanalmente durante un periodo de seis meses, la administración periespinal extratecal de etanercept llevó a una mejoría cognitiva sostenida en esta cohorte de pacientes con una probable enfermedad de Alzheimer con un rango de gravedad de leve a severo [20]. El concepto de inhibición del TNF-alfa para tratar el Alzheimer ha sido revisado recientemente[22], y está apoyado por adicionales publicaciones recientes [16,18,23-25].
El estudio piloto de 2006 del autor fue una prueba clínica IRB-aprobada cuyo protocolo incluía tests cognitivos mensuales. No había provisión para hacer tests con intervalos más cortos. No obstante, durante la duración de seis meses de esta prueba clínica, y ahora durante un periodo de más de tres años, los autores han notado un fenómeno clínico inesperado y sobre todo sin precedentes, que han observado semanalmente en la mayoría de los pacientes tratados. Este fenómeno inesperado, pero repetidamente observado era una notable mejoría clínica a los pocos minutos de la administración periespinal de etanercept [21]. Aunque no se podía medir esta rápida mejoría clínica con los intervalos de valoración que estaban incluidos en el protocolo de la prueba clínica original, los autores tuvieron recientemente la oportunidad de cuantificar este rápido efecto del tratamiento con varios tests cognitivos estandardizados en un nuevo paciente tratado como parte de su consulta médica estándar. Este paciente es el sujeto del presente informe de caso.
La disfunción sináptica ha ido ganando más reconocimiento como importante componente patofisiológico de la enfermedad de Alzheimer [28-32]. Hay recientes evidencias que sugieren que el TNF-alfa puede estar implicado en esta disfunción sináptica [33-37]. Aunque el TNF-alfa es ampliamente conocido como citocina proinflamatoria, hay estudios de la ciencia básica que sugieren que el TNF-alfa también puede tener funciones completamente diferentes en el cerebro con Alzheimer: como regulador de la transmisión sináptica; y como mediador de la interrupción de _-amiloide y _-amiloide oligomero de los mecanismos de la memoria [33-37].
El informe presente detalla las observaciones clínicas en este paciente con enfermedad de Alzheimer de comienzo tardío. Luego intenta proporcionar un marco teórico para explorar los mecanismos patofisiológicos subyacentes a la rápida mejoría en el comportamiento y la cognición del paciente, particularmente de los que implican el TNF-alfa y la función sináptica, que pueden ser culpables de los rápidos efectos clínicos observados después de la administración periespinal de etanercept.
Se ha identificado un exceso del factor-alfa necrosis tumoral (TNF) como diana terapéutica en la enfermedad de Alzheimer (AD) [1].
Se ha demostrado un exceso de TNF en el líquido cefalorraquídeo (LCR), con concentraciones 25 veces más altas que en los controles, en AD, y podría predecir la progresión de la enfermedad [2].
Etanercept es una proteína recombinante dimérica de fusión que consiste en porciones extracelulares ligandas de dos receptores humanos p75 TNF vinculados con el fragmento Fc del IgG1 humano, que funciona en vivo como potente terapéutico anti-TNF. Recientes informes de una rápida mejoría clínica en pacientes con AD y desordenes relacionados después de la administración periespinal de etanercept (MW = 150,000) sugirieron que etanercept tenía la capacidad de penetrar en el LCR del cerebro con una concentración terapéuticamente efectiva [3,4], una capacidad que recientemente fue demostrada para otro antagonista de citoquina, el receptor antagonista interleukina-1 (IL1-RA) (MW = 17,000) [5].
Para investigar esta posibilidad se conjugó el etanercept con 64Cu, usando un método desarrollado por uno de los autores [6].
64Cu es emisor de positrones. Cuando se ata al etanercept, utilizando el agente quelante (1,4,7,10-tetraazadodecane-N,N’,N”,N”’-ácido tetracético (DOTA), se produce una molécula, 64Cu-DOTA-etanercept, cuya distribución anatómica puede ser puesta en imagen con tomografía de emisión de positrones (PET) [6]. Para examinar la distribución intracraneal de etanercept radio-etiquetado, se efectuó una imagen microPET del cerebro de una rata viva seguida por la administración periférica de 64Cu- DOTA-etanercept.
Presentación del caso
Historial de la presente enfermedad
El paciente es un médico de 81 años derivado en Octubre 2007 para ser considerado para tratamiento periespinal con etanercept por su internista. El paciente había gozado de buena salud general hasta unos dos años antes de la presentación, que fue cuando su esposa notó progresivas dificultades con la memoria y con los cálculos matemáticos. Su esposa le remplazó para escribir los cheques y el paciente fue evaluado por un neurólogo hace 18 meses. Se prescribió Donepezil, pero no era tolerado y se discontinuó después de cuatro meses. Se prescribieron Memantina y rivastigmina, pero tampoco fueron tolerados por el paciente. Seis meses antes de la presentación se empezó con Galantamina, y se continúa actualmente con una dosis de 8 mg por día, reducido después de un intento con una dosis máxima de 16 mg por día debido a los efectos secundarios. Ni la familia del paciente, ni su médico de atención primaria notan efectos beneficiosos con la galantamina.
Los medicamentos actuales del paciente incluyen atorvastatina, bajas dosis de aspirina y galantamina 8 mg por día.
Pasado historial médico
El historial medico pasado del paciente incluye un disectomía lumbar y fusión efectuados veinte años antes, con dolor lumbar crónico intermitente y estenosis espinal; hipercolesterolemia; y cáncer de próstata localizado, tratado con éxito con radiación localizada sin signos de recurrencia. Para el resto el historial médico pasado era común y corriente, sin historial de diabetes, ataques, ataques isquémicos transitorios, traumas de cabeza, epilepsia, pérdida de conciencia, alucinaciones, recientes infecciones, enfermedad desmielinazante o enfermedades de sangre o sangrado, linfoma, fallo cardiaco congestivo, enfermedad autoinmune, inmunosupresión, tuberculosis o alteraciones visuales. La prueba derivativa con proteínas purificadas era negativa. El historial familiar de demencia o enfermedad neurodegenerativa era negativo.
Examen físico
El examen físico general era común y corriente. La presión sanguínea era 150/90, pulso 80 y regular, sin fiebre, respiraciones 12. El pecho estaba limpio a percusión e auscultación. No había murmullos cardiacos, ni crujidos en el cuello.
Examen neurológico un día antes del tratamiento con etanercept Los resultados del examen neurológico por el autor HG un día antes de la administración de etanercept eran como siguen:
Examen del nervio craneal II-XII estaba dentro de los límites normales: pupilas de 4 mm, redondas y reactivas a luz y acomodación. Los discos planos. Los campos visuales llenos a la confrontación; los movimientos extraoculares estaban conjugados y llenos sin nistagmus. El movimiento y las sensaciones faciales estaban simétricos y sin déficits. El paciente era capaz de íir dedo crujiendo en ambas oídos, sin embargo el procesamiento auditivo parecía disminuido y intermitentemente pedía de repetir las preguntas. Weber estaba en la línea media, la conducción del aire era mayor que la conducción ósea bilateralmente, el paladar era normal, la fuerza de esternocleidomastoideo era normal, la fuerza del trapecio era normal y los movimientos de la lengua eran normales.
Ausencia de temblores.
El examen motor y del cerebelo era corriente. Los reflejos profundos de los tendones eran como sigue: bíceps dos plus y simétrico, tríceps uno plus y simétrico, supinator a la derecha ausente, a la izquierda uno plus, cuadriceps uno plus bilateralmente, tobillos ausente a la derecha y uno plus a la izquierda. Signos de dedos de pies flexores. No hay tendencia de pronator, movimientos involuntarios anormales o Romberg. Había simétrico tono muscular, bulk y desarrollo desde el principio hasta el final. Estación y deambulación normales, y alternación de movimientos rápido y normal, dedo a dedo normal, y deambulación normal. No había signos de liberación frontales, excepto para un signo palmomental bilateral positivo.
Las respuestas del examen sensorial eran intactas en todas las posiciones articulares, con molestia pequeña y suave tocamiento. Había leve disminución de la sensación vibratoria solamente en el halux derecho. El examen del estado mental efectuado un día antes de la administración de etanercept reveló un hombre que parece digno y más joven que su edad declarada, aseado y socialmente extrovertido de modo cautivador. No había agitación, desconfianza, ni hostilidad. A veces parecía inapropiadamente eufórico. Tenía dificultades para recordar información autobiográfica personal, como su fecha de nacimiento o el trabajo de su padre. No podía recordar los nombres de ninguno de los médicos que le trataban. No estaba orientado respecto al día del calendario, de la semana, año, lugar, ciudad o estado.
Su discurso espontáneo parecía fluido con prosodia, articulación y normal ratio de producción de habla, sin ninguna disartria. En un examen detallado tenía una marcada afasia anómica, i.e., cuando se le mostraban las primeras diez imágenes del Boston Naming Test [38], el paciente no podía nombrar nueve de las diez, pero utilizaba una marcada circunlocución. Fue capaz de repetir frases complejas sin dificultades. En una tarea de fluidez verbal, i.e., al pedirle en 60 segundos una lista de palabras que empezaban con la letra F, enumeró cinco palabras, con cinco respuestas perseveratorias y un neologismo. En una tarea semántica, i.e. se le pidió de enumerar todos los animales que podía en 60 segundes, solo fue capaz de nombrar dos, perro y gato.
El paciente fue capaz de copiar un cubo tridimensional, pero cuando se le pidió de dibujar un reloj y poner las manos en las 11.10h, dibujó un cuadrado sin números y una línea para la mano de la hora o una para la de los minutos [ver Figura 1]. No fue capaz de hacer la tarea del trazo alternado y le abrumó claramente la tarea [ver Figura 1]. Fue capaz de hacer una pantomima de cuatro de ocho construcciones de dedo de complejidad en aumento.
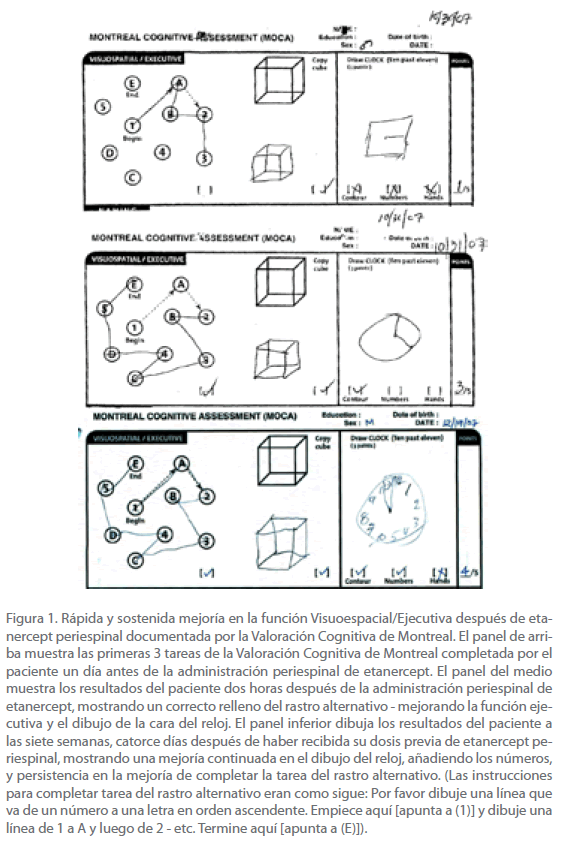
Figura 1. Rápida y sostenida mejoría en la función Visuoespacial/Ejecutiva después de etanercept periespinal documentada por la Valoración Cognitiva de Montreal. El panel de arriba muestra las primeras 3 tareas de la Valoración Cognitiva de Montreal completada por el paciente un día antes de la administración periespinal de etanercept. El panel del medio muestra los resultados del paciente dos horas después de la administración periespinal de etanercept, mostrando un correcto relleno del rastro alternativo - mejorando la función ejecutiva y el dibujo de la cara del reloj. El panel inferior dibuja los resultados del paciente a las siete semanas, catorce días después de haber recibida su dosis previa de etanercept periespinal, mostrando una mejoría continuada en el dibujo del reloj, añadiendo los números, y persistencia en la mejoría de completar la tarea del rastro alternativo. (Las instrucciones para completar tarea del rastro alternativo eran como sigue: Por favor dibuje una línea que va de un número a una letra en orden ascendente. Empiece aquí [apunta a (1)] y dibuje una línea de1 a A y luego de 2 - etc. Termine aquí [apunta a (E)]).
Se condujeron estudios en animales de acuerdo con los protocolos aplicables por el Stanford Animal Care Committee.
Se compró Etanercept (Immmunex, Amgen) en forma de polvo. Se prepare el ácido 64Cu-(1,4,7,10-tetraazadodecano-N,N’,N”,N”’-tetracético (DOTA)-etanercept según descrito previamente [6]. Se inyectaron 150 microlitros de solución de 64Cu-DOTA-etanercept (ca. 1 mCi) sobre la espina cervical de una rata.
Sprague-Dawley de 250gr a nivel C 6–7 con una aguja de 30 gauge en una profundidad de 6 mm mientras la rata estaba anestesiada con 2.5% isoflurano inhalado. Luego se colocó la rata cabeza abajo suspendida del rabo durante tres minutos, inmediatamente seguido con una posición horizontal en la cama de un escáner de imágenes microPET (microPET R4 escáner modelo para roedores, Siemens Medical Solutions USA, Inc.) diseñado para escáneres estáticos de 5-minutos; se iniciaba el escáner dos minutos después de poner la rata en la cama del escáner y se efectuó entre cinco y diez minutos después de administrar el etanercept. La rationale para este método de administración periférica es liberar el etanercept en el sistema venoso cerebroespinal como discutido previamente [3,4,7-9]. Se reconstruían las imágenes con un algoritmo máximo de 2-dimensiones de expectación de subgrupos ordenados (OSEM), y no se necesitó corrección para atenuar o corrección del scatter.
En el test de la memoria, el paciente no podía recordar el nombre del médico HG después de 90 segundos, a pesar de unas repetitivas introducciones en al menos cuatro ocasiones durante el examen. Le llevó tres pruebas al paciente registrar cinco palabras y 90 segundos más tarde, el paciente no encontró ninguna de ellas, ni siquiera con preguntas categóricas. Cuando se le dieron respuestas de múltiples elecciones, fue capaz de encontrar dos palabras.
En una tarea de vigilancia, buscando la atención sostenida, el paciente cometió cuatro errores de omisión. Fue capaz de dar una lista de cinco dígitos hacía adelante, pero no pudo dar una lista de tres dígitos en orden contrario.
El paciente no fue capaz de hacer cálculos simples y no pudo dar series del siete. Cuando se le preguntó cuanto eran 29 más 11, después de una pausa marcada, dijo 31.
El paciente no pudo expresar conceptos abstractos como en qué son similares un tren y una bicicleta, un reloj y una regla, o la música y la pintura.
En el test de Valoración Cognitivo de Montreal (MOCA) [39] el paciente puntuó siete sobre 30 posibles puntos, consistente con una demencia cortical moderada a severa.
El paciente cumplía los criterios NINCDS-ADRDA para una probable EA [40], y, además, cumplía los criterios de la EA del Manual Diagnóstico y Estadístico de Enfermedades Mentales, Cuarta Edición (DSM-IV) [41].
Resultados de laboratorio
Un examen MRI en Marzo del 2006 mostró una difusa atrofia central y cortical relacionada con la edad. En Noviembre del 2006 un escáner cerebral de tomografía de emisión FDG de positrones en la UCLA mostró atrofia cortical moderada a severa, con hipometabolismo global cortical asociado con la atrofia y superimpuesto biparietal, temporal izquierdo y hipometablismo en la córtex cingulada posterior, leído como consistente con enfermedad de Alzheimer.
Un examen en laboratorio antes del tratamiento reveló una elevación estable, pero cerca del límite de nitrógeno y creatinina en la urea sanguínea, pero por el resto fue sin nada remarcable, incluyendo RX de pecho que fue sin nada remarcable, función tiroidea normal, pruebas de función hepática normal, recuento de sangre completo normal, electrolitos y glucosa en suero normal, antígeno específico de próstata normal, colesterol, triglicéridos, nivel de ácido fólico y vitamina B12 en suero, RPR no-reactivo y FTA-ABS no-reactivo.
Tratamiento
Se obtuvo del paciente y de su esposa un consentimiento informado firmado para la administración de etanercept después de enumerar los potenciales riesgos de etanercept, incluyendo infección, citopenias, posible incremento del riesgo de linfoma y enfermedad desmielizante muerte, inflamación ocular y fallo cardiaco congestivo; y abordajes de tratamiento alternativos.
Inmediatamente antes de la administración de etanercept el autor ET preguntó al paciente. No pudo dar el año, ni el nombre del estado.
Se administró 25 mg de etanercept en 1 cc de agua estéril mediante inyección posterior cervical interespinosa en la línea media con una aguja de 27 gauge en el interespacio C6–7 seguido por posicionamiento Trendelenburg de la cabeza durante cinco minutos, como hemos descrito previamente, para hacer efecto sobre la entrada del etanercept en el sistema venoso cerebroespinal [21,27]. El paciente no tuvo dificultades con esta posición y asumió la postura sentada sin incidentes.
Diez minutos después de administrarle la dosis, se volvió a examinar al paciente. Estaba notablemente más tranquilo, menos frustrado y más atento. Era capaz de identificar correctamente el estado como California e identificó el año como 2006. Sus respuestas a las preguntas parecían venir con menos esfuerzo y más rápidas, con menos latencia. Se fue a la consulta del autor HG para más tests.
Examen neurológico dos horas después del tratamiento con etanercept
Dos horas después de administrarle el etanercept, el paciente fue otra vez examinado por el autor HG. No era capaz de recordar haber estado antes el mismo día en la consulta del autor ET, pero sí se acordaba del nombre de HG. Ahora estaba orientado respecto al mes, día de la semana y sitio, y otra vez podía nombrar correctamente el nombre del estado de California, lo que no podía hacer antes de la administración periespinal del etanercept. Se equivocó en la fecha del calendario por dos días y por un año. A medida que pasaba la prueba parecía más conciente de su deficiente actuación.
La capacidad del paciente para ponerle nombres a las imágenes había mejorado marcadamente, nombró correctamente nueve de las primeras diez imágenes del Boston Naming Test short form, que requiere pistas fonémicas para tres de los ítems (Calamares, banco, y hamaca), una marcada mejoría respecto al día anterior cuando solo pudo nombrar una de las diez imágenes presentadas y utilizando una marcada circunlocución. En la prueba FAS de fluidez verbal fue capaz de dar en 60 segundos una lista de 8 palabras que empezaban con la letra F y solo dio una respuesta perseveratoria. En una tarea de categorías semánticas fue capaz de dar una lista de 5 animales en 60 segundos.
Respecto al funcionamiento visuoespacial el paciente podía copiar un cubo tridimensional y cuando se le pidió dibujar un reloj, pintó un círculo con una manilla de hora y minutos [ver Figura 1]. Cuando se le dio el test B de pistas modificadas el paciente era claramente capaz de secuenciar y de completar la tarea, alternar letras y números de forma correcta [ver Figura 1]. Fue capaz de hacer una pantomima de siete de ocho construcciones de dedo con complejidad en aumento.
En la prueba de memoria el paciente no podía recordar ninguno de los cinco datos después de cinco minutos, ni siquiera con pistas de categorías. Con opciones múltiples pudo recordar uno de cinco datos. Sin embargo, como se mencionó antes recordó en nombre del examinador sin dificultades y sin necesidad de repetir las introducciones durante todo el examen.
En las pruebas de atención el paciente pudo dar correctamente una lista de cinco dígitos en orden subiendo y tres al revés. En una tarea A de vigilancia no cometió errores de omisión o comisión.
Con los cálculos pudo restar correctamente siete de cien, pero no pudo hacer serie de siete. No fue capaz de dividir 58 entre dos, ni sumar 29 más 11. No pudo decirle al médico HG cuántos céntimos había en un dólar.
Respecto la capacidad de los conceptos abstractos fue capaz de relacionar en qué eran similares un tren y una bicicleta; que ambos valían para el transporte. Cuando se le preguntó en qué se parecían un reloj y una regla, dijo que ambas daban información. Cuando se le preguntó en qué se parecían la mú nica durante la semana, hecho que fue informado por la familia [ver hoja adicional 1]. Se notó que era menos renuente a participar en la conversación. Cuando lo volvió a examinar el autor ET antes de repetir la dosis una semana después de la dosis inicial, el paciente identificó correctamente año, mes, estación del año, día de la semana y estado. Parecía responder con menos frustración, y la impresión del examinador era que había menos latencia de respuesta, y que su afectación parecía haber mejorado. En el test FAS para la fluidez verbal, cuando se le pidió de dar una lista de todas las palabras que conocía empezando con F, en 60 segundos enumeró 8 palabras y nombró 5 animales en 60 segundos. El paciente recibió una simple dosis de etanercept periespinal durante cada una de las primeras cinco semanas; se omitió la siguiente dosis y el paciente volvió después de siete semanas y fue otra vez testado. A las siete semanas, catorce días después de haber recibido la última dosis de etanercept periespinal, la puntuación de la Valoración Cognitiva Montreal fue de 14, tuvo una persistente mejoría en la tarea de hacer trazas, y dibujaba mejor la cara del reloj [ver Figura 1].

Figure 2: Película Quicktime. Video que describe los cambios que vio la familia en el paciente después del tratamiento periespinal con etanercept. Formato: MOV Tamaño: 3.5MB
Bajar video: https://www.jneuroinflammation.com/content/download/ supplementary/1742-2094-5-2-s1.mov
Ver película: https://www.jneuroinflammation.com/content/5/1/2/suppl/ S1
Discusión
La hipótesis preferida de los autores para explicar la rápida mejoría clínica observada se centra en la evidencia emergente, lo que sugiere que el TNF-alfa es de crítica importancia en la regulación de transmisión sináptica en el cerebro. Los autores son llevados en esta dirección por la combinación de:
1. La extrema rapidez del efecto;
2. La extraordinaria potencia y selectividad de etanercept como agente anti-TNF-alfa, debido a su naturaleza biológica y estructura molecular;
3. Las varias líneas de evidencia científica que han sugerido que la disfunción sináptica puede ser de importancia clave en la patogénesis de la enfermedad de Alzheimer [28-32];
4. La evidencia que sugiere que el TNF-alfa regula la transmisión sináptica en el cerebro [33-35,42,43]; y,
5. La evidencia que sugiere que el TNF-alfa media en la disfunción sináptica subyacente al deterioro cognitivo y conductual producido tanto por los beta-amiloides y los oligomeros beta-amiloides [36,37]. Una debilidad del estudio presente es el hecho que todos los participantes, incluyendo los médicos examinadores, eran concientes de la modalidad de tratamiento empleada lo que, potencialmente, podía predisponer los resultados, y no se puede excluir un efecto placebo. Sin embargo hay que denotar que la mejoría clínica, cognitiva y conductual en el paciente presente fue notada por sus familiares, amigos y ambos autores, y confirmados por el uso de varias medidas objetivas. La mejoría de ocho puntos del MOCA, de una puntuación de siete a 15, es notable porque excede la variación normal test-retest (0.9+/- 2.5 puntos [44]) en más de tres desviaciones estándar. El MOCA fue diseñado para medir ocho dominios cognitivos, y es particularmente sensible a los cambios en la función ejecutiva [44]. Esto es ilustrado por los resultados del paciente el la parte de trazos del test, y también en el dibujo del reloj [ver Figura 1].
Según la experiencia de los autores, la mejoría de la fluidez verbal, como sugerida por esta mejoría del paciente en los nombres de categorías, los nombres de animales y los resultados de los Nombres de Boston, es un efecto característico del etanercept periespinal. Esta ha sido particularmente notable en los pacientes con una probable enfermedad de Alzheimer, como el paciente actual, que presentan dificultades para encontrar palabras, que ha incluido un paciente con una afasia primaria progresiva tratada por los autores. La mejoría del comportamiento y la mejoría de la afectación, como se ven en este paciente, es otro efecto característico del etanercept periespinal según la experiencia de los autores.
También había que destacar que la rápida mejoría cognitiva después del etanercept periespinal no está limitada al paciente del informe actual, pero ha sido, de hecho, observado comúnmente en múltiples pacientes durante la experiencia clínica de los autores que ahora ya dura más de tres años con el uso del etanercept periespinal para tratar una probable enfermedad de Alzheimer [20,21]. La rápida respuesta al etanercept periespinal puede proporcionar una importante clave para los mecanismos patofisiológicos subyacentes, no solo a la enfermedad de Alzheimer, pero también a otras enfermedades del cerebro que implican un exceso de TNF-alfa y disfunción cognitiva, incluyendo demencia frontotemporal [45] y lesiones cerebrales traumáticos [46].
Resolver problemas complejos requiere una función cingulada prefrontal y anterior intacta que permite acordarse de actos apropiados y relevantes, pasados, presentes y futuros, asignar valor emocional a estas y compararlas con la situación presente para arreglárselas con una secuencia anticipada de eventos de forma flexible y orientada hacía una meta. El cambio prefrontal neuropatológico de diversas etiologías, incluyendo la enfermedad de Alzheimer interfiere con tales funciones complejas. La valoración de semejante disfunción ejecutiva está pobremente reflejada en la mayoría de evaluaciones psicométricas estándar. Múltiples autores han comentado sobre pacientes con déficits en el globo frontal que ejecutan bien la mayoría de pruebas psicométricas estándar, pero tienen una incapacitante discapacidad para funcionar en una vida real y entorno complejo [47,48]. Valorar dominios cognitivos aislados sin valorar la disfunción ejecutiva mediante pruebas tests, como el Mini-Examen del Estado Mental o el Instrumento de Valoración de Capacidades Cognitivas, pueden fácilmente pasar por alto unos déficits críticos en el funcionamiento ejecutivo en pacientes con implicación de los globos anterior cingulado y prefrontal.
La disfunción ejecutiva es uno de los mayores componentes de la vía final común de incapacidades en la enfermedad de Alzheimer que parecen mejorar rápidamente con etanercept periespinal como se ha documentado arriba. Sin cuantificar la función ejecutiva, un médico o la observación de la familia de una mejoría de la capacidad o el comportamiento del paciente puede ser indebidamente considerado como una interpretación subjetiva. La Valoración Cognitiva de Montreal tiene varias pantallas para la disfunción ejecutiva, incluyendo una modificada Trazas B (tarea para hacer trazas alternativas) [ver Figura 1] que reflejan le mejoría quantum denotada en el paciente presente, objetivando así las impresiones de los familiares y médicos del paciente.
La regulación inmune innata de la función cerebral es un área de intenso interés actual [34,42,43,49-51]. La rápida mejoría clínica que es característica de los pacientes con Alzheimer tratados con etanercept periespinal y que es descrita en este papel proporciona una nueva clave para investigar estos mecanismos. Uno sospecha que esta rápida mejoría clínica está relacionada con el papel del TNF-alfa como regulador de mecanismos sinápticos en el cerebro, que fue descrito por primera vez hace más de una década [52]. Ahora se sabe que los glias envuelven las sinapsis neuronales en el cerebro y liberan moléculas, gliotransmisores, que regulan la transmisión sináptica en estas sinapsis envueltas [42,50]. TNF-alfa es uno de los poquitos reconocidos gliotransmisores [33,34,42,50]. En modelos experimentales, el TNF-alfa altera la transmisión sináptica en rodajas del hipocampo de ratas, y produce una rápida exocitosis de los receptores AMPA en las células piramidales del hipocampo [35,52]. Ha sido demostrado que el TNF-alfa liberado por los glias controla la fuerza sináptica [33,34,53,54].
Se ha sugerido que la escala sináptica está centralmente implicada en la disfunción sináptica que ocurre en la enfermedad de Alzheimer [30,55]. La escala sináptica implica ajustes uniformes en la fuerza de todas las conexiones sinápticas para que una neurona responda a los cambios de la actividad eléctrica en ella [34,53,54]. La escala sináptica es un mecanismo homeostático necesario para el óptimo funcionamiento de las redes neurales [34,53,54]. Se ha demostrado que la escala sináptica está regulada por el TNF-alfa de los gliales [34]. Estos hallazgos experimentales, junto con los rápidos efectos del etanercept periespinal mostrado aquí, convergen para sugerir que la desregulación sináptica producida por el exceso de TNF-alfa [5,7-10,12,14,16,18,23] contribuyen a la disfunción cognitiva y conductual en la enfermedad de Alzheimer. Nuestros hallazgos sugieren, además, que esta disfunción sináptica puede, al menos en parte, ser reversible con un tratamiento anatómicamente dirigido al anti-TNF-alfa.
Es de relevancia en este informe la reciente evidencia que la estimulación de una sola neurona puede causar un cambio en el comportamiento de un animal [56]. Esto puede ser posible debido a la naturaleza masivamente interconectada del cerebro: una sola célula cortical piramidal conecta con varios miles de neuronas postsinápticas [56]. Es más, los procesos de un astrocito puede hacer contacto con más de 100.000 sinapsis [50]. Por esto los procesos que afectan la interacción glial-neuronal tienen el potencial de la rápida amplificación de su efecto cognitivo y conductual.
Por esto se puede extrapolar de estos hallazgos y teorizar cómo el etanercept periespinal puede tener rápidos efectos generalizados.
Los autores postulan que un exceso de TNF-alfa en la enfermedad de Alzheimer [5,7-10,12,14,16,18,23] interfiere con las funciones regulatorias sinápticas del TNF-alfa. Cuando el TNF-alfa está en un rango fisiológico, la escala sináptica no se permite, preservando así el funcionamiento óptimo de la red neural del cerebro. Cuando el TNF-alfa está sobreexpresado, debido a la activación glial se postula que las actividades sinápticas regulatorias del TNF-alfa se deterioran. Se postula que la disfunción sináptica resulta de esta desregulación, lo que puede proporcionar una base para una reducida conectividad funcional entre las regiones del cerebro en la enfermedad de Alzheimer [57,58]. Se postula que los rápidos efectos del etanercept periespinal son el resultado de la rápida neutralización del exceso de TNF-alfa, el cual con esto mejora esta desregulación sináptica, permitiendo una comunicación cruzada normal entre las diferentes regiones del cerebro.
Los autores postulan que ocurre una dualidad del efecto fisiológico dependiendo de la concentración de las citocinas en la modulación TNF-alfa de la función sináptica. Esta ha sido observada con respecto a la regulación interleucina-1(IL-1) de la potenciación a largo plazo de las rodajas del hipocampo [59]. Estos datos sugieren que se requiere IL-1 para la LTP, bajo condiciones fisiológicas, pero con dosis más altas, como se puede encontrar en ciertas condiciones patológicas, la IL-1 inhibe la LTP [59]. Los autores sugieren que ocurre una dualidad similar con respecto al TNF-alfa en la enfermedad de Alzheimer.
Se especula, en base a los resultados clínicos observados y los estudios citados arriba, que la función sináptica óptima en el cerebro humano requiere que el TNF-alfa siga dentro de un rango fisiológico; quizás análogo a la necesidad de mantener el calcio en suero en un estrecho rango fisiológico para preservar una función neuronal óptima. Los positivos efectos clínicos que los autores han observado con el etanercept periespinal para el tratamiento crónico de la enfermedad de Alzheimer en una base abierta [20,21], ahora durante un periodo que excede los tres años, sugiere que el mantenimiento de un tratamiento anti-TNFalfa puede tener efectos beneficios prolongados. Se espera que estudios futuros puedan aclarar si mantener el tratamiento con etanercept periespinal ayudará a mantener o restaurar la homeostasis del TNF-alfa en el cerebro y/o el líquido cerebroespinal de los pacientes con enfermedad de Alzheimer.
El exceso de TNF-alfa parece ahora satisfacer de forma preliminar el equivalente neurológico de las hipótesis de Koch [60] con respecto a ser un importante componente de la patofisiología de la enfermedad de Alzheimer, para la que se ha publicado evidencia científica de lo siguiente:
1. Se ha documentado un exceso de TNF-alfa, a un nivel 25 veces más alto que en los controles, en el líquido cerebroespinal de los pacientes con enfermedad de Alzheimer (AD); y un elevado TNF-alfa en el LCR correlacionaba con una progresión del deterioro cognitivo leve a la AD [7-9];
2. El examen de polimorfismos de TNF-alfa en estudios de población ha proporcionado evidencia que los polimorfismos genéticos asociados con un incremento de la producción de TNF-alfa están asociados con un incremento del riesgo de tener AD y una bajada de la edad de comienzo de la AD [10,16,18];
3. Un incremento de la producción espontánea de TNF-alfa por las células sanguíneas mononucleares periféricas estaba asociada con el incremento del riesgo de la AD en una población de pacientes seguidos como parte del estudio de Framingham [23];
4. Múltiples estudios de ciencia básica sugieren la implicación de TNFalfa en mecanismos neuroinflamatorios que pueden contribuir a la patogénesis de la AD [5,6,11,15,17,19,24,25,33-37,51,61-72];
5. TNF-alfa es un gliotransmisor [33-35,42,50,51];
6. El TNF-alfa glial puede regular los mecanismos sinápticos que implican la función sináptica en las redes neurales [33-35,50-54];
7. La disrupción de los mecanismos de la memoria por los beta-amiloides y oligomeros de beta-amiloides está mediada por el TNF-alfa [36,37]; y
8. Recientemente se ha publicada evidencia piloto que apoya la eficacia del tratamiento con diana anatómica [27] del anti-TNF-alfa para la enfermedad de Alzheimer [20,21].
El caso presentado aquí proporciona evidencia clínica de un componente rápidamente reversible, relacionado con el TNF-alfa para la disfunción cognitiva presente en la enfermedad de Alzheimer. Este mecanismos reversible preceden necesariamente un daño irreversible en la estructura neuronal, algo análogo con la reversible penumbra isquémica que rodea el infarto cerebrovascular. La rápida respuesta al tratamiento es consistente con la emergente evidencia que sugiere que el TNF-alfa derivado de los gliales puede regular los mecanismos sinápticos del cerebro. Vale la pena investigar más profundamente estos mecanismos, y puede llevar a una más temprana intervención terapéutica que puede tener el potencial de afectar favorablemente la historia natural de la enfermedad de Alzheimer.
Abreviaciones
TNF-alfa: factor-alfa necrosis tumoral; AD: enfermedad de Alzheimer; HG: Dr. Hyman Gross, MD; ET: Dr. Edward Tobinick, MD; MRI: Imágenes de resonancia magnética; PET: tomografía de emisión de positrones; FDG: Fluorodeoxiglucosa. NINCDS-ADRDA: National Institute of Neurological Communicative Disorders and Stroke-Alzheimer’s disease and Related Disorders Association; Asociación del Instituto Nacional de Enfermedades Comunicativos Neurológicos y Enfermedad de Alzheimer y Enfermedades Relacionadas. MOCA: Valoración Cognitivo de Montreal; IL-1: Interleucina-1; LTP: Potenciación a largo plazo.
Intereses competentes
El autor Dr. Hyman Gross MD, no tiene intereses competentes. Autor Edward Tobinick posee acciones en Amgen, el fabricante de etanercept, y tiene múltiples patentes hechas y pendientes, asignadas a TACT IP LLC, que describe el uso parenteral y periespinal de etanercept para el tratamiento de la enfermedad de Alzheimer y otras enfermedades neurológicas, incluyendo, pero no limitada a los patentes estadounidenses 6015557, 6177077, 6419934, 6419944, 6537549, 6982089, 7214658 y la patente australiana 758523.
Contribuciones de los autores
Ambos autores aceptan la plena responsabilidad de todo el contenido del artículo, y dan su aprobación para la versión sometida final del artículo; Edward Tobinick fue el autor principal. Hyman Gross efectuó los exámenes neurológicos antes y después del tratamiento periespinal con etanercept, contribuyó a la sección de discusión y revisó todo el manuscrito.
Agradecimientos
No hubo fuentes patrocinadores externas. Los autores quieren agradecer los miembros de la familia del paciente que generosamente acordaron permitir que sus comentarios en video acompañasen la publicación de este artículo.
916
References
- Griffin WS, Stanley LC, Ling C, White L, MacLeod V, Perrot LJ, White CL 3rd, Araoz C: Brain interleukin 1 and S-100 immunoreactivity are elevated in Down syndrome and Alzheimer disease. Proc Natl Acad Sci USA 1989, 86(19):7611-5.
- Mrak RE, Griffin WS: Interleukin-1, neuroinflammation, and Alzheimer’s disease. Neurobiol Aging 2001, 22(6):903-8.
- Akiyama H, Barger S, Barnum S, Bradt B, Bauer J, Cole GM, Cooper NR, Eikelenboom P, Emmerling M, Fiebich BL, Finch CE, Frautschy S, Griffin WS, Hampel H, Hull M, Landreth G, Lue L, Mrak R, Mackenzie IR, McGeer PL, O’Banion MK, Pachter J, Pasinetti G, Plata-Salaman C, Rogers J, Rydel R, Shen Y, Streit W, Strohmeyer R, Tooyoma I, Van Muiswinkel FL, Veerhuis R, Walker D, Webster S, Wegrzyniak B, Wenk G, Wyss-Coray T: Inflammation and Alzheimer’s disease. Neurobiol Aging 2000, 21(3):383-421.
- Mrak RE, Griffin WS: Glia and their cytokines in progression of neurodegeneration. Neurobiol Aging 2005, 26(3):349-54.
- Fillit H, Ding WH, Buee L, Kalman J, Altstiel L, Lawlor B, Wolf-Klein G: Elevated circulating tumor necrosis factor levels in Alzheimer’s disease. Neurosci Lett 1991, 129(2):318-20.
- Perry RT, Collins JS, Wiener H, Acton R, Go RC: The role of TNF and its receptors in Alzheimer’s disease. Neurobiol Aging 2001, 22(6):873-83.
- Tarkowski E, Blennow K, Wallin A, Tarkowski A: Intracerebral production of tumor necrosis factor-alpha, a local neuroprotective agent, in Alzheimer disease and vascular dementia. J Clin Immunol 1999, 19(4):223-30.
- Tarkowski E, Liljeroth AM, Minthon L, Tarkowski A, Wallin A, Blennow K: Cerebral pattern of pro- and anti-inflammatory cytokines in dementias. Brain Res Bull 2003, 61(3):255-60.
- Tarkowski E, Andreasen N, Tarkowski A, Blennow K: Intrathecal inflammation precedes development of Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2003, 74(9):1200-5.
- Laws SM, Perneczky R, Wagenpfeil S, Muller U, Forstl H, Martins RN, Kurz A, Riemenschneider M: TNF polymorphisms in Alzheimer disease and functional implications on CSF beta-amyloid levels. Hum Mutat 2005, 26(1):29-35.
- Zou JY, Crews FT: TNF alpha potentiates glutamate neurotoxicity by inhibiting glutamate uptake in organotypic brain slice cultures: neuroprotection by NF kappa B inhibition. Brain Res 2005, 1034(1–2):11-24.
- Alvarez A, Cacabelos R, Sanpedro C, Garcia-Fantini M, Aleixandre M: Serum TNF-alpha levels are increased and correlate negatively with free IGF-I in Alzheimer disease. Neurobiol Aging 2007, 28(4):533-6. Epub 2006 Mar 29
- Chiarini A, Dal Pra I, Whitfield JF, Armato U: The killing of neurons by betaamyloid peptides, prions, and pro-inflammatory cytokines. Ital J Anat Embryol 2006, 111(4):221-46.
- Zuliani G, Ranzini M, Guerra G, Rossi L, Munari MR, Zurlo A, Volpato S, Atti AR, Ble A, FellinR F: Plasma cytokines profile in older subjects with late onset Alzheimer’s disease or vascular dementia. J Psychiatr Res 2007, 41(8):686-93.
- Takeuchi H, Jin S, Wang J, Zhang G, Kawanokuchi J, Kuno R, Sonobe Y, Mizuno T, Suzumura A: Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner. J Biol Chem 2006, 281(30):21362-8.
- Ramos EM, Lin MT, Larson EB, Maezawa I, Tseng LH, Edwards KL, Schellenberg GD, Hansen JA, Kukull WA, Jin LW: Tumor necrosis factor alpha and interleukin 10 promoter region polymorphisms and risk of late-onset Alzheimer disease. Arch Neurol 2006, 63(8):1165-9.
- Meme W, Calvo CF, Froger N, Ezan P, Amigou E, Koulakoff A, Giaume C: Proinflammatory cytokines released from microglia inhibit gap junctions in astrocytes: potentiation by beta-amyloid. Faseb J 2006, 20(3):494-6.
- Lio D, Annoni G, Licastro F, Crivello A, Forte GI, Scola L, Colonna-Romano G, Candore G, Arosio B, Galimberti L, Vergani C, Caruso C: Tumor necrosis factoralpha -308A/G polymorphism is associated with age at onset of Alzheimer’s disease. Mech Ageing Dev 2006, 127(6):567-71.
- Csiszar A, Labinskyy N, Smith K, Rivera A, Orosz Z, Ungvari Z: Vasculoprotective effects of anti-tumor necrosis factor-alpha treatment in aging. Am J Pathol 2007, 170(1):388-98.
- H, Weinberger A, Cohen H: TNF-alpha modulation for treatment of Alzheimer’s disease: a 6-month pilot study. MedGenMed 2006, 8(2):25.
- Tobinick E: Perispinal etanercept for treatment of Alzheimer’s disease. Curr Alzheimer Res 2007, 4(5):550-2.
- Tweedie D, Sambamurti K, Greig NH: TNF-alpha Inhibition as a Treatment Strategy for Neurodegenerative Disorders: New Drug Candidates and Targets. Curr Alzheimer Res 2007, 4(4):375-8.
- Tan ZS, Beiser AS, Vasan RS, Roubenoff R, Dinarello CA, Harris TB, Benjamin EJ, Au R, Kiel DP, Wolf PA, Seshadri S: Inflammatory markers and the risk of Alzheimer disease: the Framingham Study. Neurology 2007, 68(22):1902-8.
- Medeiros R, Prediger RD, Passos GF, Pandolfo P, Duarte FS, Franco JL, Dafre AL, Di Giunta G, Figueiredo CP, Takahashi RN, Campos MM, Calixto JB: Connecting TNF-{alpha} Signaling Pathways to iNOS Expression in a Mouse Model of Alzheimer’s Disease: Relevance for the Behavioral and Synaptic Deficits Induced by Amyloid {beta} Protein. J Neurosci 2007, 27(20):5394-5404.
- Van Eldik LJ, Thompson WL, Ranaivo HR, Behanna HA, Watterson DM: Proinflammatory Cytokine Upregulation as a Therapeutic Target for Neurodegenerative Diseases: Function-Based and Target-Based Discovery Approaches. International Review of Neurobiology 2007, 82:278-297.
- Amgen : Enbrel(R) package insert; and data on file. Thousand Oaks, CA; 2007.
- Tobinick E: The cerebrospinal venous system: anatomy, physiology, and clinical implications. MedGenMed 2006, 8(1):53. Selkoe DJ: Alzheimer’s disease is a synaptic failure. Science 2002, 298(5594):789-91.
- Yoshiyama Y, Higuchi M, Zhang B, Huang SM, Iwata N, Saido TC, Maeda J, Suhara T, Trojanowski JQ, Lee VM: Synapse loss and microglial activation precede tangles in a P301S tauopathy mouse model. Neuron 2007, 53(3):337-51.
- Small DH: Mechanisms of synaptic homeostasis in Alzheimer’s disease. Curr Alzheimer Res 2004, 1(1):27-32.
- LaFerla FM, Oddo S: Alzheimer’s disease: Abeta, tau and synaptic dysfunction. Trends Mol Med 2005, 11(4):170-6.
- Bell KF, Claudio Cuello A: Altered synaptic function in Alzheimer’s disease. Eur J Pharmacol 2006, 545(1):11-21.
- Beattie EC, Stellwagen D, Morishita W, Bresnahan JC, Ha BK, Von Zastrow M, Beattie MS, Malenka RC: Control of synaptic strength by glial TNFalpha. Science 2002, 295(5563):2282-5.
- Stellwagen D, Malenka RC: Synaptic scaling mediated by glial TNF-alpha. Nature 2006, 440(7087):1054-9.
- Stellwagen D, Beattie EC, Seo JY, Malenka RC: Differential regulation of AMPA receptor and GABA receptor trafficking by tumor necrosis factor-alpha. J Neurosci 2005, 25(12):3219-28
- Wang Q, Wu J, Rowan MJ, Anwyl R: Beta-amyloid inhibition of long-term potentiation is mediated via tumor necrosis factor. Eur J Neurosci 2005, 22(11):2827-32.
- Rowan MJ, Klyubin I, Wang Q, Hu NW, Anwyl R: Synaptic memory mechanisms: Alzheimer’s disease amyloid beta-peptide-induced dysfunction. Biochem Soc Trans 2007, 35(Pt 5):1219-23.
- Zec RF, Burkett NR, Markwell SJ, Larsen DL: A cross-sectional study of the effects of age, education, and gender on the Boston Naming Test. Clin Neuropsychol 2007, 21(4):587-616.
- Smith T, Gildeh N, Holmes C: The Montreal Cognitive Assessment: validity and utility in a memory clinic setting. Can J Psychiatry 2007, 52(5):329-32
- McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM: Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984, 34(7):939-44.
- American Psychiatric Association: Diagnostic and statistical manual of mental disorders. 4th edition.
- Bains JS, Oliet SH: Glia: they make your memories stick! Trends Neurosci 2007, 30(8):417-24. Epub 2007 Jul 12
- Pickering M, Cumiskey D, O’Connor JJ: Actions of TNF-alpha on glutamatergic synaptic transmission in the central nervous system. Exp Physiol 2005, 90(5):663-70.
- Nasreddine ZS, Phillips NA, Bedirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H: The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005, 53(4):695-9.
- Sjögren M, Folkesson S, Blennow K, Tarkowski E: Increased intrathecal inflammatory activity in frontotemporal dementia: pathophysiological implications. J Neurol Neurosurg Psychiatry 2004, 75(8):1107-11.
- Goodman JC, Robertson CS, Grossman RG, Narayan RK: Elevation of tumor necrosis factor in head injury. J Neuroimmunol 1990, 30(2–3):213-7.
- Shallice T, Burgess PW: Deficits in strategy application following frontal lobe damage in man. Brain 1991, 114(Pt 2):727-41.
- Eslinger PJ, Damasio AR: Severe disturbance of higher cognition after bilateral frontal lobe ablation: patient EVR. Neurology 1985, 35(12):1731-41.
- Goddard CA, Butts DA, Shatz CJ: Regulation of CNS synapses by neuronal MHC class I. Proc Natl Acad Sci USA 2007, 104(16):6828-33.
- Halassa MM, Fellin T, Haydon PG: The tripartite synapse: roles for gliotransmission in health and disease. Trends Mol Med 2007, 13(2):54-63.
- Ralay Ranaivo H, Craft JM, Hu W, Guo L, Wing LK, Van Eldik LJ, Watterson DM: Glia as a therapeutic target: selective suppression of human amyloid-beta-induced upregulation of brain proinflammatory cytokine production attenuates neurodegeneration. J Neurosci 2006, 26(2):662-70.
- Tancredi V, D’Arcangelo G, Grassi F, Tarroni P, Palmieri G, Santoni A, Eusebi F: Tumor necrosis factor alters synaptic transmission in rat hippocampal slices. Neurosci Lett 146(2):176-8. 1992 Nov 9
- Abbott LF, Nelson SB: Synaptic plasticity: taming the beast. Nat Neurosci 2000, 3(Suppl):1178-83. Review
- Turrigiano GG, Nelson SB: Homeostatic plasticity in the developing nervous system. Nat Rev Neurosci 2004, 5(2):97-107. Review
- Chang EH, Savage MJ, Flood DG, Thomas JM, Levy RB, Mahadomrongkul V, Shirao T, Aoki C, Huerta PT: AMPA receptor downscaling at the onset of Alzheimer’s disease pathology in double knockin mice. Proc Natl Acad Sci USA 103(9):341 2006 Feb 28. Epub 2006 Feb 21
- Houweling AR, Brecht M: Behavioural report of single neuron stimulation in somatosensory cortex. Nature 451(7174):65-68.
- Delbeuck X, Van der Linden M, Collette F: Alzheimer’s disease as a disconnection syndrome? Neuropsychol Rev 2003, 13(2):79-92.
- Allen G, Barnard H, McColl R, Hester AL, Fields JA, Weiner MF, Ringe WK, Lipton AM, Brooker M, McDonald E, Rubin CD, Cullum CM: Reduced hippocampal functional connectivity in Alzheimer disease. Arch Neurol 2007, 64(10):1482-7.
- Ross FM, Allan SM, Rothwell NJ, Verkhratsky A: A dual role for interleukin-1 in LTP in mouse hippocampal slices. J Neuroimmunol 2003, 144(1–2):61-7.
- Inglis TJ: Principia aetiologica: taking causality beyond Koch’s postulates. J Med Microbiol 2007, 56(Pt 11):1419-22.
- Zeng C, Lee JT, Chen H, Chen S, Hsu CY, Xu J: Amyloid-beta peptide enhances tumor necrosis factor-alpha-induced iNOS through neutral sphingomyelinase/ ceramide pathway in oligodendrocytes. J Neurochem 2005, 94(3):703-12.
- Taylor DL, Jones F, Kubota ES, Pocock JM: Stimulation of microglial metabotropic glutamate receptor mGlu2 triggers tumor necrosis factor alpha-induced neurotoxicity in concert with microglial-derived Fas ligand. J Neurosci 2005, 25(11):2952-64.
- McGeer PL, McGeer EG: Local neuroinflammation and the progression of Alzheimer’s disease. J Neurovirol 2002, 8(6):529-38.
- Klegeris A, Walker DG, McGeer PL: Interaction of Alzheimer beta-amyloid peptide with the human monocytic cell line THP-1 results in a protein kinase Cdependent secretion of tumor necrosis factor-alpha. Brain Res 1997, 747(1):114- 21.
- Janelsins MC, Mastrangelo MA, Oddo S, LaFerla FM, Federoff HJ, Bowers WJ: Early correlation of microglial activation with enhanced tumor necrosis factoralpha and monocyte chemoattractant protein-1 expression specifically within the entorhinal cortex of triple transgenic Alzheimer’s disease mice. J Neuroinflammation 2005, 2:23.
- Hu W, Ranaivo HR, Roy SM, Behanna HA, Wing LK, Munoz L, Guo L, Van Eldik LJ, Watterson DM: Development of a novel therapeutic suppressor of brain proinflammatory cytokine up-regulation that attenuates synaptic dysfunction and behavioral deficits. Bioorg Med Chem Lett 2007, 17(2):414-8.
- Floden AM, Li S, Combs CK: Beta-amyloid-stimulated microglia induce neuron death via synergistic stimulation of tumor necrosis factor alpha and NMDA receptors. J Neurosci 2005, 25(10):2566-75.
- Edwards MM, Robinson SR: TNF alpha affects the expression of GFAP and S100B: implications for Alzheimer’s disease. J Neural Transm 2006, 11(11):1709- 15.
- De A, Krueger JM, Simasko SM: Glutamate induces the expression and release of tumor necrosis factor-alpha in cultured hypothalamic cells. Brain Res 2005, 1053(1–2):54-61.
- Cacquevel M, Lebeurrier N, Cheenne S, Vivien D: Cytokines in neuroinflammation and Alzheimer’s disease. Curr Drug Targets 2004, 5(6):529-34.
- Blasko I, Marx F, Steiner E, Hartmann T, Grubeck-Loebenstein B: TNFalpha plus IFNgamma induce the production of Alzheimer beta-amyloid peptides and decrease the secretion of APPs. Faseb J 1999, 13(1):63-8.
- Yamamoto M, Kiyota T, Horiba M, Buescher JL, Walsh SM, Gendelman HE, Ikezu T: Interferon-gamma and tumor necrosis factor-alpha regulate amyloid-beta plaque deposition and beta-secretase expression in Swedish mutant APP transgenic mice. Am J Pathol 2007, 170(2):680-92.







