Keywords
Alzheimer, aphasia, etanercept
Antecedentes
Existe cada vez más evidencia científica substancial a nivel clínico, genético, epidemiológico y básico que apoya un papel central del exceso del factor-alfa (TNF-alfa) de necrosis tumoral en la patogénesis de la enfermedad de Alzheimer que sugiere que el exceso de TNF-alfa es una diana terapéutica [1-19].
Etanercept, una proteína de fusión dimérica recombinante que consiste en porciones de unión extracelular de dos receptores humanos p75 TNF-alfa conectados con el fragmento Fc de IgG1 humano, se une al TNF-alfa y bloquea su interacción con la superficie celular de los receptores del TNF-alfa, reduciendo así el efecto biológico del exceso de TNFalfa [20]. Hay cada vez más evidencia que apoya un papel central del TNF-alfa en la enfermedad de Alzheimer que sugiere que, si administrado de forma apropiada, etanercept, ya aprobado por la FDA para ciertas condiciones inflamatorias mediadas por el TNF-alfa, como artritis reumatoide, podría ser eficaz en el Alzheimer. Además, al contrario que los anticuerpos anti-TNF monoclonales, como infliximab, etanercept también se une a y suprime la acción de linfotoxina (anteriormente conocida como TNF-beta), el significado fisiológico que en el Alzheimer todavía no está conocido por el momento [21,22].
Se había informado previamente que la administración periespinal de etanercept es rápidamente efectiva (en cuestión de minutos) para proporcionar alivio de dolor intratable asociado con radiculopatía lumbar y cervical [23-26]. Estos hallazgos que eran consistentes con la idea que la administración periespinal permitía al etanercept cruzar la barrera sangre-dural, llevaron a la expansión del concepto del potencial del sistema venoso cerebroespinal bidireccional como ruta de entrega de moléculas terapéuticas, tanto a la espina, como al cerebro [1-3,23-27]. Se concibió específicamente que etanercept, y potencialmente otras grandes moléculas, podrían ser entregadas al cerebro por la administración periespinal y el subsiguiente transporte retrógrado al cerebro vía el sistema venoso cerebrospinal [1-3,25,27].
En 2006, los autores y sus colegas publicaron un estudio piloto de seis meses aprobado por el IRB que implicaba una cohorte de 15 pacientes, que proporcionó una prueba del concepto que la entrega periespinal de etanercept era efectivo para tratar la enfermedad de Alzheimer [2]. La experiencia clínica sugiere una continuada efectividad clínica con mantenimiento del tratamiento, continuando durante más de dos años en algunos pacientes, como se informó en el 2007 [1]. Lo más reciente, una mejoría rápida clínica, cognitiva y conductual, empezando a los pocos minutos de la administración de etanercept periespinal, fue documentada en un paciente con moderada demencia que cumplía los criterios de un probable Alzheimer [3].
En algunos de los estudios arriba mencionados, se informó de una mejoría en las habilidades verbales después del etanercept periespinal [1-3]. Este papel proporciona adicionales datos clínicos relevantes con estos informes, en pacientes con la enfermedad de Alzheimer, y en una relacionada forma de demencia en la que los pacientes presentan prominentes efectos de la función verbal, demencia semántica. Se acaba de publicar un artículo por uno de los autores que documentaba una rápida mejoría después del etanercept periespinal en otra forma de demencia con una prominente disfunción del idioma, afasia primaria progresiva [28].
La demencia semántica, discutida en el primer informe de caso incluido, es considerada por muchos como una variante de demencia frontotemporal [29]. Lo mismo pasa con la demencia primaria progresiva, demencia semántica es una progresiva enfermedad neurodegenerativa para la que no hay tratamiento establecido. Un exceso de TNF-alfa en el fluido cerebroespinal ha sido documentado, no solo en la enfermedad de Alzheimer, pero también en la demencia frontotemporal y la vascular, de manera que todas estas pueden incluirse en la categoría de demencias mediadas por TNF-alfa [30,31].
Datos clínicos
Los datos clínicos incluidos en este artículo están separados en dos secciones. En la primera sección se informan los nuevos datos relacionados con la función verbal de un estudio de investigación clínica Fase 2 aprobado por IRB que implicó a una cohorte de 15 pacientes con enfermedad de Alzheimer que iban desde leve a severo. Estos datos suplementan un informe previo de mejoría en medidas cognitivas estándar en esta misma cohorte de 15 pacientes que había sido publicado previamente [2]. La completa metodología de esta prueba clínica que utilizó etanercept periespinal ha sido previamente informado [2]. En la segunda sección se incluyen informes del caso de dos pacientes adicionales. Estos pacientes no eran sujetos control, pero más bien fueron tratados con etanercept periespinal de forma off-label como parte de nuestra consulta habitual de medicina.
Datos de la prueba clínica
Métodos
Esta prueba clínica aprobada por la IRB fue efectuada antes de, e independiente de, los dos informes de caso descritos abajo. La metodología de este estudio ha sido previamente comunicada [2].
El paciente y su hijo dieron completo consentimiento a ser identificados en el vídeo que acompaña este artículo y para la publicación del vídeo.
Brevemente, el autor y sus colegas diseñaron y efectuaron un estudio abierto, prospectivo, en un solo centro, piloto (probar el concepto) de 15 pacientes con probable enfermedad de Alzheimer que variaba en gravedad de leve a severa, tratados semanalmente con etanercept periespinal durante un periodo de seis meses [2]. Esta prueba clínica empezó en el 2004 después de haber obtenido la aprobación del Consejo Institucional de revisiones (institutional review board) [2]. El estudio también estaba registrado en la base de datos de pruebas clínicas mantenida por el National Institute of Health (NCT00203359). Previamente se había informado [2] de una mejoría en las mayores medidas de resultados, que eran el Mini-Examen de Estado Mental (MMSE) [32], la escala de Valoración de Enfermedad de Alzheimer -Subescala Cognitiva (ADAS-Cog) [33], y la Severa Batería de deterioro [34].
Durante este estudio piloto de 15 pacientes, además de las medidas cognitivas estándar arriba mencionadas, se administraron adicionales baterías de tests neuropsicológicos, muchas de las cuales miden cuidadosamente la función verbal. Las baterías de test utilizadas incluyeron el Test de Aprendizaje Verbal California -Segunda Edición, Versión Adulta (CVLT-II) [35], Memoria Lógica I (LMI) y II (LMII) de la Escala Memoria Wechsler -Abreviada (WMS-a) [36], el Test de Comprensivas Trazas (TMT) [37,38], Boston Test de Nombres [39], y fluidez de letras (FAS) y de categorías verbales [40-42].
Mensualmente se efectuaron valoraciones neurocognitivas. Tres de los 15 pacientes en el estudio piloto con severa demencia fueron excluidos porque no se les podían valorar de forma fiable con estas herramientas.
Resultados
Se condujeron dos tests pareados (Two-tailed, paired t-tests) que comparaban la actuación en línea base con la de 6-meses más tarde en todas las medidas neuropsicológicas. Se hicieron T-tests para comparar las puntuaciones de valoración en línea base con los de 6-meses más tarde. Se utilizaron las puntuaciones estándar-T en el CVLT-II 1–5, TMT, y los análisis de Fluidez Verbal, y las puntuaciones estándar-z para WMSa, y secundarios análisis de medidas CVLT-II, mientras se emplearon los valores crudos para el Boston Naming Test. Como se puede ver en la figura (Figura 1), todas las medidas revelaron un significativo efecto excepto para el Boston Naming Test y el TMT-4, siendo WMS-LM-II marginalmente significativo en p = .05. El FAS test para la fluidez de letras [40-42] fue de lo más significativo en p < 0.0007.
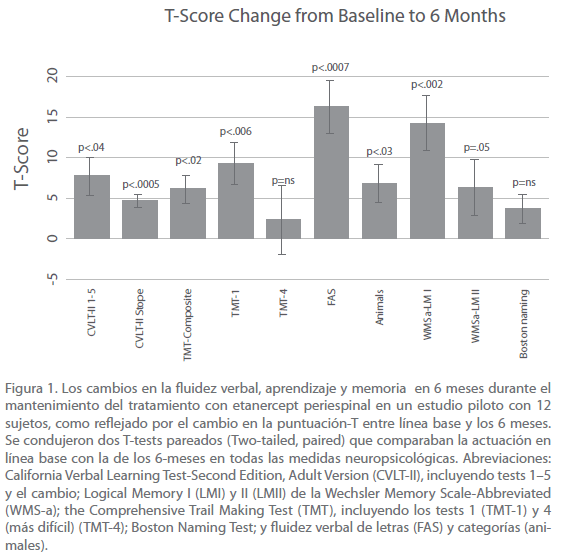
Figura 1. Los cambios en la fluidez verbal, aprendizaje y memoria en 6 meses durante el mantenimiento del tratamiento con etanercept periespinal en un estudio piloto con 12 sujetos, como reflejado por el cambio en la puntuación-T entre línea base y los 6 meses. Se condujeron dos T-tests pareados (Two-tailed, paired) que comparaban la actuación en línea base con la de los 6-meses en todas las medidas neuropsicológicas. reviaciones: California Verbal Learning Test-Second Edition, Adult Version (CVLT-II), incluyendo tests 1–5 y el cambio; Logical Memory I (LMI) y II (LMII) de la Wechsler Memory Scale-Abbreviated (WMS-a); the Comprehensive Trail Making Test (TMT), incluyendo los tests 1 (TMT-1) y 4 (más difícil) (TMT-4); Boston Naming Test; y fluidez verbal de letras (FAS) y categorías (animales).
Informe de Dos Casos
Informe Del primer caso: afasia progresiva y demencia semántica
El paciente es un hombre de 78 años con un historial de 6 años de progresiva demencia que empezó con ser olvidadizo, seguido por progresivas pausas en el habla y dificultades asociadas al idioma. Tres años antes empezó a hablar respondiendo predominantemente con una palabra a las preguntas. En Julio del 2005 tuvo una evaluación neuropsicológica que demostró una variedad de dificultades con el idioma, con errores parafásicos con sustituciones de palabras y de pronunciación. Había obvios deterioros de atención, procesamiento lingüístico y memoria. Tenía disnomia, problemas de fluidez oral y dificultades para articular. En Septiembre del 2005 se notó que empezó a sustituir palabras, como “hotto” por “honda”, “tea” por “tie” y “burgle” por “verbal”. No había cambios de ánimo, personalidad o comportamiento, ni depresión, alucinaciones o delusiones. En Abril del 2006 fue evaluado por un neurólogo local quien encontró una severa afasia. La revisión incluyó un MRI, que mostró una pérdida global del volumen y una mínima enfermedad oclusiva de los vasos pequeños. CBC, RPR, B12, folato y TSH eran normales. Se hizo el diagnóstico de una posible afasia primaria progresiva. Se empezó con Memantina. Se obtuvo una segunda opinión de otro neurólogo el 25 de abril del 2006. Su MMSE era 12/30. Había severa afasia y dificultades para encontrar palabras y comprensión severamente deteriorada, puesta de nombres y repetición de palabras. Se diagnosticó demencia semántica, una variante de idioma de demencia frontotemporal [29,43]. Se aumentó la Memantina a 10 mg, dos veces el día, pero causó estreñimiento y se discontinuó. En Mayo del 2006 se empezó con donepezil, 5 mg por día e incrementó a 10 mg al día al mes siguiente. En Septiembre 2006 las dificultades de memoria del paciente habían progresado tanto que no era capaz de recordar los eventos del mismo día. Su habla se limitó a sólo unas pocas palabras únicas. Se volvió a tomar Memantina. En Febrero 2007 tenía dificultades para efectuar las actividades normales de la vida diaria. Requería ayuda para ducharse y en el examen estuvo casi mudo. En Mayo 2007 su comprensión de las órdenes orales había empeorado, acompañado de una marcada apatía. Se dejó de tomar Memantina por una excesiva somnolencia diurna.
El 6 de Febrero 2008 se trajo el paciente a nuestra clínica para ser evaluado. Estuvo casi mudo durante más de cuatro meses. No había historial de trauma craneal, temblores o significativa enfermedad médica activa. La familia negó específicamente un historial de enfermedad desmielizadora, fallo cardiaco congestivo, enfermedad de sangrado, diabetes mellitus, linfoma, enfermedad sanguínea, hepatitis, inmunosupresión o exposición a tuberculosis. Hubo un historial previo de cirugía de disco en 1997. Las presentes medicaciones eran donepezil 5 mg por día y memantina 10 mg dos veces al día. El examen neurológico del paciente era normal excepto el estado mental. El paciente no mostraba habla espontánea, no respondió verbalmente a la mayoría de preguntas y fue incapaz de seguir otra cosa que los órdenes más simples. El examen en laboratorio era corriente, con hemograma, folato en suero, índice T4 libre, vitamina B12 en suero, creatinina y hemoglobina A1c normales. El test de piel PPD para la tuberculosis era negativo.
Después de obtener el consentimiento informado por escrito, como parte de nuestra práctica habitual de medicina, se administró etanercept periespinal (25 mg) mediante inyección en cuello posterior en la línea media seguido por postura Trendelenburg, como se ha descrito previamente [2]. Toleró la administración sin dificultades. Diez minutos después de la inyección el paciente fue capaz de repetir números simples, y se le preguntó si se sentía mejor. Contestó “No lo sé”. El hijo del paciente, quien habló sobre la mejoría de su padre ese día y ocho días más tarde (Archivo adicional 1), comentó que fue muy significativo la mejoría del habla después de la administración periespinal de etanercept. El paciente volvió a nuestra clínica para su seguimiento el 14 de Febrero y su hijo informó que el padre había mejorado en muchos aspectos. Su comportamiento había mejorado y también la habilidad para seguir órdenes orales; aumentó notablemente la emisión de palabras inteligibles, aunque las palabras eran pocas y usualmente únicas; y estaba caminando más deprisa que antes. Un mes más tarde, cuando volvieron el paciente y su hijo, el hijo informó que todas las mejorías clínicas informadas habían seguido durante todo el mes.
Archivo adicional 1. Ver Video https://www.biomedcentral.com/content/ supplementary/1471-2377-8-27-s1.mov
Informe del segundo caso: afasia no fluida secundaria a enfermedad de Alzheimer
Este ingeniero de 80 años, casado, diestro, se presentó en nuestra clínica con un historial de dos años y medio de aumento de dificultades para encontrar las palabras, que se había hecho mucho más prominente durante los últimos seis meses. Esto iba acompañado por un deterioro menos manifiesto de la memoria a corto plazo durante los últimos seis a doce meses. Durante los últimos seis meses la mujer también informó de un deterioro gradual de su escritura manual y del incremento de las dificultades para anotar cosas a mano. Seguía conduciendo el coche para ir al trabajo. Seguía independiente y capaz de efectuar todas las actividades normales de la vida diaria. No se notaron cambios en su personalidad. Tampoco había historial de alucinaciones, síntomas motores, ataques o apatía.
El historial médico pasado incluía pericarditis con posible miocarditis viral, fibrilación atrial, hipertrofia prostática benigna, hipotiroidismo e incremento del colesterol. No había historial de enfermedad desmielinizante, abuso de sustancias, fallo cardiaco congestivo, enfermedad de sangrado, diabetes mellitus, linfoma, enfermedad sanguínea, hepatitis, inmunosupresión o exposición a la tuberculosis. Tres años antes el paciente había tenido un accidente en coche con una breve pérdida de conciencia. Los actuales medicamentos eran tamsulosin, dutasterida, diltiazem, donepezil, levotiroxina, atorvastatin y warfarina.
Los tests de laboratorio eran corrientes, con normal recuento de células blancas, hemoglobina 13.4, hematocritos 39.5, plaquetas 275,000, INR 1.0 y química de suero normal, BUN, vitamina B12 y folato en suero, RPR, TSH y T4 y RX de pecho. El test PPD de piel para la tuberculosis era negativo. Un estudio dúplex de la carótida del 22 de Noviembre de 2006 mostró formación de placas en la bifurcación bilateral de la carótida sin estenosis hemodinámicamente significativa. MRI del cerebro había documentado previamente una moderada atrofia y no específica periventricular con cambios en la materia blanca consistentes con cambios isquémicos microvasculares de la materia blanca. FDG-PET del cerebro el 22 de enero 2008 mostró hipometabolismo fuera de proporción del grado de atrofia en las regiones parietal y temporal izquierdas (Figura 2). También había hipometabolismo de menor grado incluyendo la región de la corteza cingulada izquierda occipital (Figura 2). Estos hallazgos fueron leídos por un neuroradiólogo como muy consistente con un proceso primario neurodegenerativo, probablemente enfermedad asimétrica de Alzheimer.
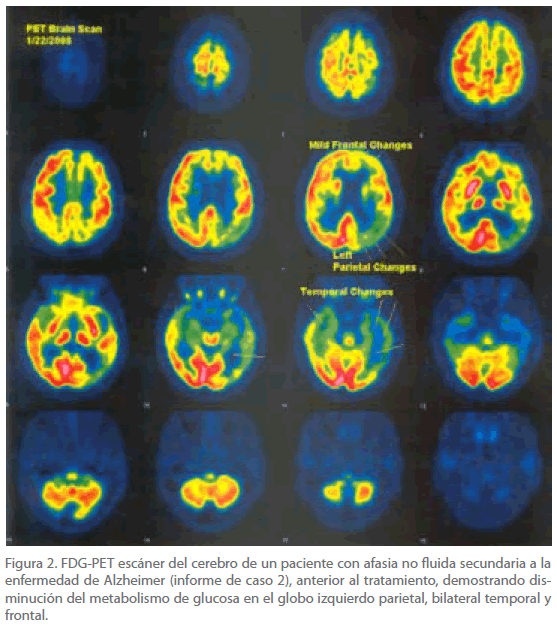
Figura 2. FDG-PET escáner del cerebro de un paciente con afasia no fluida secundaria a la enfermedad de Alzheimer (informe de caso 2), anterior al tratamiento, demostrando disminución del metabolismo de glucosa en el globo izquierdo parietal, bilateral temporal y frontal.
En el examen, la presión sanguínea del paciente era 135/77 mmHg, no tenía fiebre, pulso de 60 lpm e irregularmente irregular, ritmo respiratorio de 12 rpm y pulmones claros a la auscultación. Era agradable y cooperativo, con obvia dificultad para encontrar las palabras, incluso en una conversación casual. Su idioma espontáneo y primario era el inglés. Había una prolongada latencia de la respuesta verbal a la mayoría de preguntas, con obvia circunlocución con pronombres sustituidos por nombres, asociada con una leve ansiedad. La emoción parecía ligeramente plana.
Estaba orientado respecto al año y el mes, pero no a la fecha del calendario, el día de la semana, ciudad o sitio. En la prueba de conocimientos, podía nombrar el presidente actual y anterior de los EE.UU. pero ninguno anterior a Clinton.
Tenía un obvio deterioro para ponerle nombre a los objetos comunes; específicamente no era capaz de dar el nombre de peine, moneda, cepillo de dientes o llave. No pudo identificar imágenes de un camello o rinoceronte, pero sí de un león. En los primeros 10 ítems de la formula corta del Boston Naming Test [39] sólo pudo identificar correctamente una casa y un porche; utilizó marcadas circunlocuciones para el resto de los ítems. Fue capaz de declarar exactamente su fecha y sitio de nacimiento, edad y la cantidad de minutos en una hora, pero no la cantidad de días en un año. En un test de fluidez fonémica (FAS) [40-42] sólo pudo dar tres palabras que empiezan con la letra S en 60 segundes antes del tratamiento periespinal con etanercept. En una tarea semántica para la fluidez de categorías únicamente pudo nombrar tres animales en 30 segundos.
Tenía marcada dificultades con la memoria y precisó cinco repeticiones para registrar cinco memoranda, pero no pudo recordar ninguno de estas memorandas a los 90 segundos, a pesar de claves de categorías y uso de múltiples elecciones. Cuando se le pidió de recitar los días de la semana al revés, empezando con Domingo sólo pudo decir Domingo y Sábado.
Los nervios craneales II hasta XII estaban intactos. Tenía examen normal fundoscópico y los campos visuales estaban llenos a la confrontación. Los reflejos de los tendones profundos eran simétricos, con supinador y bíceps ++, tríceps +, cuadriceps + y ausencia de reflejos de tobillo. Los signos de dedos de pie eran flexores. Había completa fuerza por la pedestación y ambulación normal. No había atrofia, fasciculaciones o grasping. Había positivo reflejo palmomental bilateral. Había un leve temblor de intención, pero no temblor en descanso, rigidez, ataxia o distonía. La sensación al pinchazo y el tacto leve estaba intacta.
El paciente tenía dificultades con los cálculos matemáticos. Antes del tratamiento no podía dividir 58 por dos y no podía sumar 29 + 11. La puntuación MMSE era 18/30. La puntuación de la Valoración Cognitiva Montreal era de 12/30 [44]. Su puntuación en el Test de habilidades cognitivas (CASI) [45] era 69.2, todas estaban consistentes con una moderada demencia cortical.
Después de obtener un consentimiento informado por escrito, fue tratado, como parte de nuestra habitual consulta de medicina, con etanercept (25 mg) periespinal administrado en el cuello posterior en la línea media, seguida por la postura Trendelenburg. Esto fue tolerado sin dificultades.
Ocho minutos después del etanercept periespinal, el paciente fue otra vez examinado. Parecía más alerta. Su habla parecía con menos esfuerzo. Era capaz de recitar los siete días de la semana al revés, lo cual no había sido capaz antes del tratamiento, y podía correctamente calcular 58 dividido por dos.
El paciente y su esposa volaron de vuelta a Nueva York donde viven. Volvieron tres semanas más tarde, cuando el paciente recibió una segunda dosis periespinal de etanercept 25 mg. La esposa informó que durante las semanas después de la primera dosis, el paciente había mejorado en su capacidad conversacional, atención y ser olvidadizo. Estas mejorías eran particularmente notables durante la primera semana después del tratamiento. No se notaron efectos adversos al tratamiento. Al examinar la fluidez verbal del paciente se vio que había mejorado notablemente, hablaba con mayor facilidad y con menos latencia de respuesta a las preguntas. En la conversación casual parecía tener menos dificultades para encontrar palabras. Diez minutos después de su segunda dosis su habla parecía haber mejorado más.
El paciente y su esposa volaron otra vez de vuelta a casa en Nueva York y volvieron a California tres semanas más tarde. Su esposa informó de la mejoría continuada, pero otra vez notó mayor mejoría durante la primera semana después de la dosis periespinal de etanercept. Informó mejoría en su habilidad de anotar cosas a mano y en su habilidad conversacional, y también cierta mejoría de sus aptitudes organizacionales. Además, el examen antes de la tercera dosis de etanercept periespinal reveló mejoría de la emoción y la atención. Su habla era claramente más fluida, y el test de su fluidez fonémica (FAS) para la letra S era notable (11 palabras en 60 segundos) porque demostró una marcada mejoría en su actuación antes del primer tratamiento periespinal con etanercept seis semanas antes. Aunque con ciertas dificultades, también fue capaz de recitar al revés los días de la semana, cosa que no pudo hacer en absoluto antes del tratamiento. La puntuación de Valoración Cognitiva Montreal era 14/30 [44]. Fue administrada una tercera dosis de etanercept 25 mg periespinal. Ya que la mejoría había sido mayor durante la primera semana después de cada uno de los tratamientos previos, se aconsejó al paciente de intentar las dosis semanales.
Discusión
Los datos de esta prueba clínica de Fase 2 de seis meses en 12 pacientes con enfermedad de Alzheimer sugieren mejorías notables en el aprendizaje, memoria y fluidez verbal en esta cohorte tratado con etanercept periespinal. Estos datos son consistentes con la evidencia preliminar de los dos informes de caso incluidos aquí, y con el estudio de caso informado hace muy poco por los autores [3,4]. Los datos informados aquí, junto con la experiencia clínica confirmatoria de más de tres años de duración en la enfermedad de Alzheimer, sugieren que el tratamiento periespinal con etanercept de pacientes con demencias mediadas por TNF-alfa puede resultar en mejorías de la fluidez verbal y relacionadas funciones del idioma [1-4]. Además, estos datos, combinados con los de informes previos, sugieren que los efectos clínicos positivos pueden empezar rápidamente, en pocos minutos, y pueden ser duraderos con una incesante dosis de mantenimiento [1-4]. El etanercept periespinal puede resultar en una mejoría en el comportamiento, función del globo frontal y ejecutiva, habilidades conversacionales, habilidades de nombres y habilidades para comprender y seguir órdenes orales [1-4]. Los efectos clínicos sugieren que este abordaje de tratamiento, además de su utilidad para otras formas de enfermedad de Alzheimer, puede ser útil para los pacientes con demencia frontotemporal y frontal variante de la enfermedad de Alzheimer [46]. Se precisarán más estudios para caracterizar ratios de respuestas, esquemas de dosis y duración de la respuesta en las demencias no-Alzheimer.
Las observaciones de la familia y los médicos de las mejorías de la cognición, habilidad verbal y conducta del paciente, sugieren la posibilidad que el etanercept periespinal puede tener la habilidad de reducir la tara del cuidador en selectos pacientes con severa demencia. Uno puede argumentar que son observaciones en sólo una pequeña cantidad de pacientes. Pero más que pasar por alto el potencial significado científico de estas observaciones, sería más científicamente apropiado considerar estos resultados como observaciones que merecen más investigación [47]. Los estudios pequeños y los informes de caso se prestan al examen de individuales respuestas al tratamiento, particularmente con enfermedades que están bien estudiadas y caracterizadas [47]. En un estudio como éste, el primer objetivo es a menudo establecer la probabilidad de un efecto biológico detrás de la posibilidad de un error tipo I, i.e., si algún individuo experimentó un significativo efecto de tratamiento [47]. Harán falta más estudios para caracterizar los ratios de respuesta, esquemas de dosificación y duración de las respuestas.
Como previamente postulado, los actuales resultados sugieren que el etanercept periespinal puede tener la capacidad de influir en la función del cerebro, quizás mediante la entrega vía el sistema venoso cerebroespinal [1,3,25]. Esta forma de entrega puede ser facilitada por la gran área de superficie del plexo coroide (que puede tener la mitad del tamaño entero de las capilares cerebrales) y por la disminución de las características de la barrera del plexo coroide [48,49]. El etanercept que llega al plexo coroide podría tener generalizados efectos neuronales debido a su efecto sobre los glias, incluso en ausencia de una entrega cerebral más profunda, debido a los efectos generalizados ejercitados sobre las múltiples sinapsis que incluso una simple célula glial puede control, mediante sus extensas proyecciones [3,50-52].
Como previamente discutidas, las rápidas mejorías clínicas que se ven después del etanercept periespinal puede deberse a los efectos sinápticos relacionados con el papel del TNF-alfa como gliotransmisor [3,50-52]. Otras moléculas que funcionan como gliotransmisores son adenosina, glutamato, ATP y D-serina [50-52]. Debido a los efectos pro-inflamatorios relacionados del TNF-alfa y IL-1, inicialmente uno puede ser tentado a especular que el IL-1 podría tener efectos sinápticos similares a los del TNF-alfa. Puede ser necesario tener cuidado, no obstante, porque estas citocinas pueden tener efectos clínicos bastante divergentes [53]. Efectivamente, es bastante probable que los efectos de diferentes citocinas puedan variar entre las diferentes demencias, e incluso dentro del espectro de enfermedades que actualmente clasificamos juntos como diferentes formas de la enfermedad de Alzheimer [54].
Además de los efectos sinápticos, el etanercept puede tener efectos vasculares que pueden contribuir a la mejoría clínica rápida y sostenida notada. El etanercept puede tener el potencial de mejorar la disfunción endotelial y así tener un papel vasculoprotector [8]. Además, etanercept puede tener el potencial de mejorar la función microvascular, particularmente en una enfermedad clínica asociada con un exceso de TNF [55]. Esto puede ser de particular importancia en los pacientes tratados con etanercept periespinal que tienen un componente vascular en su demencia, como los pacientes con demencia mezclada de enfermedad de Alzheimer y demencia vascular.
La entrega con diana anatómica del etanercept, hecha a medida de la Diana de enfermedad, puede ser críticamente importante para asegurarse del éxito de la intervención [1,2,23-25,56-58]. La entrega de etanercept en una estructura anatómica donde no tendría acceso al sitio primario de la patología, como la administración intradiscal para el tratamiento de la radiculopatía, puede condenar tal intervención al fracaso [57]. Esto destaca la preocupación de los autores que los médicos inexpertos con la administración periespinal de etanercept podrían intentar iniciar el tratamiento de etanercept en pacientes con la demencia utilizando las rutas normalmente utilizadas para tratar a pacientes con artritis y psoriasis reumatoide, i.e. administración subcutánea en abdomen, brazos o muslos. Los datos publicados no apoyan el concepto que etanercept puede llegar al fluido cerebroespinal en una concentración terapéutica dado su habitual método de administración subcutánea en el abdomen [59,60]. El etanercept no cruza la barrera sangre-cerebro cuando es administrado de forma sistémica [59]. Al contrario, cuando se administra de forma periespinal en el plexo de Batson, las grandes moléculas pueden tener la capacidad para llegar al cerebro vía la entrega retrógrada mediante el sistema venoso cerebroespinal, una posible ruta anatómica demostrado por primera vez por Batson en cadáveres [1,27,61].
Aparte de las preocupaciones respecto la entrega del medicamento, la dosificación y los intervalos de las dosis quizás tienen que ser individualizadas para cada paciente. Esto requiere experiencia con el uso del etanercept periespinal en el tratamiento de pacientes con demencia. Los potenciales efectos secundarios del uso de etanercept periespinal para tratar la demencia, un uso off-label, incluyen todos los riesgos inherentes al uso de etanercept para sus indicaciones etiquetadas, que pueden incluir raros casos de muerte, infecciones, disminución de recuento sanguíneo, fallo cardiaco congestivo, linfoma, enfermedades desmielantes, y reactivación de la tuberculosis [62]. Hay que hacer un PPD test cutáneo antes de iniciar el tratamiento con etanercept, y se ha añadido en el prospecto del envase un aviso (black box warning) que destaca el riesgo de tuberculosis, sepsis e infecciones severas [62].
Hasta la fecha se han presentado limitaciones. La prueba clínica era abierta y no controlada. Los datos son limitados. A pesar de estas advertencias, es urgente la razón fundamental científica para la investigación adicional del tratamiento anti- TNF - alfa para la enfermedad de Alzheimer, con el apoyo de las evidencias de la ciencia genética, epidemiológica, clínica y básica [1-19,30,50,52]. Es más, los familiares, neurólogos independientes y otros observadores independientes han confirmado la mejoría clínica, cognitiva y conductual que se ha notado [1-4]. No obstante, todavía no hay, datos a doble-ciego, placebocontrolados, cuya disponibilidad podría reforzar más los resultados informados. Estos adicionales resultados de la prueba clínica en esta cohorte de 12 pacientes, junto con estos resultados de informes de caso, apoyan más la iniciación de estudios a escala más grande de esta intervención terapéutica, incluyendo ensayos clínicos Fase 3. Además, estos resultados pueden proporcionar comprensión en los mecanismos patofisiológicos básicos subyacentes a la enfermedad de Alzheimer y formas de demencia relacionadas, y sugieren la existencia de mecanismos patofisiológicos noveles, rápidamente reversibles, mediados por el TNF, para la enfermedad de Alzheimer y para la demencia semántica que valen la pena ser investigados más.
Abreviaciones
TNF-alfa: factor-alfa necrosis tumoral; AD: enfermedad de Alzheimer; HG: Dr. Hyman Gross, MD; ET: Dr. Edward Tobinick, MD; MRI: Imágenes de resonancia magnética; PET: tomografía de emisión de positrones; FDG: Fluorodeoxiglucosa; NINCDS-ADRDA: Asociación del Instituto Nacional de Enfermedades Comunicativos Neurológicos y Enfermedad de Alzheimer y Enfermedades Relacionadas; MOCA: Valoración Cognitivo de Montreal; BUN: nitrógeno de urea en sangre; RPR: test reagin rápido de plasma para sífilis; PPD: Test Purificado de Derivado de Proteínas en piel para previa exposición a tuberculosis; Test de Aprendizaje Verbal de California-Segunda Edición, Versión Adulta: CVLT-II; Escala de Memoria Wechsler-Abreviada (WMS-a) Memoria Lógica I: LMI; Escala de Memoria Wechsler-Abreviada (WMS-a) Memoria Lógica II: LMII; Test de Trazas Comprensivas: TMT.
Intereses competentes
El autor Edward Tobinick tiene múltiples patentes hechas y pendientes, asignadas a TACT IP LLC, que describen el uso parenteral y periespinal de etanercept para tratar la enfermedad de Alzheimer y otras enfermedades neurológicas, incluyendo, pero no limitadas a los EEUU patentes 6015557, 6177077, 6419934, 6419944, 6537549, 6982089, 7214658 y patente Australiana 758523. Posee acciones en Amgen, el fabricante de etanercept. Además tiene patentes pendientes que describen el uso del sistema venoso cerebroespinal y/o administración periespinal para entregar otros agentes terapéuticos o diagnósticos al cerebro, ojos, espina dorsal y otras estructuras anatómicas.
El autor Hyman Gross no tiene conflicto de intereses.
Contribuciones de los autores
ELT escribió el texto del presente artículo, con excepción de parte de un informe de caso; asume la completa responsabilidad de todo el contenido del artículo; y aprueba la versión sometida final del artículo. HG fue primariamente responsable del diseño de las medidas neurocognitivas usadas en el estudio piloto inicial, fue uno de los co-autores del estudio piloto inicial, y efectuó la evaluación neurológica y escribió parte del informe del caso en un paciente incluido en la serie de casos. Aprueba la versión sometida final del artículo.
Agradecimientos
No hubo fuentes patrocinadores externas. Los autores quieren agradecer el miembro de la familia de un paciente que generosamente acordó permitir que sus comentarios en video acompañasen la publicación de este artículo.
Los autores agradecen Arthur Tobinick por hacer la videografía utilizada para suplementar el artículo.
Se agradece la contribución de David Shirinyan, quien ejecutó el análisis estadístico y creó los gráficos incluidos como parte de los datos de la prueba clínica.
915
References
- Tobinick E: Perispinal et anercept for treatment of Alzheimer’s Disease. Curr Alzheimer Res 2007, 4(5):550-552.
- Tobinick E, Gross H, Weinberge r A, Cohen H: TNF-alpha modulation for treatment of Alzheimer’s disease: a 6-month pilot study. Med scape General Med icine 2006, 8(2):25.
- Tobinick EL, Gross H: Rapid cognitive improvement in Alzheimer’s disease following pe rispinal et anercept administration. J Neuroi nflammati on 2008, 5:2.
- Griffin WS: Perispinal et anercept : Pote ntial as an Alzheimer therape utic. J Neuroinflammati on 2008, 5(1):3.
- Ramos EM, Lin MT, Larson EB, Maezawa I, Tseng LH, Edw ards KL, Schellenberg GD, Hansen JA, Kukull WA, Jin LW: Tumor necrosis factor alpha and inte rleukin 10 promote r reg ion polymorphi sms and risk of late -onset Alzheimer disease. Arch Neurol 2006, 63(8):1165-9.
- Tan ZS, Beiser AS, Vasan RS, Roubenoff R, Dinarello CA , Harris TB, Benjami n EJ, Au R, Kiel DP, Wolf PA, Seshadri S: Inflammatory markers and the risk of Alzheimer disease: the Framingham Study. Neurology 2007, 68(22):1902-8.
- Wang Q, Wu J, Rowan MJ, Anwyl R: Bet a-amyloi d inhibition of long-te rm pote ntiation is med iated via tumor necrosis factor. Eur J Neurosci 2005, 22(11):2827-32.
- Csiszar A, Labinskyy N, Smi th K, Rivera A, Orosz Z, Ungvari Z: Vasculoprote ctive effects of anti-tumor necrosis factor-alpha treatment in aging. Am J Pathol 2007, 170(1):388- 98.
- Chiarini A, Dal Pra I, Whitfield JF, Armato U: The killing of neurons by bet a-amyloi d pept ide s, prions, and pro-i nflammatory cytokines. Ital J Anat Embryol 2006, 111(4):221- 46.
- Laws SM, Perneczky R, Wage npfeil S, Muller U, Forstl H, Martins RN, Kurz A, Riemenschneide r M: TNF polymorphi sms in Alzheimer disease and functional implications on CSF bet a-amyloi d levels. Hum Mutat 2005, 26(1):29-35.
- Mede iros R, Pred ige r RD, Passos GF, Pandolfo P, Duarte FS, Franco JL, Dafre AL, Di Giunta G, Figueired o CP, Takahashi RN, Campos MM, Calixto JB: Connecting tnf-{alpha} signaling pathways to inos expression in a mouse mode l of alzheimer’s disease: Relevance for the behavioral and synapt ic de ficits induced by amyloi d {bet a} prote in. J Neurosci 2007, 27(20):5394-5404.
- Alvarez A, Cacabelos R, Sanped ro C, Garcia-Fantini M, Aleixandre M: Serum TNFalpha levels are increased and correlate neg atively wi th free IGF-I in Alzheimer disease. Neurobiol Aging 2007, 28(4):533-6.
- Van Eldik LJ, Thompson WL, Ranaivo HR, Behanna HA, Watte rson DM: Proinflammatory cytokine upreg ulation as a therape utic target for neurodege nerative diseases: Function-based and target -based discovery app roaches. Inte rnational Review of Neurobiology 2007, 82:278-297.
- Tweed ie D, Sambamurti K, Greig NH: TNF-alpha inhibition as a treatment strateg y for neurodege nerative disorde rs: New drug candidate s and target s. Curr Alzheimer Res 2007, 4(4):375-8.
- Tarkowski E, Andreasen N, Tarkowski A, Blennow K: Intrathecal i nflammati on precede s de velopment of Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2003, 74(9):1200-5.
- Pickering M, Cumiskey D, O’Connor JJ: Actions of TNF-alpha on glutamate rgic synaptic transmission in the central nervous syste m. Exp Physiol 2005, 90(5):663-70.
- Perry RT, Collins JS, Wiener H, Acton R, Go RC : The role of TNF and its recept ors in Alzheimer’s disease. Neurobiol Aging 2001, 22(6):873-83.
- Rowan MJ, Klyubin I, Wang Q, Hu NW, Anwyl R: Synapt ic memory mechani sms: Alzheimer’s disease amyloi d bet a-pept ide -induced dysfunction. Biochem Soc Trans 2007, 35(Pt 5):1219-23.
- Tobinick E: Paradigm Shift: Excess TNF-alpha emerge s as a key therape utic target in Alzheimer’s disease. Med GenMed 2007, 9(3):17.
- Pugsley MK: Etanercept . Immunex. Curr Opin Investig Drugs 2001, 2(12):1725-31.
- Gudbrandsdott ir S, Larsen R, Sorensen LK, Nielsen S, Hansen MB, Svenson M, Bendt zen K, Muller K: TNF and LT binding capacities in the plasma of arthritis patients: effect of et anercept treatment in juvenile idiopathic arthritis. Clin Exp Rheumatol 2004, 22(1):118-24.
- Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP: Tumor necrosis factor antagonist mechani sms of action: a comprehensive review . Pharmacol Ther 2008, 117(2):244-79.
- Tobinick EL, Britschgi-Davoodifar S: Perispinal TNF-alpha inhibition for discoge nic pain. Swi ss Med Wkly 2003, 133(11–12):170-7.
- Tobinick E, Davoodifar S: Efficacy of et anercept de livered by pe rispinal administration for chronic back and/or neck disc-related pain: a study of clinical observations in 143 patients. Curr Med Res Opin 2004, 20(7):1075-85.
- Tobinick E: Spinal de livery of p38: TNF-alpha inhibitors. PLoS Med 2006, 3(11):e511.
- Tobinick EL: Targeted et anercept for discoge nic neck pain: uncontrolled , ope n-label results in tw o adults. Clin Ther 2003, 25(4):1211-8.
- Tobinick E: The cerebrospinal venous syste m: anatomy, physiology, and clinical implications. Med GenMed 2006, 8(1):53.
- Tobinick E: Perispinal et anercept produces rapid improvement in primary progressive aphasia:Ide ntification of a novel, rapidly reversible TNF-med iated pathophysiologic mechanism. The Med scape Journal of Med icine 2008, 10(6):135.
- Snowde n JS, Goulding PJ, Neary D: Semanti c de mentia: a form of circumscribed cerebral atrophy. Behav Neurol 1989, 2:167-182.
- Tarkowski E, Blennow K, Wallin A, Tarkowski A: Intracerebral production of tumor necrosis factor-alpha, a local neuroprote ctive age nt, in Alzheimer disease and vascular de mentia. J Clin Immunol 1999, 19(4):223-30.
- Sjogren M, Folkesson S, Blennow K, Tarkowski E: Increased intrathecal i nflammatory activity in frontote mporal de mentia: pathophysiological implications. J Neurol Neurosurg Psychiatry 2004, 75(8):1107-11.
- Folste in MF, Folste in SE, McHugh PR: “Mini-mental state ”. A practical met hod for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975, 12(3):189-98.
- Verhey FR, Houx P, Van Lang N, Huppe rt F, Stoppe G, Saerens J, Bohm P, De Vree se L, Nordlund A, DeDeyn PP, Neri M, Pena-Casanova J, Wallin A, Bollen E, Midde lkoop H, Narge ot MC, Puel M, Fleischmann UM, Jolles J: Cross-national comparison and validation of the Alzheimer’s Disease Assessment Scale: results from the Europe an Harmonization Proje ct for Instruments in Dementia (EURO -HARPID). Int J Geriatr Psychiatry 2004, 19(1):41-50.
- Panisset M, Roudier M, Saxton J, Boller F: Severe impai rment batte ry. A neuropsychological te st for severely de mented patients. Arch Neurol 1994, 51(1):41-5.
- Woods SP, Delis DC, Scott JC, Kramer JH, Holdnack JA: The California Verbal Learning Test – second ed ition: te st-rete st reliability, practice effects, and reliable change indices for the standard and alte rnate forms. Arch Clin Neuropsychol 2006, 21(5):413-20.
- Hilsabeck RC , Schrage r DA, Gouvier WD: Cross-validation of the tw o- and three - subte st short forms of the Wechsler Memory Scale-Revised . App l Neuropsychol 1999, 6(4):247-51.
- Moses JA Jr: Test review -Comprehensive Trail Making Test (CTMT). Arch Clin Neuropsychol 2004, 19(5):703-8.
- Smi th SR, Servesco AM , Edw ards JW, Rahban R, Barazani S, Nowi nski LA, Litt le JA, Blazer AL, Gree n JG: Exploring the validity of the comprehensive trail maki ng te st. Clin Neuropsychol 2007, 1-12.
- Zec RF, Burkett NR, Markwe ll SJ, Larsen DL: A cross-sectional study of the effects of age , ed ucation, and ge nde r on the Boston Nami ng Test. Clin Neuropsychol 2007, 21(4):587-616.
- Harrison JE, Buxton P, Husain M, Wise R: Short te st of semantic and phonological fluency: normal pe rformance, validity and te st-rete st reliability. Br J Clin Psychol 2000, 39(Pt 2):181-91.
- Fisher NJ, Tierney MC, Rourke BP, Szalai JP: Verbal fluency patte rns in tw o subgroups of patients wi th Alzheimer’s disease. Clin Neuropsychol 2004, 18(1):122-31.
- Baldo JV, Shimamura AP: Lette r and categ ory fluency in patients wi th frontal lobe lesions. Neuropsychology 1998, 12(2):259-67.
- Miller BL: Frontote mporal de mentia and semantic de mentia: anatomi c variations on the same disease or distinctive entities? Alzheimer Dis Assoc Disord 2007, 21(4):S19-22.
- Smi th T, Gilde h N, Holmes C: The Montreal Cognitive Assessment: validity and utility in a memory clinic sett ing. Can J Psychiatry 2007, 52(5):329-32.
- McCurry SM, Edland SD, Teri L, Kukull WA, Bowe n JD, McCormi ck WC, Larson EB: The cognitive abilities scree ning instrument (CASI ): data from a cohort of 2524 cognitively intact elde rly. Int J Geriatr Psychiatry 1999, 14(10):882-8.
- Taylor KI, Probst A, Miserez AR, Monsch AU , Tolnay M: Clinical course of neuropathologically confi rmed frontal-variant Alzheimer’s disease. Nat Clin Pract Neurol, in press. 2008 Feb 19, PMID: 18285751
- Shih WJ, Ohman-Strickland PA, Lin Y: Analysis of pilot and early phase studies wi th small sample sizes. Stat Med 2004, 23(12):1827-42.
- Keep RF, Jones HC: A morphomet ri c study on the de velopment of the late ral ventricle choroid plexus, choroid plexus capillaries and ventricular epe ndyma in the rat. Brain Res Dev Brain Res 1990, 56(1):47-53.
- Johanson CE, Duncan JA, Stopa EG, Baird A: Enhanced prospe cts for drug de livery and brain target ing by the choroid plexus-CSF route . Pharm Res 2005, 22(7):1011-37.
- Halassa MM, Fellin T, Haydon PG: The tripartite synapse: roles for gliotransmission in health and disease. Trends Mol Med 2007, 13(2):54-63.
- Houwe li ng AR, Brecht M: Behavioural rep ort of single neuron stimulation in somatosensory corte x. Nature 2008, 451(7174):65-8.
- Bains JS, Oliet SH: Glia: they make your memori es stick! Trends Neurosci 2007, 30(8):417-24.
- Szrette r KJ, Gangapp a S, Lu X, Smi th C, Shieh WJ, Zaki SR, Sambhara S, Tumpe y TM, Katz JM: Role of host cytokine responses in the pathoge nesis of avian H5N1 influenza viruses in mi ce. J Virol 2007, 81(6):2736-44.
- Pritchard AL, Harris J, Pritchard CW, Coate s J, Haque S, Holde r R, Bentham P, Lendon CL: The effect of the apolipoprote in E ge ne polymorphi sms and haplotype s on behavioural and psychological sympt oms in probable Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2007, 78(2):123-6.
- van Eijk IC, Pete rs MJ, Serne EH, Horst-Brui nsma IE, Di jkmans BA, Smulde rs YM , Nurmohamed MT: Microvascular function is impaired in ankylosing spondylitis and improves afte r TNF{alpha} blockade . Ann Rheum Dis 2008, in press.
- Tobinick EL: Targeted et anercept for treatment-refractory pain due to bone met astasis: tw o case rep orts. Clin Ther 2003, 25(8):2279-88.
- Tobinick EL: A critique of intradiscal administration for treatment of radiculopathy. Anesthesiology 2008, 108(2):334. author rep ly 335
- Wacnik PW, Eikmeier LJ, Simone DA, Wilcox GL, Beitz AJ: Nocicept ive characte ristics of tumor necrosis factor-alpha in naive and tumor-bearing mi ce. Neuroscience 2005, 132(2):479-91.
- Bohac D, Burke W, Cotte r R, Jillian Z, Potte r J, Gende lman H: A 24-wee k randomized , double-blind, placebo-controlled study of the efficacy and tolerability of TNFR:FC (et anercept ) in the treatment of de mentia of the Alzheimer type . Proceed ings of the 8th Inte rnational Conference on Alzheimer’s Disease and Related Disorde rs, Neurobiology of Aging, Stockholm, Swede n 2002, S83. Abstract 315
- Banks WA, Plotkin SR, Kastin AJ: Permeability of the blood-brain barrier to soluble cytokine recept ors. Neuroimmunomodulation 1995, 2(3):161-5.
- Batson OV: The Function of the Verte bral Veins and their role in the spread of met astases. Annals of Surge ry 1940, 112:138-149.







