Keywords
Diabetic foot; Bacteria; Mexico; Sensibility; Resistance
Introducción
La Organización Mundial de la Salud define al pie diabético como la infección, ulceración y destrucción de tejidos profundos de la extremidad inferior, asociada con alteraciones neurológicas y diversos grados de enfermedad vascular periférica. Otros autores lo definen como un síndrome clínico y complicación crónica grave de la diabetes mellitus, de etiología multifactorial, ocasionada y exacerbada por neuropatía sensitivo-motora, angiopatía, edema y afectación de la inmunidad, las cuales condicionan la infección, ulceración y gangrena de la extremidades inferiores, cuyo principal desenlace es la hospitalización o cirugía mutilante capaz de incapacitar parcial o definitivamente al paciente. En la actualidad su frecuencia de aparición es elevada y presenta altas tasas de recidiva, además se estima que el 25% de los diabéticos desarrollan una lesión en el pie a lo largo de su vida [1,2], y también es la complicación que mayores causas de discapacidad ocasiona ya que origina el 85% de las amputaciones no traumáticas [3]. El cuadro de infección de un pie diabético va desde la sola celulitis localizada o extendida, hasta la fascitis y necrosis, cayendo en su última instancia en la osteomielitis. La presencia de inflamación local, supuración o crepitación indica infección, pero su ausencia no la descarta y puede observarse osteomielitis bajo una úlcera no inflamatoria. En ausencia de úlceras, el 60% de las infecciones comienza en los espacios interdigitales, seguido de la región periungueal en 30% y el restante 10% en otras zonas. La infección se extiende a planos profundos con celulitis, fasceítis y/u osteomielitis [4]. Los agentes participantes en la infección del pie diabético varían según se trate de una infección superficial o profunda. Las infecciones superficiales agudas (úlcera no complicada, celulitis) adquiridas en la comunidad y sin tratamiento antibacteriano previo son, en su mayoría, mono microbianas [4]. Las infecciones profundas y/o crónicas son poli microbianas en más de 50% de los casos, con participación promedio de 2 a 3 agentes. En ellas siempre debe intentarse un diagnóstico bacteriológico preciso, mediante la obtención y procesamiento adecuados de muestras para cultivo. Aunque el cultivo podría ser innecesario para una persona con datos de infección leve [3]. La necesidad de realizar un estudio profundo de estos pacientes es de vital importancia además, existen evidencias, de que de los estudios a tiempo, depende en un gran porcentaje, la mejoría del paciente o la amputación, incluso cambios radicales, si el manejo se da en conjunto de un control metabólico [5]. De tal manera que, Espinoza-Tavera y col. (2014) detectan en Tamaulipas, México, más de 1134 cultivos positivos de bacterias patógenas en pies diabéticos infectados [6]. Sin embargo, los estudios en nuestro país son pocos, y es precisamente la falta de estudios locales sobre la morbilidad de los diferentes patógenos detectados en los pies diabéticos lo que resalta el interés de realizar el presente, teniendo como objetivos determinar los tipos de bacterias patógenas en las secreciones, enlistar las bacterias más frecuentes y determinar el fármaco con mayor sensibilidad y resistencia, en los cultivos realizados de pacientes diabéticos en Manzanillo, Colima, México.
Material y Metodos
Se realizó un estudio descriptivo transversal en el periodo que comprende de septiembre del 2016 a marzo del 2017. Participaron pacientes con DM2 que cursaron con pie diabético, tratados en la clínica de heridas del Centro de Salud Urbano de la Secretaria de Salud en Manzanillo, Colima, México. El tamaño muestral fue por conveniencia, de acuerdo al número de pacientes que acudieron en el periodo mencionado. Los criterios de inclusión fueron, pacientes con DM2 con pie diabético como lesión de base y que tuvieron cultivo de secreción. Los criterios de exclusión fueron pacientes con lesiones mixtas (úlceras por presión, ulcera varicosa más pie diabético) y pacientes que no tuvieron cultivo de secreción.
Recoleccion de muestras microbiologicas: Para el proceso de toma de muestra en el Centro de Salud Urbano se utilizó la siguiente técnica: Técnica Levine; consiste en rotar la torunda de algodón a través de un área de 1 cm2 de la úlcera durante 5 segundos , ejerciendo la presión suficiente para extraer fluido (exudado) del lecho de lesión, o de los tejidos peri lesionales. Para la toma de la muestra se utilizó un tubo de plástico estéril trasparente con tapón de rosca y un hisopo de punta de algodón con mango de madera o plástico. Medio de trasporte Stuart. Las muestras de lesiones llegaban con hisopo impregnado en medio de transporte Stuart con tapón de rosca, anexado con extendidos para tinción de Gram y BAAR. Para el proceso de la muestra, se realizó en el Laboratorio Estatal de la Secretaria de Salud, del Estado de Colima, México, utilizando las técnicas estandarizadas por el Laboratorio Estatal de Salud Pública de Colima Departamento de Control Microbiológico Laboratorio de Microbiología Medica. Las muestras fueron identificadas con los datos del paciente y el código asignado. Se registraba la muestra recibida por el Área de Recepción de Muestras, en la bitácora FO- 06-18-2401, anotando el numero consecutivo correspondiente y los datos del paciente registrados en la solicitud. Antes de iniciar el proceso, se tomaron las medidas de bioseguridad necesarias tales como el uso de guantes de látex, cubre-bocas, lentes de seguridad y bata de manga larga. Se limpió y desinfectó el área de trabajo con solución germicida siguiendo las instrucciones del fabricante. Se sacaron los medios de cultivo a utilizar: Agar Gelosa Chocolate (AGCh), Agar Salado Manitol (ASM), Agar McConkey (Mc) y/o Agar Eosina-Azul de Metileno (EMB), Agar Sangre al 5% (AS); Agar Mycocel y/u hongos patógenos se atemperó en la incubadora de 36 ± 1°C o cerca del mechero [7-13]. Se preparó el material a usar: pinzas, asas de nicromo, mechero, pipetas Pasteur estériles, los medios rotulados con la clave correspondiente, dos portaobjetos una para Gram y otra para BAAR y la muestra. En el caso de cultivo de líquido, se centrifugó la muestra a 2500 rpm por 10 minutos; transcurrido el tiempo, se desechó el sobrenadante con una Pipeta Pasteur estéril en un frasco de desecho con solución germicida. Se conservó el sedimento. Las muestras para cultivo de lesiones se tomaron con pinzas Kelly, el hisopo se inoculó directamente en los medios de cultivo. Posteriormente el hisopo se depositó en caldo de enriquecimiento BHI. Los tubos con caldo BHI inoculados se incubaron a 36 ± 1°C por 24 horas y en caso de no haber desarrollo en las placas inoculadas, se realizó una siembra en AS, a partir del caldo BHI después del periodo de incubación. Una vez inoculados lo medios, se estiraron por agotamiento los medios de AGCh, AS, ASM, EMB y el Agar Mycocel y/u Hongos Patógenos. Se colocó un disco de Bacitracina de 10 U en la placa con AGCh entre la descarga y la primera estría. Se incubó en condiciones de microaerofilia las placas de AGCh y el AS a 36 ± 1°C por 24 horas. Se incubó el ASM a 36 ± 1°C por 48 horas. Se incubó el EMB a 36 ± 1°C por 24 horas. Se aseguraron con una cinta los extremos de la placa de Agar Mycocel y/u Hongos Patógenos y se incubo a temperatura ambiente de 3-5 días, revisando desarrollo todos los días. Se procedió la identificación bacteriana y hongos. Se reportó en la bitácora FO-06-18-2401 de Bacteriología Médica. Después del reporte en la bitácora correspondiente, se realizó el reporte en el sistema electrónico con los datos solicitados por el programa y se enlazó la información a la red de laboratorios para su validación. Posteriormente las muestras remitidas a la red de laboratorios, se realizó la validación en el sistema electrónico, para su posterior impresión en las Unidades correspondientes (Laboratorio Estatal de Salud Pública de Colima).
Análisis estadistico: Se utilizaron los paquetes básicos de Excel y SPSS para el análisis estadístico. Se empleó estadística descriptiva (frecuencias, porcentajes, media, desviación estándar y valores mínimo y máximo).
Resultados
El número de pacientes estudiados durante el tiempo del estudio fue de 25. El total de bacterias Gram positivas fue de 21 (55%), Gram negativas 14 (37%) y otras 3 (8%) que fue Candida zaylanoides y ssp, un hongo Sacharomicetes, siendo un total de 38 oportunistas tipificados. En cuanto al sexo, se encontraron 17 masculinos (68%) y 8 femeninos (32%). La media de la edad fue 53.28 años y la desviación estándar fue 7.41 años. Teniendo valor mínimo 42 años y valor máximo 72 años. Cabe mencionar que ninguno de los pacientes presentaba pato logías cardiacas, renales u oftálmicas asociadas a la diabetes.
El tipo de muestra recogida durante el estudio fue exudado en el 100%. En dichas muestras se encontró tanto infecciones mono microbianas en 13 pacientes (52%) como poli microbianas en 12 pacientes (48%). Se observó una diferencia en las mono infecciones sobre las poli infecciones, cabe mencionar que solo un paciente presento 3 diferentes cepas como poli infección, el resto fueron solo 2 tipos por paciente, siendo las siguientes Candida ssp/Escherichia coli/Staphylococcus aureus.
En cuanto a la bacteriología de las lesiones del pie diabético, la especie más frecuente, fue Staphylococcus aureus con presencia en 6 cultivos representando el 15.79%, seguido de Staphylococcus epidermidis en 3 cultivos representando el 7.89%, Candida zeylanoides y Acinetobacter baumannii complex hemolyticus biotipo 02063720 ambas en dos cultivos representando el 5.26%, el resto de las bacterias solo se presentó en un cultivo (Escherichia coli biotipo 77115002, Streptococcus bovis, Staphylococcus cohnii, Staphylococcus warneri biotipo 322122, Kliebsiella pneumonae, Staphylococcus aureus meticilin resistente, Proteus mirabilis, Escherichia coli eslb, Staphylococcus auricularis, Staphylococcus hemoliticus, Pseudomona fluorescens putida biotipo 02041722, Klebsiella pneumonae eslb, Staphylococcus hemoliticus biotipo 322346, Acinetobacter baumannii complex hemoliticus biotipo 62660, Staphylococcus hemolitucus biotipo 202146, Streptococcus agalactiae (grupo B) biotipo 617101447, Enterobacter cloacae, Staphylococcus aureus biotipo 217176, Proteus mirabilis eslb, Klebsiella oxytoca biotipo 77754376, Staphylococcus aureus 217177, Candida ssp, Escherichia coli), representando en conjunto el 65.8%. Aunque los tipos de bacterias mencionadas fueron las que con más frecuencia se presentaron en los cultivos, se puede observar que la especie Staphylococcus, fue la predominante presentándose en el 24% de los cultivos realizados, sin embargo se encontraron diferentes cepas tipificadas de esta misma especie.
Sensibilidad y resistencia a antibióticos
Cada cultivo presentó diferentes bacterias así como diferentes fármacos sensibles y resistentes, que se reportan según su actividad bactericida ya sea alta, baja o nula.
Tipos de bacterias encontradas en los cultivos y cantidad de fármacos resistentes por bacteria
En la Tabla 1 se puede observar como el Staphylococcus hemoliticus sin biotipificar es la bacteria que presentó el mayor número de fármacos resistentes, encontramos al Staphylococcus auricularis y Escherichia coli eslb en segundo lugar con 14 fármacos resistentes, así como el Staphylococcus epidermidis en tercer lugar, dominando las resistencias la familia de Staphylococcus. Proteus mirabilis que aunque causante de infección y presencia en el cultivo, todos los fármacos fueron sensibles.
| Staphylococcus hemoliticus |
15 |
| Escherichia coli eslb |
14 |
| Staphylococcus auricularis |
| Klebsiella pneumonae eslb |
13 |
| Staphylococcus epidermidis |
| Staphylococcus hemolitucus biotipo 202146 |
12 |
| Staphylococcus epidermidis |
10 |
| Staphylococcus aureus meticilin resistente |
| Staphylococcus cohnii |
8 |
| Staphylococcus hemoliticus biotipo 322346 |
| Escherichia coli biotipo 77115002 |
4 |
| Streptococcus bovis |
| Staphylococcus aureus |
| Pseudomona fluorescens putida biotipo 02041722 |
| Staphylococcus warneri biotipo 322122 |
3 |
| Staphylococcus aureus |
| Kliebsiella pneumonae |
1 |
Tabla 1 Cantidad de fármacos resistentes por bacterias.
Tipos de bacterias encontradas en los cultivos y cantidad de fármacos sensibles por bacteria
En la Tabla 2 se puede observar como Proteus mirabilis, Kliebsiella pneumonae y Escherichia coli biotipo 77115002 junto con Staphylococcus aureus, fueron las bacterias con más fármacos sensibles. Se observa como el Staphylococcus aureus se presenta en múltiples ocasiones en los cultivos, más que las dos bacterias con mayor sensibilidad a fármacos, sin embargo esta mantiene en los diferentes cultivos en los que dio positividad, la cantidad de fármacos sensibles.
| Proteus mirabilis |
21 |
| Kliebsiella pneumonae |
20 |
| Escherichia coli biotipo 77115002 |
17 |
| Staphylococcus aureus |
| Staphylococcus warneri biotipo 322122 |
16 |
| Staphylococcus cohnii |
11 |
| Acinetobacter baumannii complex hemoliticus |
| Pseudomona fluorescens putida biotipo 02041722 |
10 |
| Staphylococcus aureus meticilin resistente |
8 |
| Escherichia coli eslb |
7 |
| Staphylococcus hemolitucus biotipo 202146 |
| Staphylococcus hemoliticus biotipo 322346 |
6 |
| Staphylococcus epidermidis |
| Streptococcus bovis |
5 |
| Staphylococcus auricularis |
| Klebsiella pneumonae eslb |
Tabla 2 Cantidad de fármacos sensibles por bacterias.
Las bacterias encontradas en cultivo con resistencia intermedia a diversos fármacos fueron Pseudomona fluorescens putida biotipo 02041722, Staphylococcus aureus meticilin resistente y Staphylococcus epidermidis con 1; Acinetobacter baumannii complex hemoliticus, Klebsiella pneumonae eslb y Staphylococcus hemoliticus biotipo 322346 con 2 y Staphylococcus aureus 3.
Realizando una comparación entre los fármacos resistentes y los sensibles obtenidos en este estudio, resalta el hecho de que se tiene una gran variedad de fármacos que solo presentan sensibilidad y que no aparentan tener resistencias, así como otros que solo se presentaron en pocas ocasiones como resistentes (Figura 1). Se puede observar como levofloxacino aparece como sensible en 23 cultivos (5.98%), en segundo lugar el moxifloxacino sensible en 19 cultivos (5.16%), en tercer lugar daptomicina, linezolid y vancomicina, los tres 18 cultivos con sensibilidad cada uno (4.89% cada uno, total 14.67%). Por otro lado, la ampicilina presentó resistencia en 24 cultivos (13.26%), seguida por penicilina en 17 cultivos (9.39%) y sorprendentemente por la ceftriaxona en 15 cultivos (8.29%). Aunque no de las principales, pero sí de manera considerable se encontró al ciprofluoxacino con 10 cultivos. Así también fármacos de poco uso común, como aztreonam y torvamicina, ya presentaron resistencia.
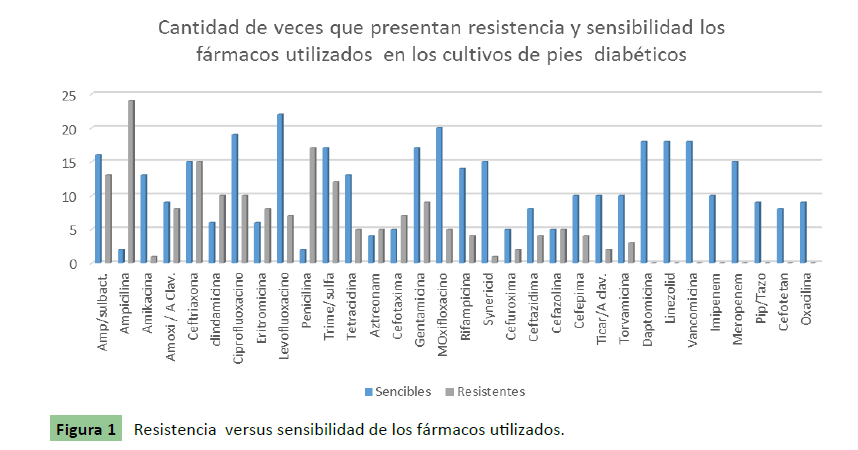
Figura 1: Resistencia versus sensibilidad de los fármacos utilizados.
Cabe mencionar que por las características clínicas que presentaron los pacientes participantes, todos se encontraban en estatus de infección, la mayoría de ellos de manera subsecuente, sin embargo no se registra por no ser objetivo del estudio, otros tuvieron infección de primera vez, pero ya con datos de isquemia y neuropatía.
Discusión
Durante la realización del presente trabajo de investigación, se observó que la mayor frecuencia de heridas es causada por infección en diabéticos como lo fue en el 100% de los pacientes participantes en este estudio. Se planteó el presente estudio debido a que no hay registros ni estadísticas de las características bacterianas en las infecciones de pies diabéticos de los pacientes, así como también la falta de un protocolo interno de acción al momento de recepción del paciente.
En diversos estudios realizados en otras regiones del país o del mundo en pie diabético, existen diferentes tipos de bacterias encontradas en los cultivos, pero el Staphylococcus aureus es el germen más frecuente [6,14-16]. De forma muy similar a lo que encontramos en el presente estudio. Otro germen que coincide con resultados previamente publicados por diversos autores [14,17-19] es la Pseudomona aeruginosa en nuestro trabajo con un 24%, comparado con 46.1% de otro estudio realizado en México y a la familia de las enterobacterias en similares proporciones a estudios diversos locales e internacionales [14,20-22]. Sin embargo en un estudio peruano solo fue del 4.7% [23].
En cuanto a la diferenciación de bacterias Gram negativas y Gram positivas, en nuestro estudio las Gram positivas mostraron una superioridad con el 55%, mientras que las Gram negativas solo un 37% y las levaduras 8%. En estudios como el de Espinoza-Tavera y cols. realizado en la Universidad Autónoma de Tamaulipas en el 2014, el 48.6% de las bacterias fueron Gram positivas y 47.7% fueron Gram negativas y 3.6% levadura diversas, aunque el porcentaje de levaduras fue similar a nuestro estudio, la diferencia de resultados en Gram fue muy diferente, siendo en nuestro estudio polarizado a Gram positivo y en el de Tamaulipas loss porcentajes muy equilibrados. Tomando en cuenta que aunque las dos están en regiones costeras, los climas son distintos ya que en la región del pacifico la humedad es mayor, que la región del norte de México. Esto podría ser un factor de tal diferencia en los estudios [14].
La edad de los participantes no fue un factor determinante en este estudio, ya que aunque el tiempo de captura de los pacientes fue suficiente, la población de mayores de 50 años solo nos permitió obtener 25 muestras para cultivos cuyos pacientes eran portadores de pie diabético, 20 pacientes fueron de 50 a 59 años y solo 5 de 60 y más. Sin embargo solo 1 de los 5 pacientes de 60 y más, presento infección mixta y los demás mono infección, de los pacientes con 50 y más 9, presentaron infección por más de una bacteria y 11 mono infección, es decir solo 20% de los pacientes con 60 y más, con infección mixta y el 45% de los pacientes entre 50 y 59 años presentó infección mixta. En cuanto al género, se observó solamente 8 mujeres contra 17 hombres.
En la sensibilidad que se observó de los antibióticos, la ampicilina se presentó 24 veces como resistente en los cultivos y solamente en 2 sensible, seguido por ceftriaxona 15 veces resistente a bacteria, sin embargo también presento 15 veces sensible a una bacteria, seguidos por la clindamicina y el ciprofluoxaciono con 10 bacterias resistentes cada uno. Se encontró que el fármaco que presento sensibilidad a mas bacterias fue el levofluoxacino con 22 bacterias sensibles, seguido de moxifluoxaciona con 20 y daptomicina, linezolid, vancomicina con 18 bacterias, es importante comentar que existieron fármacos que no presentaron ni una sola resistencia, daptomicina, linezolid, vancomicina, imipenem, meropenem, pip/tazo, cefotetan, oxacilina, otorgando un margen de fármacos para utilizar en futuras atenciones de infección.
Conclusiones
• La infección por Staphylococcus aureus fue la que se presentó con mayor frecuencia.
• La bacteria que presentó mayor número de fármacos resistentes fue el Staphylococcus hemoliticus.
• Las bacterias Gram positivas fueron encontradas con mayor frecuencia.
• El fármaco que presento mayor número de veces resistencia fue la ampicilina.
• El fármaco que presento mayor número de veces sensibilidad fue el levofluoxacino.
22895
References
- Ríos JM (2010) Pie diabético y cómo prevenirlo. La Nación Ciencia y Salud p: 15.
- Edmonds M (2005) Infection in the neuroischemic foot. Int J Low Extrem Wounds 4: 145-153.
- Audi EG, Moreira RC, Moreira ACG, Pinheiro EFC, Mantovani MF et al (2011) Avaliação dos pés e classificação do risco para pé diabético: Contribuições da enfermagem. Cogitare Enferm 16: 240-246.
- Perez Rodríguez MC, Simone de Mazzo G, Nogueira A, Trevizan PC, Mendes MA (2013) Cuidado de los pies diabéticos antes y después de la intervención educativa. Enfermería Global 29: 43-52.
- Consejo General de Colegios Oficiales de Podólogos (2011) Guía De Protocolos de pie diabético. (1ª Edn.).
- NOM-007-SSA3-2011, para la organización y funcionamiento de los laboratorios clínicos.
- NOM-006-SSA2-2013, para la prevención y control de la Tuberculosis en la Atención Primaria a la Salud.
- NOM-087-ECOL-SSA1-2002, para la protección ambiental-salud. Ambiente-residuo peligroso biológico infeccioso. Clasificación y especificaciones de manejo.
- Manual de Bioseguridad en el Laboratorio, Organización Mundial de la Salud Ginebra 2005 tercera edición.
- Espinoza-Tavera A, Hernández-Gracia G, Cantú-Ramírez RC, Díaz-López A, Ávila-Aguilar S, et al. (2014) Prevalencia y perfil de resistencia a antibióticos de microorganismos aislados de infecciones en pie diabético. Ciencia UAT 9: 84-89.
- Lavery LA, Sariaya M, Ashry H, Harkless LB (1995) Microbiology of osteomyelitis in diabetic foot infections. J Foot Ankle Surg 34: 61-64.
- Elguera Falcón F, Solís Villanueva J, Neyra Arizmendiz L (2006) Estudio bacteriológico de pacientes con pie diabético infectado en el Hospital Arzobispo Loayza. Rev Soc Per Med Intern 19: 5-9.
- Williams DT, Hilton JR, Harding KG (2004) Diagnosing foot infection in diabetes. Clin Infect Dis 39: S83-S86.
- Eron L (1999) Antimicrobial wound management in the emergency department. An educational supplement. J Emerg Med 17: 189-195.
- Lipsky B (1999) Evidence-based therapy of diabetic foot infections. Immunol Med Microbiol 26: 267-276.
- Barberán J (2009) Infecciones en el pie diabético: Importancia de las resistencias bacterianas. Enferm Infecc Microbiol Clin 27: 315-316.
- Ertugrul MB, Baktiroglu S, Salman S, Unal S, Aksoy M, et al. (2008) Pathogens isolated from deep soft tissue and bone in patients with diabetic foot infections. J Am Pediatr Med Ass 98: 290-295.
- Aragón-Sánchez J, Lipsky BA, Lázaro-Martínez JL (2013) Gram-negative diabetic foot osteomyelitis: Risk factors and clinical presentation. Int J LowExtrem Wounds 12: 63-68.
- Yovera-Aldana M, Rodríguez A, Vargas M, Heredia P, Huamán MO, et al. (2017) Bacterial resistance and associated factors in patients with infected diabetic foot with no major amputation outcomes in a Peruvian national hospital. Acta Med Peru 34: 173-181.






