Introducción
Los paragangliomas son tumores con capacidad de producción, almacenamiento y secreción de catecolaminas por ser embriológicamente originados de células cromafines extra adrenales localizadas en ganglios simpáticos paravertebrales del tórax, abdomen, pelvis o en ganglios parasimpáticos de la base del cráneo y cuello [1]. La epidemiología de los paragangliomas usualmente es descrita conjuntamente con los feocromocitomas y la incidencia individual no está claramente definida. La presentación de casos es de 2 a 8 por millón anualmente [2]. La mayoría de los paragangliomas son diagnosticados entre la tercera y quinta década de la vida, siendo estos en su gran mayoría benignos [3]. Los malignos, definidos como aquellos con compromiso metastásico, tuvieron en el 2002 una incidencia estimada de 93 casos por 400 millones en los Estados Unidos [4].
Los paragangliomas pueden tener una presentación clínica muy variable, que tiende a ser más asintomática en comparación con los feocromocitomas, sin embargo, el espectro de presentación va a depender tanto de su localización y de la producción propia de catecolaminas, lo cual representa un reto diagnóstico.
La cirugía es la base del manejo de los paragangliomas, no obstante, se debe realizar tratamiento médico previo por incremento de complicaciones perioperatorias secundario a la liberación hormonal [5].
Caso Clínico
Paciente masculino de 33 años con antecedente de urolitiasis y tabaquismo leve. Consultó por 4 días de evolución de dolor abdominal continuo, tipo cólico en flanco izquierdo de moderada intensidad, irradiado a región lumbar e inguino escrotal ipsilateral, sin otros síntomas referidos. Al ingreso con presión arterial: 120/70 mmHg, frecuencia cardiaca: 78 por minuto, frecuencia respiratoria: 13 por minuto, temperatura: 36.7 grados centígrados. Al examen físico el abdomen presentaba dolor a la palpación en flanco izquierdo, sin signos de irritación peritoneal y sin otros hallazgos importantes. Los estudios de laboratorio realizados son presentados en la Tabla 1.
| Laboratorios |
Valores |
| Hemograma |
Leucocitos: 9240; Neutrófilos: 51.4%; Linfocitos: 33%; Monocitos: 12%; Hemoglobina: 14.5; Plaquetas: 332.000. |
| Reactantes fase aguda |
VSG 63mm/h y PCR 6.19 mg/dl (VR 0-0.3) |
| Renal |
Creatinina 1.0 mg/dl; BUN 24 mg/dl |
| Electrolitos |
Calcio 8.7 mg/dl; Cloro: 102 mEq/l; Fósforo:2.8 mg/dl; Potasio: 3.9 mEq/L |
| Uroanálisis |
Color amarillo pH: 6.5 y densidad 1012 proteínas negativo, sedimento normal Gram de orina sin gérmenes |
Tabla 1: Laboratorios de ingreso.
Inicialmente se realizó ecografía abdominal total sin alteraciones, pero por persistencia de la sintomatología se ordenó una Tomografía computarizada (TC) abdominal contrastada con evidencia de masa de localización para-aórtica izquierda sólida de 30 × 25 mm con área hipodensa central que sugería necrosis (Figura 1). Se complementaron estudios de extensión con marcadores tumorales, TC de cuello y de tórax dentro de los límites normales.
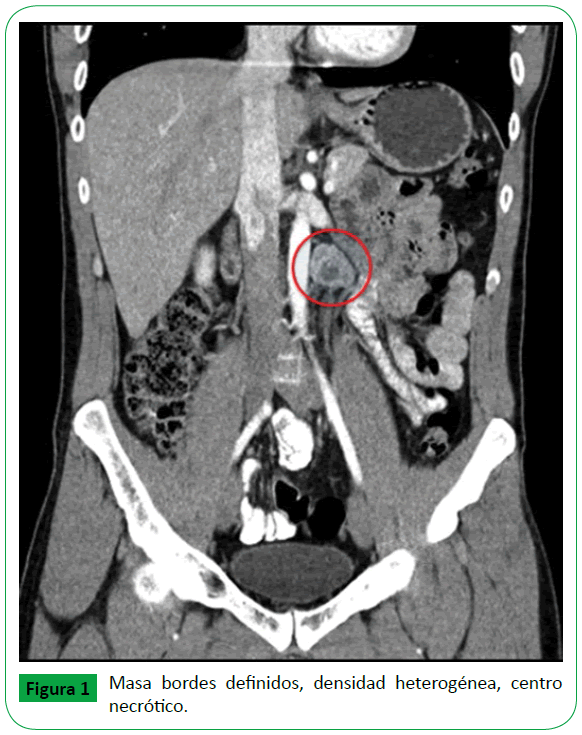
Figura 1: Masa bordes definidos, densidad heterogénea, centro necrótico.
Considerando como impresión diagnóstica más probable una lesión de origen linfoproliferativo, se realizó biopsia de dicha lesión. Durante el procedimiento quirúrgico se identificó masa para-aórtica hipervascularizada que con mínima manipulación presentó sangrado profuso y urgencia hipertensiva que resolvió con el manejo instaurado. Dadas las características del cuadro se solicitaron estudios con metanefrinas libres en plasma con los siguientes resultados:
• Metanefrina 72.4 pg/ml (Valor de referencia <90)
• Normetanefrina 226.9 pg/ml (Valor de referencia <180)
Se inició bloqueo alfa adrenérgico con prazosina y 10 días después fue llevado a resección de la masa sin complicaciones con lo cual resuelve la sintomatología y se da egreso hospitalario.
El estudio histopatológico mostró una lesión nodular de patrón paragangliomatoso, con atipia marcada focal, extensa necrosis, hemorragia y 5 mitosis en 10 campos de alto aumento. Patrón infiltrativo local e invasión linfovascular. La inmunohistoquímica fue Positiva para Cromogranina, sinaptofisina y S100. Negativa para Inhibina y melan A, Ki-67 5%.
Adicionalmente se realizó PET/CT 18 FDG y MIBG sin evidencia de compromiso metastásico (Figuras 2 y 3).
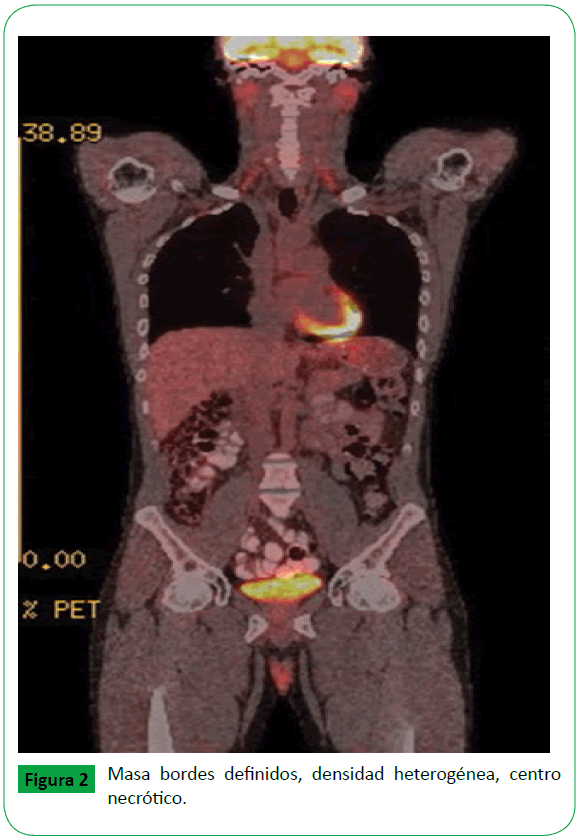
Figura 2: Masa bordes definidos, densidad heterogénea, centro necrótico.
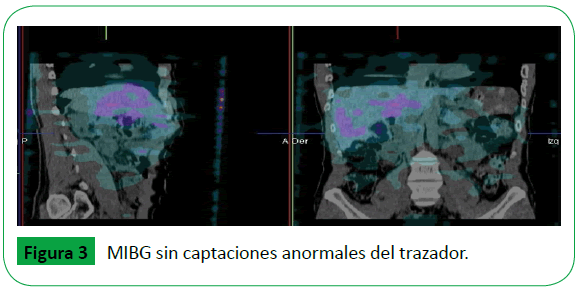
Figura 3: MIBG sin captaciones anormales del trazador.
En el seguimiento bioquímico con Cromogranina A y metanefrinas fraccionadas en plasma no se evidenció recurrencia (Tabla 2).
| Marcador |
Resultado |
Valor de Referencia |
| Cromogranina A |
51.71 ng/ml |
<101.9 ng/ml |
| Metanefrina |
48.1 pg/ml |
<90 pg/ml |
| Normetanefrina |
61.3 pg/ml |
<180 pg/ml |
Tabla 2: Marcadores bioquímicos. Cromogranina A y Metanefrinas fraccionadas en plasma.
Discusión
Los paragangliomas se localizan en el 75% de los casos en el abdomen y 10% en la pelvis, siendo éstos tumores en la mayoría de ocasiones productores de catecolaminas [6]. Usualmente son los síntomas asociados con la producción de catecolaminas, los que generan la sospecha diagnóstica y por lo tanto orienta a su búsqueda; en este caso, el debutar con dolor abdominal y hallazgo incidental de una masa abdominal con ausencia de síntomas hiperadrenergicos, conllevó a considerar otras opciones diagnósticas inicialmente.
La triada clásica de presentación consiste en diaforesis, cefalea y palpitaciones con una prevalencia del 57%, 80% y 64% respectivamente, sin embargo la clínica es variable; síntomas como síncope, ansiedad, temblor, pérdida de peso pueden ser la única manifestación o incluso ser asintomáticos [2,7].
La tríada mencionada, en un paciente hipertenso mostró una sensibilidad del 90,9% y una especificidad del 93,8% [8]. En distintas revisiones se ha estimado que la triada clásica en un paciente hipertenso tiene un LR+ (Likelihood Ratio) de 6 - 15 para el diagnóstico de paraganglioma o feocromocitoma [7], sin embargo, como ya se mencionó la presentación puede ser asintomática y así mismo en este paciente no se presentaron alguno de estos síntomas y no existía evidencia de hipertensión durante la estancia hospitalaria, catalogándolo de baja probabilidad pretest para paraganglioma.
La evaluación imagenológica se ha postulado como una ayuda diagnóstica útil para el estudio de las masas retroperitoneales. Como concepto general, las masas sólidas retroperitoneales se pueden clasificar dentro de 5 categorías basados en su tejido de origen: tumores mesodérmicos, tumores neurogénicos, tumores germinales extra gonadales, linfomas y masas metastásicas. Los paragangliomas son usualmente mayores de 3 cm, tienen márgenes definidos, redondos y lobulados. La localización paraaórtica típica se encuentra desde la arteria mesentérica inferior hasta la bifurcación de la aorta y muestra un gran componente vascular que se evidencia por la alta captación de contraste de forma temprana. La necrosis central y las calcificaciones se presentan en 40% y 15% respectivamente [9]. Aunque las características descritas son orientadoras, no hay hallazgos patognomónicos de los paragangliomas y por lo tanto la lista de diagnósticos diferenciales es amplia y requiere conservar un alto índice de sospecha siempre que se evalúan masas en retroperitoneo. Para el caso que reportamos las imágenes tomográficas hacían parte de un estudio estándar en urgencias para búsqueda de causas de dolor abdominal y por lo tanto algunas de las características del comportamiento de la masa con el medio de contraste fue una limitante. Es de aclarar que el componente necrótico hipervascular y las calcificaciones hubiese sido un hallazgo orientador hacia paraganglioma [10], pero en este caso con una clínica no sugestiva y las imágenes no conclusivas, orientó hacia la obtención de una biopsia de la lesión, que durante su realización por su comportamiento llevó a la búsqueda de un paraganglioma.
El estudio del paraganglioma se debe realizar con la medición de metanefrinas libres en plasma o metanefrinas fraccionadas en orina, las cuales se producen y se secretan continuamente por los tumores como un proceso que es independiente de la liberación de catecolaminas y la sensibilidad diagnóstica de las metanefrinas urinarias es superior sobre la medición de catecolaminas y ácido vanililmandélico [11,12]. Así también, las metanefrinas libres plasmáticas son de gran utilidad dado su alta sensibilidad (90-100%) y especificidad (85-100%), por lo cual es aconsejable iniciar el estudio con metanefrinas en plasma dado su facilidad de recolección y alto poder diagnóstico, en caso de no estar disponible, la toma de metanefrinas fraccionadas en orina es la siguiente opción [13].
Hasta el 40% de los feocromocitomas/paragangliomas tienen una mutación germinal, así que el perfil bioquímico adicionalmente puede ser orientador para la selección de los estudios genéticos dada su asociación con las mutaciones relacionadas para estos tumores. En ese sentido un perfil de predominio noradrenérgico o dopaminérgico es relacionado con mutaciones de complejo de la succinato deshidrogenasa (SDHx) y adrenérgico con mutación del gen RET o NF1 [14].
Posterior a la confirmación bioquímica, se debe realizar el estudio imagenológico con tomografía computarizada (TC) o resonancia magnética (RM) en todos los pacientes. Después de realizar las imagen anatómicas, se utilizan modalidades funcionales de medicina nuclear, las cuales son necesarias dado que entre un 17 a 20% de los casos se presenta con compromiso metastásico [15]. Principalmente los dos métodos de estudio para enfermedad metastásica son 123 I-metayodobencilguanidina (MIBG) o la tomografía por emisión de positrones con 18-fluoro-desoxiglucosa (PET/CT 18FDG), con sensibilidades entre 56-88% y 74-100%, especificidades 70-100% y 80-90%, respectivamente. De igual modo las guías de la Sociedad Europea de Endocrinología Clínica recomiendan de ser posible el uso preoperatorio del PET/CT 18 FDG en los casos de alto riesgo para compromiso metastásico, en los cuales hay evidencia de la superioridad sobre 123I-MIBG en la detección de metástasis [5,16]. Sin embargo, es de anotar que la MIBG es útil en la preparación para un posible tratamiento de la enfermedad metastásica, dado que el sesenta por ciento de los feocromocitomas/paragangliomas son MIBG ávidos, y por lo tanto, son susceptibles a la terapia sistémica 131I-MIBG [17,18].
El manejo de los paragangliomas es quirúrgico y los objetivos pre quirúrgicos abarcan la normalización de la tensión arterial, frecuencia cardiaca y el estatus de la volemia. Las guías sugieren que el bloqueo adrenérgico debe iniciarse 7-14 días previo a la cirugía [12]. El bloqueo preoperatorio con antagonistas de los receptores alfa-adrenérgicos es también el tratamiento estándar; no obstante la falta de disponibilidad de fenoxibenzamina o doxazosina en algunos hospitales hace que la terapia con prazosina o calcio antagonistas pueda ser una opción inicial para el tratamiento [19,20].
Conclusión
Los parangliomas son tumores nueroendocrinos con capacidad de síntesis, almacenamiento y secreción de catecolaminas, sin embargo, no siempre tienen una buena correlación bioquímicaclínica, por lo cual, pese al alto rendimiento de los estudios hormonales, radiológicos y funcionales, siguen constituyendo en un reto diagnóstico. Por lo anterior es recomendable mantener una alta sospecha diagnóstica en la evaluación de masas del retroperitoneo a pesar de la ausencia de sintomatología adrenérgica, puesto que los síntomas clásicamente descritos de los feocromocitomas y paragangliomas pueden no ser suficientes para establecer una sospecha diagnostica y definir así el inicio de estudios de esta patología.
Conflicto de Intereses
Los autores declaran no tener ningún conflicto de intereses.
20262
References
- Lam AK (2017) Update on adrenal tumours in 2017 World Health Organization (WHO) of endocrine tumours. Endocr Pathol.
- Fishbein L (2016) Pheochromocytoma and paraganglioma: Genetics, diagnosis and treatment. Hematol Oncol Clin North Am 30: 135-150.
- Erickson D, Kudva YC, Ebersold MJ, Thompson GB, Grant CS, et al. (2001) Benign paragangliomas: Clinical presentation and treatment outcomes in 236 patients. J Clin Endocrinol Metab 86: 5210-5216.
- Eisenhofer G, Timmers HJ, Lenders JW, Bornstein SR, Tiebel O, et al. (2011) Age at diagnosis of pheochromocytoma differs according to catecholamine phenotype and tumor location. J Clin Endocrinol Metab 96: 375-384.
- Plouin PF, Amar L, Dekkers OM, Fassnacht M, Gimenez-Roqueplo AP, et al. (2016) European Society of Endocrinology Clinical Practice guideline for long-term follow-up of patients operated on for a phaeochromocytoma or a paraganglioma. Eur J Endocrinol 174: G1-G10.
- Lee JA, Duh QY (2008) Sporadic paraganglioma. World J Surg 32: 683-687.
- Soltani A, Pourian M, Davani BM (2015) Does this patient have pheochromocytoma? A systematic review of clinical signs and symptoms. J Diabetes Metab Disord 15: 6.
- Bravo EL, Tagle R (2003) Pheochromocytoma: State-of-the-art and future prospects. Endocr Rev 24: 539-553.
- Sangster GP, Migliaro M, Heldmann MG, Bhargava P, Hamidian A, et al. (2016) The gamut of primary retroperitoneal masses: Multimodality evaluation with pathologic correlation. Abdom Radiol 41: 1411-1430.
- Scali EP, Chandler TM, Heffernan EJ, Coyle J, Harris AC, et al. (2015) Primary retroperitoneal masses: What is the differential diagnosis? Abdom Imaging 40: 1887-1903.
- Pacak K, Wimalawansa SJ (2015) Pheochromocytoma and paraganglioma. Endocr Pract 21: 406-412.
- Lenders JW, Duh QY, Eisenhofer G, Gimenez-Roqueplo AP, Grebe SK, et al. (2014) Pheochromocytoma and paraganglioma: An endocrine society clinical practice guideline. J Clin Endocrinol Metab 99: 1915-1742.
- van Berkel A, Lenders JW, Timmers HJ (2014) Diagnosis of endocrine disease: Biochemical diagnosis of phaeochromocytoma and paraganglioma. Eur J Endocrinol 170: R109-R119.
- Favier J, Amar L, Gimenez-Roqueplo AP (2015) Paraganglioma and phaeochromocytoma: From genetics to personalized medicine. Nat Rev Endocrinol 11: 101-111.
- Shulkin BL, Ilias I, Sisson JC, Pacak K (2006) Current trends in functional imaging of pheochromocytomas and paragangliomas. Ann N Y Acad Sci 1073: 374-382.
- Rufini V, Treglia G, Castaldi P, Perotti G, Calcagni ML, et al. (2011) Comparison of 123I-MIBG SPECT-CT and 18F-DOPA PET-CT in the evaluation of patients with known or suspected recurrent paraganglioma. Nucl Med Commun 32: 575-582.
- van Hulsteijn LT, Niemeijer ND, Dekkers OM, Corssmit EP (2014) (131)I-MIBG therapy for malignant paraganglioma and phaeochromocytoma: Systematic review and meta-analysis. Clin Endocrinol (Oxf) 80: 487-501.
- Timmers HJ, Chen CC, Carrasquillo JA, Whatley M, Ling A, et al. (2009) Comparison of 18F-fluoro-L-DOPA, 18F-fluoro-deoxyglucose, and 18F-fluorodopamine PET and 123I-MIBG scintigraphy in the localization of pheochromocytoma and paraganglioma. J Clin Endocrinol Metab 94: 4757-4767.
- Mazza A, Armigliato M, Marzola MC, Schiavon L, Montemurro D, et al. (2014) Anti-hypertensive treatment in pheochromocytoma and paraganglioma: Current management and therapeutic features. Endocrine 45: 469-478.
- Challis BG, Casey RT, Simpson HL, Gurnell M (2017) Is there an optimal preoperative management strategy for phaeochromocytoma/paraganglioma? Clin Endocrinol (Oxf) 86: 163-167.








