Key words
Flounder, Platichthys flesus luscus, milt, spermatological characteristics
Giris
Pisi baligi, Pleuronectes flesus luscus, Beyaz Deniz’den Akdeniz ve Karadeniz’e kadar Bati Avrupa’nin az tuzlu kiyisal sularinda yayilis gösteren Pleuronectidae takimina ait bir türdür (Nielsen, 1986). Bu takimin bazi türleri yetistiricilik açisindan oldukça önemlidir ve farkli ülkelerde kültürü yapilmaktadir (Alvail ve Manriquez, 1999; Bengston,1999; Olsen ve ark., 1999). Türkiye için ticari öneme sahip pisi baligi son yillarda yetistiricilik için de dikkate alinmaya baslanmistir (Sahin, 2000).
Sperma kalitesi su ürünleri yetistiriciliginde anaç yönetimi açisindan, döllenme orani ve böylece anaçlardan elde edilen toplam canli yumurta üretimini etkilediginden, çok önemli bir degiskendir. Sperma miktari, spermatozoa yogunlugu, motilite ve motilite süresi sperma kalitesini belirlemede en yaygin kullanilan özelliklerdir (Billard ve ark. 1995).
Sperma miktari, baligin sperma veriminin ve spermatozoa sayisinin göstergelerinden birisidir. Moon ve ark. (2003) erkek Platichthys stellatus’ta sperma miktari ve spermatozoa yogunlugu arasinda pozitif korelasyon oldugunu bildirmislerdir. Sperma miktari, sperma alma esnasinda idrar karismasi durumunda degisebilmekte, bu durumda ise renkte degisiklikler olusabilmektedir (Glogowski ve ark., 2000).
Motilite spermanin yumurta ile temas edinceye kadar tam olarak hareketli olma zorunlulugundan dolayi çok büyük öneme sahiptir (Chauvaud ve ark., 1995). Spermadaki spermatozoalar baliktan alindiktan sonra hareketsiz kalmaktadirlar (Morisawa ve ark. 1988). Birçok balik türünde, ozmotik basinçtaki azalma, hareketsiz olan spermatozoadaki motiliteyi baslatabilmektedir (Darszon ve ark. 2001). Spermato-zoadaki motilite ve motilite süresi basarili bir fertilizasyon için gereklidir. Bu durum spermato-zoanlarin ovuma ulasip dölleyebilme yetenegini göstermektedir. Iyi kalitede bir spermada, bu iki özellige ait degerler yüksek bulunmustur (Babiak ve ark., 1999, Tekin ve ark., 2003).
Spermatozoa yogunlugu fertilizasyon oranina etki edebilen bir baska spermatolojik özelliktir (Aas ve ark., 1991). Fertilizasyon oraninin % 50’den yüksek olabilmesi için ovum basina 3,8 x 105 spermatozoa olmasi gerektigi bildirilmektedir (Poole ve Dillanea, 1998). Bu nedenle spermadaki spermatozoa yogunlugunun belirlenmesi, döllenmeye etki edebilmesi yönünden önem tasimaktadir.
Spermatolojik özelliklerden bir digeri de sperma pH’idir. Sperma pH’inin spermatozoa motilitesine etki ettigi bildirilmektedir (Billard ve ark., 1995, Liley ve ark., 2002). Bu nedenle sperma pH’indaki degisimlerin belirlenmesi, spermadaki spermatozoa orani ve morfolojisi hakkinda bilgi verebilmektedir.
Birçok balik türünde sperma kalitesi ve spermatolojik özellikler çalisilmis olmasina ragmen, Türkiye’de kültüre alinan pisi baliginin spermatolojik özellikleri ile ilgili bir bilgi bulunmamaktadir. Spermatolojik özelliklerin belirlenmesi, normal bir dölveriminin elde edilmesinde ya da dölveriminde olusabilecek aksakliklarin çözülmesinde, erkege ait faktörlerin belirlenmesi açisindan da önem tasimaktadir.
Bu çalisma, üreme sezonundaki pisi baliginin spermatolojik özelliklerini belirlemek ve bu özellikler arasindaki iliskiyi ortaya koymak amaciyla yapildi.
Materyal ve Metot
Arastirma Trabzon Su Ürünleri Merkez Arastirma Enstitüsü deniz kuluçkahanesinde 2010 yili üreme sezonunda (Subat), kuluçkahanede yetistirilen ve boylari 13.1-20.0 cm, agirliklari 24.6-79.4 g arasinda degisen 10 erkek pisi baligi ile gerçeklestirildi..
Üreme sezonunda laboratuar ortaminda erkek baliklardan sperma, hormon ve anestezik madde kullanilmadan ve ürogenital bölge tamamen kurulandiktan sonra, abdominal masaj yapilarak 1 ml’lik siringa ucuna takilan 0.7 mm çapindaki ölçekli silikon tüp içerisine toplandi ve tüp içerisindeki sperma miktari tespit edilip ml olarak kaydedildi. Alinan spermalarda; spermatozoa motilitesi, motilite süresi, spermatozoa konsantrasyonu ve pH belirlendi. Spermatozoa motili-tesi, 0.5 μl sperma mikroskop altindaki lam üzerine konuldu, 50 μl deniz suyu ile karistirildi ve x400 büyütmede mikroskop altinda tek yönde ve güçlü hareket eden spermatozoonlarin, hareketsiz ve diger hareket biçimi gösteren spermatozoonlara orani olarak (%) olarak belirlendi belirlendi (Chen ve ark., 2004; Bozkurt ve Seçer, 2006). Motilite süresi, sperma ve aktivasyon solüsyonunun temasindan spermatozoa motilitesi kesilinceye kadar geçen süre bir kronometre ile dakika olarak saptandi. Spermatozoa yogunlugu hemositometrik yöntemle belirlendi ve sonuçlar x109 spermatozoa/ml olarak kaydedildi. Spermanin pH degerlendirme islemi, bir damla spermanin indikatör kagidina (Merck 5.5-9.0) damlatilmasi ve kagit üzerindeki renk degisimine bakilip skaladan okunmasi yoluyla yapildi. Çalismada her örnek için üç paralel yapilarak or-talamasi alindi. Istatistikî analizler Microsoft Office Excel 2003 programi ile yapildi.
Bulgular ve Tartisma
Kuluçkahanede anaç baliklarin tutuldugu deniz suyunun sicakligi 8.0-24.1 ºC (15.0±4.9), DO ve pH degerleri sirasiyla 5.3-9.5 mg/l (7.1±0.9) ve 7.5-8.5 (8.1±0.2) arasinda degisti
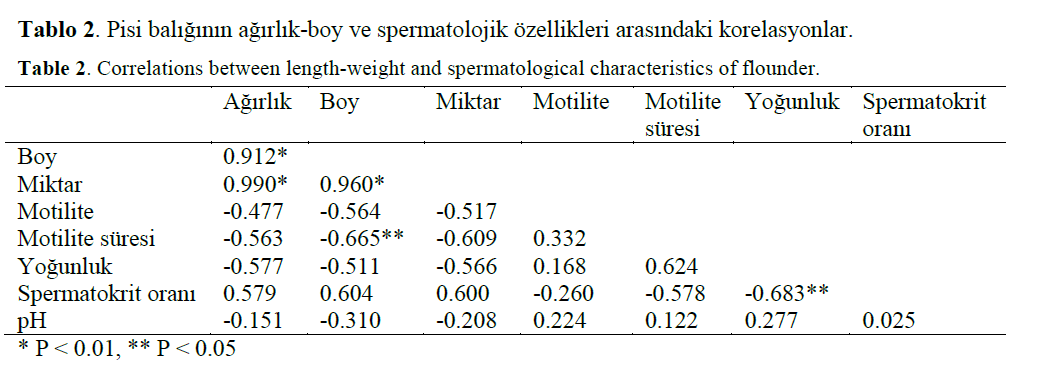
Çalismada 10 erkek pisi baliginda belirlenen biyometrik ve spermatolojik özellikler Tablo 1’de, agirlik-boy ve spermatolojik özellikleri arasindaki korelasyonlar Tablo 2’de verildi.
Table 1: Spermatological and biometric characteristics of flounders (n = 10)
Table 2: Correlations between length-weight and spermatological characteristics of flounder.
Bu çalismada örneklerden alinan sperma miktari, bireyler arasinda oldukça degisken (0.1-0.3 ml) olmakla birlikte, ortalama 0.2 ± 0.04 ml olarak saptandi. Çalismada incelenen bireylerin boy ve agirligi ile sperma miktari arasinda güçlü bir pozitif korelasyon gözlendi (P < 0.01). Pisi baliklarinin sperma miktari, kültürü yapilan deniz baliklarindan; Daniels (2000) tarafindan Paralichthys lethostigma için bildirilen sperma miktari (≤ 0.5 ml) ile benzerlik göstermesine karsin, Pseudopleuronectes americanus (Wal-baum) için 0.5-10 ml/kg (Shangguan ve Crim, 1999), Morone chrysops (Rafinesque) için 1.2 ml/kg (Mylonas ve ark., 1997a), Dicentrarchus labrax için 1-2 ml/kg (Sorbera ve ark., 1996),
Siganus guttatus için 2 ml/kg (Garcia 1991), Scophthalmus maximus için 2.2 ml/kg (Suquet ve ark., 1992b) ve Morone saxatilis için 2-4 ml/kg (Mylonas ve ark., 1997b) olarak bildirilen degerlerden düsük bulundu. Bu farkliliklar, balik türlerine bagli olabilecegi gibi, çevresel faktör-lerden de kaynaklanmis olabilir.
Sperma kalitesi için en güvenilir gösterge spermatozoa motilitesidir (Bozkurt ve ark., 2006). Arastimada spermatozoa motilite orani ortalama % 88.0 ± 13.80 olarak bulundu. Bu oran, Cyprinus carpio için % 78-87 (Linhart ve ark., 2000, Hovảrth ve ark., 2003), Hypophthal-michthys molitrix için % 75 (Alvarez ve ark., 2003), Tor khudree için % 80-85 (Basavaraja ve Hegde, 2004) olarak bildirilen spermatozoa mo-tiliteleri ile uyumlu, Rainis ve ark. (2005) taraf-indan Oncorhynchus mykiss (%100), Salmo trutta (%94) ve Sparus aurata (%92.73) için bildirilen degerlerden düsük gerçeklesti. Baliklarda sper-matozoa testis ve seminal plazma içerisinde hareketli degildir (Billard, 1986). Benau ve Ter-ner (1980) spermatozoa motilitesinde mevsime bagli varyasyonlar görülebilecegini, Gwo (1995) ATP’deki azalmanin motiliteyi düsürdügünü, Cosson ve ark. (1999) pH, katyon konsan-trasyonu, sicaklik ve ozmotik basincin motiliteyi etkileyebilecegini bildirdiler. Ayrica üreme se-zonu ilerledikçe Oncorhynchus mykiss (Munkit-trick ve Moccia, 1987), Scophthalmus maximus (Suquet ve ark., 1998), Melanogrammus aeglefi-nus (Rideout ve ark., 2004) ve Hippoglossus hippoglossus (Babiak ve ark., 2006) gibi türlerde sperma motilitesinin düstügü rapor edildi. Sper-matozoa motiliteleri arasindaki farklar, tür, sperma sagim zamani ile aktivasyon solusyo-nundaki farkliliktan kaynaklanmis olabilir.
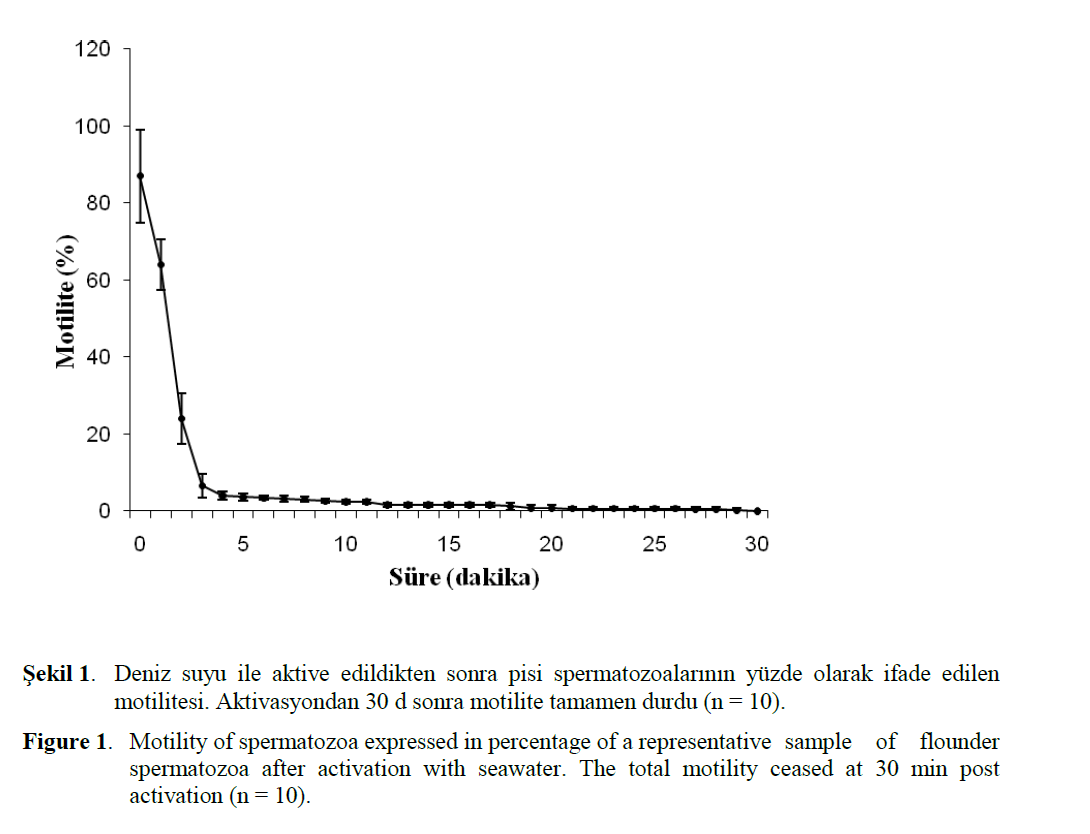
Motilite süresi çalismada kullanilan erkek pisi baliklarinda 25.4 ± 4.20 d olarak belirlendi. Mo-tilite süresini tatlisu türlerinden Esox lucius için 1 d, gökkusagi alabaligi için 30 s (Billard, 1986), Cyprinus carpio için Kruger ve ark. (1984) 2.50 d, Percheca ve ark., (1995) 90 s, Linhart ve ark. (2000) 120 s, Tor khudree için Basavaraja ve Hegde (2004) 66–75 s olarak bildirmelerine karsin, motilite süresi denizel türlerden Scophthalmus maximus için Chauvaud ve ark., (1995) 17 d, Thunnus thynnus için Doi ve ark. (1982) 15 d, Hippoglossus hippoglossus için Methven ve Crim (1991) 3 d olarak rapor ettiler. Bu çalismada motilitenin, sperma aktivasyonundan 2 d sonra %24’e, 4 d sonra %4’e düstügü, 30 d sonra ise tüm spermatozoalarin canliligini kaybettigi gözlendi (Sekil 1). Billard ve Cosson, (1992) genel olarak baliklarda motilite süresinin 2 d ile 1 saat arasinda degistigini, Geffen ve Frayer (1993) aktivasyondan 1 s sonra Scophthalmus maximus spermasinin %60 canliligini korudugunu, Barton (1981) ise ilk 3, 15 ve 28 d içinde canliligin sirasi ile, %97, %94 ve %22’ye kadar düstügünü, Billard ve ark. (1977) Dicentrarchus labrax sperma motilitesinin 30 d içinde yari yariya azaldigini bildirdiler. En yüksek spermatozoa motilitesinin üreme sezonunun ortasinda gözlendigi (Terner, 1986) ve motilitenin mevsimsel varyasyon gösterebilecegi (Benau and Terner 1980) bildirilmektedir. Chauvaud ve ark. (1995)’na göre spermatozoa motilitesi aktivasyon solusyonunun pH’sina baglidir. Sperma pH’inin Oncornhynchus mykiss (Billard, 1983), Hippoglossus hippoglossus (Billard ve ark.., 1993), Polyodon spathula (Linhart ve ark., 1995) baliklarinda spermayi aktive eden faktörlerden birisi olarak rpor ettiler. Dreanno ve ark. (1998) Psetta maxima için en iyi motilite parametrelerinin pH ~ 8.2 oldugunda elde edildigini bildirdiler. Bu arastirmada motilite süresi ve pH arasinda önemli bir iliski ortaya çikmasa da, pH’da yükselme görülürken, motilite süresinde de kismen uzama olmaktadir. Motilite süresi açisindan çalisma bulgulari ile diger arastiricilarin bildirdigi degerler arasindaki farklar, çalisilan tür, sperma alma sezonu ve aktivasyon solusyonundaki farkliliklardan kaynaklanmis olabilir.
Figure 1: Motility of spermatozoa expressed in percentage of a representative sample of flounder spermatozoa after activation with seawater. The total motility ceased at 30 min post activation (n = 10).
Çalismada spermatozoa yogunlugu (x 109 spermatozoa/ml) 2.1-4.5 (ortalama 2.87 ± 0.72), spermatokrit orani %86.3-98.0 (ortalama %92.6 ± 4.30) arasinda degisti ve yogunluk ile sperma-tokrit orani arainda oldukça güçlü pozitif bir iliski saptandi (P < 0.05). Benzer iliski Salmo salar m. sebago (Piironen, 1985), Oncornhyn-chus mykiss (Ciereszko ve Dabrowski, 1993), Gadus morhua (Rakitin ve ark., 1999), Hippo-glossus hippoglossus (Tvedt ve ark., 2001), Mel-anogrammus aeglefinus (Rideout ve ark., 2004) için de rapor edildi. Spermatozoa yogunlugu Siganus guttatus (Bloch) için 5-20 (Garcia, 1993), salmonidler için 9-26 (Scott ve Baynes, 1980), Pleuronectes ferrugineus (Storer) için 10-20 (Clearwater ve Crim 1998), Scophthalmus maximus (L.) için 20-55 (Suquet ve ark., 1992a), Dicentrarchus labrax (L.) için 5-55 (Sorbera ve ark., 1996), Alosa sapidissima (Wilson) için 66 (Mylonas ve ark., 1995) ve Morone saxatilis (Walbaum) için 60-100 (Mylonas ve ark., 1997b) bildirildi. Bu çalismada elde edilen spermatozoa yogunlugu, diger arastirmacilar tarafindan rapor edilen spermatozoa yogunlugu degerlerinden daha düsük olarak gerçeklesti. Bu farklilik, baligin türüne ya da çevreye bagli olarak olusmus olabilir
Sonuç
Sonuç olarak pisi baliginda sperma miktarinin düsük olmasina karsin, motilite ve motilite süresi oldukça yüksektir. Çalismada motilite süresi ile canli agirlik, total boy ve sperma miktari, ayrica sperma yogunlugu ile spermatokrit orani arasinda önemli iliski oldugu gözlenmistir. Elde edilen sonuçlar isiginda pisi baligi yetistiriciliginde daha etkin bir gamet yönetimi ve yavru üretiminde artis beklenebilir.
Kaynaklar
Aas, G.H., Refstie, T., Gjerde, B., (1991). Evalu-ation of milt quality of Atlantic salmon, Aq-uaculture, 95: 125-132. doi:10.1016/0044-8486(91)90079-M
Alvarez, B., Fuentes, R., Pimentel, R., Abad, Z., Cabrera, E., Pimentel, E., Arenal, A., (2003). High Fry production rates using post-thaw silver carp (Hypophthalmichthys molitrix) spermatozoa under farming condi-tions, Aquaculture, 220: 195-201. doi:10.1016/S0044-8486(02)00356-3
Alvial, A., Manriquez, J., (1999). Diversification of flatfish culture in Chile, Aquaculture, 176: 65-73. doi:10.1016/S0044-8486(99)00051-4
Babiak, I., Fraser, L., Dobosz, S., Goryczko, K., (1999). Computer-controlled freezing of rainbow trout Onchorhynchus mykiss (Wal-baum) spermatozoa for routine programmes, Aquaculture Research, 30: 707-710. doi:10.1046/j.1365-2109.1999.00381.x
Babiak I., Ottesen O., Rudolfsen G., Johnsen S., (2006). Quantitative characteristics of At-lantic halibut, Hippoglossus hippoglossus L., semen throughout the reproductive season, Theriogenology, 65: 1587-1604. doi:10.1016/j.theriogenology.2005.09.004
Barton L.A. (1981). Egg-quality of turbot (Scophthalmus maximus L.) kept in captive conditions. PhD thesis. University of Liver-pool, 127 pp.
Basavaraja, N., Hegde, N.S., (2004). Cryopreser-vation of the endangered mahseer (Tor khudree) spermatozoa: I. Effect of extender composition, cryoprotectants, dilution ratio, and storage period on post-thaw viability, Cryobiology, 49: 149-156. doi:10.1016/j.cryobiol.2004.05.007
Benau D., Terner, C., (1980). Initiation, prolon-gation and reactivation of the motility of salmonid spermatozoa, Gamet Research, 3: 247-257. doi:10.1002/mrd.1120030307
Bengston, D.A., (1999). Aquaculture of summer flounder (Paralicththys dentatus): status of knowledge, current research and future re-search priorities, Aquaculture, 176: 39-49. doi:10.1016/S0044-8486(99)00048-4
Billard, R., J. DuPont, J., Barnabe, G., (1977). Diminution de la motilité et de la durée de conservation du sperme de Dicentrarchus labrax L. (Poisson, Téléostéen) pendant la période de spermiation, Aquaculture, 11: 363-367. doi:10.1016/0044-8486(77)90086-2
Billard, R., (1983). Effects of ceolomic and seminal fluids and various saline diluents on the fertilizing ability of spermatozoa in the rainbow trout, Salmo gairdneri, Journal of Reproduction Fertilization, 68: 77-84. doi:10.1530/jrf.0.0680077
Billard, R., (1983). Effects of ceolomic and seminal fluids and various saline diluents on the fertilizing ability of spermatozoa in the rainbow trout, Salmo gairdneri, Journal of Reproduction Fertilization, 68: 77-84. doi:10.1530/jrf.0.0680077
Billard, R, Cosson, M.P., (1992). Some problems related to the assessment of sperm motility in freshwater fish, Journal of Experimental Zoology, 261: 122-131. doi:10.1002/jez.1402610203
Billard, R., Cosson, J., Crim, L.W., (1993). Mo-tility of fresh and aged halibut sperm, Aquatic living Resources, 6: 67-75. doi:10.1051/alr:1993008
Billard, R., Cosson, J., Perchec, G., Linhart, O., (1995). Biology of sperm and artificial re-production in carp, Aquaculture, 124: 95-112. doi:10.1016/0044-8486(94)00231-C
Billard, R., Cosson, J., Perchec, G., Linhart, O., (1995). Biology of sperm and artificial re-production in carp, Aquaculture, 124: 95-112. doi:10.1016/0044-8486(94)00231-C
Bozkurt, Y., Seçer, S., (2006). Aynali Sazan (Cyprinus carpio) Baliklarinda Üreme Mevsimi Boyunca Spermatolojik Özel-liklerin Belirlenmesi, Ege Üniversitesi Su Ürünleri Dergisi, 23(1/2): 195-198.
Bozkurt, Y., Seçer, S., Bekcan, S., (2006). Rela-tionship Between Spermatozoa Motility, Egg Size, Fecundity and Fertilization Suc-cess in Salmo trutta abanticus, Tarim Bilimleri Dergisi, 12(4): 345-348.
Chauvaud, L., Cosson, J., Suquet, M., Billard, R., (1995). Sperm motility in turbot, Scopthal-mus maximus: initiation of movement and changes with time of swimming characteris-tics, Environmental Biology of Fishes, 43: 341-349. doi:10.1007/BF00001167
Chen, S.L., Ji, X.S., Yu, G.C., Tian, Y.S., Sha, Z.X., (2004). Cryopreservation of sperm from turbot (Scophthalmus maximus) and application to large-scale fertilization, Aqua-culture, 236: 547-556. doi:10.1016/j.aquaculture.2003.10.027
Ciereszko, A., Dabrowski, K., (1993). Estimation of sperm concentration of rainbow trout, whitefish and yellow perch using a spectro-photometric technique, Aquaculture, 109: 367-373. doi:10.1016/0044-8486(93)90175-X
Clearwater S.J., Crim L.W., (1998). Gonadotro-pin releasing hormone-analogue treatment increases sperm motility, seminal plasma pH and sperm production in yellowtail flounder Pleuronectes ferrugineus, Fish Physiology and Biochemistry, 19: 349-357. doi:10.1023/A:1007759620936
Cosson, J., Dreanno, C., Billard, R., Suquet, M., Cibert, C., (1999). Regulation of axonemal wave parameters of fish spermatozoa by ionic factors. In: Gagnon, C. (Ed.). The male gamete: From basic science to clinical appli-cations. Cache River Pres, Paris, 500 p.
Daniels, H.V., (2000). Species Profile Southern Flounder. Southern Regional Aquaculture Center. SRAC Publication No. 726.
Darszon, A., Beltrán, C., Felix, R., Nishigaki, T., Treviño, L.C., (2001). Ion transport in sperm signaling, Developmental Biology, 240: 1-14. doi:10.1006/dbio.2001.0387
Doi, M., Hoshino, T., Taki, Y., Ogasawara, Y., (1982). Activity of the sperm of the bluefin tuna Thunnus thynnus under fresh and pre-served conditions, Bulletin of the Japanese Society of Scientific Fisheries, 48: 495-498
Dreanno, C., Suquet, M., Desbruyeres, E., Cos-son, J., Delliou, H.L., Billard, R., (1998). Ef-fect of urine on semen quality in turbot Psetta maxima, Aquaculture, 169: 247-262. doi:10.1016/S0044-8486(98)00262-2
Garcia, L.M.B., (1991). Spermiation response of mature rabbit¢sh, Siganus guttatus Bloch, to luteinizing hormone-releasing hormone an-alogue (LHRHa) injection, Aquaculture, 97: 291-299. doi:10.1016/0044-8486(91)90271-8
Garcia, L.M.B., (1993). Sustained production of milt in rabbitfish, Siganus guttatus Bloch, by weekly injection of luteinizing hormone-re-leasing hormone analogue (LHRHa), Aqua-culture, 113: 261-267. doi:10.1016/0044-8486(93)90479-I
Geffen, A.J., Frayer, O., (1993). Retention of sperm motility in turbot, Scophthalmus maximus L.: the effects of time from activa-tion, thermal shock and adenosine triphos-phate levels, Aquaculture and Fisheries Management, 24: 203-209.
Glogowski, J., Kwasnik, M., Piros, B., Dabrowski, K., Goryczko, K., Dobosz, S., Kuzminski, H., Ciereszko, A., (2000). Char-acterization of rainbow trout milt collected with a catheter: semen parameters and cry-opereservation success, Aquaculture Re-search, 31: 289-296. doi:10.1046/j.1365-2109.2000.00400.x
Gwo, J.C., (1995). Ultrastructural study of os-molality effects on spermatozoa of three ma-rine teleost, Tissue & Cell, 27(5): 491-497. doi:10.1016/S0040-8166(05)80057-6
Horváth, A., Miskolczi, E., Urbányi, B., (2003). Cryopreservation of common carp sperm, Aquat. Living Resour., 16: 457-460. doi:10.1016/S0990-7440(03)00084-6
Horváth, A., Miskolczi, E., Urbányi, B., (2003). Cryopreservation of common carp sperm, Aquat. Living Resour., 16: 457-460. doi:10.1016/S0990-7440(03)00084-6
Kruger, J.C., Smit, G.L., Van Vuren, J.H.J., Fer-reira, J.T., (1984). Some chemical and physical characteristics of the semen of Cy-prinus carpio and Oreochromis mossambi-cus, Journal of Fish Biology, 24: 263-272. doi:10.1111/j.1095-8649.1984.tb04797.x
Liley, R.N., Tamkee, P., Tsai, R., Hoysak, J.D., (2002). Fertilization dynamics in rainbow trout (Oncorhynchus mykiss): effect of male age, social experience, and sperm concen-tration and motility on in vitro fertilization, Canadian Journal of Fisheries and Aquatic Sciences, 59: 144-152. doi:10.1139/f01-202
Linhart, O., Mims, S.D., Shelton, W.L., (1995). Motility of spermatozoa from shovelnose sturgeon, Scaphirhynchus platorynchus, and paddlefish, Polyodon spathula, J Fish Biol., 47: 902-909. doi:10.1111/j.1095-8649.1995.tb06011.x
Linhart, O., Rodina, M., Jacky Cosson, J., (2000). Cryopreservation of sperm in common carp Cyprinus carpio: Sperm motility and hatch-ing success of embryos, Cryobiology, 41: 241-250. doi:10.1006/cryo.2000.2284
Methven, D.A., Crim, L.W., (1991). Seasonal changes in spermatocrit, plasma sex steroids, and motility of sperm from Atlantic halibut, Hippoglossus hippoglossus. In: Scott, A.P., Sumpter, J.P., Kime, D.E., Rolfe, M.S. (Eds.), Proc. Fourth Int. Symp. Reprod. Physiol. Fish, Sheffield. Published by Fish Symp. 91, Sheffield, U.K., p. 170.
Moon, S.H., Kwon, Y.J., Lee, K.J., Chang, J.Y., (2003). Icreased plasma 17-hydroxyproges-terone and milt production in response to gonadotropin-releasing hormone agonist in captive male starry flounder, Platichthys stellatus, Aquaculture, 218: 703-716. doi:10.1016/S0044-8486(02)00643-9
Morisawa, M., Suzuki, K., Morisawa, S., (1988). Effects of Potassium and osmolality on spermatozoan motility of salmonid fishes, The Journal of Experimental Biology, 107: 105-113.
Munkittrick, R.K., Moccia, D.R., (1987). Sea-sonal changes in the quality of rainbow trout (Salmo gairdneri) semen: Effect of a delay in stripping on spermatocrit, motility, vol-ume and seminal plasma constituents, Aqua-culture, 64: 147-156. doi:10.1016/0044-8486(87)90350-4
Mylonas, C.C., Zohar, Y., Richardson, B.M., Minkinnen, S.P., (1995). Induced spawning of wild American shad, Alosa sapidissima, using sustained administration of gonado-tropin-releasing hormone analog (GnRHa), Journal of the World Aquaculture Society, 26: 240-251. doi:10.1111/j.1749-7345.1995.tb00252.x
Mylonas, C.C., Gissis, A., Magnus, Y., Zohar, Y., (1997a). Hormonal changes in male white bass (Morone chrysops) and evalua-tion of milt quality after treatment with a sustained-release GnRHa-delivery system, Aquaculture, 153: 301-313. doi:10.1016/S0044-8486(97)00021-5
Mylonas, C.C., Scott, A.P., Vermeirssen, E.L.M., Zohar, Y., (1997b). Changes in plasma gon-adotropin II and sex steroid hormones, and sperm production of striped bass after treat-ment with controlled-release gonadotropin-releasing hormone agonist-delivery systems, Biology of Reproduction, 57: 669-675. doi:10.1095/biolreprod57.3.669
Nielsen, J.G., (1986). Pleuronectidae. In: White-head, P.J.P., Bauchot, M.-L., Nielsen, J.-C.P., Tortonese, E. (Eds.). Fishes of the North-eastern Atlantic and the Mediterra-nean. Vol.3, Paris. pp. 1299-1307
Olsen, Y., Evjemo, J.O., Olsen, A., (1999). Status of the cultivation technology fro production of Atlantic halibut (Hippoglossus hippoglos-sus) juveniles in Norway/Europe, Aquacul-ture, 176: 3-13. doi:10.1016/S0044-8486(99)00045-9
Percheca, G., Cossonb, J., André, F., Billard, R., (1995). Degradation of the quality of carp sperm by urine contamination during strip-ping, Aquaculture, 129: 135-136. doi:10.1016/0044-8486(95)91958-X
Piironen, J., (1985). Variation in the properties of milt from the Finnish landlocked salmon (Salmo salar m. sebago Girard) during a spawning season, Aquaculture, 48: 337-350. doi:10.1016/0044-8486(85)90136-X
Poole, R.W., Dillane, G.M., (1998). Estimation of sperm concentration of wild and recondi-tioned brown trout, Salmo trutta, Aquacul-ture Research, 29(6): 439-445. doi:10.1046/j.1365-2109.1998.00223.x
Rainis, S., Gasco, L., Ballestrazzi, R., (2005). Comparative study on milt quality features of different finfish species, Italian Journal of Animal Science, 4: 355-363.
Rakitin, A., Ferguson, M.M., Trippel, E.A., (1999). Spermatocrit and spermatozoa den-sity in Atlantic cod (Gadus morhua): corre-lation and variation during the spawning season, Aquaculture, 170: 349-358. doi:10.1016/S0044-8486(98)00417-7
Rideout, R.M., Trippel, E.A., Litvak, M.K., (2004). Relationship between sperm density, spermatocrit, sperm motility and spawning date in wild and cultured haddock, Journal of Fish Biology, 65: 319-332. doi:10.1111/j.0022-1112.2004.00451.x
Scott, A.P., Baynes, S.M., (1980). A review of the biology, handling and storage of salm-onid spermatozoa, Journal of Fish Biology, 17: 707-739. doi:10.1111/j.1095-8649.1980.tb02804.x
Shangguan, B., Crim, L.W., (1999). Seasonal variations in sperm production and sperm quality in male winter flounder, Pleu-ronectes americanus: the effects of hy-pophysectomy, pituitary replacement ther-apy, and GnRH-A treatment, Marine Biol-ogy, 134: 19-27. doi:10.1007/s002270050521
Sorbera, L.A., Mylonas, C.C., Zanuy, S., Carillo, M., Zohar, Y., (1996). Sustained admin-istration of GnRHa increases milt volume without altering sperm counts in the sea bass, Journal of Experimental Zoology, 276: 361-368. doi:10.1002/(SICI)1097-010X(19961201)276:5<361::AID-JEZ6>3.0.CO;2-M
Suquet, M., Omnes, M.H., Normant, Y., Fauvel, C., (1992a). Assessment of sperm concen-tration and motility in turbot (Scophthalmus maximus), Aquaculture, 101: 177-185. doi:10.1016/0044-8486(92)90241-C
Suquet, M., Omnes, M.H., Normant, Y., Fauvel, C., (1992b). In£uence of photoperiod, fre-quency of stripping and presence of females on spermoutput in turbot, Scophthalmus maximus (L), Aquaculture and Fisheries Management, 23: 217-225.
Suquet, M., Dreanno, C., Dorange, G., Normant, Y., Quemener, L., Gaignon, J.L., Billard, R., (1998). The age ing phenomenon of turbot, Scophthalmus maximus, spermatozoa: efects on morphology, motility and concentration, intracellular ATP content, fertilization and storage capacities, Journal of Fish Biology, 32: 31-41. doi:10.1111/j.1095-8649.1998.tb01550.x
Sahin, T., (2000). Larval rearing of flounder, Pleuronectes flesus luscus, under laboratory conditions, Turkish Journal of Marine Sci-ences, 6: 263-270
Tekin, N., Seçer, S., Akçay, E., Bozkurt, Y., Kayam, S., (2003). Gökkusagi ala-baliklarinda (Oncorhynchus mykiss W., 1792) yasin spermatolojik özellikler üzerine etkisi, Turkish Journal of Veterinary and Animal Sciences, 27: 37-44.
Terner, C., (1986). Evaluation of salmonid sperm motility for cryopreservation, The Proggres-sive Fish Culturist, 48: 230-232. doi:10.1577/1548-8640(1986)48<230:EOSSMF>2.0.CO;2
Tvedt, H.B., Benfey, T.J., Martin-Robichaud, D.J., Power, J., (2001). The relationship between sperm density, spermatocrit, sperm motility and fertilization success in Atlantic halibut, Hippoglossus hippoglossus, Aqua-culture, 194: 191-200. doi:10.1016/S0044-8486(00)00516-0725