Keywords
Zebra fish, Heavy metal, Oxidative stress
Giriş
Sucul ekosistemler sıklıkla evsel ve endüstri-yel atıklar tarafından kirletilirler. Sucul ekosis-temde bulunan en önemli çevresel kirleticilerden biri de ağır metallerdir. Ağır metaller deniz, göl ve akarsularda fazla miktarda bulundukları za-man sucul organizmalar tarafından bünyelerine alınırlar (Akçalı vd., 2009; Richetti vd., 2011; Oliva vd., 2012). Toksik ağır metaller sucul can-lıların özellikle metabolik olarak aktif organla-rında birikme eğilimindedirler. Balıklarda bu tip kirleticiler ile ilk etkileşen organ solungaçlardır. Kirleticiler hedef organ ve dokularda birikerek yapısal ve işlevsel mekanizmalara hasar verebilir-ler (Hsu vd., 2013; Pereira vd., 2013).
Oksidatif stres, antioksidan savunma sistemi ile hücrelerin lipid tabakasının peroksidasyonuna neden olan serbest radikal üretimi arasındaki dengesizlik olarak tanımlanabilir. Proteinler, li-pidlere oranla serbest radikallerden daha az etki-lenirler. Serbest radikaller nedeniyle meydana ge-lebilecek hücre hasarlarını engelleyen sisteme “antioksidan savunma sistemi” denir. Bu mole-küller, serbest oksijen radikallerine bir hidrojen iyonu verirler ve bu radikalleri kendilerine bağ-larlar. Bu şekilde onları zayıf bir moleküle çevi-rirler ve radikal hasarını önlerler. En önemli anti-oksidan enzimler Süperoksit dismutaz (SOD), Katalaz (CAT) ve Glutatyon peroksidaz (GSH) olarak sayılabilir (Stegeman vd., 2010). Bu ça-lışmanın amacı; 96 saat süreyle farklı subletal dozlarda (her ağır metal için sırasıyla; 0.1 ppm, 0.5 ppm, 1 ppm ve 5 ppm) bakır, çinko ve kad-miyumun uygulandığı zebra balıklarının solungaç dokularında oluşabilecek lipid peroksidasyon so-nucu Malondialdehit (MDA) seviyesini belirle-mektir. Ayrıca antioksidatif enzimler olan Glu-tatyon (GSH) ve Katalaz (CAT) ile total protein seviyeleri incelemektir.
Materyal ve Metot
Zebra Balığı (Danio rerio Hamilton-Buchanan, 1882): Zebra Balığı (Danio rerio) Cyprinidae familyasına ait tropikal bir türdür. Anavatanı Güneydoğu Asya olan zebra balıkları yoğun olarak Pakistan ve Hindistan’da iç sularda bulunmaktadır. Balığın gövdesi ışığa bağlı olarak koyu mavi, gümüş beyazı veya altın sarısı çizgi-lerle örtülüdür. Son yıllarda, ekotoksikoloji araş-tırmalarında zebra balığı dokuları, yumurtaları ve embriyoları sıklıkla kullanılmaya başlanmıştır. Zebra balığı, dayanıklı bir tür olması, kolay elde edilmesi, laboratuar ortamında kolay bakılabil-mesi ve çoğaltılması, ergin dişilerin haftalık ara-lıklarla yüzlerce yumurta bırakabilmesi, yumurta ve larva gelişimlerinin kolay izlenebilmesi, üre-me zamanının kısa olması ve embriyolarının tok-sik ajanlara duyarlı oluşu gibi nedenlerle toksiko-loji çalışmalarında sıklıkla kullanılan model or-ganizmaların başında gelmektedir (www.fishbase.org).
Çalışmada kullanılacak olan Zebra balıkları ticari firmalardan temin edilmiştir. Marmara Ün-iversitesi, Biyoloji Bölümü, Zooloji Araştırma Laboratuarına plastik torbalar ile getirilmiştir. Zebra balıkları gruplara ayrılarak, her grupta 10 balık olacak şekilde (toplam 130 balık) büyük-lükleri 70x30x45 cm olan cam akvaryumlarda ortama uyumları sağlanmıştır. Balıkların bulun-duğu akvaryumlardaki su piyasadaki ticari içme sularından hazırlanmıştır. Akvaryumlardaki su sıcaklığı 22-23°C, pH 7 ve aydınlık: karanlık (12:12) olacak şekilde sabitlenmiştir. Akvaryum-lara bir hava motoru yardımı ile yeterli düzeyde (9-12 mg/l) sürekli oksijen verilmiş, deneme sü-resince oluşan buharlaşma minimum seviyede olduğu için su eklenmemiştir. Denemede balıkla-rın beslenmesi için toz balık yemi kullanılmıştır. Yemleme, yeter miktarda sabah ve akşam olmak üzere günde iki öğün tekrarlanmıştır. Yemleme-ye, toksikolojik testlerin başlangıcına iki gün ka-lana kadar devam edilmiş ve toksikolojik deney-ler esnasında yemleme yapılmamıştır (OECD, 1999). Balıkların ortama uyumları sağlandıktan sonra akvaryumlara 96 saat süreyle farklı artan dozlarda bakır (0.1 ppm Cu, 0.5 ppm Cu, 1 ppm Cu ve 5 ppm Cu), çinko (0.1 ppm Zn, 0.5 ppm Zn, 1 ppm Zn ve 5 ppm Zn) ve kadmiyum (0.1 ppm Cd, 0.5 ppm Cd, 1 ppm Cd ve 5 ppm Cd) eklenmiştir. Kontrol grubu ise (10 balık) aynı fi-ziksel şartlara sahip olarak bırakılmış, deney sü-resinin kısalığı nedeniyle balıklara herhangi bir stres önleyici anestezik madde uygulanmamıştır. 96 saat devam eden test süresince akvaryum sula-rının fizikokimyasal özelliklerini kontrol etmek amacıyla toksik madde ilavesi yapıldıktan sonra suyun sıcaklığı, çözünmüş oksijeni, pH'sı, toplam sertliği, alkalinitesi, amonyak ve nitrit konsant-rasyonları günde bir defa olmak üzere deneme süresince ölçülmüştür. Zebra balıklarının bulun-duğu akvaryumların pH değerleri Thermo Orion 420A model pH metre kullanılarak ölçülmüş, ağır metal içeren akvaryum sularının çözünmüş oksijen değeri 6.36 ±0.47 mg/L, sıcaklık 19.2 ±0.1°C, pH 7.64 ±0.12, toplam sertlik 34.0 ±1.5 mg/L (CaCO3 olarak), alkalinite 23.5 ±2.2 mg/L (Ca-CO3 olarak), amonyak 11±5 ng/L ve nitrit 8.5 ±5.0 μg/L olarak belirlenmiştir. Belirlenen deney süreleri sonunda balıklar derin dondurucuda 3-5 dakikalık soğuk şoku ile uyuşturulduktan sonra solungaç dokuları hızlıca dekapiye edilmiştir.
%10 Doku homojenatının hazırlanması: So-lungaç örnekleri ayrı ayrı serum fizyolojik ile yı-kanıp temizlendikten sonra süzgeç kağıdı ile ku-rutulmuş ve tartılmıştır. Bistüri yardımıyla küçük parçalara ayrılmış ve gerekli miktar serum fizyo-lojik ve cam boncuklar yardımıyla homojeniza-törde parçalanmıştır. Her doku homojenatı epen-dorf tüplere konularak etiketlenmiş ve -200C’de analiz zamanına kadar saklanmıştır.
Solungaç Dokusunda Malondialdehit (MDA) Tayini (Ledwozyw Yöntemi): LPO ürünü olan MDA ile tiyobarbitürik asit (TBA) arasındaki re-aksiyon sonucu oluşan pembemsi rengin absor-bansı spektrofotometrik olarak değerlendirilmiş, doku homojenatında LPO düzeyleri MDA için saptanmış ekstinksiyon kat sayısı (1.56.105 M-1 cm-1) kullanılarak nmol MDA/mg protein cin-sinden hesaplanmıştır (Ledwozyw vd., 1986).
Solungaç dokusunda İndirgenmiş Glutatyon (GSH) Tayini (Beutler Yöntemi): Elmann ayı-racı, 5-5’ ditiyobis 1-2 nitro benzoikasid (DTNB) ile sülfidril gruplarının reaksiyonu sonucu oluşan renkli ürün spektrofotometrik olarak değerlendi-rilmiş, homojenatta GSH düzeyleri, seyreltme faktörü ve oluşan sarı renkli ürünün 412 nm’de ekstinksiyon katsayısı (13600/M-1cm-1) kullanı-larak GSH μg/mg protein cinsinden hesaplanmış-tır (Beutler, 1975).
Solungaç Dokusunda Katalaz Aktivitesi (CAT) Tayini (Aebi Yöntemi): CAT enzimi; H2O2’nin, H2O’ya dönüşüm reaksiyonunu kata-lizlemektedir. Bu dönüşüm 240 nm’de absorban-sın azalması ile takip edilebilmekte, bir dakika-daki absorbans azalması katalaz aktivitesi ile iliş-kilidir. Süpernatantta katalaz aktivitesi bu deney için belirlenmiş ekstinksiyon katsayısı 0.004 (0.00394) mM-1/ mm-1 kullanılarak ve yapılan seyreltmeler göz önüne alınarak Ü/mg protein dk cinsinden hesaplanmıştır (Aebi, 1984).
Solungaç Dokusunda Protein Tayini (Brad-ford Yöntemi): Coomassie Brilliant Blue G-250 boyasının proteinlere bağlanması sonucunda oluşturduğu renkli çözeltilerin 595 nm’de absor-bansının ölçülmesi ilkesine dayanmaktadır. Bunun için % 10 mg albümin stok çözeltisi hazır-lanmış, 10 mg albümin az distile suda tamamen çözüldükten sonra hacmi 100 mL’ye distile su ile tamamlanmış, protein çalışma standart çözeltileri stok çözeltiden uygun hacimler alınarak % 20, 40, 60, 80 μg albumin ihtiva edecek şekilde disti-le su ile seyreltilerek hazırlanmıştır. Bradford re-aktifi stok çözeltiden kullanılmış, standartların grafiği üzerinden protein miktarı hesaplanmıştır (Bradford, 1976).
İstatistiksel Analizler: İstatistiksel analizler SPSS 17.0 paket programı kullanılarak yapılmış, tanımlayıcı istatistiklerde ise sürekli ölçümlü de-ğişkenler için ortalama ± standart hata (SH) ve medyan (minimum-maksimum) olarak verilmiş-tir. Kategorik değişkenler gözlem sayısı ve (%) değer olarak gösterilmiştir. Gruplar arası karşılaş-tırmalarda normal dağılım gösteren değişken için Student’s t testi, normal dağılım göstermeyen de-ğişkenler için Mann-Whitney-U testi kullanılmış-tır. Biyokimyasal parametrelerin gruplar arasın-daki farklılıkları Varyans analizi ile tespit edil-miş, Bonferroni testi ile her bir parametre için gruplar bire bir karşılaştırılmıştır. p<0.05 değeri üzerinden istatistiksel olarak anlamlılık kabul edilmiştir.
Bulgular ve Tartışma
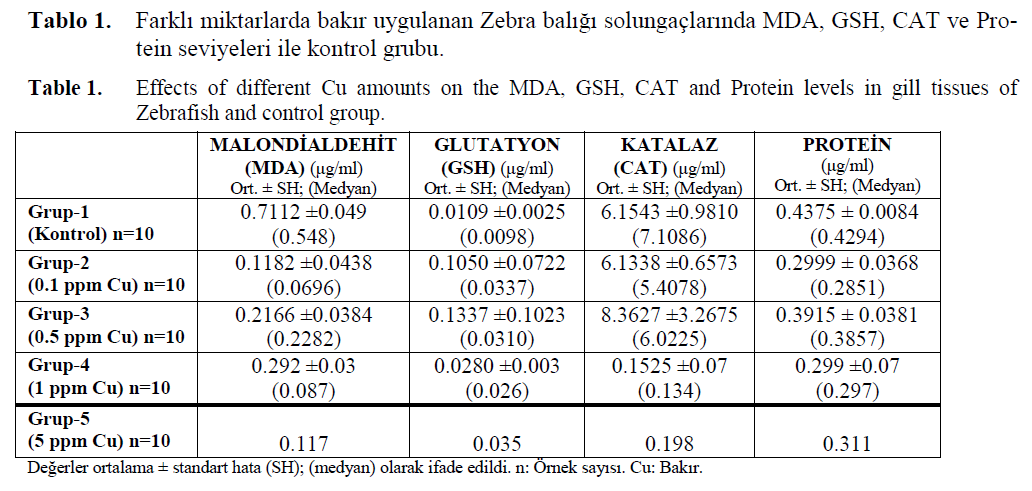
Çalışmamızda farklı subletal dozlarda ağır metal (bakır, kadmiyum ve çinko) uygulanmış zebra balıklarının solungaç dokularından belirle-nen lipid peroksidasyon (MDA), antioksidatif en-zimler (GSH, CAT) ve total protein seviyeleri her bir ağır metal için ayrı tablolarda verilmiştir. Ay-rıca tek yönlü varyans analizi ile metalin biyo-kimyasal seviyede etkisi belirlenmiştir. Solungaç dokusunda ölçülen MDA seviyeleri kontrol gru-bunda, farklı dozlarda uygulanan bakır gruplarına kıyasla anlamlı olarak yüksek bulunmuş, 0.1-5 ppm arasındaki bakır dozlarının balık solungaç dokusundaki MDA seviyeleri üzerine etkili ol-madığı gözlemlenmiştir. Herhangi bir ağır metal uygulanmamış (Kontrol grubu) olan Grup-1’deki GSH seviyeleri, 0.1 ppm Cu uygulanmış balıkla-rın (Grup-2) solungaçlarında ölçülen GSH sevi-yelerinden istatistiksel olarak daha düşük bulun-muştur (p< 0.05).
0.1 ppm Cu (Grup-2) ve 0.5 ppm Cu (Grup-3) uygulanan balıkların GSH seviyeleri arasında an-lamlı bir fark saptanmamıştır (p >0.05). 1 ppm (Grup-4) ve 5 ppm (Grup-5) gibi yüksek dozlarda bakır uygulanan gruplarda ise antioksidatif stres mekanizmalarının engellendiği belirlenmiştir. 0.1 ve 0.5 ppm Cu uygulanan gruplar ile kontrol gru-bu arasında katalaz enzim aktivitesi açısından an-lamlı bir fark olmadığı gözlenmiştir. Ancak 1 ve 5 ppm Cu uygulanan gruplarda CAT aktivitesinin azaldığı belirlenmiştir. Kontrol grubunun (Grup-1) protein seviyeleri, 0.1 ppm Cu (Grup-2) ve 1 ppm Cu (Grup-4) uygulanmış balıkların solun-gaçlarında ölçülen protein seviyelerinden istatis-tiksel olarak yüksek bulunmuştur (p< 0.05) (Tablo.1).
Tablo 1. Farklı miktarlarda bakır uygulanan Zebra balığı solungaçlarında MDA, GSH, CAT ve Pro-tein seviyeleri ile kontrol grubu.
Table 1. Effects of different Cu amounts on the MDA, GSH, CAT and Protein levels in gill tissues of Zebrafish and control group.
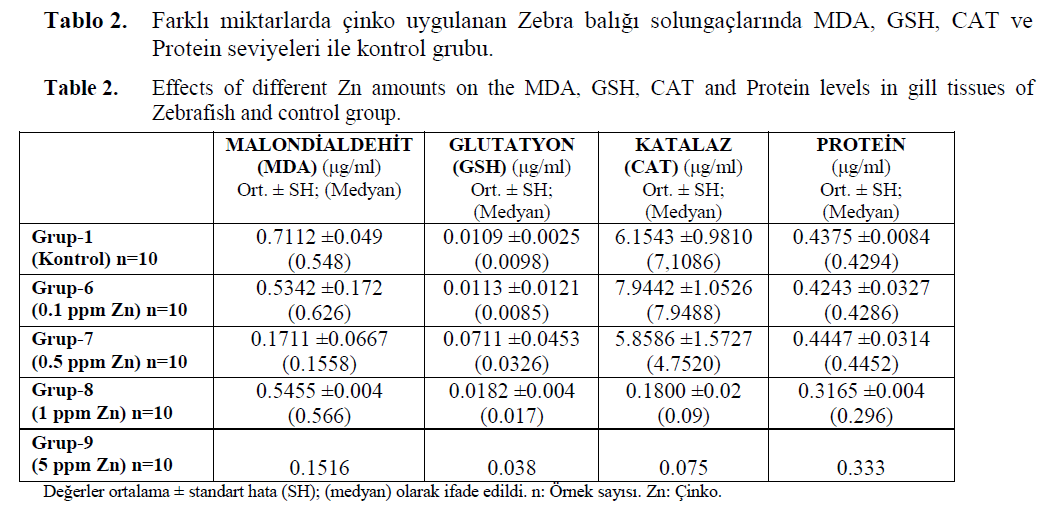
Kontrol grubunda ölçülen GSH, CAT ve pro-tein seviyeleri ile 0.1 ppm Zn (Grup-6) ve 0.5 ppm Zn (Grup-7) uygulanmış balıkların solun-gaçlarında ölçülen GSH, CAT ve protein seviye-leri seviyeleri arasında istatistiksel olarak anlamlı bir fark bulunamamıştır (p >0.05). Kontrol grubu balıkların solungaçlarında ölçülen MDA seviye-leri, 0.1 ppm ve 0.5 ppm Zn uygulanan balıkların MDA düzeylerinden daha yüksek bulunmuştur. (p<0.01). 0.1 ppm Zn uygulanan balıkların so-lungaç doku MDA düzeyleri, 0.5 ppm Zn uygu-lanan balıklara göre daha yüksek bulunmuştur (p<0.05). 1 ppm’den daha yüksek çinko uygula-nan gruplarda ise CAT aktivitesinin hızla azaldığı gözlemlenmiştir (Tablo.2).
Tablo 2. Farklı miktarlarda çinko uygulanan Zebra balığı solungaçlarında MDA, GSH, CAT ve Protein seviyeleri ile kontrol grubu.
Table 2. Effects of different Zn amounts on the MDA, GSH, CAT and Protein levels in gill tissues of Zebrafish and control group.
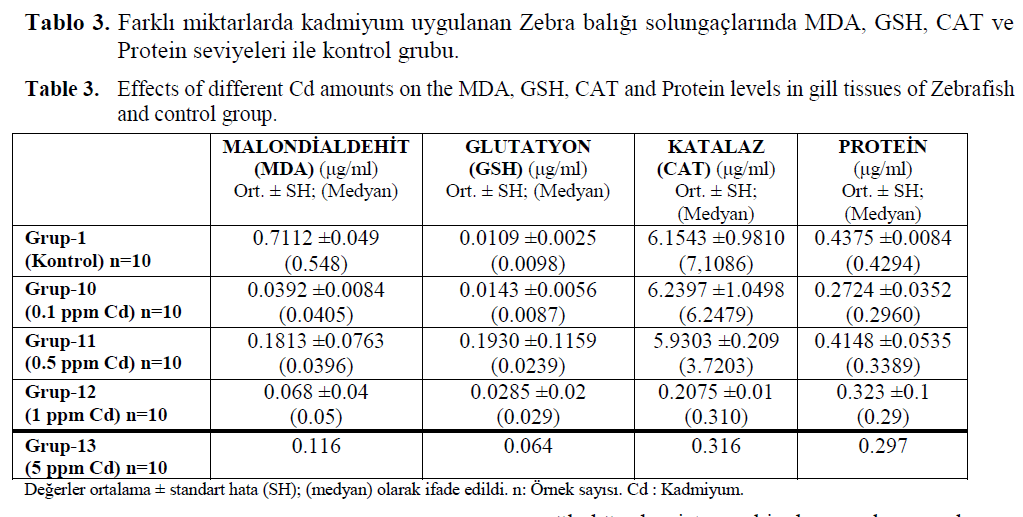
Tablo 3. Farklı miktarlarda kadmiyum uygulanan Zebra balığı solungaçlarında MDA, GSH, CAT ve Protein seviyeleri ile kontrol grubu.
Table 3. Effects of different Cd amounts on the MDA, GSH, CAT and Protein levels in gill tissues of Zebrafish and control group.
Kontrol grubuna ait GSH ve CAT seviyeleri, 0.1 ppm Cd uygulanmış balıklar (Grup-10) ile farklılık göstermezken, 0.5 ppm Cd (Grup-11) uygulanmış grup ile karşılaştırıldığında GSH dü-zeylerinin daha düşük (p<0.05); CAT düzeyleri-nin ise daha yüksek olduğu belirlenmiştir (p<0.05). 0.1 ppm Cd (Grup-10) ve 0.5 ppm Cd (Grup-11) uygulanan balıkların solungaç doku MDA seviyelerinin, kontrol grubuna göre daha düşük olduğu gözlenmiştir. 0.5 ppm Cd uygula-nan gruba ait MDA seviyelerinin, 0.1 ppm Cd uygulanan balıkların MDA seviyelerinden daha fazla olduğu görülmüştür (p<0.05). Kontrol gru-buna ait total protein seviyeleri, 0.1 ppm Cd uy-gulanan gruba oranla daha yüksek bulunmuştur. 0.1 ppm Cd uygulanan grubun total protein sevi-yeleri ise, 0.5 ppm Cd uygulanan gruba kıyasla daha düşük olduğu gözlenmiştir (p<0.05).
Sucul ekosistemlerle ilişkili ekotoksikolojik etkilerin araştırılmasında çeşitli omurgasız ve omurgalı test organizmaları kullanılmaktadır. Özellikle son on yılda model organizma olarak çeşitli türde balıkların kullanılması oldukça yay-gınlaşmıştır. Glutatyon (GSH), oksijen radikali yakalayıcısı olarak antioksidant savunmada önemlidir. GSH düzeyindeki değişim, canlının detoksifikasyon yeteneğinin önemli bir belirteci-dir. GSH sistemi balıklarda oksidatif hasara karşı farklı yollardan kofaktör gibi davranarak çalışır. Hücrelerde glutatyonun anti-oksidatif fonksiyo-nu, konsantrasyon, reaksiyon hızı ve sentez hızı-na bağlı olarak meydana gelmektedir. Metal GSH konjugasyon işlemi metallerin safra ile atılmasını sağladığından istenen bir durum olmasına karşın glutatyonu tüketmesine bağlı olarak antioksidant savunma kapasitesini azaltmaktadır (Fırat vd., 2009; Loro vd., 2012; Hsu vd., 2013). Hücresel GSH miktarı hücresel işlevlerin korunmasında önemlidir ve detoksifikasyon ve oksidatif stres durumunda azalabilmektedir. Ancak devam eden stres durumunda GSH/GSSG oranı adaptif meka-nizmaların etkisi ile oksidatif strese karşı koya-bilmek üzere artmaktadır (Zhang vd., 2005).
Stres şartları altında ve bazı hastalıklarda ba-kır iyonları, GSH ile etkileşime girerek redoks aktif bakır formunda dokulardan salınır. Glutat-yon L-askorbik asitin suda çözülebilir antioksi-danlar olarak çeşitli reaktif oksijen türlerini ortadan kaldırdığı gösterilmiştir. Çünkü hidrojen pe-roksit ile etkileşen bakır, hidroksil radikali oluş-turarak hücrede lipit, protein ve nükleik asitleri hasarlayan reaktif oksijen türleri gibi davranırlar (Halliwell ve Gutteridge, 1990). Kadmiyum, su-cul ortamlarda yer alan en zararlı ağır metal kirle-ticilerden biridir. Literatürde kadmiyum toksite-sinin reaktif oksijen türleri ile birlikte gelişen ok-sidatif hasar ile ilişkisi çeşitli çalışmalarda göste-rilmiştir (Bagchi, 2000; Shi, 2005; Taş vd., 2009). Balıklarda kadmiyumun glutatyon meta-bolizmasına etkilerini inceleyen sınırlı sayıda ça-lışma bulunmaktadır. Balıklarda kadmiyum biri-kimin hedef organı böbrek ve karaciğer olduğun-dan çalışmalar bu yönde yoğunlaşmıştır (Kim vd., 2004). Bakır ve kadmiyum doğrudan ya da dolaylı olarak hücresel demir düzeylerinin yük-selmesine neden olarak antioksidan aktiviteyi en-geller, hücresel glutatyon kullanımına neden olur ya da glutatyon ile ilişkili enzimleri inhibe eder (Kang, 1997). Pek çok enzimatik ve non-enzimatik detoksifikasyon reaksiyonlarının subst-ratı olan glutatyon, kirleticilere maruz kalan ba-lıklarda etkin bir biyobelirteç olarak ele alınmak-tadır.
Çalışmamızda balıklara uygulanan 0.1 ve 0.5 ppm’lik bakır dozlarının kontrol grubu balıklara kıyasla daha yüksek seviyelerde olması, balık so-lungaçlarında bulunan GSH varlığına bağlı olarak bakır tutulumunu göstermektedir. Çalışmamızda 0.5 pmm Cu uygulanan grupta, kontrole oranla daha yüksek GSH seviyeleri görülmüştür. Ancak 1 ppm ve daha yüksek dozlarda benzeri bir etki görülmeyip, kontrol grubu ile benzer sonuçlar el-de etmemiz, artan bakır miktarının GSH tarafın-dan tutulduğunu ve muhtemelen böbreklere taşı-narak atıldığını düşündürmektedir. Çalışmamıza ait tüm çalışma grupları arasında sadece 0.5 ppm Cd (Grup-11) uygulanmış grupta yüksek GSH yanıtı gözlenmiştir. MDA, lipit peroksidasyonu sonucu oluşan ürünlerden biridir ve oksidatif ha-sarı göstermede yaygın olarak kullanılan bir pa-rametredir. MDA miktarının yüksek bulunması lipit peroksidasyonuna işaret etmektedir. Lipit peroksidasyonu meydana gelmemesi veya düşük düzeylerde olması oksidatif enzimlerin koruyucu etkilerinin göstergesidir. Oksidatif stresin pek çok biyolojik hedefleri arasında yer alan lipitler okside olarak birçok ikincil ürün oluştururlar. Bu ikincil ürünler arasında yer alan MDA çoklu doymamış peroksidasyon ürünü olarak oluşur. MDA, DNA ve proteinler ile etkileşime girebil-diğinden potansiyel bir mutajendir. MDA’ nın nükleik asit ve proteinler ile etkileşimi, hücrenin fonksiyonel kapasitesini belirleyen mekanizmala-rın geri dönüşümsüz olarak bozulmasına neden olur (Hsu vd., 2013).Bakır, lipit peroksidasyonunu hızlandıran bir metaldir. Lipid peroksidasyonunu başlatıcı ajan olarak görev yapan bakır, aynı zamanda sonraki reaksiyon basamaklarında katalizor olarak rol alır. LPO’nun primer ürünleri olarak meydana gelen lipit hidroperoksitler bakır ve demir gibi metaller ile reaksiyona girerek alkoksil ya da pe-roksil radikallerini oluştururlar. Deltametrin ve kadmiyumun, Channa punctata (Spotted snake-head)’da oksitatif stres etkilerinin araştırıldığı bir çalışmada lipid peroksidasyonunun önemli ölçü-de arttığı, solungaç dokuda en fazla sadece del-tametrin verilen gruplarda (%53 kontrole oranla) saptanmıştır (Atıf vd., 2005). Seyhan Baraj Gö-lü’nde kirli ve temiz olmak üzere iki ayrı istas-yondan toplanan sazangiller ailesine ait tatlı su balıklarının karaciğer dokusunda malondialdehit düzeyleri karşılaştırılmış ve kirli alandan topla-nan örneklerde malondialdehitin önemli düzeyde arttığı bildirilmiştir (Kamunde ve MacPhail, 2010). Yapılan bir tez çalışmasında, Kılıçkuyruk Balığı (Xiphophorus hellerii)’nın solungaç doku-su üzerine farklı dozlarda uygulanan deltametrin ve kadmiyumun oksidatif strese neden olması se-bebiyle malondialdehit düzeylerinde artış görül-müştür. İndirgenmiş glutatyon miktarının ise ok-sidatif strese karşı koyabilmek üzere arttığı ve oksidatif stresle oluşan oksijen radikallerinin ka-talaz enzim aktivitesini inhibe ettiği rapor edil-miştir (Kaymak, 2011). Çeşitli ağır metallerin oluşturdukları oksidatif hasarlar sonucu artan do-ku spesik GSH seviyeleri ve antioksidan enzim aktivitelerindeki değişiklikler halen tartışma ko-nusudur. Balıkların karaciğer ve böbrek dokuları, metaller tarafından oluşan oksidatif stresden ko-runmak amacıyla CAT ve SOD gibi antioksidan savunma sistemlerince zengindir (Basha ve Rani, 2003; Lushchak, 2011).
Katalaz (CAT), H2O2’i substrat olarak kulla-narak oksijen ve suya parçalayan ve böylece H2O2 detoksifikasyonunu sağlayan peroksidaz-lardandır. Katalazın ksenobiyotik etkisinde farklı yanıtlar verdiği saptanmıştır. Aşırı O2 tüketiminin CAT aktivitesini inhibe edebilme özelliği ile CAT aktivitesini azaltabileceği belirtilmiştir (Su-vetha vd., 2010). CAT, tüm biyolojik membran-lardan geçip, bazı enzimleri inaktivite eder. Me-talik ya da organik kirleticilere maruz kalan ba-lıklarda doza bağlı olarak katalaz aktivite yanıtla-rının indüklenme ya da inhibe olma yönünde farklılık gösterdiği bilinmektedir. Bu nedenle ba-lıklarda zararlı etkiler oluşmadan hemen önce be-lirlenen CAT aktivitesinin oksidatif stres için hassas bir biyobelirteç olduğu kabul edilmektedir (Romeo vd., 2000; Gül vd., 2004). Metallerin (Cu, Cd, Fe ve Ni) Channa punctata’nın solun-gaçlarının biyokimyasal ve morfolojik özellikle-rine etkilerinin incelendiği bir çalışmada CAT, GST ve SOD gibi antioksidant enzim aktivitele-rinde zamana bağlı azalmalar gözlenmiştir (Sanchez vd., 2005).
Kadmiyum ve çinkonun Tilapya Balığı (Ore-ochromis niloticus)’nda eritrosit antioksidan sis-temleri üzerine etkisinin araştırıldığı bir çalışma-da 5 mg/l Zn, 1 mg/l Cd ve ikisinin kombinasyo-nu olmak üzere üç grup oluşturulmuş ve GSH ve CAT aktiviteleri araştırılmıştır. Her iki antioksi-dan sistemin tüm gruplarda arttığı bildirilmiştir (Pandey vd., 2008). Bizim çalışmamızda 1 ve 5 ppm bakır dozlarının CAT aktivitesini inhibe et-tiği gözlenmiştir. Katalaz enziminin çeşitli kirle-ticiler etkisinde farklı yanıtlar verdiği saptanmış-tır. Aşırı O2 tüketiminin CAT aktivitesini inhibe edebilme özelliği ile CAT aktivitesini azaltabile-ceği belirtilmiştir. Bu konuyla ilgili yapılan diğer bir çalışmada, Hindistan’ın Yamuna Nehri’nin ağır metallerce kirlendiği düşünülen Panipat ve Agra bölgelerinden yakalanan Wallago attu (Mully Catfish) türü balıkların karaciğer, solun-gaç ve böbrek dokularında CAT, GSH ve lipit peroksidasyon düzeyleri incelenmiştir. Avlanan balıklarda GSH ve lipid peroksidasyonunun yük-sek olduğu, CAT aktivitesinin solungaç, karaci-ğer ve böbrekte önemli derecede azaldığı belir-tilmiştir (Pandey vd., 2003). Benzer sonuçlara pestisitlerle yapılan çalışmalarda da rastlanmak-tadır. Çipura (Sparus aurata) türü balıklara farklı dozlarda kadmiyum uygulaması sonucunda, kata-laz enzim aktivitesininde önemli düşüşler göz-lendiği bildirilmiştir (Goel vd., 2005).
Subletal dozlarda kadmiyum uygulanan gök-kuşağı alabalığı (Oncorhynus mykiss) solungaç dokularında bazı antioksidan enzim aktivitelerin-deki değişimler incelenmiştir. Bu amaç doğrultu-sunda üç grup halindeki balıklara yedi gün sürey-le 1 ve 5 ppm Cd uygulanmıştır. Deneylerin üçüncü gününde süperoksit dismutaz, glutatyon peroksidaz ve katalaz enzim aktivitelerinin so-lungaç dokusunda önemli derecede (p<0.05) art-tığı, beşinci günden itibaren ise azaldığı belirtil-miştir. Subletal dozlardaki kadmiyumun, gökku-şağı alabalıklarında oksidatif strese sebep olduğu ve diğer antioksidan enzimlerin bu stresin önlenmesinde rol oynadıkları rapor edilmiştir (Alak ve Hisar, 2008).
Sonuç
Çevre kirliliğinin bir göstergesi olarak canlı-larda ölçülen metalik kirleticiler özellikle su ürünlerinde sıklıkla yüksek seviyelere ulaşabilir. Günümüzde artan nüfus yoğunluğu ve besin ihti-yacına bağlı olarak insan ve çevre sağlığı bu ne-denle büyük önem kazanmıştır. Sucul organizma-larda ağır metal birikim ve hasarlarının incelen-diği araştırmaların yapılması, ağır metallere karşı duyarlılığı yüksek olan türlerin belirlenmesinin yanısıra sucul organizmaların biyokimyasal ve fizyolojik parametrelerinde meydana gelebilecek değişikliklerin belirlenmesi açısından da önemli-dir. Su kaynaklarına yakın yerlerdeki endüstriyel faaliyetler ilgili kurumlarca sıklıkla denetlenme-lidir. Su ortamı ve sucul canlılarda kirlilik izleme programları ve ekotoksikolojik risk değerlendir-me çalışmaları ağır metal yükü olduğu düşünülen ortamlarda periyodik olarak izlenmelidir.
Teşekkür
Bu araştırma, Marmara Üniversitesi Bilimsel Araştırma Projeleri Komisyonu (BAPKO) tara-fından desteklenmiştir. Proje no: FEN-C-YLP-211009-0324
Kaynaklar
Aebi, H., (1984). Catalase Invitro,
Methods in Enzymology, 105: 121-126. doi: 10.1016/S0076-6879(84)05016-3
Akçalı, İ., Küçüksezgin, F., (2009). EgeDenizikıyılarındagörülenkahverengialg
Cystoser-is sp.’de ağır metal birikimi,
Ege University Journal of Fisheries & Aquatic Science, 26(3): 159-163.
Alak, G., Hisar, O., (2008). KadmiyumunGök-kuşağıAlabalığı
(Oncorhynusmykiss) kara-ciğerveböbrekdokularındakibazıantioksi-danenzimaktiviteleriüzerineetkisi.
YüksekLisansTezi, Atatürk Üniversitesi, Su ÜrünleriBölümü, YÖKTez no: 25240.
Atıf, F., Parvez, S., Ali, M., Kaur, M., Rehman, H., Khan, H.A., Raisuddin, S., (2005). Mod-ulatory effect of cadmium exposure on del-tamethrin-induced oxidative stress in
Chan-napunctatabloch,
Archives of Environmen-tal Contamination and Toxicology, 49: 371-377.doi: 10.1007/s00244-003-9231-4
Bagchi, D., Joshi, S.S., Bagchi, M., Balmoori, J., Benner, E.J., Kuszynski, C.A., Stohs, S.J., (2000). Cadmium and chromium-induced oxidative stress, DNA damage, and apoptot-ic cell death in cultured human chronic mye-logenous leukemic K562 cells, promyelocy-tic leukemic HL-60 cells, and normal human peripheral blood mononuclear cells, Journal of Biochemical and Molecular Toxicolog, 14: 33-41. DOI:doi: 10.1002/(SICI)1099-0461(2000)14:1<33::AID-JBT5>3.0.CO;2-Y
Basha, P.S., Rani, A.U., (2003). Cadmium-induced antioxidant defense mechanism in freshwater teleost Oreochromismossambi-cus (Tilapia), Ecotoxicology and Environ-mental Safety, 56: 218-221.doi: 10.1016/S0147-6513(03)00028-9
Beutler E., (1975)., Glutathione in Red Cell Me-tabolism: A Manual of Biochemical Meth-ods. 2nd ed., Grune and Stratton, N.Y., 112-114.
Bradford, M.M., (1976). A Rapid and Sensitive Method for the Quantitation of Microgram Quantitites of Protein Utilizing the Principle of Protein-dye Binding. Analytical Bio-chemistry, 72: 248-254.doi: 10.1016/0003-2697(76)90527-3
Fırat, Ö.,Çoğun, H.Y., Aslanyavrusu, S., Kargın, F., (2009). Antioxidant responses and metal accumulation in tissues of Nile Tilapia Ore-ochromisniloticus under Zn, Cd and Zn+Cd Exposures, Journal of Applied Toxicology, 29: 295-301.doi: 10.1002/jat.1406Fish Base - https://www.fishbase.org/summary/4653
Goel, A., Dani, V., Dhawan, D.K., (2005). Pro-tective effects of zinc on lipid peroxidation, antioxidant enzymes and hepatic histoarchi-tecture in chlorpyrifos induced toxicity, Chemico-Biological Interactions, 156: 131-140.doi: 10.1016/j.cbi.2005.08.004
Gül, Ş., Belge-Kurutaş, E., Yıldız, E., Şahan, A., Doran, F., (2004). Pollution correlated modi-fications of liver antioxidant systems and histopathology of fish (Cyprinidae) living in Seyhan Dam Lake, Turkey, Environment In-ternational, 30: 605–609.doi: 10.1016/0076-6879(90)86093-B
Halliwell, B., Gutteridge, J.M.C., (1990). Role of free radicals and catalytic metal ions in hu-man disease: an overview, Methods in En-zymology, 186: 80-85.
Hsu, T., Huang, K.M., Tsai, H.T., Sung, T.S., Ho, T.N., (2013). Cadmium (Cd)-induced oxidative stress down-regulates the gene ex-pression of DNA mismatch recognition pro-teinsMutS homolog 2 (MSH2) and MSH6 in zebrafish (Daniorerio) embryos, Aquatic Toxicology, 126: 9-16.doi: 10.1016/j.aquatox.2012.09.020
Kamunde C., MacPhail R., (2010). Metal-metal interactions of dietary cadmium, copper and zinc in rainbow trout, Oncorhyncusmykiss, Ecotoxicology and Environmental Safety, 74(4): 658-667.doi: 10.1016/j.ecoenv.2010.10.016
Kang, Y.J., (1997). Alteration of antioxidant sys-tem. In: Masaro, E. (Ed.), Handbook of Hu-man Toxicology. CRC Press, Boca Raton, Florida, USA, 275-284.
Kaymak, G., (2011). FarklıdozlardadeltametrinvekadmiyumuygulananKılıçkuyruğu (Xiphophorushellerii) balıklarındaoluşanoksidatifstrestayini. Yükseklisanstezi, Marmara Üniversitesi Fen Bilimleri En-stitüsüBiyoloji A.B.D., İstanbul.
Kim, S.G., Jee, J.H., Kang, J.C., (2004). Cadmi-um accumulation and elimination in tissues of juvenile olive flounder, Paralichthysoli-vaceus after sub-chronic cadmium exposure, Environmental Pollution, 127: 117-123.doi: 10.1016/S0269-7491(03)00254-9
Ledwozyw A., Michalak D., Stepien A., Kadziolka A., (1986). The relationship be-tween plasma triglycerides, cholesterol, total lipids and lipid peroxidation products during human atherosclerosis, ClinicaChimica Ac-ta, 155(3): 275-283.doi: 10.1016/0009-8981(86)90247-0
Loro, V.N., Jorge, MB., Rios da Silva, K., Wood, CM., (2012). Oxidative stress parametersand antioxidant response to sublethal water-borne zinc in a euryhaline teleost Fundulusheteroclitus: Protective effects of salinity, Aquatic Toxicology, 110-111: 187-193.doi: 10.1016/j.aquatox.2012.01.012
Lushchak, V.L., (2011). Environmentally in-duced oxidative stress in aquatic animals, Aquatic Toxicology, 101: 13-30.doi: 10.1016/j.aquatox.2010.10.006
OECD., (1999). https://www.oecd.org/dac/environment-development/1884214.pdf
Oliva, M., José Vicente, J., Gravato, C., Guil-hermino, L., Galindo-Riaño, MD., (2012). Oxidative stress biomarkers in Senegal sole, Soleasenegalensis, to assess the impact of heavy metal pollution in a Huelva estuary (SW Spain): Seasonal and spatial variation, Ecotoxicology and Environmental Safety, 75(1): 151-162.doi: 10.1016/j.ecoenv.2011.08.017
Pandey S., Parvez S., Sayeed I., Haque R., Bin-Hafeez, Raisuddin S., (2003). Biomarkers of Oxidative Stress: A Comparative Study of River Yamuna Fish Wallagoattu (Bl. &Schn.), The Science of The Total Environ-ment, 309: 105-115.doi: 10.1016/S0048-9697(03)00006-8
Pereira, S., Cavalie, I., Camilleri, V., Gilbin, R., Adam-Guillermin, C., (2013). Comparative genotoxicity of aluminium and cadmium in embryonic zebrafish cells, Mutation Re-search/Genetic Toxicology and Environmen-tal Mutagenesis, 750(1-2): 19-26.doi: 10.1016/j.mrgentox.2012.07.007
Richetti, S.K., Rosemberg, D.B., Ventura-Lima, J., Monserrat, J.M., Bogo, M.R., Bonan, D., (2011). Acetylcholinesterase activity and an-tioxidant capacity of zebrafish brain is al-tered by heavy metal exposure, NeuroToxi-cology, 32(1): 116-122.doi: 10.1016/j.neuro.2010.11.001
Romeo, M., Bennani, N., Gnassia-Barelli, M., Lafaurie, M., Girard, J.P., (2000). Cadmium and copper display different responses to-wards oxidative stress in the kidney of the sea bass Dicentrarchuslabrax, Aquatic Tox-icology, 48: 185-194.doi: 10.1016/S0166-445X(99)00039-9
Sanchez,W., Palluel, O., Meunier, L., Coquery, M., Porcher, J.M., Ait-Aissa, S., (2005). Copper-induced oxidative stress in three-spined stickleback: relationship with hepatic metal levels, Environmental Toxicology and Pharmacology, 19: 177-183.doi: 10.1016/j.etap.2004.07.003
Shi, H.S.; Sui, Y.X.; Wang, X.R.; Luo, Y.; Ji, L.L., (2005). Hydroxyl radical production and oxidative damage induced by cadmium and naphthalene in liver of Carassius au-ratus, Comparative Biochemistry and Physi-ology, 140C: 115-121.doi: 10.1016/j.cca.2005.01.009
Stegeman, J.J., Goldstone, J.V., Hahn, M.E., (2010). Perspectives on zebrafish as a model in environmental toxicology, Fish Physiolo-gy, 29: 367-439.doi: 10.1016/S1546-5098(10)02910-9
Suvetha, L., Ramesh, M., Saravanan, M., (2010)., Influence of cypermethrin toxicity on ionic regulation and gill Na+/K+-ATPase Activity of a freshwater teleost fish Cyprinuscarpio, Environmental Toxicology and Pharmacol-ogy, 29: 44-49.doi: 10.1016/j.etap.2009.09.005
Taş, E.Ç., Ergen, Z. veSunlu, U., (2009). 2002-2004 YıllarıarasındaHomaLagünü’nden (İzmir Körfezi) toplananHedistediversicol-or’daveyaşadığısedimentteağır metal düzeylerinin (Cd, Cu, Zn, Pb, Cr, Fe) araştırılması, Ege University Journal of Fisheries&Aquatic Sciences, 26(3): 179-185.
Zhang, J.F., Liu, H., Sun, Y.Y., Wang, X.R., Wu, J.C., Xue, Y.Q., (2005). Responses of the antioxidant defenses of the Goldfish Carassiusauratus, exposed to 2,4-dichlorophenol, Environmental Toxicology and Pharmacology, 19: 185-190.doi: 10.1016/j.etap.2004.07.00167