Keywords
Fish, protein purification, chromatographic methods, electrophoretic methods
Giriş
Proteinin saflaştırılması bir hücre
ekstraktından, biyolojik aktivite kaybı olmaksızın
proteinin izolasyonu anlamına gelmektedir. Proteinler
biyolojik aktivitelerini ancak sınırlı pH ve
sıcaklık aralığında göstermektedir. Dolayısıyla,
saflaştırmada kullanılacak metodlar proteinin
fiziksel, kimyasal ve biyolojik özelliklerine bağlı
olarak seçilmelidir (Toker, 2000).
Eczacılık sanayinde hormonlar (insülin, bovin
somatostatin), viral antijenler (hepatit B antijeni),
büyüme faktörleri (interferonlar, interleukinler,
koloni uyarıcı faktörler) ve antikorların eldesinde
protein saflaştırma yöntemleri kullanılmaktadır.
Gıda sanayinde bebek mamaları gibi fonksiyonel
gıdalara ilave edilmesi uygun olan proteinler ve
peynir gibi gıdaların üretilmesi için zorunlu olan
enzimler de saflaştırılmaktadır. Tabaklama Endüstrisinde
de saflaştırılmış proteinler kullanılmakta,
derilerin boyama işlemine hazırlanması
amacıyla deri üzerindeki protein kısımlar, saflaştırılmış
bağlayıcı proteinlerle veya saflaştırılmış
proteaz enzimi ile işlenerek, deriden uzaklaştırılabilmektedir.
Deterjan Endüstrisinde ise saflaştırılmış
proteaz, protein bazlı lekelerdeki proteini
parçalayarak, düşük ısı ve daha az enerji ile temizlik
sağlar. Proteinler daha fazla verim almak
için balık ve diğer hayvan yemlerine katılır, toprak
iyileştirmesi ve organik azot kaynağı olarak
tarlalara atılırlar. Ayrıca gıda, kimya, genetik
mühendisliği gibi bölümlerde akademik çalışmalar
doğrultusunda saflaştırılmış proteinler
kullanılmaktadır (Wrolstad vd., 2005).
Özel bir proteinin saflaştırılması, gıdaların besinsel
değerindeki rolünün ve fizikokimyasal
özelliklerinin daha iyi anlaşılması için gereklidir.
Benzer şekilde bir çok enzim gıdaların tekstür,
renk, lezzet ve besinsel değerine olan etkisini
çalışmak için saflaştırılmaktadır. Gıda zehirlenmelerine
ve gıda allerjilerine neden olan proteinlerin
saflaştırılması ve karakterizasyonu da bu
vakalardaki rollerinin daha iyi anlaşılması ve
mücadele edilebilmesi bakımından gereklidir
(Wrolstad vd., 2005).
Bugüne kadar su ürünleri işleme teknolojisi
açısından proteinlerle ilgili birçok çalışma yapılmıştır.
Barakuda balık proteinlerinin emülsiyon
aktivitesi, emülsiyon kararlılığı, köpük oluşturma,
köpük hacmi kararlılığı, viskozite, su
tutma kapasitesi, jel dayanıklılığı gibi fonksiyonel
özellikleri incelenmiş ve surimi gibi ürünlere
ilave edilebileceği önerilmiştir (Ramachandran vd., 2007). Alaska polloklarının (Theragra chalcogramma) yan ürünlerinden elde edilen
proteinlerin arzu edilen fonksiyonel ve besinsel
özelliklere sahip olmasından dolayı gıda endüstrisinde
kullanılması önerilmiştir (Sathivel ve
Bechtel, 2006). Balık yumurtalarından elde edilen
proteinlerin bazı fonksiyonel özellikleri incelenmiş
ve gıdaların besinsel özelliklerinin zenginleştirilmesi
için ilave edilmesi uygun görülmüştür
(Bechtel vd., 2007). Alabalık filetoları
üzerine tuz ve şeker karışımının serpilmesiyle
oluşturulan gravad balık ürününün soğukta muhafazası
sırasında proteinlerinde meydana gelen
değişimler incelenmiş ve saklama koşulları ile
ilgili önerilerde bulunulmuştur (Michalezyk ve
Surowka, 2007). Dondurulmuş ringa balıklarının
muhafazası boyunca proteinlerinde meydana
gelen değişiklikler incelenmiş ve 3 aydan fazla
dondurulmuş olarak muhafaza edilmemesi önerilmiştir
(Geirsdottir vd., 2007).
Proteinlerin stabilizasyonu
Protein saflaştırmada en hassas konu, proteinin
aktivitesinin korunmasıdır. Aktivite kaybı
önlenemez ise elde edilecek ürün miktarı da o
kadar azalır. Önemli olan nokta, en son basamakta
daha fazla aktif protein elde etmektir. Her
basamakta stabilizasyon kuralları tekrar yerine
getirilmelidir. Stabilizasyonu sağlayan fiziksel ve
kimyasal faktörler; pH, sıcaklık (tercihen 4oC),
oksidasyon derecesi, ağır metal konsantrasyonu,
polarite, proteaz ve nükleazların konsantrasyonu,
saflaştırmada başlangıçtan sona kadar geçen süre
ve elde edilecek ürünün ortamdaki konsantrasyonudur
(Toker, 2000; Janson ve Ryden, 1998).
Saflaştırma akış şeması
Balık proteinlerinin saflaştırılması için aşağıdaki
adımlar izlenmektedir.
- Ekstraksiyon: Ekstraksiyon sıvılaştırma anlamına
gelmektedir ve saflaştırmanın ilk koşuludur.
İzolasyon koşullarına göre sadece sıvılaştırılmış
materyal kullanılır. Bu işlem için su, tampon
ve tuzlar kullanılmaktadır. Saflaştırma işleminin
ileriki safhalarında kullanılan matriksin
tıkanmasını önlemek ve matriksten maksimum
performans sağlamak için, kolona uygulanmadan
önce örneği diğer protein, iyon, su vb. maddelerden
arındırmak önemlidir (Yada, 2004).
Gıdaların ekstraksiyon aşamasında en çok
distile sudan yararlanılır. Distile suda yumurta
akında bulunan ovalbumin, kaslarda bulunan miyojen, kan serumunda bulunan serumalbumin
ve sütte bulunan laktalbümin gibi albuminler
çökelir. Prosedür proteolizi önlemek için tercihen
4oC’de belli bir zaman periyodunda (30 dk-2
saat) distile su ile örneğin karıştırılmasını içerir.
Çözünemeyen materyalleri uzaklaştırmak için
yapılan santrifüj işleminden sonra, fazla tuzu
elimine etmek ve kontamine olan tuzda çözünebilir
proteinleri (globulinler) çöktürmek için
süpernatant distile suya karşı diyaliz edilir. Hedef
proteinden kayıpları engellemek için düşük moleküler
ağırlıklı bir membran (<8000) diyalizde
kullanılmalıdır. Diyalizin tamamlanması ile diyaliz
torba içerikleri santrifüj edilir (yada filtre
edilir) ve süpernatant (yada filtrat) albuminin
izolasyonu için dondurulup kurutulur (Yada,
2004).
Amonyum sülfat [(NH4)2SO4] ve sodyum klorür
(NaCl) gibi tuzlarda globulinler (kan serumundaki
serum globülin, sütteki laktoglobülin ve
kaslardaki miyosin, muko protein, glikoprotein,
orosomukoid, antitripsin, lipoprotein, transferin,
seruloplazmin, makroglobulin) çökelmektedir
(Huang ve Ochiai, 2005; Yamashita vd., 2003).
Proteinler farklı konsantrasyonlardaki çözünürlüklerine
göre fraksiyonlanabilir. Bu proteinin
ortamda bulunan tuza karşı hassasiyet göstermesinden
kaynaklanmaktadır. Düşük iyonik güçte
protein çözünürlüğü tuz konsantrasyonu ile artar
(salting in), bununla birlikte yüksek iyonik güçte,
protein çözünürlüğü azalır (salting out). Bu yüzden
çeşitli proteinler içeren bir solüsyonda
amonyum sülfat konsantrasyonu hedef proteinin
çökme noktasının aşağısında ayarlanabilir. Bu
hedef proteini solüsyonda bırakırken istenmeyen
birçok proteini çöktürecektir. Bunun aksine, tuz
konsantrasyonu hedef proteinin çökme noktasının
üzerinde ayarlanabilir. Bu şekilde istenmeyen
proteinlerin çoğunun solüsyonda kalması sağlanır.
Amonyum sülfat diyaliz, Sephadex G25 kolonunda
tampon değiş tokuşu ile ya da hidrofobik
interaksiyon ile proteinden uzaklaştırılabilir.
Seyreltik NaCl solüsyonu kullanılarak yapılan
ekstraktsiyonu santrifüj ve süpernatantın
(ekstrakt) suya karşı diyalizi takip eder. Diyalize
(proteolizi engellemek için 4oC’de) tuz solüsyonu
ile de ekstrakte edilen albuminleri globulinlerden
ayrıştırmak için gerek vardır. Diyaliz boyunca
NaCl uzaklaştırılır ve suda çözünebilen
albuminler solüsyon içine bırakılırken globulinler
çöktürülür. Örn: temel globulin proteinleri 0.15
M NaCl ve 11S globulin 0.35 M NaCl ile
ekstrakte edilebilir (Yada, 2004).
Ayrıca uygun pH ve iyonik güçteki tamponlar
da ekstraksiyon için kullanılmaktadır. Bunlara
HCl/KCl, glisin/HCl, Na2HPO4/sitrik asit, sitrik
asit/NaOH, asetik asit /NaOH veya sodyum asetat,
NaH2PO3/Na2HPO4, bis.tris/HCl, bis.tris
propan/HCl, trietonalamin hidroklorid/NaOH,
tris/HCl, dietonalamin, sodyumborat/HCl,
glisin/NaOH, sodyumkarbonat/sodyum bikarbonat,
sodyumborat/NaOH ve Na2HPO4/NaOH
tamponları örnek olarak verilebilir. Bütün proteinler
bir izoelektrik noktasına (pI) sahiptir.
İzoelektrik noktası proteinlerin hiç net yük taşımadığı
pH’dır. Proteinler kendi izoelektrik noktasında
en az çözünür. Proteinlerin izoelektrik
noktası farklı olduğu için; başlangıçta
fraksiyonlama yaparken çoğunlukla hedef proteini
çözen, arzu edilmeyen proteinleri çökelekte
bırakan bir pH değerindeki tampon kullanılabilir.
Santrifüjden sonra, hedef proteinin izolasyonu ve
saflaştırılması için süpernatant konsantre bir kaynak
olarak kullanılır. Tampon çözeltiler normal
konsantrasyonlarının 10-100 katı oranlarda hazırlanır
ve stoklanırlar. Gerekli durumda bu
stoklardan kullanılır (Ikoma vd., 2003; Yada,
2004; Toker, 2000).
Protein konsantrasyonları, örneklerin asitli
sularla (pH proteinlerin pI’larına göre ayarlanır)
ekstrakte edilmesi ile üretilebilir. Asitli su şeker,
koku ve tat maddeleri gibi bazı küçük proteinler
gibi çözünebilen maddeleri uzaklaştırır.
Ekstraksiyon pH’sında polisakkaritler ve bazı
minerallerle birlikte proteinlerin çoğu çözünmez
ve çökelekte kalır. Çökelek bir alkali solüsyonla
nötralize edilir ve protein konsantrasyonu (minimum
%65 protein içeriği) gibi dondurulup kurutulur
(Janson ve Ryden, 1998).
Sodyum hidroksitte (NaOH) glutelinler (buğdaydaki
gluten vb.) çökelmektedir. Etanolde ise
prolaminler ya da gliadinler (somon balığındaki
salmin, ringa balığındaki klupein) çökelmektedir
(Aksoy, 2000).
Hedef protein birçok arzu edilmeyen biyolojik
materyaller içinde olabilir. Örneğin; proteazın
hedef proteinin moleküler yapısı ve şeklinin bozulmasını
engellemek için inaktive edilmesine ya
da örnekten çabucak uzaklaştırılmasına gerek
vardır. Ekstraksiyon işlemi boyunca proteaz inhibitörleri
proteinlerin bozulmasını önlemek için
ilave edilebilir ya da proteinlerin polimerizasyonunu
teşvik eden sülfidrili engellemek için
redükleyici ajanlar (merkaptoetanol ve
ditiyotreitol) eklenebilir. Proteinlerin metal
iyonlar tarafından oksitlenmesini önlemek için EDTA gibi metal selatlar da eklenebilir. Gıda
kaynaklarından alınan proteinlerin çözünebilmesi
için mekanik araçlar (homojenizatör, blendır ve
ultrasound) kullanılır. Protein solüsyonu
ekstrakte edilince denatürasyonu önlemek için
soğukta (4oC) saklanır (Janson ve Ryden, 1998).
- Hücre bütünlüğünün bozulması: Hücre bütünlüğünün
yani hücre zarının bozulması
amacıyla kimyasal, fiziksel yada mekanik
yöntemler kullanılmaktadır (Toker, 2000; Janson
ve Ryden, 1998).
Kimyasal yöntemlerin uygulanması için deterjanlar
(Triton X-100) ve organik çözücülerden
yararlanılır. Bu maddeler hücrelerin membran
yapısını bozarak hücre içeriğinin ortama geçmesini
sağlar. Bu yöntemlerde kullanılan kimyasalların
pahalı olması, istenmeyen protein
denatürasyonlarına neden olması ve ortamdan
hemen uzaklaştırılması gibi bazı dezavantajları
bulunmaktadır (Janson ve Ryden, 1998).
Fiziksel yöntem olarak ozmotik lizis uygulanır.
Bu metotla hücre hipotonik bir ortama alınır
ve hücrenin su alıp şişerek patlaması sağlanır
(Janson ve Ryden, 1998).
Mekanik yöntem olarak Fransız presi,
sonikasyon ve homojenizasyon işlemleri uygulanır.
Fransız presi; çelik bir kaba yerleştirilen
hücre süspansiyonu üzerine uygulanan yüksek
basınçla, hücreler küçük bir delikten geçirilerek
membran yapılarının parçalanmasına dayanır.
Sonikasyon; hücre süspansiyonuna daldırılan
sonikatör, titreşim yaparak ve yüksek ses dalgalarıyla
hücre bütünlüğünün bozulmasını sağlar.
Homojenizasyon; en çok kullanılan yöntemdir.
Cam homojenizatör kabında pistonun düzenli
dönüşü ya da vuruşu ile sağlanan mekanik güçle,
hücreler piston ve cam çeper arasında sıkıştırılır,
hücre zarı parçalanır, hücre içeriği tampona geçer,
elde edilen süspansiyon, bütünlüğü bozulmamış
birçok organeli içerir ve homojenat olarak
adlandırılır (Janson ve Ryden, 1998).
- Konsantrasyon: Konsantrasyon amacıyla
santrifüj, zonal ultrasantrifügasyon, diyaliz ve
ultrafiltrasyon yöntemlerinden yararlanılır
(Toker, 2000; Janson ve Ryden, 1998).
Santrifüj; Sulu karışımlar (süspansiyon/
homejenat)’a santrifüj kuvveti uygulandığında,
daha büyük ve yoğun komponentler, daha
hızlı çökerler. Santrifüj işlemi örneğe bağlı olarak
10000-50000 devirler arasında ve 15-30 dk sürmektedir.
Düşük hızlı santrifüj tam hücreleri,
deney ortamından ayırırken, yüksek hızlı santri Santrifüj; Sulu karışımlar (süspansiyon/
homejenat)’a santrifüj kuvveti uygulandığında,
daha büyük ve yoğun komponentler, daha
hızlı çökerler. Santrifüj işlemi örneğe bağlı olarak
10000-50000 devirler arasında ve 15-30 dk sürmektedir.
Düşük hızlı santrifüj tam hücreleri,
deney ortamından ayırırken, yüksek hızlı santrifüj
farklı büyüklük ve yoğunluktaki subselüler
organelleri ayırır. Differensiyel santrifüj uygulamasında
homojenat, gittikçe artan santrifüj kuvvetine
maruz bırakılarak fraksiyonlarına ayrılması
sağlanır. Kütle büyüdükçe, çökmesini sağlayan
santrifüj gücü azalır (Ramachandran vd.,
2007; Chomnawang vd., 2007; Martinez-Alvarez
ve Gomez-Guillen, 2006; Huang ve Ochiai,
2005). Zonal ultrasantrifügasyon; yoğunluk esasına
dayanır ve santrifüje göre daha hassas bir
yöntemdir. Yoğunluk ve büyüklük olarak birbirine
çok yakın olan organeller, differansiyel santrifüjle
ayrılamaz. Bu amaçla zonal santrifügasyon
kullanılır. Plastik bir tüpte % 5-20 konsantrasyonda
sukroz çözeltileri oluşturulur. En üste
homojenat uygulanır. 100.000 devirde santrifüj
yapılır. Homejanat, yoğunluğuna uyan tabakalara
dağılır (Toker, 2000; Janson ve Ryden, 1998).
Diyaliz; molekül büyüklüğüne bağlı difüzyon
anlamına gelmektedir. Yarı geçirgen bir
membran aracılığıyla filtrasyon yapılır. Proteinler,
tuz, iyon ve küçük moleküllerden ayrılır.
0.22μm filtreler steril filtrasyon ya da ekstra temiz
örnekler için tavsiye edilir. Ultrafiltrasyonun
prensibi diyalize benzer. Ultrafiltrasyon tüpünün
alt kısmında yarı geçirgen bir membran bulunur.
Üstten uygulanan basınçlı azot gazı ile çözücü ve
küçük moleküller membran dışına çıkar. 1 000-
30 000 kDa moleküler ağırlık engelleyici
membranlar kullanılır (Wunschel vd., 2005;
Ebran vd., 2000; Toker, 2000; Janson ve Ryden,
1998).
Saflaştırmada kullanılan yöntemler
Proteinlerin saflaştırılması için kullanılan
kromatografik ya da elektroforetik yöntemler
proteinlerin fiziksel, kimyasal ya da biyolojik
özelliklerine bağlı belli prensipler altında seçilir.
Proteinler büyüklük ve kütlesine göre jel
filtrasyon kromatografisi, taşıdıkları net yüklere
göre iyon değişim kromatografisi veya
izoelektrik fokuslama, biyolojik aktivitelerine
göre affinite kromatografisi, polaritelerine göre
revers faz kromatografisi, hidrofobik etkileşim
kromatografisi ve membran kromatografisi yöntemlerinden
yararlanılmaktadır. Tüm kolon
kromatografilerinde prensip aynı şekildedir. Öncelikle
kolon, proteinleri seçici adsorblayan bir
maddeyle (katı porlu matriks) doldurulur.
Matriks sistemin sabit faz kısmını oluşturur.
Daha sonra protein karışımı kolona tatbik edilir
ve kolon tampon çözelti ile yıkanır. Tampon
çözelti sistemin mobil faz kısmıdır. Sonuçta
adsorbe edilmeyen proteinler kolondan önce, adsorbe edilen proteinler daha geç çıkarlar
(Toker, 2000; Janson ve Ryden, 1998).
Kromatografik Yöntemler
- Jel filtrasyon kromatografisi: Jel filtrasyon
kromatografisi diğer adıyla boyut dışlama
kromatografisi proteinleri molekül büyüklüğüne
göre ayırır. Kolon, jel boncuklar [dekstran ya da
agaros veya poliakrilamid gibi polimerler-ticari
isimleri; sephadex, sepharose, biojel-, genellikle
0,1 mm çaplıdırlar) polisakkarid veya
poliakrilamid polimer] ile doldurulur. Protein
karışımını içeren tampon, kolondan geçirilir.
Proteinlerin, matriksteki porlara takılma yüzdesi,
büyüklüğü ile ters orantılıdır. Porlara takılan
proteinler daha yavaş sürüklenirler. Bu yöntemin
büyük miktarda protein karışımını saflaştırabilmesi
gibi bir avantajı varken, yavaş ayırım yapması
da dezavantajıdır. En iyi ayrışma için kolon
içine konulan örnek hacmi kolon hacminin
%5’ini aşmamalıdır. Bu yüzden elde edilen örneğin
hacmi küçük olmaktadır (Yada, 2004; Janson
ve Ryden, 1998).
- İyon değişim kromatografisi: Proteinleri,
üzerlerinde taşıdıkları net yüklere göre ayırır.
Kolon pozitif (anyon değiştirici) veya negatif
(katyon değiştirici) yüklü bağlayıcı gruplar içeren
reçineyle doldurulur. Protein karışımı düşük iyonik
güçteki bir tamponla kolon boyunca taşınır.
Bu tamponun pH’sı hedef proteinin reçineye
bağlanmasını teşvik edecek değere sahip olmalıdır.
Eğer tampon pH’sı proteinin pI’dan daha
küçük tutulursa proteinin yükü pozitif olur ve bir
katyon değiştirici ile bağlanır. Bunun tersine
tampon pH’sı proteinin pI’dan daha küçük tutulursa
proteinin yükü negatif olur ve bir anyon
değiştirici ile bağlanarak kolonda tutulur. Bağlanmayan
proteinler, kolondan ilk olarak çıkarlar.
İyonik gücü ya da pH’sı farklı bir tampon kolondan
geçirilir bağlı proteinlerin yükü değiştirilerek
kolondan ayrılması sağlanır. Jel filtrasyon
kromotografisinde kullanılan kolonlardan farklı
olarak kolonları kısa ve şişmandır. Proteinlerin pI
değerinin belirlenmesi bağlayıcı grubun seçilebilmesi
bakımından önemlidir. Protein çeşitliliği
açısından kapasitesi yüksek olduğundan saflaştırma
işleminin ilk basamaklarında kullanılabilir.
Ayrıca hedef proteinin yüksek tuz konsantrasyonu
içerikli tamponlarda olması arzu edilmez.
Proteindeki tuzu uzaklaştırmak için yarı geçirgen
membran kullanılan diyaliz uygulanabilir. Bunun
için önce protein örneği bir diyaliz torbası içine
konur ve bu torba su ya da arzu edilen düşük
konsantrasyonlu tuzlu su tamponu içine konur. Membran küçük tuz moleküllerini diyaliz torbasının
dışını çevreleyen su ya da düşük tuz konsantrasyonlu
tampon içine geçirirken proteinleri
diyaliz torbasının içinde bırakır. Protein örneğinin
tuzu daha hızlı bir şekilde jel filtrasyon
kromatografisi kullanılarak da uzaklaştırılabilir
(Ötleş, 2005; Yada, 2004; Janson ve Ryden,
1998).
- Affinite kromatografisi: Enzim, hormon, vb.
spesifik proteinlerin saflaştırılmasında kullanılır.
Kolonun dolgu maddesine, (dekstran,
poliakrilamid, selüloz vb.) spesifik protein ile
kompleks yapabilen ligandlar (bağlayıcı grup)
bağlanır. Ligand ile kompleks yapan spesifik
protein, katı desteğe bağlanarak kolonda tutulurken
serbest proteinler kolonu terk ederler. Bağlı
protein, daha sonra, pH, iyonik güç ya da polarite
değişiklikleri / tuz çözeltileri veya ligand ilavesiyle
kolondan ayrılır. Ligandlar küçük moleküller
(ATP, pigment, aminoasit, kofaktör ve iyonlar),
nükleik asitler, şekerler, steroidler, yağ asitleri,
proteinler ve antibadiler olabilir. Örneğin;
konkavalin A glukoza ve Lektin mannoza bağlanan
proteinlerdir ve bu yöntemle saflaştırılırlar
(Ötleş, 2005; Yada, 2004; Janson ve Ryden,
1998).
- Revers faz kromatografisi: Proteinleri
hidrofobik özelliklerine göre saflaştırır. Ters faz
kromatografisi sabit fazın hidrofobik, mobil fazın
sabit fazdan daha hidrofilik olduğu bir
kromatografi çeşididir. Bu normal faz
kromatografisinin tersi bir durumdur. Protein
solüsyonu hidrokarbon zincir gruplarının tutunduğu
Silica boncukları içeren bir kolona pompalanır.
Örneğin; Octasesil, Butil, Propil,
Fenildimetil. Proteinin hidrofobik grupları boncuklara
bağlanır. Hidrofilik proteinler kolondan
ilk çıkar. Bağlı proteinler genellikle asetonitril
konsantrasyonunun arttırılmasıyla çözdürülür.
Bir çok farklı kolon boyu vardır: 2.5-5cm, 0.4-
1cm ve 0.1-0.2cm. Kullanılan çözücüler, su + %
0.1 Triflorasetik asit veya Asetonitrildir. Kullanılan
ligandlar: C4, C8 ya da C18 n-alkil hidrokarbonlardır.
Yöntemin avantajı, çözünme daha
iyi ve daha hızlı olması, dezavantajı ise standart
ve kolonların pahalı olmasıdır. Bu da maliyeti
arttırıcı bir özelliktir. Proteinlerin çoğu organik
çözücüler yüzünden denatüre olur. Bu yüzden, bu
yöntem gıda sistemlerinden ziyade analitik ayrışmalar
için tavsiye edilir (Ötleş, 2005; Yada,
2004; Janson ve Ryden, 1998).
- Hidrofobik etkileşim kromatografisi: Kolonlar
hidrofobik uçlu ligandların bağlandığı boncuklarla doldurulur. Ligandlar hidrofobik
bölgesi açıkta bırakılan proteinlere bağlanır.
Böylece proteinlerin hidrofobik özelliklerindeki
farklılığa göre ayrışması sağlanır. Hidrofilik bölgeleri
açıkta bırakılan proteinler ligandlara bağlanmaz
ve kolondan ilk olarak çıkar. Ayrıca bu
interaksiyon ortama yüksek iyonik güce sahip
tamponların ilavesiyle arttırılabilir. Kolona bu
şekilde tutunan proteinler tuzun kademeli olarak
azaltılması, deterjanların ilave edilmesi, sıcaklığın
ya da pH’nın değiştirilmesi ile kolondan ayrılması
sağlanır. Bu yöntemde kullanılan
ligandların bağlama gücü en yüksekten en düşüğe
doğru şu şekilde sıralanabilir: eter, isopropil,
butil, octil, fenil (Ötleş, 2005; Yada, 2004;
Janson ve Ryden, 1998).
- Membran kromatografisi: Metot, diğer
kromatografi metotlarında olduğu gibi protein
moleküllerinin katı bir desteğe adsorblanmasına
dayanır. Bununla birlikte destek ortamı olarak
boncukların yerine ince mikroporlu membranlar
kullanılır. Bu yüzden basınç kaybı sınırlayıcı bir
etki değildir. Membranların iç kısmındaki porları hedef proteini bağlayan adsorblayıcı gruplar içerir.
Yöntemin avantajı; örneğin membrandan akıp
geçmesi hızı arttırır ve proteinin tutulma süresini
kısaltır. Difüzyon direncinin yok edilmesinden
dolayı diğer kromatografi yöntemlerinin 1/10’u
sürede tamamlanır (Yada, 2004; Janson ve
Ryden, 1998).
- Hızlı performans likit kromatografisi
(FPLC): Yerçekimi akış kromatografisi adı da
verilmektedir. Proteinlerin ayrıştırılması, saflaştırılması,
belirlenmesi ve nitelendirilmesi amacıyla
fazlasıyla geliştirilmiş bir kolon kromatografi
modelidir. Pompalar tampon veya örneği kolon
içine iter. Fraksiyonlar kolonun dışına çıkınca,
protein konsantrasyonlarının belirlenmesi için bir
spektrofotometreden geçirildikten sonra tüpler
içine otomatik olarak toplanır (Ötleş, 2005).
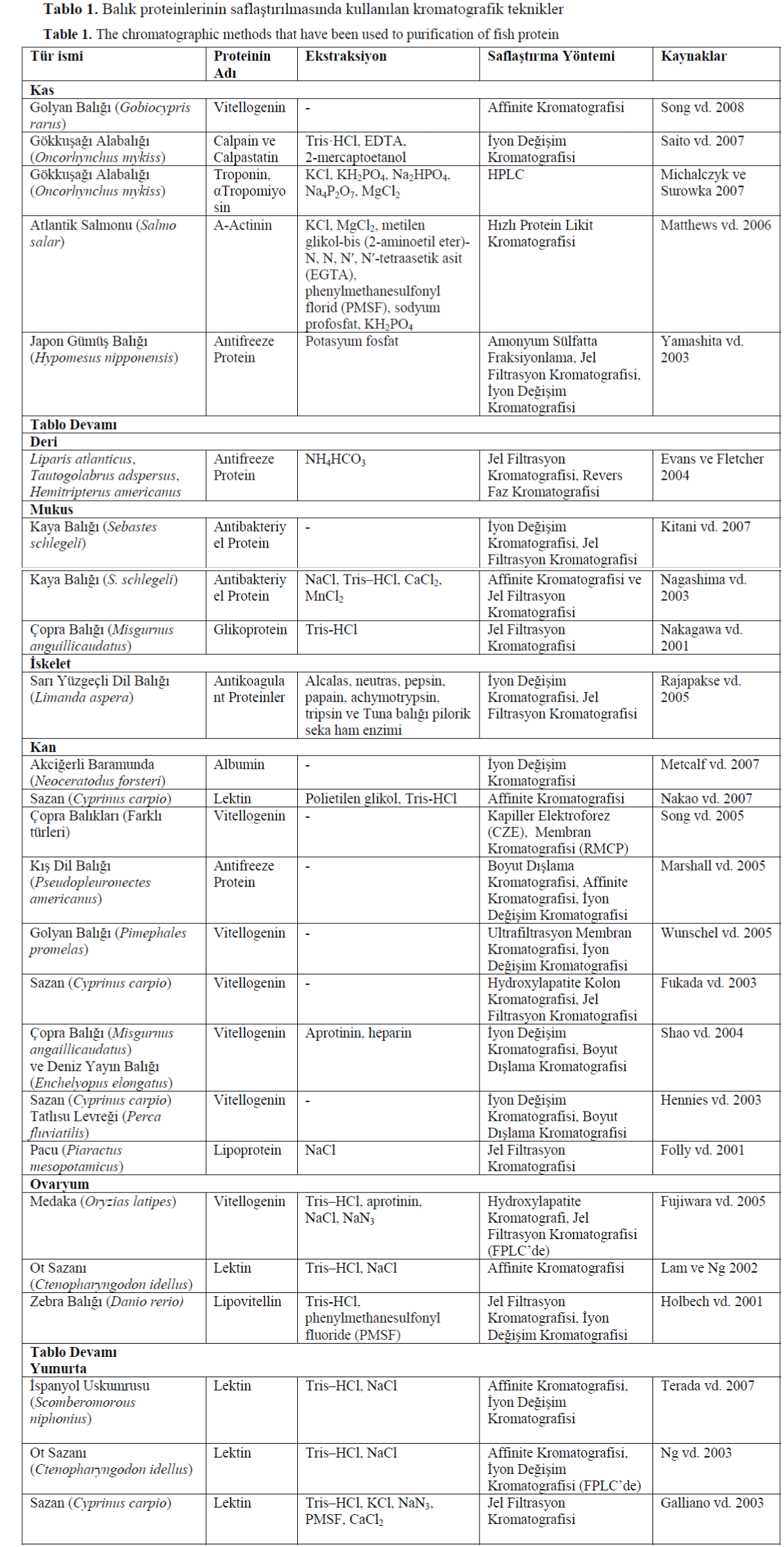
Tablo 1’de balık proteinlerinin saflaştırılmasında
kullanılan kromatografik teknikler ile ilgili
çalışmalar ayrıntılı olarak gösterilmiştir.
Tablo 1. Balık proteinlerinin saflaştırılmasında kullanılan kromatografik teknikler
Table 1. The chromatographic methods that have been used to purification of fish protein
Elektroforetik Yöntemler
- İzoelektrik fokuslama: Metot, bir fokuslama
sistemi içinde protein örneğinin arzu edilen pH
aralığındaki taşıyıcı amfolit ya da diğer taşıyıcı
tamponlarla karışmasına dayanır. Amfolit çözeltisindeki
H+ ve OH- iyonları, biri diğerini nötralize
ederek sürüklenirken, fokuslama sistemi
üzerinde farklı pH değerleri oluşur. Protein karışımı
izoelektrik ortamına uygulanıp elektroforez
yapıldığında, karışımdaki her protein kendi
izoelektrik noktasına kadar ortam üzerinde sürüklenir
ve durur. Yöntemin avantajı; protein
karışımları jel ortamı olmaksızın kendi pI’larına
göre fraksiyonlanır. Dezavantajı; proteinler kendi
pI’larında yüksek konsantrasyonlarda çökerler ve
bu fraksiyonların birleşmesine sebep olur. pH
gradienti oluşturmak için kullanılan amfolitler
elektrosprey iyonizasyon-mass spektrometresi
gibi sonra uygulanabilecek analizleri engelleyebilir.
Bu problemden kaçınmak için amfolitleri
uzaklaştırmak üzere protein fraksiyonları diyaliz
edilebilir ya da jel kromatografisinden geçirilebilir.
Yüksek derecede hidrofobik proteinler örnek
hazırlamada ya da proteinlerin kendi pI’larına
ulaştıklarında fokuslama boyunca kaybedilebilir
(Ötleş, 2005; Yada, 2004; Janson ve Ryden,
1998).
- Sodyum dodesil sülfat poliakrilamid jel
elektroforezi (SDS-PAGE): En yaygın olarak
kullanılan protein elektroforez tekniğidir. Bu
metodda, örnek hazırlama tamponuna bir miktar
anyonik bir deterjan olan SDS eklenir. SDS, örnekteki
protein moleküllerinin etrafında boşluk
kalmayacak şekilde bir katman oluşturur. Sonuçta,
her molekül, homojen bir şekilde (-) yükle kaplanmış olur. Poliakrilamid, polimerizasyondan
önce akrilamid içeriği değiştirilerek
porozitesi kolaylıkla değiştirilebilen inert bir
destek materyalidir. Elektroforetik ayırmada
sadece etkin moleküller kütleye bağlıdır ve jeldeki
moleküler elek doğrultusunda ayrışma gerçekleşir.
Bu yöntem daha çok proteinlerin molekül
ağırlıklarının saptanmasında, protein saflığının
kontrolünde, proteinleri fraksiyonlamada, saf
proteinin alt yapısının incelenmesinde kullanılmaktadır
(Janson ve Ryden, 1998).
- Kapiller Elektroforez: Bu yöntemin avantajları;
duyarlı olması, düşük reaktif (sadece tampon)
sarfiyatı nedeniyle test maliyetinin düşük
olması, az miktarda örnekle çalışılabilmesi, hızlı
sonuç alınmasından ve fazla sayıda fraksiyon
elde edilmesinden dolayı otomasyona uygun
olması ve test çeşitliliğinin fazla olmasıdır.
Kapiller elektroforez küçük çaplı (25-75 μm),
100 cm. uzunluğunda ‘fused’ silika bir kapiller
boru kullanılarak gerçekleştirilen bir yöntemdir.
Kapillerin sonundan yüksek bir voltaj uygulandığında
örnek moleküller, iç kapiller yüzeyde aşırı
(+) iyonların katoda doğru hareketinin sonucunda
oluşan bir hacim akışı olan elektroozmotik akışla
ayrılır. Örnekteki (+) iyonlar, elektroozmotik akış
ve iyon hareketinin aynı yönde olması nedeniyle
kapiller çıkışa daha erken gelirler. Örnekteki (-)
iyonlar, aynı zamanda kapiller çıkışa hareket
ederler, ama hızları daha yavaştır (Janson ve
Ryden, 1998).
Tablo 2’de balık proteinlerinin saflaştırılmasında
kullanılan elektroforetik teknikler ile ilgili
çalışmalar ayrıntılı olarak gösterilmiştir.
Tablo 2. Balık proteinlerinin saflaştırılmasında kullanılan elektroforetik teknikler
Table 2. The electrophoretic methods that have been used to purification of fish protein
Sonuç
Balık proteinlerinin saflaştırılmasında, arzu edilen
proteinin saflık derecesine göre sadece tek bir
yöntem kullanılabilirken ardışık olarak birçoğu
da kullanılabilir. Ekstraksiyon aşamasından itibaren
her saflaştırma aşamasında toplam protein
içeriği ve örnekte bulunan proteinlerin çeşidi
devamlı olarak kontrol edilmelidir. Miktar olarak
en fazla protein eldesine imkân veren yöntemler,
membran kromatografisi, iyon değişim kromatografisi,
hidrofobik interaksiyon kromatografisi
ve revers faz kromatografisidir. Küçük miktarda
protein saflaştırmak istendiğinde affinite
kromatografisi tercih edilebilir (Wrolstad vd.,
2005).
Protein herkesin almak zorunda olduğu bir temel
besin maddesidir. Balık ve diğer su ürünleri protein
eldesi için ucuz bir hammadde alternatifidir.
Saf halde elde edilen balık proteinleri karakteristik bir koku içermez ve tüketici kesim açısından
protein hammadde kaynaklı besinler yerine saf
proteinlerin alınması daha ucuza mal olur. Elde
edilen saf proteinler çeşitli fonksiyonel gıdalara
ilave edilerek gıdaların besinsel değeri arttırılabilir.
Protein sadece gıda endüstrisinde değil eczacılık
sanayinde, tabaklama endüstrisinde ve hatta
sadece insanlar için değil bazı zirai hayvanların
üretiminde ve tarımsal üretimde kullanılabilmektedir.
Günümüzde, özellikle sporcu proteinleri,
proteinli içeçekler vb. ürünlerin kullanımındaki
artış, bu sektörün hızla geliştiğini göstermektedir.
Bu kadar geniş bir kullanım alanına
sahip olan proteinlerin ekonomik değeri düşük
olan balıklardan saf halde elde edilmesine yönelik
çalışmalar yapılmasının ülke ekonomisi için
büyük bir kazanç olacağı kanısındayız.
Kaynaklar
Aksoy, M. (2000).
Beslenme Biyokimyası. 622 s.,
Hatipoğlu Yayınevi, Ankara.
Bechtel, P. J., Chantarachoti, J., Oliveira, A. C.
M., Sathivel, S., (2007). Characterization of
protein fractions from immature Alaska
walleye pollock (
Theragra chalcogramma)
roe,
Journal of Food Science,
72(5): 338-
343.
Chomnawang, C., Nantachai, K.,
Yongsawatdigul, J., Thawornchinsombut, S.,
Tungkawachara, S., (2007). Chemical and
biochemical changes of hybrid catfish fillet
stored at 4 OC and its gel properties,
Food Chemistry,
103: 420–427.
Ebran, N., Julien, S., Orange, N., Auperin, B.,
Molle, G., (2000). Isolation and
characterization of novel glycoproteins from
fish epidermal mucus: correlation between
their pore-forming properties and their
antibacterial activities,
Biochimica et Biophysica Acta,
1467: 271-280.
Evans, R. P., Fletcher, G. L., (2004). Isolation
and purification of antifreeze proteins from
skin tissues of snailfish, cunner and sea
raven,
Biochimica et Biophysica Acta,
1700:
209–217.
Folly, E., Bastos, V.L.C., Alves, M.V., Bastos,
J.C., Atella, G.C., (2001). A high density
lipoprotein from
Piaractus mesopotamicus,
pacu, (Osteichthyes, Characidae), is
associated with paraoxonase activity,
Biochimie,
83: 945−951.
Fujiwara, Y., Fukada, H., Shimizu, M., Hara, A.,
(2005). Purification of two lipovitellins and
development of immunoassays for two
forms of their precursors (vitellogenins) in
medaka (
Oryzias latipes),
General and Comparative Endocrinology,
143: 267–277.
Fukada, H., Fujiwara, Y., Takahashi, T.,
Hiramatsu, N., Sullivan, C.V., Hara, A.,
(2003). Carp (
Cyprinus carpio) vitellogenin:
purification and development of a
simultaneous chemiluminescent
immunoassay,
Comparative Biochemistry and Physiology Part A,
134: 615–623.
Galliano, M., Minchiotti, L., Campagnoli, M.,
Sala, A., Visai, L., Amoresano, A. Pucci, P.,
Casbarra, A., Cauci, A., Perduca, M.,
Monaco, H.L., (2003). Structural and biochemical characterization of a new type
of lectin isolated from carp eggs,
Biochemical Journal,
376: 433–440.
Geirsdottir, M., Hlynsdottir, H., Thorkelsson, G.,
Sigurgisladottir, S. (2007). Solubility and
viscosity of herring (
Clupea harengus)
proteins as affected by freezing and frozen
storage,
Journal of Food Science,
72(7):
376-380.
Hennies, M., Wiesmann, M., Allner, B.,
Sauerwein, H., (2003). Vitellogenin in carp
(
Cyprinus carpio) and perch (
Perca fluviatilis): purification, characterization and
development of an ELISA for the detection
of estrogenic effects.
The Science of the Total Environment,
309: 93–103.
Holbech, H., Andersen, L., Petersen, G. I.,
Korsgaard, B., Pedersen, K. L., Bjerregaard,
P. (2001). Development of an ELISA for
vitellogenin in whole body homogenate of
zebrafish (
Danio rerio).
Comparative Biochemistry and Physiology Part C.,
130:
119-131.
Huang, M-C., Ochiai, Y. (2005). Fish fast
skeletal muscle tropomyosins show speciesspecific
thermal stability,
Comparative Biochemistry and Physiology Part B.,
141:
461 – 471.
Ikoma,T., Kobayashi, H., Tanaka, J., Walsh, D.,
Mann, S., (2003). Physical properties of type
I collagen extracted from fish scales of
Pagrus major and
Oreochromis niloticas,
International Journal of Biological
Macromolecules,
32: 199–204.
Janson, J.C., Ryden, L., (1998). Protein
Purification- Principles, High Resolution
Methods, and Applications. 695 p. Wiley-
VCH, New York.
Joo, J.D., Park, J.W. (2007). Extraction of sardine
myoglobin and its effect on gelation
properties of Pacific whiting surimi,
Journal of Food Science,
72: 202-207.
Kitani, Y., Tsukamoto, C., Zhang, G. Nagai, H.,
Ishida, M., Ishizaki, S., Shimakura, K.,
Shiomi K., Nagashima, Y., (2007).
Identification of an antibacterial protein as
L-amino acid oxidase in the skin mucus of
rockfish
Sebastes schlegeli,
FEBS Journal,
274: 125–136.
Lam, Y.W., Ng, T.B., (2002). Purification and
characterization of a rhamnose-binding lectin with immunoenhancing activity from
grass carp (
Ctenopharyngodon idellus)
ovaries,
Protein Expression and
Purification,
26: 378–385.
Marshall, C.B., Chakrabartty, A., Davies, P.L.,
(2005). Hyperactive antifreeze protein from
winter flounder is a very long rod-like dimer
of α-helices,
The Journal of Biological
Chemistry,
280(18): 17920–17929.
Martinez-Alvarez, O., Gomez-Guillen, M.C.,
(2006). Effect of brine salting at different
pHs on the functional properties of cod
muscle proteins after subsequent dry salting,
Food Chemistry,
94: 123-129.
Matthews, S.J., Ross, N.W., Lall, S.P., Gill, T.A.,
(2006). Astaxanthin binding protein in
Atlantic salmon.
Comparative Biochemistry and Physiology Part B,
144: 206–214.
Metcalf, V.J., George, P.M., Brennan, S.O.,
(2007). Lungfish albumin is more similar to
tetrapod than to teleost albumins:
Purification and characterisation of albumin
from the Australian lungfish,
Neoceratodus
forsteri, Comparative Biochemistry and Physiology Part B,
147: 428–437.
Michalezyk M., Surowka K., (2007). Changes in
protein fractions of rainbow trout
(
Oncorhynchus mykiss) gravads during
production and storage,
Food Chemistry,
104: 1006–1013.
Mitsuhashi, T., Kasai, M., Hatae, K., (2002).
Detection of giant myofibrillar proteins
connectin and nebulin in fish meat by
electrophoresis in 3-5% gradient sodium
dodecyl sulfate polyacrylamide slab gels,
Journal of Agricultural and
Food Chemistry,
50: 7499-7503.
Nagashima, Y., Kikuchi, N., Shimakura, K.,
Shiomi, K., (2003). Purification and
characterization of an antibacterial protein in
the skin secretion of rockfish
Sebastes schlegeli,
Comparative Biochemistry and Physiology Part C,
136: 63–71.
Nakagawa H., Hama Y., Sumi T., Li S.C., Li
Y.T., (2001). KDN-containing glycoprotein
from loach skin mucus,
Advances in
Experimental Medicine and Biology,
491:
171-84.
Nakao, M., Kajiya, T., Sato, Y., Somamoto, T.,
Kato-Unoki, Y., Matsushita, M., Nakata, M.,
Fujita, T.F., Yano, T., (2007). Lectin pathway of bony fish complement:
identification of two homologs of the
mannose-binding lectin associated with
MASP2 in the common carp (
Cyprinus carpio),
The Journal of Immunology,
177:
5471-5479.
Ng, T.B., Lam, Y.W., Woo, N.Y.S., (2003). The
immunostimulatory activity and stability of
grass carp (
Ctenopharyngodon idellus) roe
lectin,
Veterinary Immunology and
Immunopathology,
94: 105–112.
Ötleş, S., (2005).
Methods of Analysis of Food
Components and Additives. 437 p., CRC
Press Taylor & Francis Group, Boca Raton.
Rajapakse, N., Jung, W.K., Mendis, E., Moon,
S.H., Kim, S.K., (2005). A novel
anticoagulant purified from fish protein
hydrolysate inhibits factor XIIa and platelet
aggregation,
Life Sciences,
76: 2607–2619.
Ramachandran, D., Mohan, M., Sankar, T.V.,
(2007). Physicochemical characteristics of
muscle proteins from barracuda (
Sphyraena
jello) of different weight groups,
LWT-Food
Science and Technology,
40: 1418–1426.
Saito, M., Li, H., Thompson, V. F., Kunisaki, N.,
Goll, D. E. (2007). Purification and
characterization of calpain and calpastatin
from rainbow trout,
Oncorhynchus mykiss.
Comparative Biochemistry and Physiology Part B,
146: 445–455.
Sathivel, S., Bechtel, P.J., (2006). Properties of
soluble protein powders from Alaska
pollock (
Theragra chalcogramma),
International
Journal of Food Science and
Technology,
41: 520-529.
Shao, J., Shi, G., Liu, J., Jiang, G., (2004). A
rapid two-step chromatographic method for
the quantitative determination of
vitellogenin in fish plasma,
Analitical and
Bioanalitical Chemistry,
378: 615–620.
Song, M, Lv, X., Wang, H., Jiang, G. (2008).
Fast purification of trace vitellogenin from
Chinese rare minnow using protein Aimmobilized
antibody,
Analitical and
Bioanalitical Chemistry,
390: 2151–2157.
Song, M., Wang, J., Shao, J., He, B., Jiang, G.,
Shi, G., (2005). Separation and detection of
vitellogenin in fish plasma by capillary zone
electrophoresis,
Journal of Chromatography
B,
821: 38–44.
Songchotikunpan, P., Tattiyakul, J., Supaphol P.,
(2008). Extraction and electrospinning of
gelatin from fish skin, International Journal
of Biological Macromolecules,
42: 247–
255.
Terada, T., Watanabe, Y., Tateno, H., Naganuma,
T., Ogawa, T., Muramoto, K., Kamiya, H.,
(2007). Structural characterization of a
rhamnose-binding glycoprotein (lectin) from
Spanish mackerel (
Scomberomorous
niphonius) eggs,
Biochimica et Biophysica Acta,
1770: 617–629.
Toker, N.Y., (2000). Protein saflaştırılması ile
ilgili bazı metodlar,
Vetfakdergi, 2, 12. Makale.
Undeland, I., Kelleher, S.D. Hultin, H.O.,
Mcclements, J., Thongraung, C., (2003).
Consistency and solubility changes in
herring (
Clupea harengus) light muscle
homogenates as a function of pH,
Journal of Agricultural and
Food Chemistry,
51:
3992-3998.
Wrolstad, R.E., Acree, T.E., Decker, E.A.,
Penner M.H., Reid, D.S., Schwartz, S.J.,
Shoemaker, C.F., Smith, D.M., Sporns, P.,
(2005). Handbook of Food Analytical
Chemistry, 768 p. Wiley –Interscience,
Hoboken, N. J.
Wunschel, D., Schultz, I., Skillman, A., Wahl, K,
(2005). Method for detection and
quantitation of fathead minnow vitellogenin
(Vtg) by liquid chromatography and matrixassisted
laser desorption/ionization mass
spectrometry, Aquatic Toxicology,
73: 256–
267.
Yada, R.Y., (2004). Proteins in Food Processing.
686 p. Woodhead Publishing, Cambridge.
Yamashita, Y., Miura, R., Takemoto, Y., Tsuda,
S., Kawahara, H., Obata, H., (2003). Type
III antifreeze protein from a mid-latitude
freshwater fish, japanese smelt (
Hypomesus
nipponensis),
Bioscience Biotechnology and
Biochemistry,
67(3): 461-466.
1163