Key words
Flow cytometry, Hydrobiology
Giriş
Flow Sitometri, çeşitli hücrelerin süspansiyon halinde bir kanal boyunca tek tek bir sıra haline gelerek ince bir kanaldan geçmesiyle, hücre büyüklüğü ve granülaritesine bağlı olarak sınıf-landırılması ilkesine dayanan bir cihazdır (Alice 2004). Sitometri hücrelerin veya biyolojik parti-küllerin fiziksel yada kimyasal karakterlerinin ölçülmesidir Flow sitometri’de ölçümler, süspan-siyon içindeki hücrelerin ölçüm yapacak olan aparattan birer birer geçmesiyle yapılır.
Flow Sitometrinin çalışma prensleri 1870 yıllara kadar eski olsa da 1969 yıllında argon lazerinin kullanılmaya başlaması, 1980 yıllında ayırma işleminin bulunması ve son 10 yıldır sürekli olarak geliştirmesiyle günümüze kadar gelişmiştir (Dunphy 2004).Flow Sitometrinin temel yaklaşımı, hücrelerin boyut, şekil, DNA ve RNA içeriği, sitoplazmik granüleritesi açısında değerlendirilmesidir (Demirel 1995). Bu amaçla hedeflenen yapı ya da hücre önce flüoresan madde ile işaretli bir antikor veya özel bir boya (nükleik asitlere özel propidium iodide) kullanılarak işaretlenir. Bazı durumda ise klorofil gibi maddeler kendileri flüoresan özelliğe sahiptir. (Collier 2000). Flow sitometri analizi hedeflene yapı ve hücrelerinin sayısını türünü çok kısa sürede, ucuz ve etkin bir şekilde belirleyebilir (Karaboz ve ark., 2008).
On binlerce hücrenin yada partikülün(virus, spor vb) kısa zaman içinde analiz edilmesi, İstatistiksel bilginin çok çabuk elde edilmesi, elde edilen bilginin esnek olması Flow sitometrinin iyi bir analiz aracı olarak öne çıkarmkatadır.
Günümüzde flow sitometrinin biyoloji ve hidrobiyolojide bağlıca kullanım alanları:
o DANN (miktar ve DNA kompozisyonu), RNA, Protein analizleri,
o Hücre antijenlerinin ve yoğunluğunun belirlenmesi.,
o Korofil veya fikoeritrin gibi hücre pigmentleri,
o Hücre ölümü(apoptozis) ve proliferasyonun belirlenmesi,
o Mikroorganizma (hücre içi bakteri, virüs, bakteri ve alg) sayısı (Binet ve ark., 2006) ve tür analizi yapılması (Collier & Campbell, 1999)
o Parazit, mantar belirlenmesi,
o Hücre zar geçirgenliği ve potansiyelinin değerlendirmesi,
o Hücre kültüründe virüs, bakteri, hücre sayımı,
o Bağıl klorofil içeriği ne bağlı alt populasyonların, türlerin ve bireylerin belirlenmesi (Heidi ve ark., 1989; Dignum ve ark., 2004),
o Nötral yağ içeriğinin belirlenmesi,
o Hücreler arası serbest kalsiyum ölçümü,
o Hücre pH ölçümü,
o Hücre büyüme dinamikleri, eğrilerinin çıkarılması (Forget ve ark., 2010)
o Alglerde toksik madde etkileri LC50 değerlerinin bulunmasında (Franklin ve ark., 2001; Kong ve ark., 2007),
o Alglerde sitotoksik çalışmalarda (Franqueira ve ark., 2000; Li & Yang, 2003),
o Ekotoksikolojik çalışmalarda(Stauber ve ark., 2001).
Sitometri, hücrelerin veya biyolojik partiküllerin fiziksel ya da kimyasal karakter-lerinin incelenmesidir. "Flow" sitometri ise, akan bir sıvının içerisindeki hücrelerin özelliklerinin incelenmesi olarak tanımlanabilir (Taneli 2007). Flow sitometri, hücre veya partiküllerin akmakta olan bir akışkanın içindeyken karakteristiklerinin ölçülmesidir. Flow sitometrisi ile bir süspansiyon halindeki hücre ya da partiküller, lazer ışığı ile aydınlatılmakta olan bir bölmeden geçirilir; hücrelerin ışığın önünden geçerken verdikleri sinyaller toplanarak analiz edilir. Oluşan sinyallerin kaynağı, hücrenin büyüklük, granularite gibi fiziksel özellikleri olabildiği gibi; hücreye bağlanan çeşitli fluorokromlar da olabilir. Böylece hücre ya da partikülün immunfenotipi, DNA iceriği (da Silva & Reis, 2008), enzim aktiviteleri, hücre membran potansiyeli, canlılığı gibi çeşitli özellikleri hakkında bilgi toplanabilir. Çok küçük olmaları nedeniyle belirlenmeleri çok zor olan virusler (Baculoviridae, Herpesviridae, Myoviridae, Phycodnaviridae, Picornaviridae, Podoviridae, Retroviridae, and Siphoviridae) özel boyalar ile (SYBR Green I, SYBR Green II, OliGreen, PicoGreen) flow sitometri ile belirlenebilir (Brussaard ve ark., 2000).
Başta tıpta hematoloji, immünoloji, patoloji kullanım alanı bulan flow Sitometrinin hidrobiyolojide kullanım alanlarını özetlenmesi, flow Sitometrinin çalışma prensibinin, uygulama alanlarının gösterilmesi amaçlanmıştır.
Flow sitometrinin çalışma ilkesi
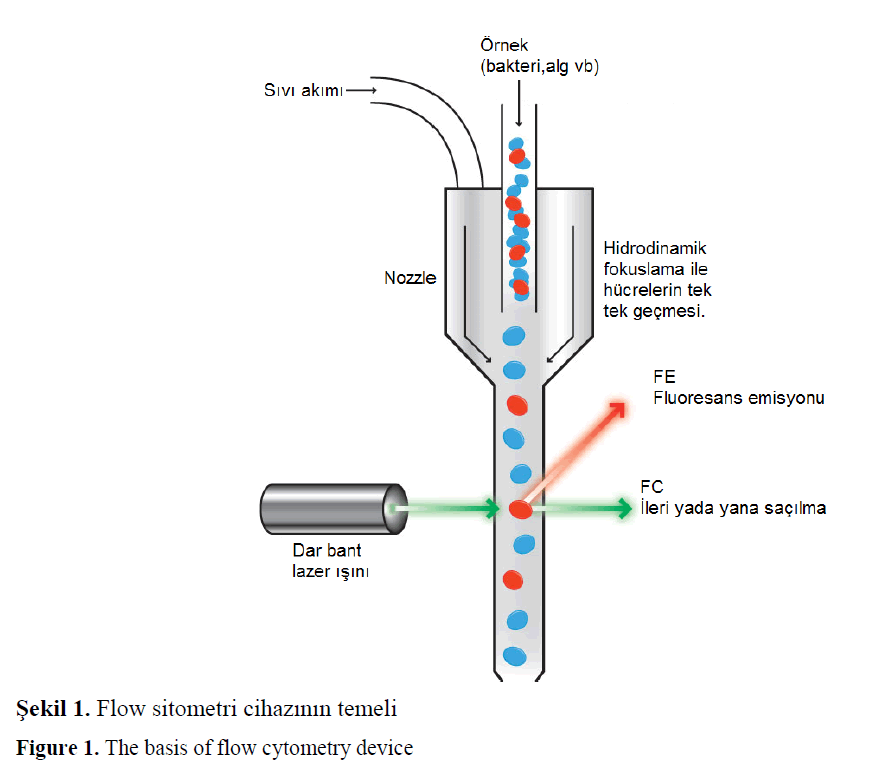
Flow sitometri cihazında bir sıvı içinde yer alan her bir hücre veya partikül lazer demetinin içinden geçerken saptırma ve geçirme şeklinde okunurken yayınlanan fluorosen ışığı bir araya getirilip, optik filtreler ve aynalar tarafından farklı dalga boylarına göre ayrılarak, bilgisayar ortamına aktarılır (Karaboz ve ark. 2008). Elde edilen veriler histogramlar olarak bilgisayar ortamına aktarılır. Histogram, ölçülen parametrelerin frekans dağılımlarının görsel sunumudur (Olson ve ark. 2005). Ölçüm sırasında hücreler canlı veya sabit olmalıdır, ayrıca sıvı içinde hücreler tek tek askıda olmalıdır. Hücreleri içeren süspansiyon sürekli bir akışla lazer ısını içinden geçmelidir. Her bir hücre lazer ışığının bir kısmını saptırır ve aynı zamanda lazer tarafından uyarıldıklarından yani ekstra enerji yüklenmiş olduğundan, fluorosen ışığı yayarlar (Olson ve ark. 2005) (Şekil 1).
Sekil 1. Flow sitometri cihazının temeli
Figure 1. The basis of flow cytometry device
Flow sitometride temel kısımlar:
1- Akışkan sistemi(fluidics system): Hidro dinamik odaklama ile örneğin tek tek lazer demetinin önünden sabit bir akış hızıyla düzenli geçmesimden sorumludur.
2- Laserler: Farklı dalga boyunda ışık verirler.
3- Optik system: İleri ve yana saçılma için blazer ışını ayarlar, farklı detektörlere farklı ışınların ulaşmasına izin verirler (Baumgarth & Bigos, 2004).
4- Detektörler Optik sistem tarafından ayrılmış olan farklı ışınların elektronik olarak algılanması ve değerlendirilmesini yapar.
5- Elektronik ve bilgisayara sistemi: detektörlere gelen elektronik bilginin değerelendirilmesi ve bilgisayar tarafında analiz edilreke kullanıcıya sunulması yapılır. Analiz sonunda elde edilen verilerin ileri yöntemler değerelen-dirilmesi mümkündür (Wilkins ve ark., 2001).
Flow sitometri cihazında bir sıvı içinde yer alan her bir hücre veya partikül lazer demetinin içinden geçerken saptırma ve geçirme şeklinde okunurken yayınlanan fluorosen ışığı bir araya getirilip, optik filtreler ve aynalar tarafından farklı dalga boylarına göre ayrılarak, bilgisayar ortamına aktarılır (Collier 2000, Taneli 2007) (Şekil 1.). Elde edilen veriler histogramlar olarak ekrana aktarılır. Histogram, ölçülen parametrelerin frekans dağılımlarının görsel sunumudur (Olson ve ark. 2005).
Temel olarak bir Flow sitometri cihazından
1- İleri saçılma grafiği (Forward scatter)
2- Yana saçılma grafiği (Side scattre garfaiği)
3- Fluorescen grafiği (belli dalga boyuna has parıldama elde edilir. Elde edilen de-ğerlerin 2’li, 3’lü değerlendirtmesiyle bilgisayar ortamında yapılabilir.
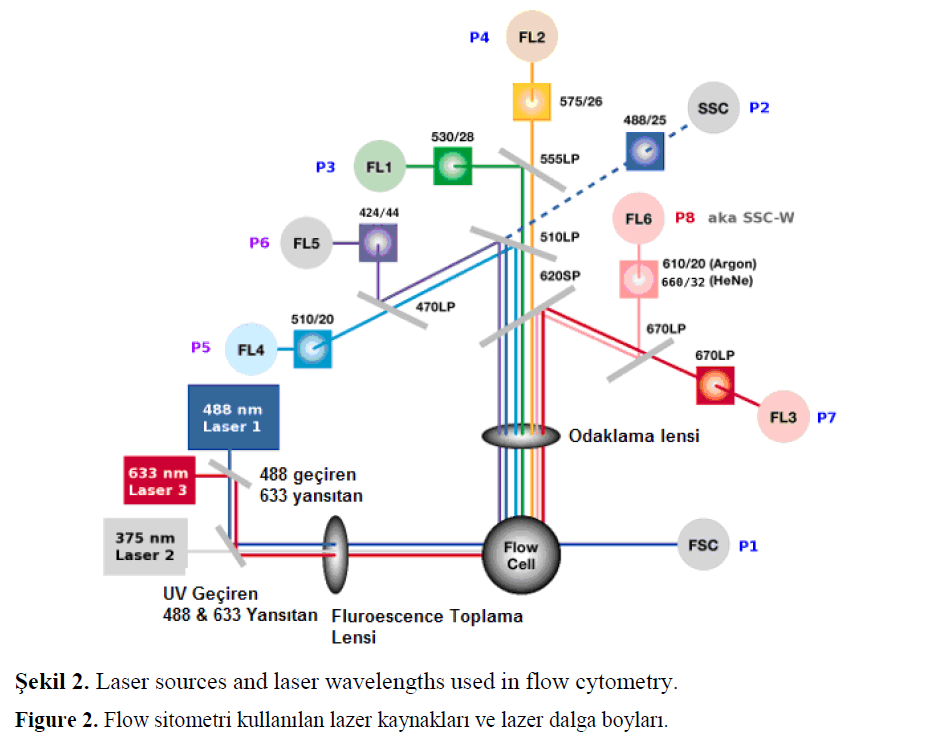
Ölçüm sırasında hücreler canlı veya sabit olmalıdır, ayrıca sıvı içinde hücreler tek tek askıda olmalıdır (Heidi ve ark. 1989). Hücreleri içeren süspansiyon sürekli bir akışla lazer ısını içinden geçmelidir (Şekil 2.). Her bir hücre lazer ışığının bir kısmını saptırır ve aynı zamanda lazer tarafından uyarıldıklarından yani ekstra enerji yüklenmiş olduğundan, fluorosen ışığı yayarlar (Olson ve ark. 2005).
Sekil 2. Laser sources and laser wavelengths used in flow cytometry.
Figure 2. Flow sitometri kullanılan lazer kaynakları ve lazer dalga boyları.
Sitometri her bir hücre için aynı anda birçok parametre ölçer:
o Hücre çapı ile yaklaşık orantılı olarak düşük acıda ileri saçılma yoğunluğu
o Hücre içindeki granül yapı sayısı ile yaklaşık orantılı olarak ortogonal (90°) saçılma yoğunluğu
o Birçok dalga boyundaki fluoresen yoğunluğu
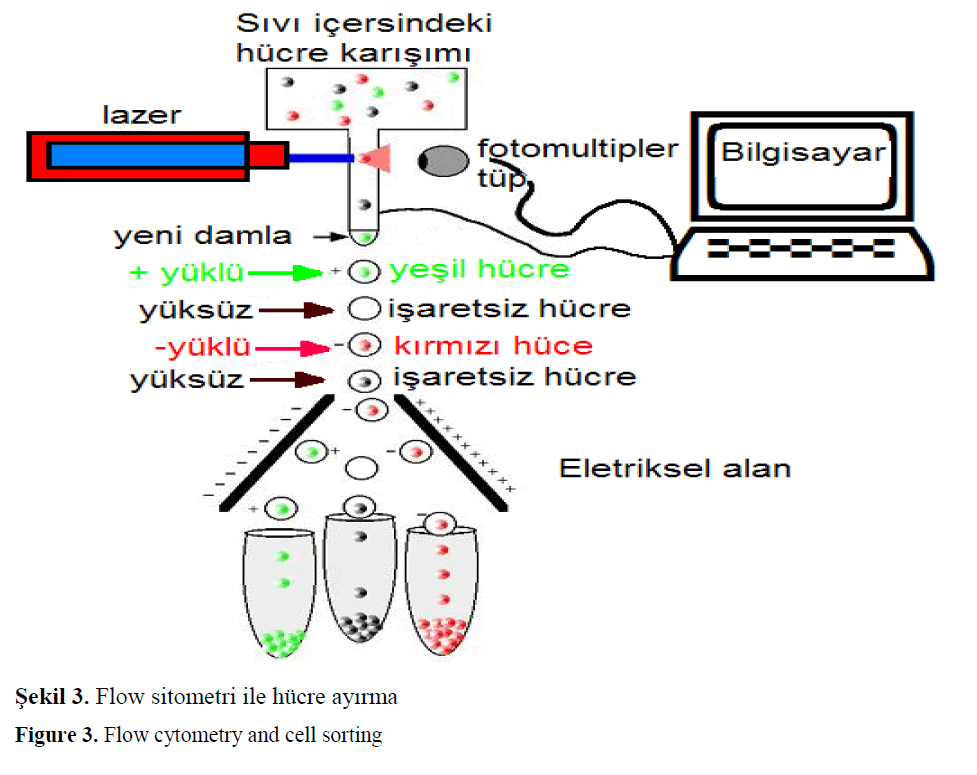
Flow sitoemtri çihazın ileri modeleri hücreleri ölçüm parametrelerine göre sınıflandırıp ayırabilir (Jones ve ark., 1989). Bu imkan özellikle saf kültür elde edilmesinde hızlı, kolay, ucuz bir yöntemdir (Dignum ve ark., 2004) (Şekil 3.). Flow sitometrik yöntemle belli parametrelere göre mikroskopik canlıların ayrılması(canlı olarak) saflaştırılması, canlığının belirlnmesi kolaylıla ve hızlı yapılabilir (Saunders ve ark., 1985).
Sekil 3. Flow sitometri ile hücre ayırma
Figure 3. Flow cytometry and cell sorting
Flow sitometri cihazı belirli boyalarla boyanmış olan partiküleri sayabilir, ayırabilir. Verileri bilgisayar ortamında değerlendirerek alt grupları (gate alma) oranlarını, sayılarını, kalibre edildiğinde ise boyutları hakkında yüksek hızda doğru sonuç verebilir
Araştırmacıların farklı amaçlar için farklı tipteki partikülleri (mikroorganizmalar, dokular, canlı yada cansız yapılar) gerekli ayar yada kalibrasyonları yaparak analizleri yapabilir. Flow sitometri cihazın florusen özeliği granüteyi ölçen bunu çok hızlı ve doğru bir şekilde yapan bir analiz cihazı olduğu ve uygun her hücre, partikül ve yapı ile farklı onlarca analizin yapılabileceği unutulmamalıdır (Dignum ve ark. 2004). Aynı şekilde sınıflandırılan hücrelerin ayrılmasıda yapılabilir (Şekil 3.).
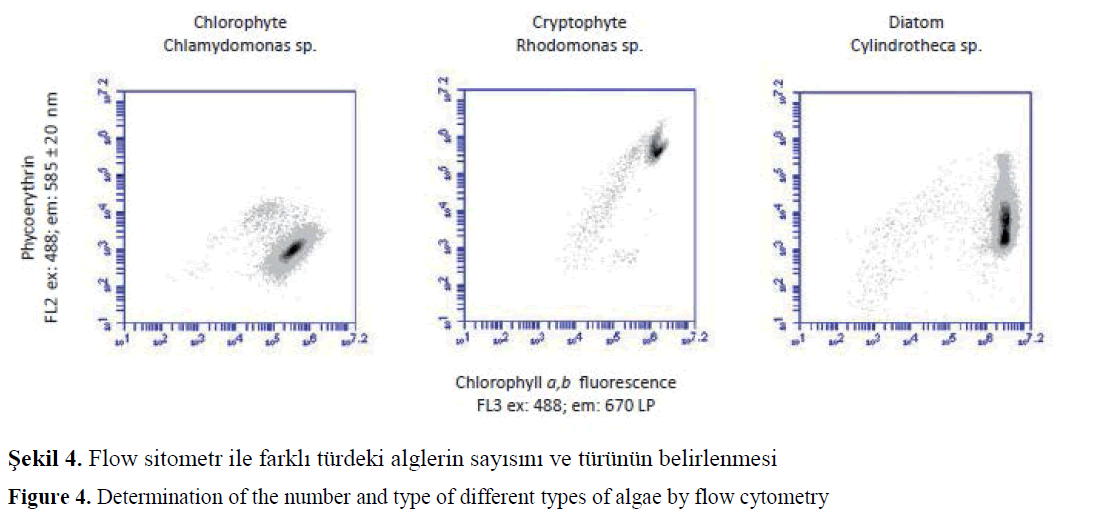
Alglerin su ortamında direk olarak sayısının ve türlerinin belirlenmesi sağlayan flow sitometri cihazının protipi ilk kez 1960 yılında geliştirildi. (Şekil 4.). Flow sitometri ile optik ölçümler, siyanobakterler, proklorofitler, kokolitoforitler, pennat diatomlar ve kriptofitler gibi fitoplanktonları ve gruplarını tanımlamak ve saymak için kullanabilir (Collier ve Campbell 1999). Yeni geliştiren otomatik örnekleme cihazları örnekleme, analiz işlemlerini güneş enerji ile yapabilmektedir. Bu şekilde karadan bağımsız olarak, tüm yıl istenen sıklıkta ve derinlikte veri toplaması yapılabilir (Barnaba ve ark., 2006).Üstelik gelecekte çok daha gelişmiş araçlarla daha fazla veri daha ucuza toplayabilecektir.
Sekil 4. Flow sitometr ile farklı türdeki alglerin sayısını ve türünün belirlenmesi
Figure 4. Determination of the number and type of different types of algae by flow cytometry
Flow Sitometrinin Avantajları
o Hız: Teknik hızlıdır, saniyede binlerce partikül sayımı yapabilir.(tek hücreli florusans özelliği olan canlıların çok kısa zamanda çok duyarlı olarak sayılmasına izin verir(Stauber ve ark., 2002).
o Duyarlılık: Yüksek duyarlılıkla analiz yapma imkanı vardır (Her bir dalga boyunu yada her bir partikül boyunun ayrı ayrı sayılması mümkündür).
o Doğruluk: Tek tip mikro küreciklerin ışık saçılımı ve fluorosen ölçümleri için varyasyon sabiti (CV=standart sapma/ortalama); %1 küçüktür
o Gruplama: Flow sitometrinin en güçlü ve kendisine özgü avantajı, herhangi bir optik karakteristiğe veya bunların kombinasyonlarına bağlı olarak hücrelerin fiziksel olarak birbirlerinden ayırabilmesidir. Böylece daha ileri analizler yapabilmek için, spesifik hücrelerin saf örneklerini elde etmek mümkün olur (Olson ve ark. 2005).
o Yıl boyunca farklı noktalrda farklı derinliklreden alınan örneklerinin sürekli ölçümü yapılabilir (Şekil 5.).
Sekil 5. Alg analizi yapan ilk prototip ve son hali.
Figure 5. The fist protype which anayles algea and next generation.
o Flow sitometri cihazlarının kurulun maliyetleri yüksek olmasına karşın, kullanım bakım maliyetleri düşüktür.
Flow Sitometrinin Dezavantajları
o Sınırlı çözümleme: Flow sitometriler tipik olarak sadece ileri yapısal detayları değil de pik yapan veya entegre sinyalleri ölçebilir. Ayrımı yapılacak olan partikül (örneğin fitoplanktondaki) morfolojik özellikleri dikkate almaz. Bu sorun ölçüm yapılması istenen partikülere özel olarak bağlanan yada incelenemesi istenen yapı dışında tüm yapılara bağlanan optik olarak aktif kimyasallarla çözülebilir.
o Küçük örnek boyutu: Birçok flow sitometri çok küçük hacimleri (<0.5 mm) analiz eder. Oysa, hücreler en az yaklaşık 103/ml olarak bulunurlar. Bu nedenle flow sitometri cihazının doğru şekilde kalibre ve ayarlanması gerekir. Flow sitometriler çok doğru ölçümler yapabiliyor olmalarına rağmen, bu ölçümler kullanılan örneğin özelliğine göre kalibrasyonuna bağlıdır (Olson ve ark. 2005).
Sonuç
Fow sitometri temel olarak bir analiz yöntemidir. Kullanım alanı yoğun olarak tıpta özellikle hematolojide öne çıkmaktadır. Ancak bir analiz yöntemi olarak çok farklı konularda farklı metod ve yöntemlerde kullanılma imkanı vardır. Özellikle farklı dalga boylarında boyanma, ışıma yapma imkanı olan tek hücrelilerde (özellikle algler) alternatif yöntem metodlara göre daha kesin, ucuz vve hızlı sonuç alma imkanı vardır.
Günümüzde flow sitometri hızla gelişmeye devam etmektedir. Özellikle partikül (hücre) belirleme dışında ayırma işlemi yapan özel sistemler geliştirilmiştir. Bu yolla yalnız belirleme değil, ayırma işlemi içinde Flow sitometri kullanabilir. Flow sitometri gelecek yıllarda daha etkin analiz, ayırma yapabileceği, kullanım alanın genişleyeceği düşülmektir. Bu noktada araştırmacıların flow sitometri haberdar olup, öğrenmeleri, uygulamaları ve araştırmalarında bir seçenek olarak değerlendirmeleri gerekmektedir. Flow sitometrimin bir araç olduğu bu araçla araştırmacıların amaçına yönelik eylemlerin çok hızlı, duyarlı, hassas, ucuz yapılabileceği ihtimali göz ardı edilmemelidir.
References
Alice, L.,G., (2004). Flow Cytometry, Protocols Methods in Molecular Biology, 263: 1-31. DOI: 10.1385/1-59259-773-4:001
BrussaardC.P.D ., Dominique, M., Gunnar B., (2000). Flow cytometric detection of viruses, Journal of Virological Methods, 85: 175-182. doi:10.1016/S0166-0934(99)00167-6
Collier, J.,L., (2000). Flow Cytometry and The single cell in Phycology, Journal of Phycol-ogy, 36: 628-644. doi:10.1046/j.1529-8817.2000.99215.x
Collier, J.,L., Campbell L., (1999). Flow cytometry in molecular aquatic ecology, Hydrobiologia, 401: 33-53. doi:10.1023/A:1003769806881
Demirel, D., (1995). Flow Stimetrik DNA analizininTemelPrensipleri, TürkpatalojiDregisi, 11(2): 64-65.
Dignum, M., Hoogveld, H.L., Matthijs, H.,C.,P., Laanbroek, H.,J., Pel, R., (2004). Detecting the phosphate status of phytoplankton by enzyme-labelled fluorescence and flow cytometry, FEMS Microbiology Ecology, 48: 29-38. doi:10.1016/j.femsec.2003.12.007
Dunphy, C.,H., (2004). Applications of Flow Cytometry and immunohistochemistry to Diagnostic Hematopathology, Archives of Pathology & Laboratory Medicine, 128(9): 1004-1022.
Barnaba, F., Fiorani, L., Palucci, A., Tarasov, P., (2006). First characterization of marine particles by laser scanning flow cytometry, Journal of Quantitative Spectroscopy &Radiative Transfer, 102(1): 11-17. doi:10.1016/j.jqsrt.2006.02.051
Baumgarth, N., Bigos, M., (2004). Optimization of emission optics for multicolor flow Cytometry. Cytometry, 4th Edition: New Developments, 75: 3-22.
Dignum, M., Hoogveld, H.L., Matthijs, H.C.P., Laanbroek, H,.J., Pel, R., (2004). Detecting the phosphate status of phytoplankton by enzyme-labelled fluorescence and flow cytometry, FEMS Microbiology Ecology 48: 29-38. doi:10.1016/j.femsec.2003.12.007
Dunphy, C.H., (2004). Applications of Flow Cytometry and immunohistochemistry to Diagnostic Hematopathology, Archives of Pathology & Laboratory Medicine, 128(9): 1004-1022.
Forget, N., Belzile, C., Rioux, P., Nozais, C., (2010). Teaching the microbial growth curve concept using microalgal cultures and flow cytometry, Journal of Biological Education, 44(4): 185-189. doi:10.1080/00219266.2010.9656220
Franklin, N.M., Stauber, J.L., Lim, R.P., (2001). Development of flow cytometry-based algal bioassays for assessing toxicity of copper in natural waters, Environmental Toxicology and Chemistry, 20(1): 160-170. doi:10.1002/etc.5620200118
Franqueira, D., Orosa, M., Torres, E., Herrero, C., Cid, A., (2000). Potential use of flow cytometry in toxicity studies with microalgae, Science of the Total Environment, 247(2-3): 119-126.doi:10.1016/S0048-9697(99)00483-0
Heidi, M.S, Sallie, W.C., Olson, R.J., (1989). Chlorophyll Fluorenscence from single Cells: Interpretation of Flow Cytometrics Signals, Limnology and Ocenography, 34(8): 1749-1761.
doi:10.4319/lo.1989.34.8.1749
Johnson, K.W., Dooner, M, Quesenberry, P.J., (2007). Fluorescence activated cell sorting: a window on the stem cell, Current Pharma-ceutical Biotechnology, 8(3): 133-9. doi:10.2174/138920107780906487
Jones, B.M., Nicholson, J.K.A., Holman, R.C., & Hubbard, M. (1989). Comparison of Monocyte Separation Methods Using Flow Cytometric Analysis, Journal of Immunological Methods, 125(1-2): 41-47. doi:10.1016/0022-1759(89)90076-8
Karaboz, I., Kayar., E., Akar, S., (2008). Flow SitometriveKullanimAlanlari, ElektronikMikrobiyolojiDergisi TR (Eskiadi: OrLabOnLineMikrobiyolojiDergisi) 06(2): 01-18 www.mikrobiyoloji.org/pdf/702080201.pdf.
Kong, F.X., Yu, Y., Wang, M.L., Qian, L.L., Shi, X.L. (2007). Determination of short-term copper toxicity in a multispecies microalgal population using flow cytometry, Ecotoxicology and Environmental Safety, 66(1): 49-56. doi:10.1016/j.ecoenv.2005.10.014
Laane, E., Tani, E., Bjorklund, E., Elmberger, G., Everaus, H., Skoog, L., Porwit-Mac Donald. A., (2005). Flow cytometricimmunophenotyping including Bcl-2 detection on fine needle spirates in the diagnosis of reactive lymphadenopathy and non-Hodgkin's ymphoma, Cytometry Part B Clinical Cytometry, 64(B1): 34-42. doi:10.1002/cyto.b.20043
Li, Z., Yang, M.J. (2003). The application of flow cytometry in toxicology, Toxicology, 191(1): 55-55.
Olson, R.J., Zetter, E.R., Anderson, O.K., (2005). Discrimination of eukaryotic phytoplankton cell type from light scatter and autofluorescence properties measured by flow cytometry, Cytometry, 10: 636-693. doi:10.1002/cyto.990100520
Saunders, G.C., Jett, J.H., Martin, J.C., (1985). Amplified Flow-Cytometric Separation-FreeFluorescence Immunoassays, Clinical Chemistry, 31(12): 2020-2023.
Stauber, J.L., Franklin, N.M., Adams, M.S., (2001). New applications of flow cytometry in ecotoxicology, Toxicology, 164(1-3): 37-37.
Stauber, J.L., Franklin, N.M., Adams, M.S., (2002). Applications of flow cytometry to ecotoxicity testing using microalgae, Trends in Biotechnology, 20(4): 141-143. doi:10.1016/S0167-7799(01)01924-2
Taneli, F., (2007). Flow SitometriTeknigiveKlinikLaboratuvarlardaKullanimi, TürkKlinikBiyokimyaDergisi, 5(2): 75-82.
Wilkins, M.F., Hardy, S.A., Boddy, L., Morris, C.W., (2001). Comparison of five clustering algorithms to classify phytoplankton from flow cytometry data, Cytometry, 44(3): 210-217. doi:10.1002/1097-0320(20010701)44:3<210::AID-CYTO1113>3.0.CO;2-Y
691