Key words
Ichthyophonus hoferi, Carassius auratus, histopathology
Giriş
Ichthyophonus hoferi çok sayıda balık türünü
enfekte eden, özel bir coğrafik alan ve konak tercihi
olmayan, kozmopolit bir endoparazittir
(Sitja-Bobadilla ve Alvarez-Pellitero, 1990;
Criscione ve ark., 2002; Whipps ve ark., 2006).
İlk önce bir mantar türü olarak tanımlanan
Ichthyophonus hoferi, günümüzde hem protozoa
hem de mantar özelliği gösteren organizmaların
bulunduğu Mesomycetozoea sınıfı,
Ichthyophonida ordosu, Ichthyophonae ailesinin
bir türü olarak sınıflandırılmıştır (Mendoza ve
ark., 2002; Arkush ve ark., 2003; Gavryuseva,
2007).
Ichthyophoniasis hastalığına neden olan etkenin
morfolojisi ve oluşturduğu patoloji farklı
balık türlerinde pek çok araştırıcı tarafından
incelenmiştir (Timur ve Timur, 1984; Paperna,
1986; Spanggaard ve ark., 1995; Rahimian, 1998;
McVicar, 1999). Hastalığın enfekte ve ölü balıkların
tüketilmesi, spor taşıyan yemlerin veya suda
bulunan kistlerin oral yol ile alınması sonucu
balıklara bulaştığı, özellikle kalp, böbrek, dalak,
karaciğer gibi kan bakımından oldukça zengin
hematopoietik organlar başta olmak üzere enfekte
balığın hemen hemen her organında granulamatöz
enfeksiyonlara neden olduğu rapor
edilmiştir (Timur ve Timur, 1984; Mellergaard ve
Spanggaard, 1997). Ichthyophoniasis enfeksiyonları
deniz, tatlısu ve akvaryum balıklarının
kronik bir mantar hastalığı olarak 1954-1970
yılları arasında rapor edilmeye başlanmış
(Bendele ve Klontz, 1975) ve günümüze kadar
Amerika’dan (Kocan ve ark., 1999; 2004) Japonya’ya
(Miyazaki ve Jo, 1985; Okamoto ve
ark., 1987), Kuzey Avrupa ve Asya ülkelerinden
(Rahimian ve Thulin, 1996; Gavryuseva, 2007)
Güney Afrika’ya (Paperna, 1986) kadar dünyanın
farklı pek çok bölgesindeki çeşitli deniz ve tatlısu
balıklarında, kültürü yapılan balıklarda ve akvaryum
balıklarında kronik, sistemik enfeksiyonlara
ve epizootiklere neden olduğu rapor
edilmiştir. Etkenin patojenitesi enfeksiyonun
bildirildiği balık türleri arasında değişiklik
göstermektedir. Özellikle ciddi kayıpların ve
salgınların görüldüğü Clupea harengus ve Pleuronectes
platessa türlerinin doğal ve deneysel I.
hoferi enfeksiyonlarına oldukça duyarlı oldukları
bildirilirken (Rahimian ve Thulin, 1996), Salmo
salar ve bazı alabalık türlerinin orta decerece
duyarlı, japon, lepistes gibi bazı balık türlerinin
ise dirençli olduğu rapor edilmiştir (Schmidt-
Posthaus ve Wahli, 2002). Ayrıca deneysel olarak japon balıkları (Carasius auratus) kurbağalarda
Ichthyophonus-benzeri bir etkenin patojenitesini
belirlemek üzere kullanılmış ancak enfeksiyonun
kurbağalarda oluşmasına karşın japon
balıklarında oluşmadığı ve buna bağlı bir patojenite
gelişiminin belirlenmediği de not edilmiştir
(Mikaelian ve ark., 2000).
Özel bir coğrafik alan ve konak tercihi bulunmaksızın
100’den fazla balık türünü enfekte
eden I. hoferi enfeksiyonu ile ilgili ülkemizde bir
kayıt mevcut değildir. Ancak, bu çalışma ile I.
hoferi patojeni, sporadik ölümlerin görüldüğü
özel bir akvaryumda ölümlerin nedenini araştırmak
amacıyla morfolojik ve histopatolojik olarak
incelenen Carassius auratus balığında tespit
edilmiş ve bu balık türünde Ichthyophonus hoferi
olgusu ilk kez tanımlanmıştır.
Materyal ve Metot
Enfekte balık otopsi tekniğine uygun olarak
açılmış ve incelenmiştir. Balık vücut yüzeyi,
yüzgeçler ve solungaç boşluğu makroskobik olarak
ve bu bölgelerden alınan materyal de lam-lamel
arasına alınıp ezildikten sonra ışık mikroskobunda
incelenmiştir. Ardından kalp, beyin, karaciğer,
dalak ve böbreklerden ezme preparatlar
hazırlanarak; mide barsak içeriği bir lam üzerine
alınarak ışık mikroskobunda incelenmiştir. Etkenin
görüldüğü organlar histolojik ve yapısal inceleme
için %10’luk tamponlanmış formol ile
tespit edilmiştir. 4-5 μm kalınlıkta seri kesitleri
alınan örnekler H&E ile boyandıktan sonra
histopatolojik açıdan incelenmiştir. Hastalık etkenine
ait fotoğraflar Nikon Eclipse E600 marka
mikroskoba takılı Pixelink marka dijital bir kamera
ile çekilmiştir.
Bulgular ve Tartışma
Klinik olarak enfekte balıklarda durgunluk,
renkte solgunluk, pullarda düzensizlik ve vücut
yüzeyinde yoğun pul kayıpları, kuyruk ve göğüs
yüzgeçlerinde erozyonlar, nekropside iç organlarda
özellikle kalp ve böbrekte kremsi-beyaz
renkte granüler oluşumların bulunduğu gözlenmiştir.
Benzer dış bulgular Plecoglossus altivelis
(Miyazaki ve Jo, 1985) ile Salmo salar
(Zubchenko ve Karaseva, 2002) balıklarında da
bildirilmiştir. Ichthyophonus enfeksiyonunun belirtileri
farklı balık türleri ile karşılaştırmalı olarak
pek çok araştırıcı tarafından tanımlanmasına
rağmen hastalığın ana belirtileri genellikle iç or ganlarda, deri altında ya da bağ dokuda geliştiği için rapor edilmiştir.
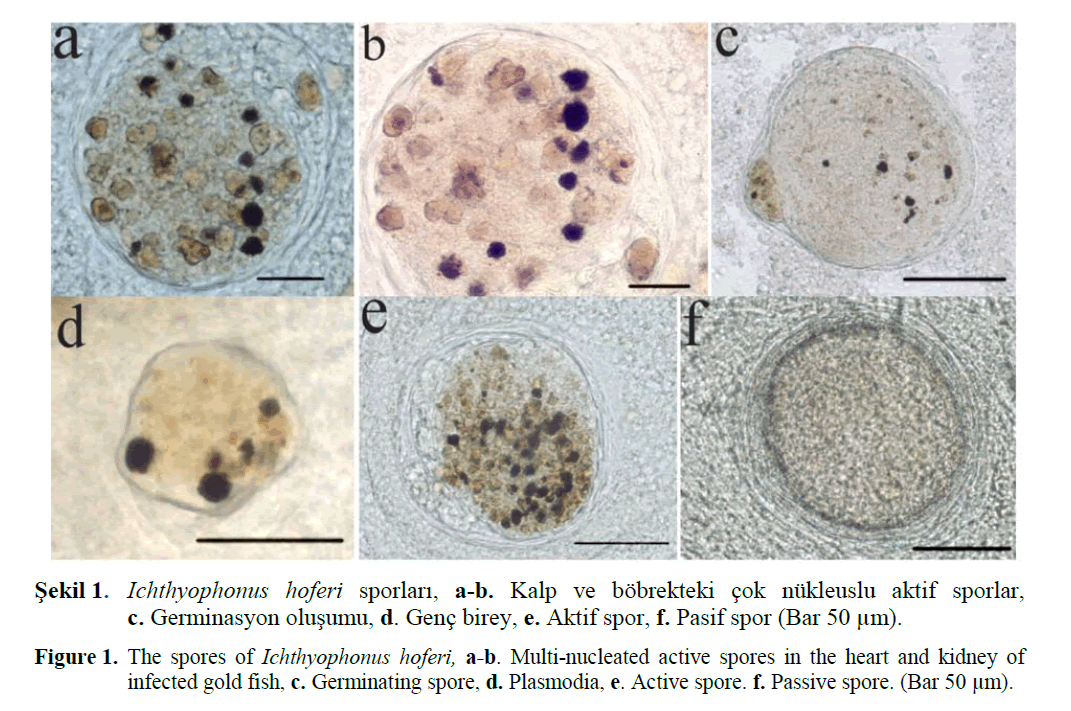
Kalp, karaciğer, dalak ve böbreklerden hazır-lanan ezme preparatlarda etrafı kalın duvarlı fibröz bir zarla çevrelenmiş, boyutları oldukça değişken (10 - 250 μm çapında), küre şekilli ve çok çekirdekli bir morfolojik özellik gösteren et-ken Ichthyophonus hoferi olarak tanımlanmıştır (Şekil 1-2). Patojen, Carassius auratus balığının kalp, dalak ve böbrek gibi iç organlarında yoğun olarak bulunmuştur. Enfekte balığın karaciğer dokusunda ve mide-barsak duvarında daha düşük yoğunlukta tespit edilen etkene beyin ve kas do-kusunda rastlanılmamıştır. Etkenin mikroskobik yapısı etken üzerinde ayrıntılı çalışmalarda bu-lunmuş Spanggaard ve ark. (1995) ve Rahimian (1998) bulgularıyla benzerlik göstermekte olup spor hücre duvarının nispeten ince olduğu “aktif evre” ile spor hücre duvarının oldukça kalın ol-duğu ve uygun koşullarda aktif evreye dönüşebi-len “pasif evre” olarak isimlendirilen iki farklı yaşam evresine rastlanılmıştır.
Sekil 1. Ichthyophonus hoferi sporları, a-b. Kalp ve böbrekteki çok nükleuslu aktif sporlar, c. Germinasyon oluşumu, d. Genç birey, e. Aktif spor, f. Pasif spor (Bar 50 μm).
Figure 1. The spores of Ichthyophonus hoferi, a-b. Multi-nucleated active spores in the heart and kidney of infected gold fish, c. Germinating spore, d. Plasmodia, e. Active spore. f. Passive spore. (Bar 50 μm).
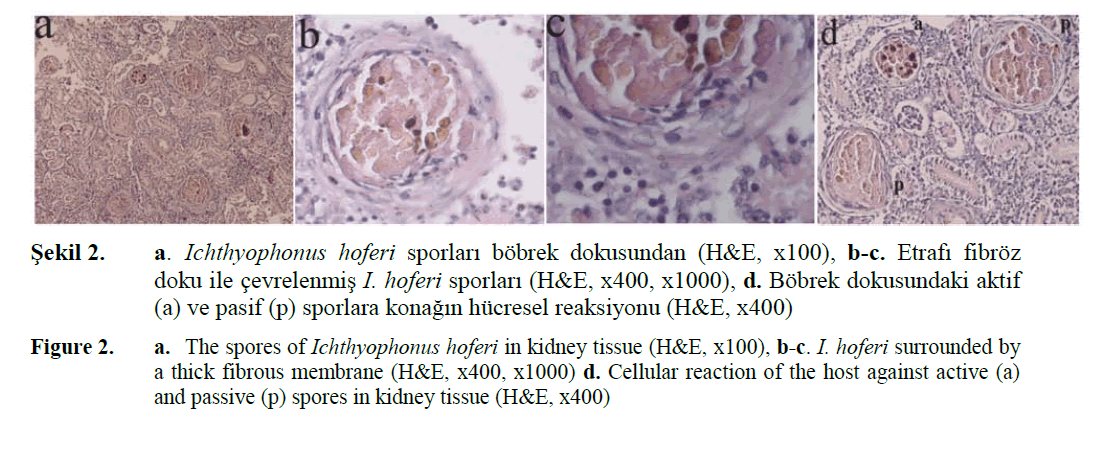
Sekil 2. a. Ichthyophonus hoferi sporları böbrek dokusundan (H&E, x100), b-c. Etrafı fibröz doku ile çevrelenmiş I. hoferi sporları (H&E, x400, x1000), d. Böbrek dokusundaki aktif (a) ve pasif (p) sporlara konağın hücresel reaksiyonu (H&E, x400)
Figure 2. a. The spores of Ichthyophonus hoferi in kidney tissue (H&E, x100), b-c. I. hoferi surrounded by a thick fibrous membrane (H&E, x400, x1000) d. Cellular reaction of the host against active (a) and passive (p) spores in kidney tissue (H&E, x400)
Histopatolojik incelemede etkenin granulom oluşumuna dair gelişim aşamaları ve granülomatöz lezyonlara neden olduğu gözlen-miştir. İncelenen dokularda I. hoferi patojeninin her iki aktif ve pasif evreleri de belirlenmiştir. Etkenin gelişim evrelerine bağlı olarak konakta meydana gelen değişimlerde de farklılıklar sap-tanmıştır. Çoğunluğu kalp dokusunda bulunan aktif evredeki bazı bireylerde germinasyon oluşumu gözlenmiş ve bu bireylere konağın be-lirgin bir hücresel reaksiyon göstermediği ya da minimum düzeyde bir reaksiyon gösterdiği sap-tanmıştır. Pasif evredeki kistlerin etrafında makrofaj infiltrasyonu ile oluşan epiteloid hücreler ve bağ doku hücreleri ile kalın bir mem-bran ve fibroz dokunun varlığı belirlenmiştir. Konak balığın Ichthyophonus hoferi patojenine karşı geliştirdiği makrofajlı inflamasyon, çok çekirdekli dev hücre oluşumu ve granulom reak-siyonları oldukça yaygın gözlenen durumlar arasındadır. Bu araştırma esnasında tespit edilen I. hoferi etkeninin enfekte balıklarda yaptığı histopatolojik bulguları, Pleuronectes platessa (Timur ve Timur, 1984), Leptocottus armatus (Olson, 1986), Dicentrarchus labrax (Sitja-Bo-badilla ve Alvarez-Pellitero, 1990), Limanda fer-ruginea (Rand, 1994), Clupea harengus (Meller-gaard ve Spanggaard, 1997; Rahimian, 1998), Salmo salar (Zubchenko ve Karaseva, 2002), Oncorhynchus kisutch (Gavryuseva, 2006) gibi farklı balık türlerinde çeşitli araştırıcılar tarafın-dan bildirilen bulgularla benzerlik göstermekte-dir.
Hastalığın seyri ve belirtileri etkenin hangi organ ve dokularda bulunduğuna, yoğunluğuna ve konak balığın durumuna bağlı olarak sporadik ölümler ya da epizootik salgınlar halinde farklılık sergilemektedir. Her ne kadar sistemik Ichthyo-phonus enfeksiyonlarının ölümcül olduğu bildirilse de konak balık türleri arasında görülen ölüm oranı hastalığın akut veya kronik seyrine bağlı olarak değişmektedir. Kronik seyir izleyen durumlarda düşük ölüm oranı ile enfekte balığın aylarca yaşadığı, etkenin pasif formda balığın tüm organlarında yaygın olarak bulunduğu bildirilmiştir (Rahimian, 1998; Sitja-Bobadilla ve Alvarez-Pellitero, 1990). Hastalığın akut seyrinde ise yüksek ölüm oranı görülürken etkenin özel-likle genç formlarının kalpte yoğun olarak bulun-duğu tespit edilmiştir (Gavryuseva, 2007). Ay-rıca, konak balığın genel durumuna ve kötü çevre koşullarına bağlı olarak pasif formdaki etken ak-tif hale geçebilir ve hastalığın kronik seyrini akut yöne değiştirebilir. Bu araştırmada saptanan granulomatöz lezyonların varlığı, etkenin çoğunluğu aktif evredeki bireyler olmak üzere her iki evrenin yaygın olarak enfekte japon balığında bulunması enfeksiyonun balıkta daha önce var olduğunu, ancak olumsuz çevre koşul-ları ve ölümlerin görülmesiyle ile enfeksiyonun kronik seyrinin subakut yönde değiştiğini de-stekler niteliktedir.
Ichthyophonus enfeksiyonlarının ortaya çıkışı ile su sıcaklığı arasında pozitif bir ilişkinin varlığı bilinmektedir. Özellikle su sıcaklığının 15 °C’nin üzerine çıktığı durumlarda etkenin patojenik et-kisinin ve ölüm oranının artığı atlantik salmonu ve gökkuşağı alabalıklarında bildirilmiştir (Oka-moto ve ark, 1987) Bu araştırmada, japon balık-larının yaşadığı su sıcaklığının 22-24 °C olduğu düşünüldüğünde, sıcaklığın patojenin etkisini arttırdığı ve ölümlere neden olduğu söylenebilir.
Bu hastalığın kontrolu ve tedavisi için yapılan az sayıda da olsa birkaç çalışma mevcuttur. Azadirachta indica bitkisinin balıklardaki Ich-thyophoniasis hastalığına karşı etkili olduğu ve güvenle kullanılabileceği tilapya balıklarında yapılan bir çalışmada bildirilmiştir (El-Ghany ve Alla, 2008). Ayrıca Hershberger ve ark. (2008) in vitro olarak kullandıkları klor ve iyot solusyonlarının Ichthyophonus sporlarını inaktive etmede etkili olduğunu, özellikle Ichthyophonus üzerine canlı kültürlerin ya da enfekte balıkların kullanıldığı araştırma laboratuarlarında biokon-taminasyonun önlenmesinde ve laboratuar mal-zemelerin dezenfeksiyonunda kullanılabileceğini bildirmişlerdir.
Sonuç
Konak balığın türü, büyüklüğü ve cinsiyeti enfeksiyon oranını etkileyen faktörler arasında yer almaktadır. Farklı balık türlerindeki enfeksiyonun seyrindeki değişimler ve Ichthyophonus enfeksiyonlarını etkileyen biyotik ve abiyotik faktörlerdeki çeşitlilik bu etken üzerine daha ayrıntılı çalışmaların yapılması gerektiğini ortaya koymaktadır. Günümüze kadar japon balığında (Carassius auratus) bildirilmemiş Ichthyophonus hoferi patojeninin bu araştırma ile ilk defa bildirilmesi literatüre katkı sağlaması bakımından önemlidir Ayrıca Türkiye’ye yurtdışından ithal edilen japon balıklarında bulunan ve zaman içerisinde diğer balık populasyonları üzerinde de yayılım gösterebilme potansiyeline sahip hastalık etkenlerinin kapsamlı bir şekilde incelenmesi gerekmektedir.
Kaynaklar
Arkush, K. D., Mendoza, L., Adkison, M. A., Hedrick, R. P., (2003). Observations on the life stages of Sphaerothecumdestruensn.g., a mesomycetozoen fish pathogen formally referred to as the rosette agent, Journal of Eukaryotic Microbiology, 50(6): 430-438. doi:10.1111/j.1550-7408.2003.tb00269.x
Bendele, R.A., Klontz, G.W., (1975). Histopa-thology of teleost kidney disease.in: The Pathology of Fishes, Eds. W.E. Ribelin y G. Migaki, Univ. Wisconsin Press (Madison, Wisconsin): 365-382.
Criscione, C.D., Watral, V., Whipps, C.M., Blouin, M.S., Jones, S.R.M., Kent, M.L., (2002). Ribosomal DNA sequences indicate isolated populations of Ichthyophonushoferiin geographic sympatry in the north-easternPasific Ocean, Journal of Fish Disease, 25(10): 575-582. doi:10.1046/j.1365-2761.2002.00404.x
El-Ghany, N.A.A., Alla, H.M.L.A., (2008). A trial for treatment of Ichthyophonosis in cultured Oreochromisniloticususing fucus and neem plants. 8th International Sympo-sium on Tilapia in Aquaculture, Egypt, Oc-tober 12-14, 2008, 1329-1349 pp.
Gavryuseva, T.V., (2007). First report of Ich-thyophonushoferiinfection in young Coho Salmon Oncorhynchuskisuth(Walbaum) at a fish hatchery in Kamchatka, Russian Jour-nal of Marine Biology, 33(1): 43-48. doi:10.1134/S106307400701004X
Hershberger, P.K., Pacheco, C.A., Gregg, J.L., (2008). Inactivation of Ichthyophonus spores using sodium hypochlorite and polyvinyl pyrroliodine iodine, Journal of Fish Disease, 31(11): 853-858. doi:10.1111/j.1365-2761.2008.00959.x
Kocan, R.M., Mehl, T., Elder, N., Bradley, M., Wildermuth, D., Stick, K., (1999). Patho-genicity of Ichthyophonushoferifor labora-tory-reared Pacific herring Clupeapallasiand its early appearance in wild Puget Sound herring, Disease of Aquatic Organisms, 35(1): 23-29. doi:10.3354/dao035023
Kocan, R.M., Hersberger, P., Winton, J. (2004). Ichthyophoniasis: An Emerging Disease of Chinook Salmon in the Yukon River, Jour-nal of Aquatic Animal Health, 16(2): 58–72.doi:10.1577/H03-068.1
McVicar, A.H. (1999) Ichthyophonusand related organisms.In: Fish Diseases and Disorders, Vol. 3, Viral, Bacterial and Fungal Infec-tions (Woo, P.T.K. and Bruno, D.W., Eds.) pp 661-687. CABI Publishing, Oxon, New York
Mellergaard, S., Spanggaard, B., (1997). An Ichthyophonushoferiepizootic in herring in the North Sea, the Skagerrak, the Kattegat and Baltic Sea, Disease of Aquatic Organ-isms, 28(3): 191-197.doi:10.3354/dao028191
Mendoza, L., Taylor, J. W., Ajello, A., (2002). The Class Mesomycetozoea: A heterogene-ous group of microorganisms at the animal-fungal boundary, Annual Review of Micro-biology, 56: 315-344. doi:10.1146/annurev.micro.56.012302.160950
Mikaelian, I., Ouellet, M., Pauli, B., Rodrigue, J., Harsbarger, J.C., Green, D.M., (2000).Ich-thyophonus-like infection in wild amphibi-ans from Quebec, Canada, Disease of Aquatic Organisms, 40(3): 195-201. doi:10.3354/dao040195
Miyazaki, T., Jo, Y., (1985). Studies on Ichthyo-phonusdisease of Ayu, Fish Pathology, 20(1): 45-48.
Okamoto, N., Nakase, K., Sano, T., (1987). Re-lationships between water temperature, fish Size, infective dose and Ichthyophonusin-fection in rainbow trout, Nippon Suisan Gakkaishi, 53(4): 581-584.
Olson, R.E., (1986). Ichthyophonusinfection in a PasificStaghornSculphin (Leptocottusar-matus) from Oregon, Journal of Wildlife Disease, 22(4): 566-569.
Paperna, I., (1986). Ichthyophonusinfection in grey mullet from Southern Africa: Histopa-thological and Ultrastructural study, Disease of Aquatic Organisms, 1: 89-97.
Rahimian, H., (1998). Pathology and morphology of Ichthyophonushoferiin naturally infected fishes off the Swedish west coast, Disease of Aquatic Organisms, 34(2): 109-123. doi:10.3354/dao034109
Rahimian, H., and Thulin, J., (1996). Epizootiol-ogy of Ichthyophonushoferiin herring populations off the Swedish west coast, Diseases of Aquatic Organisms, 27(3): 187-195. doi:10.3354/dao027187
Rand, T.G., (1994). An unusual form of Ichthyo-phonushoferi(Ichthyophonales: Ichthyophonaceae
Ichthyophonaceae) from yellowtail flounder Li-mandaferrugineafrom the Nova Scotia shelf, Disease of Aquatic Organisms, 18: 21-28. doi:10.3354/dao018021
Schmidt-Posthaus, H., Wahli, T. (2002).First re-port of Ichthyophonushoferiinfection in wild brown trout (Salmotrutta) in Switzer-land, Bulletin European Association of Fish Pathology, 22(3): 225-228.
Sitja-Bobadilla, A., Alvarez-Pellitero, P., (1990).First report of Ichthyophonusdisease in wild and cultured sea bass Dicentrarchuslabraxfrom the Spanish Mediterranean area, Dis-ease of Aquatic Organisms, 8: 145-150.doi:10.3354/dao008145
Spanggaard, B., Huss, H.H., Bresciani, J., (1995). Morphology of Ichthyophonushoferias-sessed by lighy and scanning electron mi-croscopy, Journal of Fish Disease, 18(6): 567-577. doi:10.1111/j.1365-2761.1995.tb00361.x
Timur, G., Timur, M., (1984). Giant-cell reaction associated with Ichthyophonushoferiinfec-tion in wild plaice, PleuronectesplatessaL., Journal of Fish Disease, 7(6): 513-514. doi:10.1111/j.1365-2761.1984.tb01178.x
Whipps, C. M., Burton, T., Watral, V.G., Hilaire, S., Kent, M. L., (2006). Assessing the accu-racy of a polymerase chain reaction test for Ichthyophonushoferi in Yukon River Chi-nook Salmon Oncorhynchustshatwytscha, Disease of Aquatic Organisms, 68(2): 141-147.doi:10.3354/dao068141
Zubchenko, A. V., Karaseva, T. A., (2002). Ich-thyophonushoferias one of possible causes of increased marine mortality in post-smolts of Atlantic Salmon, NPAFC Technical Re-port No:4, 90-92.
866